2. 福建三明森林生态系统国家野外科学观测研究站, 福建 三明 365000
2. Fujian Sanming Forest Ecosystem National Observation and Research Station, Sanming 365000, Fujian, China
气候变暖和降水格局改变是全球变化的2个重要表现,会对陆地生态系统的功能与结构产生重要影响[1–3]。IPCC第五次气候变化评估报告表明,全球平均地表温度在过去100 a中上升了0.78 ℃, 预计到本世纪末将进一步上升1.5 ℃~3.7 ℃;而降水在不同纬度带的变化趋势不一,低纬地区降水呈减少趋势,中高纬度地区降水则呈增加趋势[4]。随着全球气候变暖以及区域性降水量的减少,全球许多地区在未来将面临面积广且强度大的干旱状况[5]。有研究表明,高温和干旱的环境会降低生态系统的初级生产力和呼吸作用[6],并直接或间接影响生态系统碳动态[7]。因此,研究中亚热带地区森林生态系统对全球气候变暖和降水减少的动态反馈,有利于进一步推动中亚热带地区森林生态系统经营管理研究及提供基础研究数据。
细根(直径≤2 mm)是植物的高度结构化器官, 具有基本的吸收和运输功能[8],同时也是陆地生态系统化学元素循环的重要贡献者[9]和气候变化的高度敏感者[10]。全球气候变化对植物细根的影响可能体现在很多方面,如细根生物量、形态和化学计量学特征等,反映出细根对于气候变暖和降水格局改变的响应。目前,有关增温或隔离降水的单因子控制试验对细根生物量、形态及养分特征的影响已有研究,但研究结果并不一致。Bronson等[11]对加拿大南部区域的黑云杉(Picea mariana)的研究表明, 增温使细根生物量下降了24%~46%;而Yuan等[12]对挪威云杉(P. asperata)的研究表明,细根生物量随温度上升而显著增加。根系形态学在平衡根系的成本和收益方面起着重要作用,其中,细根比根长(SRL)和比表面积(SRA)作为植物根系结构中的2个重要形态指标,在植物营养元素的吸收和运输效率、反应根系功能过程及生长发育状况等方面具有重要的指示意义[13–14]。有研究表明,增温会改变细根的形态特征,如细根直径和长度等[15];而降水减少不会影响细根形态特征[16]。细根化学组成在根系生长发育过程中具有关键作用,如影响细根生理生化、死亡分解动态过程和土壤微生物活性等[17],气候变暖和降水变化对其的影响会受到地理位置、植物种类以及土壤理化性质等的显著影响[18]。但迄今为止,中亚热带地区关于增温与隔离降水双因子交互试验对细根生物量、形态及养分特征的影响研究较少[19],这不利于科学理解中亚热带地区森林生态系统地下生态过程对全球变化的响应及适应。因此,在中亚热带地区开展增温和隔离降水对细根生物量、形态及养分特征的影响研究十分重要。
我国中亚热带地区对于全球变化具有极强的敏感性,该区域是我国重要的人工林基地,其中, 杉木是该地区分布广泛且具有较高经济价值的重要树种之一,在我国森林生产及碳循环中发挥着显著的作用[20]。为此,本文以杉木为研究对象, 通过模拟增温和隔离降水双因子试验研究气候变化对杉木细根生物量、形态及养分特征的影响,揭示杉木细根在气候变化背景下对于环境胁迫的响应策略。研究的开展也有助于更好的理解其对森林生态系统生产力格局变化以及生物地球化学循环的影响, 并为中亚热带地区森林经营提供科学依据。
1 材料和方法 1.1 试验区概况本研究在福建三明森林生态系统国家野外科学观测研究站(26°19′ N,117°36′ E,海拔300 m)进行。研究区属典型的亚热带季风气候,年均温、年均相对湿度和年均降水量、年均蒸发量分别为19.1 ℃、80%和1 670、1 585 mm,土壤为红壤,pH为4.6~5.3。
1.2 试验设计试验采用随机区组设计,设置对照(CT)、增温5 ℃ (W)、隔离50%降水(P)和增温5 ℃+隔离50%降水(WP)共4种处理,每处理5个重复。试验小区4周均采用PVC板(200 cm×70 cm深)焊接而成,与周围土壤隔开,以防止小区之间相互干扰。小区大小为2 m×2 m,每小区均匀种植4棵1 a生杉木幼苗,位置均处于两条电缆线之间。样地土壤从附近的杉木人工林内分层取土,取回后剔除土壤内的碎石块、死根以及动物残体等杂物,并充分分层混合均匀后重新填回试验小区,同时,为了保持与原土壤容重接近,采用压实法调整土壤容重,以保证试验科学性。
所有试验小区于2013年10月布设加热电缆(TXLP/1, Nexans, Norway),埋藏深度为10 cm,电缆间距20 cm,在小区10、20、40和60 cm深度各设置3个温度传感器(T109 from Campbell Scientific Inc, Logan, UT, USA)和湿度传感器(Decagon, Pull- man, Washington, USA)(均放置于2条电缆线中间)用于监测各深度土层的温湿度。所有数据每5 min扫描记录1次,每1 h保存1次。2014年初在隔离降水试验小区每隔5 cm安装0.05 m×5 m的透明U型塑料管,以便隔离50%的天然降水。样地全部布设完成后,于2014年3月开始增温和隔离降水双因子试验。
1.3 根系采样和生长量调查2017年8月,对小区内的杉木根系进行随机取样,采用土钻法(土钻直径5 cm)在每个2 m×2 m小区取6个土钻,取样深度分别为0~10、10~20、20~ 40和40~60 cm。所取土壤中表皮半脱落或完全脱落且褶皱严重的黑色根为死根,根据此标准按照土层深度剔除死根后将根系挑出并立即带回实验室处理, 按照0~1和1~2 mm对活细根进行分级,并进一步对细根相关指标进行测定。取样的同时对杉木树高和地径进行测量,并根据前期数据建立的异速生长方程对各处理地上总生物量、地下总生物量、地上+地下总生物量进行分析。
1.4 细根生物量和形态测定用数字化扫描仪Espon scanner对细根分径级扫描,使用Win-RHIZO (Pro 2009b0)根系图像分析软件进行形态特征分析,得到细根直径、长度及表面积等基础指标。待细根扫描完成后,将样品分别装入信封袋中并放进65 ℃烘箱烘干后称取质量,计算细根生物量、比根长和比表面积。本研究中细根形态和养分指标的分析主要针对0~10 cm土层细根, 细根生物量(g/m2)=细根质量(g)×104/[π(d/2)2], 比根长(m/g)=根长(m)/细根质量(g), 比表面积(cm2/g)=细根表面积(cm2)/细根质量(g), 式中,d为土钻内径。
1.5 细根碳氮含量和δ15N测定使用自动球磨仪将烘干的细根磨碎,使用碳氮元素分析仪(Vario EL III,Elemental Analysis,Germany)测定细根的C、N含量,利用同位素质谱仪(Thermo Scientific MAT253)测定细根氮稳定同位素比率(δ15N)[21], δ15N (‰)=(R1-R2)/R2×1000, 式中,R1为样品15N/14N的比值; R2为大气15N/14N比值。
1.6 数据的统计和分析利用Excel 2016对数据进行整理,采用SPSS 20.0软件中单因素方差分析(One-Way ANOVA)和LSD检验各指标在不同处理间的差异,采用线性混合模型分析增温、隔离降水和土层或径级对细根生物量和形态的影响;采用ANOVA双因素方差分析检验增温、隔离降水及其交互作用对细根总生物量、碳氮含量和δ15N的影响。用Origin 9.0软件绘制相关图表,显著性水平设为P<0.05。
2 结果和分析 2.1 对土壤温度与湿度的影响如图 1所示,与CT相比,W和WP处理的土壤温度分别显著升高4.95 ℃和5.09 ℃ (P<0.05), 均达到预期增温效果;W、P和WP处理的土壤湿度分别为16.69%、17.83%和15.15%,比CT分别显著降低17.43%、11.77%和25.04% (P<0.05),P和WP处理的土壤含水率差异显著(P<0.05)。

|
图 1 增温和隔离降水对土壤温度和湿度的影响。CT: 对照; W: 增温; P: 隔离降水; WP: 增温+隔离降水。柱上不同字母表示差异显著(P<0.05)。 Fig. 1 Effects of warming and precipitation exclusion on soil temperature and moisture. CT: Control; W: Warming; P: Precipitation exclusion; WP: Warming+ precipitation exclusion. Different letters upon column indicate significant differences at 0.05 level. |
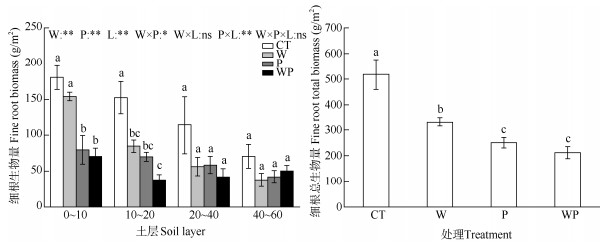
从表 1可见,W、P和WP处理对杉木的地上生物量、地下生物量、总生物量均有影响,但对根冠比的影响不显著。从图 2可见,与CT相比,W、P和WP处理的细根总生物量分别显著降低35.7%、51.7%和59.1% (P<0.05)。其中,P和WP处理间的细根总生物量无显著差异(P>0.05),但两者均显著低于W处理(P<0.05)。在不同土层中,W处理10~20 cm土层的细根生物量显著低于CT (P<0.05),而0~10、20~40和40~60 cm土层细根生物量与对照无显著差异(P>0.05);与CT相比,P和WP处理0~10和10~20 cm土层的细根生物量均分别显著降低56.01%、66.02%和54.2%、66.15% (P<0.05), 20~40和40~ 60 cm土层细根生物量无显著差异(P>0.05); P和WP处理相比,所有土层的细根生物量均无显著差异(P>0.05)。线性混合模型分析表明,增温、隔离降水、土层以及隔离降水和土层的交互作用对细根总生物量的影响均达到极显著水平(P<0.01), 增温与隔离降水的交互作用对细根总生物量的影响显著(P<0.05),而增温与土层的交互作用以及增温、隔离降水和土层的交互作用对细根总生物量影响不显著(P>0.05)。双因素方差分析表明,增温、隔离降水及其交互作用均对细根总生物量有显著影响(P<0.05),其中增温和隔离降水的影响达到极显著水平(P<0.01)(表 2)。
| 表 1 不同处理对杉木幼树生物量的影响 Table 1 Biomass of Cunninghamia lanceolata saplings for all the treatments |
|
图 2 增温和隔离降水对细根生物量的影响。CT: 对照; W: 增温; P: 隔离降水; WP: 增温+隔离降水。L: 土层; 柱上不同字母表示差异显著(P<0.05)。 Fig. 2 Effects of warming and precipitation exclusion on fine root biomass. CT: Control; W: Warming; P: Precipitation exclusion; WP: Warming+precipitation exclusion. L: Soil layer; Different letters upon column indicate significant differences at 0.05 level. |
| 表 2 增温和隔离降水及其交互作用对细根的双因素方差分析 Table 2 Effects of warming, precipitation exclusion and their interaction on the fine roots by Two-Way ANOVA |
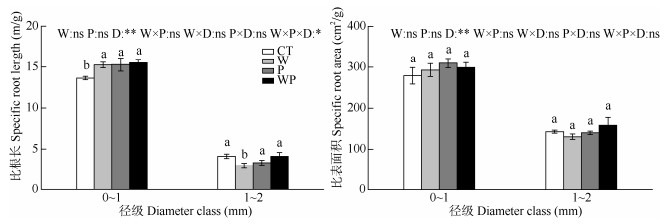
从图 3可见,W、P和WP处理的0~1 mm细根SRL均显著高于CT (P<0.05),W处理的1~2 mm细根SRL显著低于CT (P<0.05),而P和WP处理的1~2 mm细根SRL与CT间均无显著差异(P>0.05); W、P和WP处理的0~1和1~2 mm细根SRA与CT均无显著差异(P>0.05)。增温和隔离降水对细根总SRL和SRA的影响均不显著(P>0.05),而径级对细根总SRL和SRA的影响均达到极显著水平(P<0.01), 增温和隔离降水、增温和径级以及隔离降水和径级的交互作用对细根总SRL和SRA的影响均不显著(P>0.05),增温、隔离降水和径级的交互作用对细根总SRL的影响达到显著水平(P<0.05), 而对SRA无显著影响(P>0.05)。
|
图 3 增温和隔离降水对细根形态的影响。CT: 对照; W: 增温; P: 隔离降水; WP: 增温+隔离降水; D: 径级。柱上不同字母表示差异显著(P<0.05)。 Fig. 3 Effects of warming and precipitation exclusion on fine root morphological characteristics. CT: Control; W: Warming; P: Precipitation exclusion; WP: Warming+precipitation exclusion; D: Diameter class. Different letters upon column indicate significant differences at 0.05 level. |
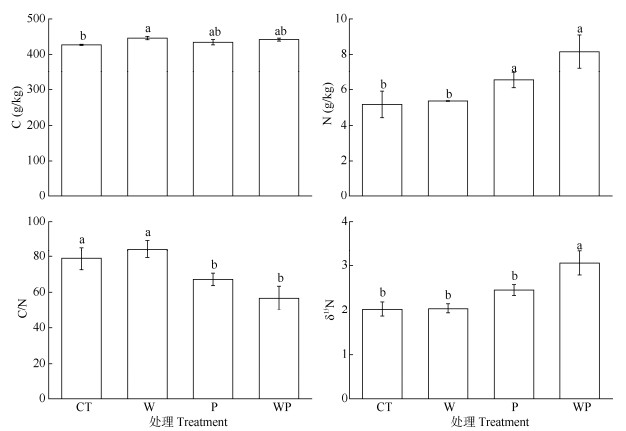
从图 4可见,与CT相比,W处理的细根N含量、C/N和δ15N均无显著差异(P>0.05),而C含量显著增加(P<0.05);P处理的细根C含量和δ15N无显著变化(P>0.05),N含量显著增加(P<0.05),C/N显著降低(P<0.05)。WP与P处理相比,细根的C、N含量和C/N无显著变化(P>0.05),δ15N显著增加(P<0.05);WP与W处理间的细根N含量、C/N和δ15N差异显著(P<0.05),C含量无显著差异(P>0.05)。增温对细根N含量的影响达极显著水平(P<0.01), 对C含量、C/N和δ15N无显著影响(P>0.05);隔离降水对细根C含量、C/N和δ15N的影响达极显著水平(P<0.01),而对N含量的影响不显著(P>0.05); 增温和隔离降水的交互作用对细根C、N含量、C/N和δ15N的影响均不显著(P>0.05)(表 2)。
|
图 4 增温和隔离降水对细根碳、氮含量和δ15N的影响。CT: 对照; W: 增温; P: 隔离降水; WP: 增温+隔离降水。柱上不同字母表示差异显著(P<0.05)。 Fig. 4 Effects of warming and precipitation exclusion on carbon and nitrogen contents and δ15Nof fine roots. CT: Control; W: Warming; P: Precipitation exclusion; WP: Warming+precipitation exclusion. Different letters upon column indicate significant differences at 0.05 level. |
本研究结果表明,增温3 a对细根生物量的影响极为显著,与CT相比,W处理的细根总生物量显著降低35.7%,其中10~20 cm土层细根生物量显著降低44.7%,这与前人[22–23]的研究结果一致。Wan等[24]研究表明,短期增温会显著降低红枫(Acer rubrum)和糖枫(A. saccharum)的细根生物量。本研究中,W处理杉木细根总生物量显著降低,但地上、地下总生物量及根冠比均无显著变化,表明杉木可能通过促进粗根的生长和维持地上部分的分配来储存和运输养分、水分和获得稳定的光合产物,以此响应增温并支撑自身生长;另一方面在于增温提高了细根周转速率,导致细根现存生物量降低[25]。但谭钠丹等[26]的研究表明,长期增温6 a会显著降低木荷(Schima superba)和马尾松(Pinus massoniana)的根冠比和地下生物量的分配,这种差异可能与植物物种不同有关,不同植物对所处生长环境存在适应性差异。另外,W处理的0~10 cm土层细根生物量无显著影响,而Melillo等[27]和时应贵等[28]报道增温会显著降低表层土壤(0~10 cm)细根生物量,原因可能是大部分获取养分的细根主要集中于0~ 10 cm的土层,为了减小土壤温度升高对自身生长的影响,植物细根产生了一定的温度适应[29]。而冯建新[30]和史顺增等[31]的研究表明,短期增温1 a对杉木幼苗细根生产量具有显著的促进作用,其研究区地处亚热带,降水量丰富,即使在增温后水分有效性也相对较高(特别是在雨季),也有可能是增温能促进土壤氮矿化,增加土壤氮有效性,因而增温后细根生产量较高。最近的一项meta分析表明, 生物过程会随时间发生动态变化,这可能导致随着增温时间的延长,细根生物量对增温的响应进一步增强或减弱[15]。本研究中,与CT相比,P处理的细根总生物量显著降低51.7%,可能是因为隔离降水之后地上生物量显著增加,因此地下根系通过调整生长策略,增加粗根生长比例以保障水分和养分的运输;亦可能是P处理降低了雨水淋溶作用的强度,间接提高了土壤养分有效性,养分变得更容易获取,从而导致细根生物量的降低。有研究表明,虽然增温及其与隔离降水的交互作用对细根生物量均具有显著影响,但是WP与W处理相比,0~10 cm土层细根生物量显著降低,可能是WP处理产生温度升高和降水减少的双重环境胁迫,导致土壤干旱程度更高,水分有效性降低程度更大,植物在水分有效性严重降低的情况下所增加的细根生长量不足以抵消受到严重干旱胁迫而死亡的细根死亡量[32], 说明相较于温度升高,降水减少导致的水分有效性降低可能是影响表层土壤细根生物量积累的主要限制性因素。本试验中,W、P和WP处理细根总生物量显著降低,而深层土壤(20~60 cm)细根生物量没有显著降低,可能是干旱胁迫促使细根更多的往深层分布,但由于增温后导致细根死亡增加,周转速率加快[25],因而导致深层土壤细根生物量无显著变化。
SRL和SRA是重要的细根形态特征指标,是细根吸收土壤水分和养分以及资源竞争能力的重要体现,其中0~1 mm细根是养分吸收的主要器官, 而1~2 mm主要是结构根[33]。有研究表明,干旱胁迫会增强水分有效性的限制能力,促使植物细根SRL和SRA的增加[34]。本研究中,与CT相比,W、P和WP处理的0~1 mm细根SRL均显著增加,表明杉木幼树通过采取提高获取水分的能力和效率的策略来响应增温。这与Beyer等[35]的研究结论一致。W处理的1~2 mm细根SRL显著降低,P和WP处理的差异不显著,可能是1~2 mm细根不是吸收水分的主要器官,受水分有效性的限制较小, 因此,在增温和隔离降水的双重环境胁迫下,温度成为影响1~2 mm细根SRL的主要限制性因子。但是,相较于细根SRL,细根SRA的改变更能体现植物对外界环境变化的响应[36],而本研究中,0~1和1~2 mm细根SRA变化均不显著,并且双因素方差分析也表明,增温、隔离降水及其交互作用对0~1和1~2 mm细根SRL和SRA均没有显著影响,这在一定程度上表明通过调整表层土壤细根形态特征可能并不是杉木幼树在夏季应对干旱胁迫的主要策略,主要策略可能是通过调整细根生物量分配来响应外部干旱胁迫[37]。
3.2 增温和隔离降水对细根化学元素特征的影响碳元素是组成植物体干物质的主要元素,而氮元素则是植物体内合成蛋白质的重要元素之一,这2种元素均是植物生长发育和调节植物生理过程中不可缺少的矿物元素[38]。许多研究表明,增温会增强细根活性以及提高土壤N有效性,从而影响细根N含量[23, 39]。但本研究表明, 与CT相比,W处理的细根N含量没有显著变化,可能是增温促进了微生物活性的提高,从而增加微生物对土壤无机氮的吸收[40],也可能是增温3 a后杉木幼树仍处于生长速生期,对体内N元素的吸收利用增加[25]。但W处理的细根C含量显著增加,表明杉木在夏季来临前,可能会提前储存更多的C以应对干旱胁迫。本研究中,与CT相比,P处理的细根C/N显著降低,是因为细根C含量无显著变化,而N含量显著增加,这与Sardans等[41]的研究结论一致。这可能一方面是P处理会提高植物对土壤水分的吸收能力和效率, 从而分配更多的N到细根;另一方面是P处理显著降低了土壤含水率,提高了土壤通气性,促进土壤氮矿化[36]。氮稳定同位素是指示森林生态系统氮循环速率及氮饱和度的重要指标[42]。与CT相比,W和P处理对细根δ15N的影响均不显著,细根δ15N也没有随N含量的显著增加而发生变化,但是WP处理细根δ15N差异显著,可能是WP处理的双重干旱胁迫,导致土壤有机氮的矿化速率高于W和P处理,促使土壤无机氮库15N富集,从而导致WP处理细根δ15N显著增加[43]。
综上所述,W、P及WP处理细根总生物量相较于CT均显著降低,P及WP处理的细根总生物量及0~10 cm土层细根生物量均显著低于W处理,一定程度上表明降水减少对杉木幼树细根生物量积累的影响更为显著;W、P和WP处理的0~1 mm细根SRL均显著增加,而0~1和1~2 mm细根SRA均无显著变化,表明夏季在高温和干旱的环境胁迫下,调整表层细根形态特征可能不是杉木幼树的主要应对策略;W处理细根N、C/N和δ15N无显著变化,P处理对细根N和C/N均有显著变化,WP处理细根N、C/N和δ15N显著变化,表明土壤水分条件可能是影响杉木幼树表层(0~10 cm)细根化学元素分配的主要因素。因此,未来在全球变暖和降水减少的双重环境胁迫下,调整表层细根形态特征可能不是杉木幼树的主要应对策略,而相较于温度升高,降水减少可能是影响杉木幼树细根生物量及表层化学元素分配的主要环境因子。本文研究了亚热带杉木幼树夏季在增温及隔离降水的条件下细根生物量、形态及化学元素特征及其响应策略,为促进我国亚热带地区杉木人工林的保护、恢复及经营的可持续发展提供了一定的基础研究数据。
| [1] |
MELILLO J M, STEUDLER P A, ABER J D, et al. Soil warming and carbon-cycle feedbacks to the climate system[J]. Science, 2002, 298(5601): 2173-2176. DOI:10.1126/science.1074153 |
| [2] |
ARONSON E L, MCNULTY S G. Appropriate experimental ecosystem warming methods by ecosystem, objective, and practicality[J]. Agric For Meteorol, 2009, 149(11): 1791-1799. DOI:10.1016/j.agrformet.2009.06.007 |
| [3] |
BAI W M, WAN S Q, NIU S L, et al. Increased temperature and precipitation interact to affect root production, mortality, and turnover in a temperate steppe: Implications for ecosystem C cycling[J]. Glob Chang Biol, 2010, 16(4): 1306-1316. DOI:10.1111/j.1365-2486.2009.02019.x |
| [4] |
IPCC. Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovern- mental Panel on Climate Change [M]. Cambridge: Cambridge University Press, 2013: 95–123.
|
| [5] |
DAI A G. Increasing drought under global warming in observations and models[J]. Nat Clim Change, 2013, 3(1): 52-58. DOI:10.1038/NCLIMATE1633 |
| [6] |
CIAIS P, REICHSTEIN M, VIOVY N, et al. Europe-wide reduction in primary productivity caused by the heat and drought in 2003[J]. Nature, 2003, 437(7058): 529-533. DOI:10.1038/nature03972 |
| [7] |
KURZ W A, DYMOND C C, STINSON G, et al. Mountain pine beetle and forest carbon feedback to climate change[J]. Nature, 2008, 452(7190): 987-990. DOI:10.1038/nature06777 |
| [8] |
MCCORMACK M L, DICKIE I A, EISSENSTAT D M, et al. Rede- fining fine roots improves understanding of below-ground contri- butions to terrestrial biosphere processes[J]. New Phytol, 2015, 207(3): 505-518. DOI:10.1111/nph.13363 |
| [9] |
PERSSON H Å, STADENBERG I. Spatial distribution of fine-roots in boreal forests in eastern Sweden[J]. Plant Soil, 2009, 318(1/2): 1-14. DOI:10.1007/s11104-008-9811-1 |
| [10] |
YUAN Z Y, CHEN H Y H. Fine root biomass, production, turnover rates, and nutrient contents in boreal forest ecosystems in relation to species, climate, fertility, and stand age: Literature review and meta- analyses[J]. Crit Rev Plant Sci, 2010, 29(4): 204-221. DOI:10.1080/07352689.2010.483579 |
| [11] |
BRONSON D R, GOWER S T, TANNER M, et al. Response of soil surface CO2 flux in a boreal forest to ecosystem warming[J]. Glob Change Biol, 2008, 14(4): 856-867. DOI:10.1111/j.1365-2486.2007.01508.x |
| [12] |
YUAN Z Y, SHI X R, JIAO F, et al. Changes in fine root biomass of Picea abies forests: Predicting the potential impacts of climate change[J]. J Plant Ecol, 2017, 11(4): 595-603. DOI:10.1093/jpe/rtx032 |
| [13] |
LEUSCHNER C, HERTEL D, SCHMID I, et al. Stand fine root biomass and fine root morphology in old-growth beech forests as a function of precipitation and soil fertility[J]. Plant Soil, 2004, 258(1): 43-56. DOI:10.1023/B:PLSO.0000016508.20173.80 |
| [14] |
COOMES D A, GRUBB P J. Impacts of root competition in forests and woodlands: A theoretical framework and review of experiments[J]. Ecol Monogr, 2000, 70(2): 171-207. DOI:10.2307/2657174 |
| [15] |
WANG J S, DEFRENNE C, MCCORMACK M L, et al. Fine-root functional trait responses to experimental warming: A global meta- analysis[J]. New Phytol, 2021, 230(5): 1856-1867. DOI:10.1111/nph.17279 |
| [16] |
BRUNNER I, HERZOG C, DAWES M A, et al. How tree roots respond to drought[J]. Front Plant Sci, 2015, 6: 547. DOI:10.3389/fpls.2015.00547 |
| [17] |
ZHOU Y M, TANG J W, MELILLO J M, et al. Root standing crop and chemistry after six years of soil warming in a temperate forest[J]. Tree Physiol, 2011, 31(7): 707-717. DOI:10.1093/treephys/tpr066 |
| [18] |
HONG J T, WU J B, WANG X D. Effects of global climate change on the C, N, and P stoichiometry of terrestrial plants[J]. Chin J Appl Ecol, 2013, 24(9): 2658-2665. 全球气候变化对陆地植物碳氮磷生态化学计量学特征的影响[J]. 应用生态学报, 2013, 24(9): 2658-2665. DOI:10.13287/j.1001-9332.2013.0517 |
| [19] |
CLEVELAND C C, WIEDER W R, REED S C, et al. Experimental drought in a tropical rain forest increases soil carbon dioxide losses to the atmosphere[J]. Ecology, 2010, 91(8): 2313-2323. DOI:10.1890/09-1582.1 |
| [20] |
CHEN G S, YANG Z J, GAO R, et al. Carbon storage in a chrono- sequence of Chinese fir plantations in southern China[J]. For Ecol Manage, 2013, 300: 68-76. DOI:10.1016/j.foreco.2012.07.046 |
| [21] |
OELBERMANN K, SCHEU S. Stable isotope enrichment (δ15N and δ13C) in a generalist predator (Pardosa lugubris, Araneae: Lycosidae): Effects of prey quality[J]. Oecologia, 2002, 130(3): 337-344. DOI:10.1007/s004420100813 |
| [22] |
LYONS E M, POTE J, DACOSTA M, et al. Whole-plant carbon relations and root respiration associated with root tolerance to high soil temperature for Agrostis grasses[J]. Environ Exp Bot, 2007, 59(3): 307-313. DOI:10.1016/j.envexpbot.2006.04.002 |
| [23] |
FENG J X, XIONG D C, SHI S Z, et al. Effects of soil warming on the ecophysiological properties of the fine roots of Chinese fir (Cunning- hamia lanceolata) seedlings[J]. Acta Ecol Sin, 2017, 37(1): 35-43. 土壤增温对杉木幼苗细根生理生态性质的影响[J]. 生态学报, 2017, 37(1): 35-43. DOI:10.5846/stxb201603260543 |
| [24] |
WAN S Q, NORBY R J, PREGITZER K S, et al. CO2 enrichment and warming of the atmosphere enhance both productivity and mortality of maple tree fine roots[J]. New Phytol, 2004, 162(2): 437-446. DOI:10.1111/j.1469-8137.2004.01034.x |
| [25] |
XIONG D C, YANG Z J, CHENG G S, et al. Interactive effects of warming and nitrogen addition on fine root dynamics of a young subtropical plantation[J]. Soil Biol Biochem, 2018, 123: 180-189. DOI:10.1016/j.soilbio.2018.05.009 |
| [26] |
TAN N D, LI X, WU T, et al. Effects of warming on biomass allocation patterns and nutrient accumulations of four dominant tree species in mixed forest of Dinghushan, China[J]. J Trop Subtrop Bot, 2021, 29(4): 389-400. 增温对鼎湖山混交林中4种优势树种生物量分配和养分积累的影响[J]. 热带亚热带植物学报, 2021, 29(4): 389-400. DOI:10.11926/jtsb.4325 |
| [27] |
MELILLO J M, BUTLER S, JOHNSON J, et al. Soil warming, carbon-nitrogen interactions, and forest carbon budgets[J]. Proc Natl Acad Sci USA, 2011, 108(23): 9508-9512. DOI:10.1073/pnas.1018189108 |
| [28] |
SHI Y G, XIONG D C, YE W M, et al. Effects of soil and air warming on fine root biomass and leaf traits of Chinese fir saplings[J]. Chin J Ecol, 2021, 40(7): 1916-1923. 土壤和大气增温对杉木幼树细根生物量和叶片性状的影响[J]. 生态学杂志, 2021, 40(7): 1916-1923. DOI:10.13292/j.1000-4890.202107.014 |
| [29] |
JARVI M P, BURTON A J. Root respiration and biomass responses to experimental soil warming vary with root diameter and soil depth[J]. Plant Soil, 2020, 451(1/2): 435-446. DOI:10.1007/s11104-020-04540-1 |
| [30] |
FENG J X, XIONG D C, DENG F, et al. Effects of soil warming and precipitation exclusion and their interaction on fine roots production of Chinese fir (Cunninghamia lanceolata) seedlings[J]. Acta Ecol Sin, 2017, 37(4): 1119-1127. 土壤增温、隔离降水及其交互作用对杉木幼苗细根生产的影响[J]. 生态学报, 2017, 37(4): 1119-1127. DOI:10.5846/stxb201606211207 |
| [31] |
SHI S Z, XIONG D C, DENG F, et al. Interactive effects of soil warming and nitrogen addition on fine root production of Chinese fir seedling[J]. Chin J Plant Ecol, 2017, 41(2): 186-195. 土壤增温、氮添加及其交互作用对杉木幼苗细根生产的影响[J]. 植物生态学报, 2017, 41(2): 186-195. DOI:10.17521/cjpe.2016.0274 |
| [32] |
KNUTZEN F, MEIER I C, LEUSCHNER C. Does reduced precipi- tation trigger physiological and morphological drought adaptations in European beech (Fagus sylvatica L.)? Comparing provenances across a precipitation gradient[J]. Tree Physiol, 2015, 35(9): 949-963. DOI:10.1093/treephys/tpv057 |
| [33] |
JIA S X, WANG Z Q, LI X P, et al. Effect of nitrogen fertilizer, root branch order and temperature on respiration and tissue N concentration of fine roots in Larix gmelinii and Fraxinus mandshurica[J]. Tree Physiol, 2011, 31(7): 718-726. DOI:10.1093/treephys/tpr057 |
| [34] |
METCALFE D B, MEIR P, ARAGÃO L E O C, et al. The effects of water availability on root growth and morphology in an Amazon rain- forest[J]. Plant Soil, 2008, 311(1/2): 189-199. DOI:10.1007/s11104-008-9670-9 |
| [35] |
BEYER F, HERTEL D, LEUSCHNER C. Fine root morphological and functional traits in Fagus sylvatica and Fraxinus excelsior saplings as dependent on species, root order and competition[J]. Plant Soil, 2013, 373(1/2): 143-156. DOI:10.1007/s11104-013-1752-7 |
| [36] |
ZHONG B Y, XIONG D C, SHI S Z, et al. Effects of precipitation exclusion on fine-root biomass and functional traits of Cunninghamia lanceolata seedlings[J]. Chin J Appli Ecol, 2016, 27(9): 2807-2814. 隔离降水对杉木幼苗细根生物量和功能特征的影响[J]. 应用生态学报, 2016, 27(9): 2807-2814. DOI:10.13287/j.1001-9332.201609.023 |
| [37] |
POORTER H, RYSER P. The limits to leaf and root plasticity: What is so special about specific root length?[J]. New Phytol, 2015, 206(4): 1188-1190. DOI:10.1111/nph.13438 |
| [38] |
SARDANS J, RIVAS-UBACH A, PEÑUELAS J. The elemental stoi- chiometry of aquatic and terrestrial ecosystems and its relationships with organismic lifestyle and ecosystem structure and function: A review and perspectives[J]. Biogeochemistry, 2012, 111(1/2/3): 1-39. DOI:10.1007/s10533-011-9640-9 |
| [39] |
BASSIRIRAD H. Kinetics of nutrient uptake by roots: Responses to global change[J]. New Phytol, 2000, 147(1): 155-169. DOI:10.1046/j.1469-8137.2000.00682.x |
| [40] |
ACOSTA-MARTÍNEZ V, COTTON J, GARDNER T, et al. Predo- minant bacterial and fungal assemblages in agricultural soils during a record drought/heat wave and linkages to enzyme activities of biogeo- chemical cycling[J]. Appl Soil Ecol, 2014, 84: 69-82. DOI:10.1016/j.apsoil.2014.06.005 |
| [41] |
SARDANS J, RIVAS-UBACH A, PEÑUELAS J. The C∶N∶P stoi- chiometry of organisms and ecosystems in a changing world: A review and perspectives[J]. Persp Plant Ecol Evol Syst, 2012, 14(1): 33-47. DOI:10.1016/j.ppees.2011.08.002 |
| [42] |
HANDLEY L L, RAVEN J A. The use of natural abundance of nitrogen isotopes in plant physiology and ecology[J]. Plant Cell Environ, 1992, 15(9): 965-985. DOI:10.1111/j.1365-3040.1992.tb01650.x |
| [43] |
WATMOUGH S A. An assessment of the relationship between potential chemical indices of nitrogen saturation and nitrogen deposi- tion in hardwood forests in southern Ontario[J]. Environ Monit Assess, 2010, 164(1/2/3/4): 9-20. DOI:10.1007/s10661-009-0870-4 |
 2022, Vol. 30
2022, Vol. 30


