2. 上海辰山植物园, 华东野生濒危资源植物保育中心, 上海, 201602
2. Eastern China Conservation Centre for Wild Endangered Plant Resources, Shanghai Chenshan Botanical Garden, Shanghai 201602, China
雌雄异株植物约占被子植物的5%~6%[1], 其繁殖资源分配主要包括繁殖分配和性别分配[2]。雌雄异株不同性别植株在生殖功能上存在显著差异, 雄性生殖活动仅需要产生雄花, 而雌性在生殖过程中需要产生雌花和果实, 其能量消耗和资源分配远远大于雄性[3]。因此多年生植物中, 雄株常在开花阶段分配更多资源, 雌株则在结实阶段分配更多资源[4]。繁殖策略不仅与环境资源(如光、温、水等)有关, 还与植株大小、花结构及传粉系统等密切相关[2, 5-6]。
风媒传粉系统及虫媒传粉系统被认为是雌雄异株植物主要的传粉系统, 两种及以上传粉系统同时出现在同种植物中即称为混合传粉系统[7]。风媒花一般通过增加雄花数量来维持花粉可用性以确保繁殖成功率[8-10]。虫媒花中, 昆虫为了获得花报酬(如花粉、花蜜等)而进行访花[11]。“传粉者限制假说(Pollinator limitation hypothesis)”认为传粉者通常因雄花能同时提供花粉和花蜜2种花报酬, 而歧视只提供花蜜的雌花, 出现偏好访问雄花的现象[12]。为平衡传粉者偏好访问的选择压力, 雌花会通过气味模仿[13]、奖励机制[14-15], 以及欺骗引导[16]等策略来吸引传粉昆虫, 以提升繁殖效率。对于具有混合传粉系统的雌雄异株植物, 如何在雌雄个体中进行生殖资源分配来提升繁殖效率值得深入研究。
大多数植物是依赖花部释放的挥发物向传粉者传递信息[17-18]。Tollsten等检测了柳属(Salix)植物黄花柳(S. caprea)、灰柳(S. cinerea)和S. repens的雌雄花序挥发物, 认为柳属植物雌雄株的挥发物保持了高度的相似性, 推测雌雄花序相似的挥发物能诱使传粉者同时访问雌雄花, 保证传粉的有效性[13, 15]。Dötterl等[19]对黄花柳花香挥发物进行了研究, 认为雄株的1, 4-二甲氧基苯含量比雌株更高, 因而更具吸引力。在自然居群中黄花柳雌株明显多于雄株, 雌雄花序挥发物的相似性或雄株具有更高比例的吸引传粉者的挥发物, 都能减少花粉限制的风险[20]。这一现象是否在其他柳属植物中存在, 仍需进一步研究。
杨柳科(Salicaceae)柳属在全球约有450种[21], 均为雌雄异株植物。该属植物传粉系统常为风媒和虫媒混合的传粉系统[7, 22]。不同地区和不同物种柳属植物的虫媒和风媒的传粉效率占比不同, 从几乎完全风媒到几乎完全虫媒不等, 如S. lasiolepis虫媒传粉效率达99%, 即几乎完全虫媒[23]; 而S. lanata和S. myrsinites的虫媒传粉效率仅8%和2%, 即几乎完全风媒; 另外, S. lapponum、S. herbacea、S. reticulata的虫媒传粉效率分别为47%、57%和52%, 是典型的混合传粉系统[24]。而柳属植物在雌雄株中如何平衡生殖投资策略, 同时满足风媒和虫媒条件以提升繁殖效率, 这尚需深入探讨。
本文以长梗柳(Salix dunnii)为研究对象, 通过调查福建省长梗柳野外居群的传粉系统、主要访花昆虫, 性别比例、花和花序特征、挥发物的种类及相对含量, 探讨长梗柳的传粉机制和生殖分配策略。
1 材料和方法 1.1 研究地点本研究主要在3个野外居群开展,福建省三明市沙县沙溪支流的郭墩村(117°38′55″ E, 26°25′39″ N, 海拔190~229 m)和高地村(117°39′48″ E, 26°24′ 59″ N, 海拔217.4~224.2 m),及福建省武夷山市崇阳溪的东边村(118°2′46″E, 27°46′45″N, 海拔205~ 212 m),均处于亚热带海洋性气候区, 三明市年均温20.9 ℃, 年均降水量1 268 mm, 武夷山市年均温21.1 ℃, 年均降水量1 158 mm, 气候温和湿润。
1.2 花和花序的特征统计和性别比例对郭墩村和高地村2个长梗柳野外自然居群的雌雄株花序进行抽样调查和测量[20, 25]。在调查地沿岸随机抽取长势良好的植株, 两地各选择4~5棵雌株和雄株进行调查(两地共19株, 雌、雄分别为9和10株), 每株选择树冠下部长势良好、长度大于20 cm的末端分枝枝条5~13根, 统计和测量分枝长度和花序数, 计算单位长度的花序数, 使用精度为0.01 mm的游标卡尺测量花序长度, 并利用体视显微镜(LEICA DFC550)拍摄花部。此外, 每株统计8~46个单花序的花数量, 枝条单位长度花序数=单枝条花序数/枝条长度,单位长度以1 cm计。雌花序直接用计数法进行统计; 雄花序近5朵小花排列成一轮(图 1: A), 因此雄花序花数量以轮数×5进行统计。

|
图 1 长梗柳雌雄花和花序形态。A: 雄花和雌花; B: 花序横切,示着生方式, 单花约5朵一轮; C: 雌花序; D: 中华蜜蜂访问雄花序; E: 雌花序花蜜珠。标尺=1 mm Fig. 1 Morphology of male and female flowers and catkins of Salix dunnii. A: Male and female flower; B: Cross section of male catkin showing about five flowers per round; C: Female catkin; D: Apis cerana was visiting male catkin; E: Nectar of female catkin. Bars=1 mm |
两地随机抽取雌雄各4株进行统计分析。以植株性别为因变量, 即1 (雄性)或0 (雌性), 以株数为数据分组(表 1), 随机不放回抽取2个居群雌雄株各20根枝条和分别300、40个花序, 统计枝条单位长度花序数、花序长度和花序单花数, 运用广义线性混合模型(generalized linear mixed model, GLMM)[26-27]对长梗柳雌雄株枝条单位长度花序数、花序长度和单花序花总数差异进行显著性程度检验(P < 0.05)。使用Microsoft Excel 2016进行数据统计计算。
根据线路调查法, 对郭墩村、高地村和东边村河流两岸分布的长梗柳雌雄株个体数量进行统计。使用Pearson’s Chi-squared test对性别比例(雌/雄)偏离1∶1零假设的显著性程度(P < 0.05)进行检验。
1.3 长梗柳传粉系统选择郭墩村和高地村长梗柳各5棵雌株, 分别编号为XG1~XG5和LT1~LT5, 于3月2和3日(长梗柳初花期)进行套袋套网试验[23-24, 28]。长梗柳花小且多, 因此本试验对枝条整枝进行套袋套网。设置3个处理, 每株设置3个重复:①套硫酸纸袋; ②套100目圆柱尼龙网袋, 用铁丝网支撑; ③仅标记不套袋。分别检测长梗柳无融合生殖、风媒传粉和自然结实情况。
花期过后(约4月下旬)将网袋和硫酸纸袋摘除, 于果期采收枝条, 利用体视镜统计正常发育的果和空果数量,以及果内发育和败育的种子数量, 计算座果率和结实率,座果率=(每个花序正常发育的果实数/该花序所有果实数)×100%;结实率=发育正常的种子数/总种子数×100%,其中, 正常发育果实内含至少1粒发育正常的种子, 而败育果实则含败育种子或空果; 发育正常的种子为绿色、圆润, 而败育种子为枯黄色、皱缩[29]。使用单因素方差分析(ANOVA)来检验平均座果率、平均结实率是否在不同处理(套硫酸纸袋、套网袋及无处理)之间存在差异。
1.4 主要访花昆虫和访花频率选择郭墩村长梗柳盛花期长势良好的雌雄株进行连续3 d观察, 每日观察和捕捉时间为8:00—18:00 (计划观察时间为2019年3月12—14日, 由于3月14日阴雨天气, 为了数据准确稳定, 顺延至3月15日), 观察访花昆虫种类和访花频率[30-31]。我们对访问并停留在花序上超过0.5 min的昆虫进行捕捉, 捕捉范围网杆(5 m)所能及高度内的访花昆虫, 雌雄株每30 min交替捕捉, 统计每30 min雌雄株上出现的昆虫数量, 将捕获的昆虫放入装有乙酸乙酯的毒瓶中杀死, 制成标本, 标本交由中国科学院动物研究所鉴定。
采用Microsoft Excel 2016和R v3.6.3进行数据统计计算并出图, 使用Pearson’s Chi-squared test对访花频率进行显著性程度检验(P < 0.05), 按访花昆虫对长梗柳每个性别平均日访花次数确定该昆虫访花频率[30]。
1.5 花序挥发物分析取东边村长梗柳盛花期长势良好的雌株和雄株各4株, 每株采集3个重复, 共计24个花序样品; 同时收集当地空气作为空白对照。采集的花序送往福州大学国家科技园测试中心测定挥发物。
利用顶空固相微萃取(SPME)法对长梗柳花序挥发物进行采集, 选用非极性的PDMS萃取头(65 μm PDMS/DVB), 利用全二维气相色谱-高分辨飞行时间质谱联用仪(LECO GC×MS PEGASUS HRT 4D plus)进行分析。采气前孵化(35 ℃) 1 h, 使花香挥发, 同时萃取头在280 ℃下老化0.5 h,以后萃取前均280 ℃老化5 min。将老化的萃取头插入采样瓶中, 置于待测样品上方约1 cm处萃取0.5 h,拔出针头后入GC-MS进样口解吸4 min。一维GC条件为: Rxi-5ms石英毛细管柱(30 m×0.25 mm×0.25 μm), 进样采用不分流模式, 柱温40 ℃保持7 min, 以3 ℃/min升温至260 ℃, 保持10 min。传输线温度280 ℃, 进样口温度280 ℃。载气为高纯氦气, 流速为1.4 mL/min。二维GC条件为: Rxi-17Sil石英毛细管柱(2 m×0.25 mm×0.25 μm), 二维炉温在一维炉温基础上+5 ℃, 调制器温度在二维炉温基础上+15 ℃, 调制周期4 s, 每次热吹0.8 s, 每次冷吹1.2 s。MS条件为: 以电子轰击方式(EI)电离, 扫描范围35~500 amu, 电子能量为70 eV; 离子源温度250 ℃, 溶剂延迟240 s, 扫描速度200谱图/s, 一维和二维MS条件一致。
挥发物鉴定首先利用仪器自带的标准谱库(NIST 2017库)和增加wiley10数据库检索, 并参阅文献资料加以确定化合物。可能由于样品浓度过低或仪器质谱检测限较高导致2个雌花序样本和1个雄花序样本数据无法使用, 最终我们使用了10个雌花序样本及11个雄花序样本进行后续统计分析。根据CAS号, 利用化源网(https://www.chemsrc.com/)确定化合物名称。对雌雄花序挥发物含量的分析时, 要求各个样本挥发物的筛选条件为相对含量大于1%且与标准谱库的相似度大于85%, 筛选过后有1个雌花序样本不满足上述条件, 因此仅使用了9个雌花序样本及11个雄花序样本进行NMDS分析。
根据非度量多维标度分析法(NMDS), 使用Vegan (https://github.com/vegandevs/vegan) (R v3.6.3)对雌雄株花序挥发物组成成分进行划分, 以Stress值(值越小, 拟合效果越好)作为判断NMDS排序结果拟合优度的标准, 并对不同样本的相似性在二维平面进行可视化展示[32]。采用Mann-Whitney U test对长梗柳雌雄花序挥发物相对含量进行显著性检验。
2 结果和分析 2.1 花和花序统计及性别比例情况长梗柳花期在3月上旬至4月下旬, 花药颜色为黄色, 雄花和雌花均含有腺体(图 1: A), 可以为蜜蜂提供花蜜来源。
运用GLMM对长梗柳雌雄株1 cm枝条花序数、花序长度和单花序花数进行统计(表 1), 共测量197根枝条(雌株88根, 雄株109根)、3 044个花序(雌花序1 199个, 雄花序1 845个), 并统计375个花序(雌花序134个, 雄花序241个)上的花。结果表明, 雄株单位长度枝条的花序数显著多于雌株(M: 0.53± 0.03, n=40; F: 0.41±0.03, n=40; F=8.31, P=0.005); 此外雄株单花序的花朵数也明显多于雌株(M: 110±2, n=80; F: 60±1, n=80; F=611.63, P < 0.000 1),而雌株的平均花序长度显著长于雄株[F: (65.17±0.75) mm, n=600; M: (60.47±0.75) mm, n=600; F=19.81, P < 0.000 1]。可见, 长梗柳雌雄株的枝条花序数、花序长度和单花序花数的差异均达到显著水平。
| 表 1 长梗柳雌雄株的花序特征 Table 1 Catkin characters of female and male of Salix dunnii |
居群的性别比调查结果表明(图 2),东边村显著偏雄(♂∶♀=1.28∶1, n=336∶263, χ2=4.22, P= 0.04 < 0.05), 郭墩村(♂∶♀=1.21∶1, n=318∶263, χ2= 2.423, P=0.12)和高地村(♂∶♀=1.06∶1, n=132∶125, χ2=0.049, P=0.83)均不显著偏离1∶1。
|
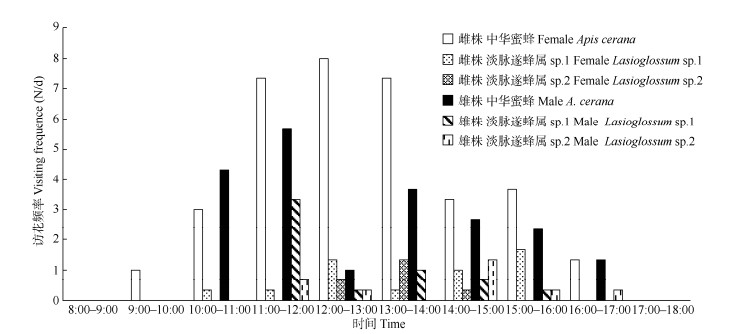
图 2 长梗柳雌雄株主要访花昆虫日访花频率 Fig. 2 Daily visiting frequency of main visiting insects of male and female Salix dunnii |
由于雨水和人为等因素的干扰, 部分套袋被破坏, 排除被破坏的套袋数据后, 最终统计了4棵长梗柳雌株(郭墩村XG1、XG2和高地村LT1、LT3)共4 053个果实16 930粒种子。其中, 套硫酸纸袋的枝条共产生297个空果,没有成熟果, 座果率0.00%; 套网袋的枝条共产生562个空果和427个成熟果, 座果率达43.90%, 成熟果里有718粒发育种子和61粒败育种子; 自然状态下的枝条共产生116个空果和2 551个成熟果, 座果率高达90.90%, 成熟果中含14 844粒发育种子和1 307粒败育种子。经单因素方差分析(ANOVA)表明, 自然传粉的座果率显著高于套网袋处理(F=9.63, P=0.02), 套网袋处理显著高于套硫酸纸袋处理(F=8.94, P=0.02); 自然传粉的结实率与套网袋处理的差异不显著(F= 0.87, P=0.39), 套网袋处理的平均座果率显著高于套硫酸纸袋处理(F=14.53, P < 0.05) (表 2)。
| 表 2 长梗柳的座果率和结实率 Table 2 Fruiting rate and setting rate of Salix dunnii |
本研究共捕获和鉴定长梗柳的访花昆虫4目22科40属44种(表 3), 主要是膜翅目(Hymenoptera)的蜜蜂科(Apidae)、隧蜂科(Halictidae)、胡蜂科(Vespidae)、地蜂科(Andrenidae)和叶蜂科(Tenthredinidae); 双翅目(Diptera)的实蝇科(Tephritidae)、食蚜蝇科(Syrphidae)、花蝇科(Anthomyiidae)、丽蝇科(Calliphoridae)、麻蝇科(Sarcophagidae)、舞虻科(Empididae)、毛蚊科(Bibionidae)和蝇科(Muscidae);鞘翅目(Coleoptera)的瓢虫科(Coccinellidae)、伪叶甲科(Lagriidae)、花萤科(Cantharidae)、步甲科(Carabidae)、大蕈甲科(Erotylidae)、象甲科(Curculionidae)和天牛科(Cerambycidae);半翅目(Homoptera)的蝽科(Pentatomidae)和叶蝉科(Cicadellidae)。雌雄株共有访花昆虫包括蜜蜂科、隧蜂科、胡蜂科、叶蜂科、丽蝇科、毛蚊科、舞虻科、食蚜蝇科、花萤科昆虫,雌株独有的访花昆虫主要包括隧蜂科隧蜂属、胡蜂科约马蜂(Polistes jokahamae)、舞虻科平须舞虻属、麻蝇科昆虫,雄株独有的访花昆虫主要包括瓢虫科红颈盘瓢虫(Lemnia melanaria)以及伪叶甲科昆虫。
| 表 3 长梗柳主要访花昆虫名录 Table 3 List of main flower-visiting insects of Salix dunnii |
主要访花昆虫为蜜蜂科膜翅目的中华蜜蜂(Apis cerana, 1 793)和隧蜂科淡脉隧蜂属昆虫(Lasioglossum sp. 1和sp. 2)。中华蜜蜂占雄株总访花昆虫的45.65%, 占雌株总访花昆虫的52.50%, 淡脉隧蜂属昆虫次之, 分别占雄雌株访花昆虫的18.84%♂和11.00%♀, 且停留时间为0.5~5 min。其他访花昆虫分别占雄雌株总访花昆虫的35.51%♂和36.50%♀。
对访花的中华蜜蜂进行3 d网捕,结果表明(图 2), 12日访问雌花的中华蜜蜂(37只)多于访问雄花的(12只), 13日访问雌花的中华蜜蜂(24只)与访问雄花的(26只)相近, 15日访问雌花的中华蜜蜂(44只)多于访问雄花的(25只), 中华蜜蜂显著倾向访问雌花(χ2=8.07, P=0.018 < 0.05)。
2.4 花序挥发物雌株和雄株共有挥发物14种, 雌株特有的9种, 雄株特有的15种(表 4)。雌雄株花序共有挥发性成分相对含量有所差异, 雌株比雄株多的有: β-石竹烯(P < 0.001)、2-甲基丁腈(P < 0.05)、环五聚二甲基硅氧烷(P < 0.001)、2, 2, 4, 6, 6-五甲基庚烷(P < 0.001)、八甲基环四硅氧烷(P < 0.001)、Germacrene d和2, 3-dimethyl butanedinitrile; 雄株比雌株多的有: α-蒎烯、桧烯、trans-α-ocimene、月桂烯、(-)-β-蒎烯、(S)-(-)-柠檬烯和(3E)-4, 8-二甲基-1, 3, 7-壬三烯。
| 表 4 长梗柳雌、雄株花序的挥发性成分 Table 4 Volatile compounds in female and male catkins of Salix dunnii |
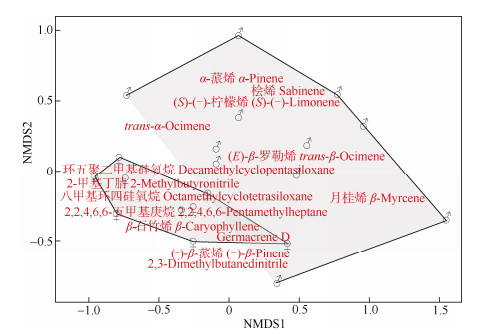
对雌雄花序中14种共有挥发性成分进行NMDS分析(Stress=0.16), 结果表明雌雄花序挥发性成分存在部分重叠, 但分离显著(图 3)。对雌雄花序不同挥发性成分相对含量进行Shapiro正态性检验, Mann- Whitney U test比较结果表明,β-石竹烯在雌花序中的含量与雄花序呈极显著差异(P=0.000 093 62 < 0.001)。
|
图 3 长梗柳雌雄花序共有挥发物NMDS分析 Fig. 3 Non-metric multidimensional scaling (NMDS) analysis of volatile components shared in male and female catkins of Salix dunnii |
套硫酸纸袋试验结果表明, 长梗柳不存在无融合生殖的现象; 套网袋的平均座果率为43.9%, 而套硫酸纸袋的为0.00%, 二者差异显著,说明风媒传粉具有重要作用; 自然状态的平均座果率为90.9%, 较套网袋处理的显著增加, 说明昆虫传粉也具有重要作用[23], 因此长梗柳传粉系统为风媒和虫媒混合系统, 平均风媒、虫媒传粉效率分别为71.5%和28.5%, 说明风媒传粉效率更高, 这与Tamura等[7]对S. miyabeana和S. sachalinensis传粉系统的研究结果一致。雌雄株上同时出现且数量最丰富的昆虫是膜翅目蜜蜂科蜜蜂属的中华蜜蜂(45.65%♂, 52.50%♀), 其次是膜翅目膜隧蜂科淡脉隧蜂属(Lasioglossum)的昆虫(18.84%♂, 11.00%♀), 是长梗柳潜在的主要传粉者, 中华蜜蜂访问雌花频率显著高于雄花(P=0.018), 淡脉隧蜂属的2种昆虫访雌雄花频率差异不显著。这进一步支持蜂类是柳属植物的主要传粉者[19, 33]。
3.2 长梗柳的生殖投资策略雌花序长度明显大于雄花序, 较长的花序可能更有利于扩大吸附花粉的面积和访花昆虫的落脚面积, 从而提升结实率, 达到资源配比的最优值[24]。雄株的平均单枝着生花序数和平均花序花数均明显多于雌株, 这与前人[8, 19, 22]的研究结果一致,可能利于风媒传粉。
繁殖资源分配在个体水平可以体现在两性的性别比例上[6, 34], 长梗柳的3个野外居群中雄株数量均较雌株多, 但其中2个居群差异不显著, 仍需长期更大尺度的调查, 以进一步确定[34-36]。在雌雄异株多年生植物中, 雄性早于雌性成熟的现象普遍存在, 性别比例会有所偏倚, 这可能是性分配差异所致[36-37]。此外, Pucholt等[38]报道S. viminalis的雌雄株性比偏倚与ZW性别决定系统有关,而长梗柳偏雄性比是否与其具有的XY性别决定系统[39]有关尚需进一步研究。
长梗柳雌花β-石竹烯的相对含量[(14.58± 8.34)%]显著高于雄花(P < 0.001), 而β-榄香烯[(0.18± 0.54)%]、芳樟醇[(0.22±0.66)%]仅在雌花序中检出。这些花香挥发性成分在吸引中华蜜蜂及其他访花昆虫中起到关键信号作用[40-43]。根据NMDS结果, 雌雄花序挥发性成分仅有部分重叠, 分离达到了显著水平, 而雄性占据了更多的面积代表雄花序挥发性成分的相对含量更多, 但吸引主要访花昆虫中华蜜蜂的物质β-石竹烯在雌花序中的含量极显著(P < 0.001)高于雄花序。有研究表明,温带和寒带柳属植物的挥发性成分中均有对访花昆虫具有吸引作用的1, 4-二甲氧基苯[44-45], 但我们在亚热带的长梗柳中并没有鉴定出1, 4-二甲氧基苯, 这可能是由于植物的花香气味受到地理环境因素的影响而产生了相应的变化[46]。然而长梗柳花序挥发性成分多达38种, 含量较高的挥发性成分,如α-蒎烯、2-甲基丁腈、环五聚二甲基硅氧烷和2, 2, 4, 6, 6-五甲基庚烷等是否具有吸引访花昆虫的作用尚不明确。
综上所述, 长梗柳雄株在早期繁殖资源分配中投入更多的能量, 体现在花朵和花序数量上, 这是确保风媒传粉效率的前提; 雌株则通过产生吸引访花昆虫的挥发性成分来抵抗“传粉者限制”效应, 或许可以加强虫媒传粉的效率。本研究支持长梗柳为虫媒风媒的混合传粉系统, 通过风媒和虫媒有效组合提升繁殖效率。
致谢 特别感谢福州大学测试中心刘薇老师对挥发性成分进行测试, 中国科学院动物研究所吴超老师鉴定访花昆虫, 福建农林大学马晓开老师对本文提出的建设性建议。
| [1] |
RENNER S S. The relative and absolute frequencies of angiosperm sexual systems: Dioecy, monoecy, gynodioecy, and an updated online database[J]. Am J Bot, 2014, 101(10): 1588-1596. DOI:10.3732/ajb.1400196 |
| [2] |
PENG D L, ZHANG Z Q, NIU Y, et al. Advances in the studies of reproductive strategies of alpine plants[J]. Biodiv Sci, 2012, 20(3): 286-299. 高山植物繁殖策略的研究进展[J]. 生物多样性, 2012, 20(3): 286-299. DOI:10.3724/SP.J.1003.2012.14039 |
| [3] |
BOECKLEN W J, PRICE P W, MOPPER S. Sex and drugs and herbivores: Sex-biased herbivory in arroyo willow (Salix lasiolepis)[J]. Ecology, 1990, 71(2): 581-588. DOI:10.2307/1940311 |
| [4] |
FREEMAN D C, KLIKOFF L G, HARPER K T. Differential resource utilization by the sexes of dioecious plants[J]. Science, 1976, 193(4253): 597-599. DOI:10.1126/science.193.4253.597 |
| [5] |
ZHANG D Y. Plant Life History Evolution and Reproductive Ecology[M]. Beijing: Science Press, 2004. 植物生活史进化与繁殖生态学[M]. 北京: 科学出版社, 2004. |
| [6] |
HUTCHINGS M J. Resource allocation patterns in clonal herbs and their consequences for growth [M]// BAZZAZ F A, GRACE J. Plant Resource Allocation. San Diego: Academic Press, 1997: 161–181. doi: 10.1016/B978-012083490-7/50008-6.
|
| [7] |
TAMURA S, KUDO G. Wind pollination and insect pollination of two temperate willow species, Salix miyabeana and Salix sachalinensis[J]. Plant Ecol, 2000, 147(2): 185-192. DOI:10.1023/A:1009870521175 |
| [8] |
SINCLAIR J P, EMLEN J, FREEMAN D C. Biased sex ratios in plants: Theory and trends[J]. Bot Rev, 2012, 78(1): 63-86. DOI:10.1007/s12229-011-9065-0 |
| [9] |
BURD M, ALLEN T F H. Sexual allocation strategy in wind-pollinated plants[J]. Evolution, 1988, 42(2): 403-407. DOI:10.1111/j.1558-5646.1988.tb04145.x |
| [10] |
WHITEHEAD D R. Wind pollination: Some ecological and evolutionary perspectives [M]// REAL L. Pollination Biology. Orlando: Academic Press, 1983. doi: 10.1016/B978-0-12-583980-8.50012-0.
|
| [11] |
WANG Q, DENG H P, DING B, et al. Comparison of floral morphology and pollination characteristics between the sexes in Eurya obtusifolia[J]. Acta Ecol Sin, 2012, 32(12): 3921-3930. 钝叶柃不同性别花的花部形态与传粉特征比较[J]. 生态学报, 2012, 32(12): 3921-3930. DOI:10.5846/stxb201108081162 |
| [12] |
CHARLESWORTH D. Why are unisexual flowers associated with wind pollination and unspecialized pollinators?[J]. Am Nat, 1993, 141(3): 481-490. DOI:10.1086/285485 |
| [13] |
TOLLSTEN L, KNUDSEN J T. Floral scent in dioecious Salix (Salicaceae): A cue determining the pollination system?[J]. Plant Syst Evol, 1992, 182(3/4): 229-237. DOI:10.1007/BF00939189 |
| [14] |
HEMBORG Å M, BOND W J. Different rewards in female and male flowers can explain the evolution of sexual dimorphism in plants[J]. Biol J Linn Soc, 2005, 85(1): 97-109. DOI:10.1111/j.1095-8312.2005.00477.x |
| [15] |
WILLSON M F, ÅGREN J. Differential floral rewards and pollination by deceit in unisexual flowers[J]. Oikos, 1989, 55(1): 23-29. DOI:10.2307/3565868 |
| [16] |
DUFAΫ M, ANSTETT M C. Cheating is not always punished: Killer female plants and pollination by deceit in the dwarf palm Chamaerops humilis[J]. J Evol Biol, 2004, 17(4): 862-868. DOI:10.1111/j.1420-9101.2004.00714.x |
| [17] |
KNAUER A C, SCHIESTL F P. Bees use honest floral signals as indicators of reward when visiting flowers[J]. Ecol Lett, 2015, 18(2): 135-143. DOI:10.1111/ele.12386 |
| [18] |
SRINIVASAN M V, ZHANG S W, ZHU H. Honeybees link sights to smells[J]. Nature, 1998, 396(6712): 637-638. DOI:10.1038/25272 |
| [19] |
DÖTTERL S, GLÜCK U, JÜRGENS A, et al. Floral reward, advertisement and attractiveness to honey bees in dioecious Salix caprea[J]. PLoS One, 2014, 9(3): e93421. DOI:10.1371/journal.pone.0093421 |
| [20] |
ELMQVIST T, ÅGREN J, TUNLID A. Sexual dimorphism and between-year variation in flowering, fruit set and pollinator behaviour in a boreal willow[J]. Oikos, 1988, 53(1): 58-66. DOI:10.2307/3565663 |
| [21] |
HE L, WAGNER N D, HÖRANDL E. Restriction-site associated DNA sequencing data reveal a radiation of willow species (Salix L., Salicaceae) in the Hengduan Mountains and adjacent areas[J]. J Syst Evol, 2021, 59(1): 44-57. DOI:10.1111/jse.12593 |
| [22] |
KARRENBERG S, KOLLMANN J, EDWARDS P J. Pollen vectors and inflorescence morphology in four species of Salix[J]. Plant Syst Evol, 2002, 235(1/2/3/4): 181-188. DOI:10.1007/s00606-002-0231-z |
| [23] |
SACCHI C F, PRICE P W. Pollination of the arroyo willow, Salix lasiolepis: Role of insects and wind[J]. Am J Bot, 1988, 75(9): 1387-1393. DOI:10.1002/j.1537-2197.1988.tb14200.x |
| [24] |
PEETERS L, TOTLAND Ø. Wind to insect pollination ratios and floral traits in five alpine Salix species[J]. Can J Bot, 1999, 77(4): 556-563. DOI:10.1139/b99-003 |
| [25] |
ELMQVIST T, CATES R G, HARPER J K, et al. Flowering in males and females of a Utah willow, Salix rigida and effects on growth, tannins, phenolic glycosides and sugars[J]. Oikos, 1991, 61(1): 65-72. DOI:10.2307/3545407 |
| [26] |
BOLKER B M, BROOKS M E, CLARK C J, et al. Generalized linear mixed models: A practical guide for ecology and evolution[J]. Trends Ecol Evol, 2009, 24(3): 127-135. DOI:10.1016/j.tree.2008.10.008 |
| [27] |
KABIR F, MORITZ K K, STENBERG J A. Plant-sex-biased tritrophic interactions on dioecious willow[J]. Ecosphere, 2014, 5(12): 1-9. DOI:10.1890/ES14-00356.1 |
| [28] |
DOUGLAS D A. Pollination, capsule damage, and the production of seeds in Salix setchelliana (Salicaceae), an Alaskan glacial river gravel bar willow[J]. Can J Bot, 1997, 75(7): 1182-1187. DOI:10.1139/b97-831 |
| [29] |
GRAMLICH S, HÖRANDL E. Fitness of natural willow hybrids in a pioneer mosaic hybrid zone[J]. Ecol Evol, 2016, 6(21): 7645-7655. DOI:10.1002/ece3.2470 |
| [30] |
GONG Y B, HUANG S Q. On methodology of foraging behavior of pollinating insects[J]. Biodiv Sci, 2007, 15(6): 576-583. 传粉昆虫行为的研究方法探讨[J]. 生物多样性, 2007, 15(6): 576-583. DOI:10.3321/j.issn:1005-0094.2007.06.002 |
| [31] |
LI Y Q, ZHANG D X. Fly pollination of Antidesma montanum (Euphorbiaceae) in Hainan, China[J]. Acta Phytotaxon Sin, 2007, 45(2): 217-226. 山地五月茶的蝇类传粉研究[J]. 植物分类学报, 2007, 45(2): 217-226. |
| [32] |
FÜSSEL U, DÖTTERL S, JÜRGENS A, et al. Inter-and intraspecific variation in floral scent in the genus Salix and its implication for pollination[J]. J Chem Ecol, 2007, 33(4): 749-765. DOI:10.1007/s10886-007-9257-6 |
| [33] |
SIMON S J, KEEFOVER-RING K, PARK Y L, et al. Characterization of Salix nigra floral insect community and activity of three native Andrena bees[J]. Ecol Evol, 2021, 11(9): 4688-4700. DOI:10.1002/ece3.7369 |
| [34] |
ALSTRÖM-RAPAPORT C, LASCOUX M, GULLBERG U. Sex determination and sex ratio in the dioecious shrub Salix viminalis L.[J]. Theor Appl Genet, 1997, 94(3/4): 493-497. DOI:10.1007/s001220050442 |
| [35] |
CRAWFORD R M M, BALFOUR J. Female predominant sex ratios and physiological differentiation in arctic willows[J]. J Ecol, 1983, 71(1): 149-160. DOI:10.2307/2259968 |
| [36] |
UENO N, SUYAMA Y, SEIWA K. What makes the sex ratio female-biased in the dioecious tree Salix sachalinensis?[J]. J Ecol, 2007, 95(5): 951-959. DOI:10.1111/j.1365-2745.2007.01269.x |
| [37] |
YIN C Y, LI C Y. Gender differences of dioecious plants related sex ratio: Recent advances and future prospects[J]. Chin J Appl Environ Biol, 2007, 13(3): 419-425. 雌雄异株植物与性别比例有关的性别差异研究现状与展望[J]. 应用与环境生物学报, 2007, 13(3): 419-425. DOI:10.3321/j.issn:1006-687X.2007.03.028 |
| [38] |
PUCHOLT P, HALLINGBÄCK H R, BERLIN S. Allelic incompatibility can explain female biased sex ratios in dioecious plants[J]. BMC Genom, 2017, 18(1): 251. DOI:10.1186/s12864-017-3634-5 |
| [39] |
HE L, JIA K H, ZHANG R G, et al. Chromosome-scale assembly of the genome of Salix dunnii reveals a male-heterogametic sex determination system on chromosome 7[J]. Mol Ecol Resour, 2021, 21(6): 1966-1982. DOI:10.1111/1755-0998.13362 |
| [40] |
GERLACH G, SCHILL R. Composition of orchid scents attracting euglossine bees[J]. Bot Acta, 1991, 104(5): 379-384. DOI:10.1111/j.1438-8677.1991.tb00245.x |
| [41] |
LUO C W, HUANG Z Y, LI K, et al. EAG responses of Apis cerana to floral compounds of a biodiesel plant, Jatropha curcas (Euphorbiaceae)[J]. J Econ Entomol, 2013, 106(4): 1653-1658. DOI:10.1603/ec12458 |
| [42] |
ZHANG X M. Floral volatile sesquiterpenes of Elsholtzia rugulosa (Lamiaceae) selectively attract Asian honey bees[J]. J Appl Entomol, 2018, 142(3): 359-362. DOI:10.1111/jen.12481 |
| [43] |
BHOWMIK B, SARITA S, ALOK S, et al. Role of insect pollinators in seed yield of coriander (Coriandrum sativum L.) and their electroantennogram response to crop volatiles[J]. Agric Res J, 2017, 54(2): 227-235. DOI:10.5958/2395-146X.2017.00042.4 |
| [44] |
DÖTTERL S, FÜSSEL U, JÜRGENS A, et al. 1, 4-Dimethoxybenzene, a floral scent compound in willows that attracts an oligolectic bee[J]. J Chem Ecol, 2005, 31(12): 2993-2998. DOI:10.1007/s10886-005-9152-y |
| [45] |
FOWLER R E, ROTHERAY E L, GOULSON D. Floral abundance and resource quality influence pollinator choice[J]. Insect Conserv Divers, 2016, 9(6): 481-494. DOI:10.1111/icad.12197 |
| [46] |
MAJETIC C J, RAGUSO R A, ASHMAN T L. Sources of floral scent variation: Can environment define floral scent phenotype?[J]. Plant Sign Behav, 2009, 4(2): 129-131. DOI:10.4161/PSB.4.2.7628 |
 2022, Vol. 30
2022, Vol. 30



