红苞凤梨(Ananas comosus var. bracteatus)为凤梨科(Bromeliaceae)凤梨属多年生地生性常绿草本, 原产于南美洲,株型优美,果实红艳,是重要的热带观赏植物[1]。金边红苞凤梨(A. comosus var. bracteatus ‘Chiyan’)是经长期栽培而选育出的叶色嵌合品种,叶片中央为绿色,边缘为白色,绿白条纹嵌合的叶色特征使得金边红苞凤梨叶果兼赏,延长了观赏期,提高了观赏价值。除了观赏价值,叶片的绿白嵌合特征在植物光合作用机理、激素生理、核-质基因组相互作用、遗传育种等理论研究和实际应用中均具有无可替代的价值[2]。我们的前期研究表明,金边红苞凤梨叶片边缘白化组织的光合色素含量近趋于0,均极显著低于绿色组织[3]。徒手切片显微观察发现,金边红苞凤梨叶片边缘白化组织的叶肉细胞为无色透明状,未见明显的叶绿体分布[4]。叶绿体的发育异常会导致植物发生叶色突变[5]。花叶矢竹(Pseudosasa japonica f. akebonosuji)白叶质体类囊体片层垛叠程度低,曝光成熟后降解成小囊泡,使叶绿体形成障碍,是叶色变异的生理本质[6]。茶树(Camellia sinensis) ‘小雪芽’白化叶片的叶绿体发育异常,体积膨胀变大,并且基粒片层和类囊体膜结构发育受阻,出现囊状空泡[7]。因此,金边红苞凤梨叶片边缘组织的白化和绿白嵌合性状的形成可能与叶肉细胞叶绿体的发育紧密相关。Golden2-like (GLK)蛋白是核基因组中调控叶绿体发育的重要转录因子[8]。研究表明,拟南芥glk1glk2双突变体全株褪绿,叶绿素含量显著下降, 叶绿体横截面积约是野生型的50%,并且其堆叠的基粒高度降低[8]。自从拟南芥(Arabidopsis thaliana)中克隆出AtGLK1和AtGLK2后,其他物种,如水稻(Oryza sativa)、番茄(Lycopersicon esculentum)、小立碗藓(Physcomitrella patens)等的鉴定和表征分析工作也不断进行[8–14]。
本研究以金边红苞凤梨为材料,对其叶片进行了超微结构观察,并克隆了AbGLK1基因,对其编码的AbGLK1蛋白进行了生物信息学、转录激活活性和亚细胞定位分析,利用RT-qPCR检测了AbGLK1基因在金边红苞凤梨不同组织中的表达水平,分析了AbGLK1基因的表达与金边红苞凤梨嵌合叶片叶绿体发育的关系,为进一步研究AbGLK1基因调控金边红苞凤梨叶绿体发育的分子机制提供理论依据。
1 材料和方法 1.1 材料试验材料金边红苞凤梨(Ananas comosus var. bracteatus ‘Chiyan’)购于广东省湛江市,在四川农业大学风景园林学院温室大棚(成都,中国)进行养护管理,选用长势一致,无病虫害,嵌合性状明显的植株。分别采集金边红苞凤梨根、茎以及同一成熟功能叶片的绿色组织和白化组织后用液氮速冻, 置于–80 ℃冰箱保存,用于RNA提取。剪下成熟功能叶片,插入水中,带回实验室做徒手切片和透射电镜。
1.2 超微结构观察横向截取叶片中间绿、白分界清晰部分2~3 cm, 采用双面刀片进行徒手切片,将切好的薄片做成简易切片,置于激光共聚焦显微系统下观察叶片叶绿体自发荧光并拍照。激发波长488 nm,孔径8.0 μm,共振频率7.8 Hz。
将嵌合叶片的绿色组织和白化组织分别切成1 mm×1 mm小块放入3% (V/V)戊二醛中,于4 ℃冰箱中保存。透射电镜样品制备参考李春雷和倪德江的方法,用LEICADC61C超薄切片机切片,在JEM-1010电子显微镜下观察叶绿体超微结构[15]。
1.3 AbGLK1基因的克隆总RNA的提取和cDNA的合成 采用LAB GENETM植物RNA提取试剂盒(多糖多酚样本,兰博基因)提取样品的总RNA,提取的总RNA经Nano Drop 2000 spectrophotometer (Thermo Scientific)和1.2%的凝胶电泳检测合格后,以其为模板,利用Evo M-MLV RT Kit whit gDNA Clean for qPCR Ⅱ试剂盒(艾科瑞生物)合成cDNA,置于–20 ℃冰箱保存。
基因克隆 在已获得的金边红苞凤梨转录组信息的基础上,利用Premier premier 5.0设计引物(表 1),以金边红苞凤梨叶片cDNA为模板进行AbGLK1基因开放阅读框(ORF)全长扩增。PCR反应体系(25 μL):cDNA模板1 μL,上下游引物各1 μL, Mix(green)Golden Star T6 Super PCR Mix (1.1×) 22 μL (擎科生物)。PCR反应程序:98 ℃预变性2 min;然后98 ℃变性10 s,53.5 ℃退火10 s,72 ℃延伸20 s,共35个循环;最后72 ℃延伸1 min。PCR产物经过电泳和胶回收后,连接到克隆载体pClone007 (擎科生物),并转化大肠杆菌DH5α感受态。挑取PCR检测阳性的菌液送至成都擎科公司测序。
| 表 1 引物列表 Table 1 Primer list of this study |
利用NCBI上的ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/)查找AbGLK1的开放阅读框, 并推测其氨基酸序列;运用ExPASy ProtParam (https://web.expasy.org/protparam/)分析AbGLK1蛋白的理化性质;使用ProtScale (https://web.expasy.org/protscale/)分析氨基酸的疏水性与亲水性;通过NetPhos 2.0 Server (https://www.cbs.dtu.dk/services/NetPhos)预测磷酸化位点;通过SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/sespredsopma.pl)预测蛋白质二级结构;通过SignalP 4.1 Server (https://www.cbs.dtu.dk/services/SignalP)进行信号肽预测;利用TMHMM Server对蛋白进行跨膜结构预测(https://www.cbs.dtu.dk/services/TMHMM-2.0guide.html); 利用PSORT Ⅱ Server (https://www.genscript.com/psort.html)进行蛋白的亚细胞定位分析;利用NCBI上的blastp程序查找AbGLK1蛋白在不同植物中的同源序列,并利用MEGA 7.0软件进行多重序列比对和系统进化树的构建。
1.5 AbGLK1蛋白亚细胞定位分析将亚细胞定位载体和p131-35s-YFP空载转化农杆菌GV3101感受态。转化成功的农杆菌菌液过夜扩摇,离心,弃上清,用相同菌液体积悬浮液(10 mmol/L MgCl2,100 μmol/L AS,10 mmol/L MES)重悬菌体,室温静置3 h后注射4~5叶期的本氏烟草(Nicotiana benthamiana)叶片。注射3~5 d后,以p131-35s-YFP空载为对照,利用激光共聚焦显微镜观察带有黄色荧光标记的AbGLK1蛋白在烟草叶片中的分布情况。
1.6 AbGLK1蛋白转录激活活性分析将阳性对照pGBKT7-53+pGADT7-T、阴性对照pGBKT7-Lam+pGADT7-T和重组诱饵载体pGBKT7-AbGLK1分别转入Y2H Gold酵母感受态(维地生物)中,并涂布于相应的缺陷型固体培养基上,倒置于30 ℃恒温箱中培养3~5 d,观察其生长情况。挑取直径为2~3 mm的单菌落接种到YPDA液体培养基中,于30 ℃,250 r/min摇床培养12 h,分别稀释0、10、100倍,均匀点样于相应的含有100 ng/mL AbA的SD/-Trp/-Leu/X-α-gal和SD/-Trp/X-α-gal缺陷型固体培养基上,观察菌斑生长情况,以判断能否激活报告基因。
1.7 AbGLK1基因的表达分析利用RT-qPCR技术检测AbGLK1基因在金边红苞凤梨不同组织中的表达情况。以金边红苞凤梨不同组织(根、茎和同一叶片的绿色和白化组织)的cDNA为模板,参照SYBR® Green Premix Pro Taq HS qPCR Kit说明书(艾科瑞生物)进行RT-qPCR扩增。反应体系25 μL:2X SYBR® Green Pro Taq HS Premix 12.5 μL,模板cDNA 1 μL,上下游引物各0.5 μL,RNase free water 10.5 μL。扩增程序为:95 ℃预变性30 s;然后95 ℃变性5 s,58 ℃退火15 s,72 ℃延伸15 s,共40个循环。每个样品3次生物学重复,每个生物学重复设置3次技术重复,采用2–ΔΔCT法计算基因的相对表达量。
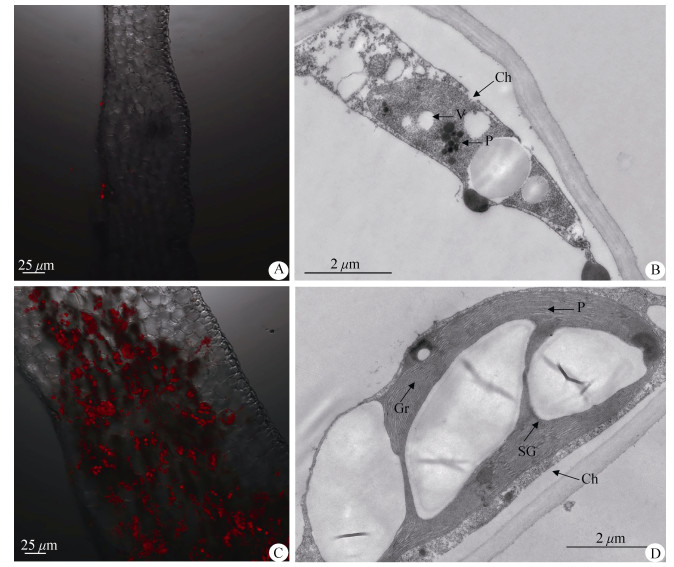
2 结果和分析 2.1 叶片中叶绿体的分布和超微结构叶绿体在反射光下呈现红色,这种现象称为叶绿素荧光现象。在激光共聚焦显微镜下,叶片边缘白化组织部分没有检测到红色荧光(图 1: A);叶片中心绿色组织部分绝大多数细胞发出红色荧光,并能清晰地看到叶肉细胞内密集分布着椭圆形叶绿体(图 1: C),说明金边红苞凤梨嵌合叶片白化组织没有结构完整、能够发出叶绿素荧光的叶绿体。为了进一步弄清绿、白组织中叶绿体结构的差异,采用透射电镜检测了叶片绿色组织和白化组织的叶绿体超微结构,结果表明白化组织叶肉细胞中的叶绿体结构异常,内膜系统模糊,无类囊体存在,含有大量囊状小泡,质体小球数量多且体积较大(图 1: B)。而绿色组织叶肉细胞中的叶绿体结构完整,呈梭状或长椭圆形,能清晰见到淀粉粒,内膜形成丰富的基粒类囊体,基粒片层结构明显且排列整齐,质体小球零星分布在叶绿体内(图 1: D)。这说明金边红苞凤梨叶片白化组织叶绿体的类囊体膜和基粒片层未发育成熟,导致叶绿体结构异常,不能正常积累叶绿素,从而表现出白化表型。
|
图 1 金边红苞凤梨叶片中叶绿体的分布(A, C)和超微结构(B, D)。A, B: 白化组织; C, D: 绿色组织; Ch: 叶绿体; Gr: 基粒; SG: 淀粉粒; P: 质体小球; V: 囊泡。 Fig. 1 Distribution (A, C) and ultrastructure (B, D) of chloroplast in leaves of Ananas comosus var. bracteatus 'Chiyan'. A, B: Albino tissue; C, D: Green tissue. Ch: Chloroplast; Gr: Grana; SG: Starch granule; P: Plastoglobulus; V: Vesicles. |
金边红苞凤梨叶片边缘白化组织表现出典型的叶绿体发育异常现象,是其叶片白化的关键原因。GLK基因是核基因组中调控叶绿体发育的重要转录因子。为揭示叶片边缘白化组织叶绿体发育异常的分子调控机制,对金边红苞凤梨中的AbGLK1进行ORF全长扩增,得到1个约1 500 bp的目的片段,片段大小与预期一致。测序结果表明, AbGLK1基因含有1个1 371 bp的开放阅读框,编码456个氨基酸(图 2)。

|
图 2 金边红苞凤梨AbGLK1的核苷酸序列和推测的氨基酸序列 Fig. 2 Nucleotide sequence of AbGLK1and deduced amino acid sequence in Ananas comosus var. bracteatus 'Chiyan' |
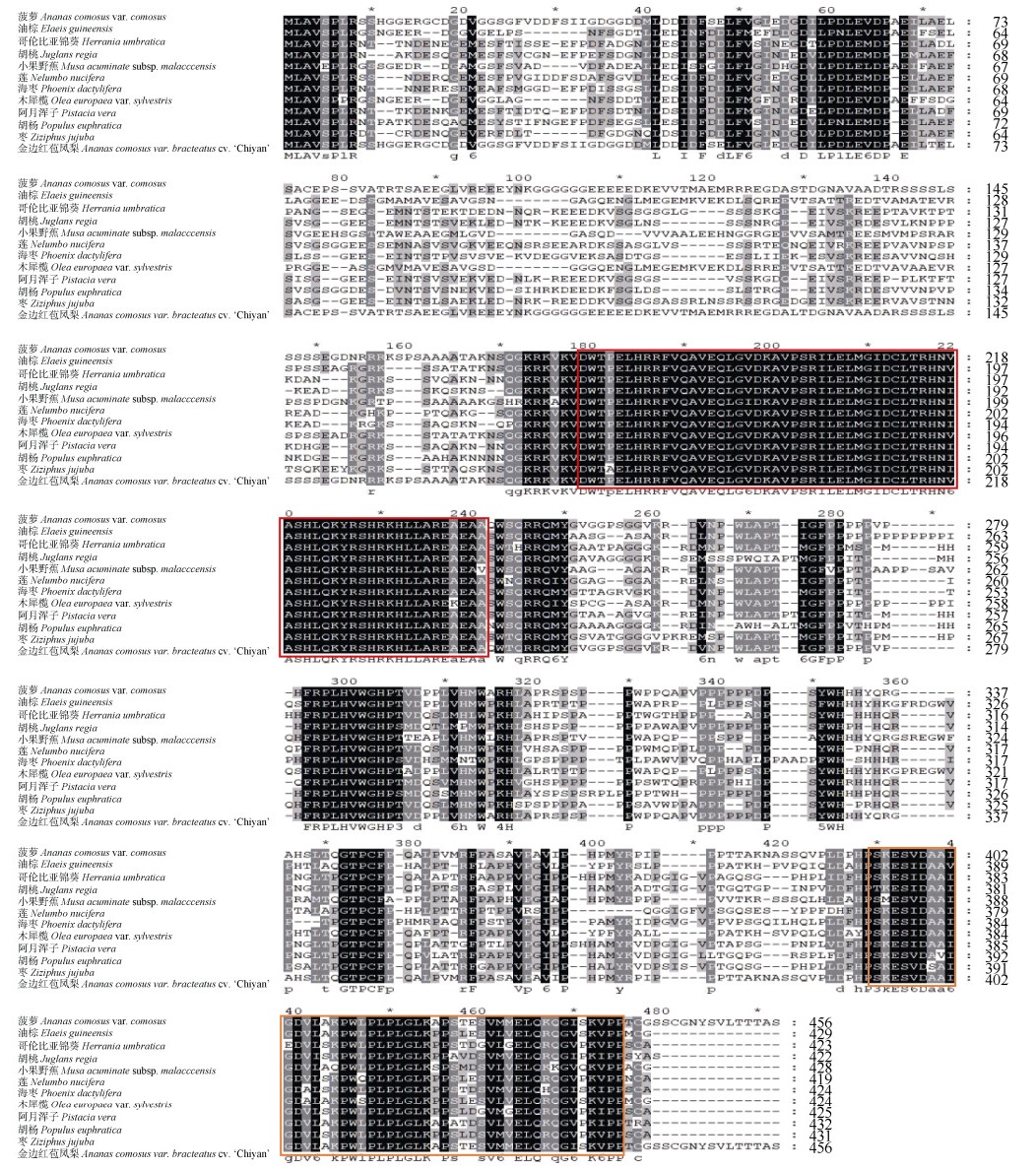
在NCBI数据库中使用blastp检索不同植物中GLK蛋白的同源序列,比对结果表明,AbGLK1的氨基酸序列与菠萝(A. comosus var. comosus, XP_ 020100867.1)的相似性最高(99.12%),其次是海枣(Phoenix dactylifera, XP_008783138.1, 60.7%)和油棕(Elaeis guineensis, XP_010916010.1, 60.35%),与胡桃(Juglans regia, XP_018834281.1)、小果野蕉(Musa acuminata sp. malaccensis, XP_009381033.1)、莲(Nelumbo nucifera, XP_010260326.1)、木犀榄(Olea europaea var. sylvestris, XP_022877228.1)、阿月浑子(Pistacia vera, XP_031255395.1)、胡杨(Populus euphratica, XP_011047697.1)、枣(Ziziphus jujube, XP_015881406.1)、哥伦比亚锦葵(Herrania umbratica, XP_021279775.1)等的相似度较低,约为50%~60%。利用MEGA 7.0软件进行多重序列比对,结果表明,AbGLK1蛋白和其他物种的GLK蛋白都含有高度保守的GARP-DNA结合域和C末端结构域GCT box (GOLDEN2 C-terminal box),符合GLK转录因子家族的典型结构特征。位于N末端的GARP-DNA结合域包含1个HLH基序,第1个螺旋由以PELHRR基序为起始的14个氨基酸组成,第2个螺旋以NI/VASHLQ基序为起始,2个螺旋中间是包含22个氨基酸的环(图 3)。
|
图 3 金边红苞凤梨AbGLK1与其他植物GLK蛋白的氨基酸序列多重比对分析。红色方框为保守的GARP-DNA结合域,橙色方框为保守的GCT box。 Fig. 3 Multiple alignment of amino acid sequences of AbGLK1 in Ananas comosus var. bracteatus 'Chiyan' and GLK proteins in other plants. The red boxes show the conserved GARP-DNA binding domain, and orange boxes show the conserved GCT binding domain. |
为研究AbGLK1在GLK转录因子家族中的系统进化地位,利用MEGA 7.0软件中的Neighborjoining方法分析AbGLK1蛋白与拟南芥(NP_00118 9562.1, NP_199232.1)、番茄(NP_001266193.1, NP_ 001266252.1)、桃(Prupe.3G127700)、水稻(XP_01564 4244.1, XP_015615913.1)、玉米(NP_001105513.1, NP_001105018.1)、菠萝(XP_020100867.1)间的进化关系。由图 4可知,AbGLK1转录因子与菠萝的GLK亲缘关系最近。金边红苞凤梨、菠萝、玉米、水稻等单子叶植物的GLK聚为一支,而拟南芥、桃、番茄等双子叶植物的GLK间的距离较远,说明单、双子叶植物的GLK同源蛋白有明显差异。此外, 在单子叶分支中,AbGLK1与玉米ZmGLK1和水稻OsGLK1聚为同一亚支,说明AbGLK1可能与ZmGLK1以及OsGLK1有着相似的功能。

|
图 4 金边红苞凤梨AbGLK1与其他植物GLK蛋白的系统发育分析 Fig. 4 Phylogenetic analysis of AbGLK1 in Ananas comosus var. bracteatus 'Chiyan' and GLK proteins in other plants |
AbGLK1蛋白由20种氨基酸组成,其中含量最高的是脯氨酸(Pro, 11.8%)和丝氨酸(Ser, 9.2%)。该蛋白原子总数为6 822,分子量为49.090 kDa,推测分子式为C2153H3369N621O662S17,理论等电点为5.79, 酸性氨基酸(Asp+Glu)占12.5%,碱性氨基酸(Arg+Lys)占9.87%,不稳定指数为66.09,脂肪系数为69.52。氨基酸亲水性(负值)和疏水性(正值)全部分布在–3.233~1.589,其中峰值分布在负值的比例明显高于峰值分布在正值的比例,平均亲水指数为–0.508,说明该蛋白为亲水性蛋白。亲水性最强的位点和疏水性最强的位点分别是第153、154位的天冬氨酸(Asn)、精氨酸(Arg)和第362、363位的丙氨酸(Ala)、缬氨酸(Val)。磷酸化位点预测表明, AbGLK1蛋白含有32个丝氨酸(Ser)磷酸化位点, 13个苏氨酸(Thr)磷酸化位点以及3个酪氨酸(Tyr)磷酸化位点。信号肽序列和跨膜结构预测结果表明该蛋白没有信号肽和跨膜结构。二级结构表明, 该蛋白存在丰富的无规卷曲(64.69%)和α-螺旋(26.97%),而延伸链(5.70%)和β-转角(2.63%)相对较少。
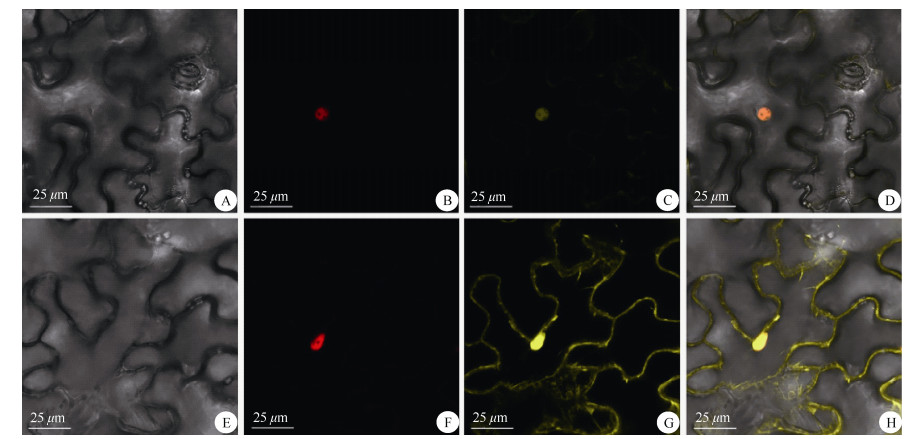
2.5 AbGLK1蛋白的亚细胞定位分析为明确AbGLK1转录因子在植物细胞中的定位情况,利用农杆菌介导的烟草瞬时表达技术进行亚细胞定位研究,通过激光共聚焦显微镜观察侵染后烟草叶片中的荧光信号分布情况。从图 5可见, 带有黄色荧光标记的AbGLK1蛋白主要分布于细胞核中,而对照的荧光信号在整个细胞中均能被检测到,这说明AbGLK1定位在细胞核中,与PSORTⅡ Server的预测结果一致。
|
图 5 金边红苞凤梨AbGLK1的亚细胞定位。A: 明场; B: 细胞核定位maker的荧光场; C: AbGLK1黄色荧光蛋白; D: 3个通道的叠加; E~H: 空载体对照。 Fig. 5 Subcellular localization of AbGLK1 in Ananas comosus var. bracteatus 'Chiyan'. A: Bright field; B: Nuclei-maker; C: AbGLK1 YFP; D: Merged signal of the three channels; E-H: Empty vector control. |
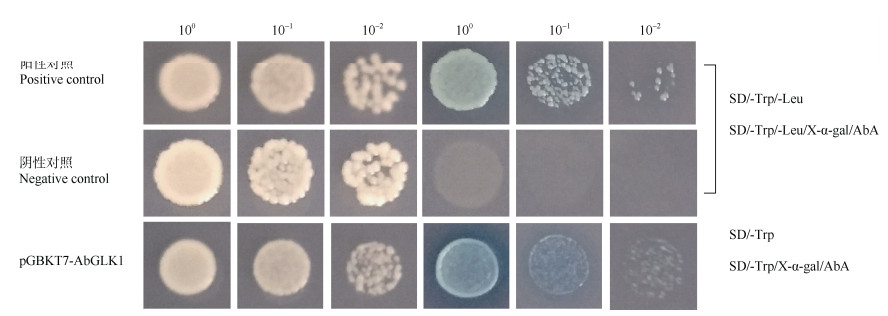
转录因子的转录调控区域可以抑制或者激活基因的转录活性,但是有的转录因子可能不含有转录调控区域[16]。从图 6可见,阳性对照和阴性对照在SD/-Trp/-Leu培养基上均能正常生长。在SD/-Trp/-Leu/X-α-Gal/AbA培养基上,只有阳性对照能够正常生长,而阴性对照不能生长。转化了pGBKT7-AbGLK1载体的Y2HGold酵母细胞在SD/-Trp和SD/-Trp/X-α-Gal/AbA培养基上均能生长。这说明AbGLK1蛋白具有转录激活活性,促使下游报告基因AbAr和MEL1表达,从而使酵母细胞在添加了AbA和X-α-Gal时仍然可以生长并且显蓝色。蛋白转录激活活性的验证说明AbGLK1具备转录因子的调控下游基因表达的基本功能,能够通过结合下游靶基因的启动子,启动下游靶基因的表达。
|
图 6 金边红苞凤梨AbGLK1的转录激活活性 Fig. 6 Transcriptional activation assay of AbGLK1 in Ananas comosus var. bracteatus 'Chiyan' |
从图 7可见,AbGLK1在金边红苞凤梨的根、茎和叶片中均有表达,但具有组织器官差异性。AbGLK1在根中的表达水平最低,茎中的表达水平是根中的33.29倍。嵌合叶片绿色组织和白化组织中的表达水平都显著高于根和茎(P < 0.05),分别是根的176.64和63.93倍。金边红苞凤梨的嵌合叶片分化成为了具有完整叶绿体结构、富含叶绿素的绿色组织和叶绿体发育异常、不含叶绿素的白化组织。AbGLK1基因在边缘白化组织中的表达水平显著低于绿色组织,约为绿色组织的1/3 (P < 0.05)。这说明AbGLK1基因的下调表达可能是白化组织叶绿体发育异常的原因之一。
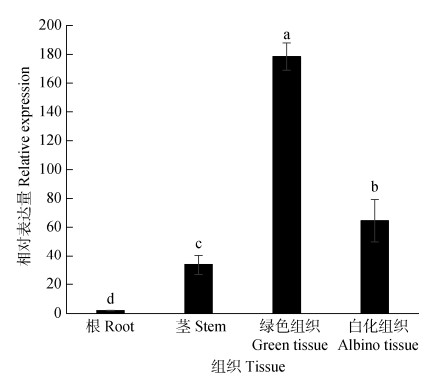
|
图 7 金边红苞凤梨AbGLK1基因的表达。柱上不同字母表示差异显著(P < 0.05)。 Fig. 7 Expression of AbGLK1 in Ananas comosus var. bracteatus 'Chiyan'. Different letters upon column indicate significant difference at 0.05 level. |
在本研究中,金边红苞凤梨叶片白化组织叶绿体内膜解体、呈囊泡状结构, 无明显基粒结构,也无完整类囊体片层结构,在结构上属于不正常的叶绿体。这与之前的研究类似,水稻白化突变体叶肉细胞内都是囊状空泡,没有叶绿体[17];返白系小麦(Triticum aestivum)叶绿体的类囊体发育处于停滞状态,未发育出明显的片层结构[18]。叶绿体类囊体膜是1个由各种叶绿素-蛋白质复合体高度构成的有组织性体系,是叶绿素的载体[19]。叶绿体内膜系统降解,致使膜蛋白复合物不能稳定存在于叶绿体内,叶绿素也不能正常累积[6]。因此, 叶绿体发育不成熟会导致叶绿素不能正常累积, 这可能是金边红苞凤梨白化组织形成的直接原因。
叶绿体发育是一个复杂的过程,需要核基因组和质体基因组共同调控。转录因子在调控叶绿体发育的过程中发挥了重要作用,GLK蛋白是核基因组中调控叶绿体发育的重要转录因子[8]。GLK基因在原始的开花植物中是以单个基因形式存在的,后来在某些物种中GLK基因进行了复制[20]。本研究首次从金边红苞凤梨中克隆了AbGLK1基因。AbGLK1定位在细胞核,并通过酵母系统验证了AbGLK1具有转录调控下游基因表达的功能。拟南芥AtGLK1主要通过结合启动子中的CCAATC特异性序列来激活核基因的表达[21]。通过系统进化分析,找到进化距离较近的已知功能的转录因子,可以为其功能研究提供参考[22]。在本研究中,AbGLK1与玉米ZmGLK1、水稻OsGLK1聚为同一亚支,且与水稻OsGLK1距离更近,暗示AbGLK1可能与水稻OsGLK1有着相似的功能。Nakamura等[23]提出OsGLK1调节叶绿体的发育是通过提高核编码的叶绿体相关基因的表达水平,同时还通过提高核编码的sigma因子的表达水平来促进质体编码光合作用相关基因的表达。由此推测AbGLK1可能通过激活核编码叶绿体相关基因的表达来调控金边红苞凤梨的叶绿体发育。金边红苞凤梨AbGLK1的表达量在叶片中最高,其次是茎,在根中最低,这与拟南芥、水稻和玉米等的研究结果一致,即AbGLK1基因具有组织器官特异性,主要在光合组织中表达。对比金边红苞凤梨叶片绿色组织和白化组织中AbGLK1基因的表达,绿色组织的表达量高于白化组织,类似的表达特征也出现在茶树浅绿突变体、银杏(Ginkgo biloba)变异黄叶、紫薇(Lagerstroemia indica)黄叶突变体以及红掌(Anthurium andraeanum)白化突变体等中其他叶色突变中[24–27]。桦树(Betula platyphylla× B. pendula)黄绿突变体yl中存在1个含有BpGLK1的40 kb缺失,互补试验证实了BpGLK1基因是桦树叶绿体发育和叶绿素合成的重要调控因子,在叶片失绿突变中发挥重要作用[28]。因此,AbGLK1基因的下调表达可能是金边红苞凤梨白化组织叶绿体发育不成熟的潜在原因之一。
本研究以金边红苞凤梨为研究对象,叶片超微结构观察发现白化组织叶绿体发育不成熟。生物信息学分析表明, AbGLK1基因开放阅读框全长1 371 bp, 编码456个氨基酸,具备GLK蛋白的结构域特征。亚细胞定位分析和转录激活检测结果表明,AbGLK1定位于细胞核并具有转录激活能力。RT-qPCR分析表明,AbGLK1基因的表达具有组织器官差异性, 且绿色组织的表达水平高于白化组织,由此推测AbGLK1低水平表达可能是金边红苞凤梨叶片边缘白化组织叶绿体发育不成熟的潜在原因之一。这为探究AbGLK1调控金边红苞凤梨叶绿体发育的分子机制提供了理论依据。接下来的工作重点是利用反向遗传学和分子生物学的技术手段,构建AbGLK1介导的调控网络,揭示金边红苞凤梨绿白嵌合叶片形成的分子机理。
| [1] |
MA J, KANAKALA S, HE Y H, et al. Transcriptome sequence analysis of an ornamental plant, Ananas comosus var. bracteatus, revealed the potential unigenes involved in terpenoid and phenylpropanoid biosynthesis[J]. PLoS One, 2015, 10(3): e0119153. DOI:10.1371/journal.pone.0119153 |
| [2] |
ZHU M K, HU Z L, ZHOU S, et al. Research progress of plant leaf albino[J]. Chin Bull Life Sci, 2012, 24(3): 255-261. 朱明库, 胡宗利, 周爽, 等. 植物叶色白化研究进展[J]. 生命科学, 2012, 24(3): 255-261. DOI:10.13376/j.cbls/2012.03.011 |
| [3] |
XUE Y B, MA J, HE Y H, et al. Comparative transcriptomic and proteomic analyses of the green and white parts of chimeric leaves in Ananas comosus var. bracteatus[J]. PeerJ, 2019, 7: e7261. DOI:10.7717/peerj.7261 |
| [4] |
MAO M Q, XUE Y B, HE Y H, et al. Systematic identification and comparative analysis of lysine succinylation between the green and white parts of chimeric leaves of Ananas comosus var. bracteatus[J]. BMC Genom, 2020, 21(1): 383. DOI:10.1186/s12864-020-6750-6 |
| [5] |
DU W K, YUAN S X, HU F R. Research progress on molecular mechanisms of the leaf color mutation[J]. Mol Plant Breed, 2019, 17(6): 1888-1897. 杜文凯, 袁素霞, 胡凤荣. 植物叶色突变分子机制的研究进展[J]. 分子植物育种, 2019, 17(6): 1888-1897. DOI:10.13271/j.mpb.017.001888 |
| [6] |
YANG H Y. Study on mechanism of leaf color variation of Pseudosasa japonica f. akebonosuji[D]. Beijing: Beijing Forestry University, 2015: 39-56. 杨海芸. 花叶矢竹叶色变异机理研究[D]. 北京: 北京林业大学, 2015: 39-56. |
| [7] |
LI N N. Physiological, biochemical characteristics and molecular albinism of the albino tea (Camellia sinensis) plant[D]. Hangzhou: Zhejiang University, 2015: 14-24. 李娜娜. 新梢白化茶树生理生化特征及白化分子机理研究[D]. 杭州: 浙江大学, 2015: 14-24. |
| [8] |
FITTER D W, MARTIN D J, COPLEY M J, et al. GLK gene pairs regulate chloroplast development in diverse plant species[J]. Plant J, 2002, 31(6): 713-727. DOI:10.1046/j.1365-313X.2002.01390.x |
| [9] |
HALL L N, ROSSINI L, CRIBB L, et al. GOLDEN 2: A novel transcriptional regulator of cellular differentiation in the maize leaf[J]. Plant Cell, 1998, 10(6): 925-936. DOI:10.1105/tpc.10.6.925 |
| [10] |
ROSSINI L, CRIBB L, MARTIN D J, et al. The maize Golden2 gene defines a novel class of transcriptional regulators in plants[J]. Plant Cell, 2001, 13(5): 1231-1244. DOI:10.2307/3871376 |
| [11] |
YASUMURA Y, MOYLAN E C, LANGDALE J A. A conserved transcription factor mediates nuclear control of organelle biogenesis in anciently diverged land plants[J]. Plant Cell, 2005, 17(7): 1894-1907. DOI:10.1105/tpc.105.033191 |
| [12] |
POWELL A L T, NGUYEN C V, HILL T, et al. Uniform ripening encodes a Golden 2-like transcription factor regulating tomato fruit chloroplast development[J]. Science, 2012, 336(6089): 1711-1715. DOI:10.1126/science.1222218 |
| [13] |
LI G W, CHEN D Y, TANG X F, et al. Heterologous expression of kiwifruit (Actinidia chinensis) GOLDEN2-LIKE homolog elevates chloroplast level and nutritional quality in tomato (Solanum lycopersicum)[J]. Planta, 2018, 247(6): 1351-1362. DOI:10.1007/s00425-0182853-6 |
| [14] |
LUPI A C D, LIRA B S, GRAMEGNA G, et al. Solanum lycopersicum GOLDEN 2-LIKE 2 transcription factor affects fruit quality in a lightand auxin-dependent manner[J]. PLoS One, 2019, 14(2): e0212224. DOI:10.1371/journal.pone.0212224 |
| [15] |
LI C L, NI D J. Effects of aluminium on photosynthesis and ultrastructure in leaves of tea plant[J]. Hubei Agric Sci, 2014, 53(3): 604-606. 李春雷, 倪德江. 铝对茶树光合特性和叶片超微结构的影响[J]. 湖北农业科学, 2014, 53(3): 604-606. DOI:10.3969/j.issn.0439-8114.2014.03.028 |
| [16] |
YANG Z R, WANG X C, LI X M, et al. Advance on the study of transcription factors in higher plants[J]. Hereditas, 2004, 26(3): 403-408. 杨致荣, 王兴春, 李西明, 等. 高等植物转录因子的研究进展[J]. 遗传, 2004, 26(3): 403-408. DOI:10.3321/j.issn:0253-9772.2004.03.027 |
| [17] |
LI Y H, WANG B H, DAI Z Y, et al. Morphological structure and genetic mapping of a new leaf color mutant in rice[J]. Chin J Rice Sci, 2011, 25(6): 587-593. 李育红, 王宝和, 戴正元, 等. 一个水稻新型叶色突变体的形态结构与遗传定位[J]. 中国水稻科学, 2011, 25(6): 587-593. DOI:10.3969/j.issn.1001-7216.2011.06.004 |
| [18] |
YANG L, GUO A G, GUAN X. Studies on the chloroplast ultrastructure of "stage albinism line the winter wheat" (SA) mutant during the albescent period[J]. Acta Agric Boreali-Occid Sin, 2003, 12(4): 64-67. 杨莉, 郭蔼光, 关旭. 小麦突变体返白系返白阶段叶绿体超微结构变化研究[J]. 西北农业学报, 2003, 12(4): 64-67. DOI:10.3969/j.issn.1004-1389.2003.04.018 |
| [19] |
JANIK E, SZCZEPANIUK J, MAKSYMIEC W. Organization and functionality of chlorophyll-protein complexes in thylakoid membranes isolated from pb-treated secale cereale[J]. J Photobiol B Biol, 2013, 125: 98-104. DOI:10.1016/j.jphotobiol.2013.05.008 |
| [20] |
WANG P, FOURACRE J, KELLY S, et al. Evolution of GOLDEN2-LIKE gene function in C3 and C4 plants[J]. Planta, 2013, 237(2): 481-495. DOI:10.1007/s00425-012-1754-3 |
| [21] |
WATERS M T, WANG P, KORKARIC M, et al. GLK transcription factors coordinate expression of the photosynthetic apparatus in Arabidopsis[J]. Plant Cell, 2009, 21(4): 1109-1128. DOI:10.1105/tpc.108.065250 |
| [22] |
TATUSOV R L, KOONIN E V, LIPMAN D J. A genomic perspective on protein families[J]. Science, 1997, 278(5338): 631-637. DOI:10.1126/science.278.5338.631 |
| [23] |
NAKAMURA H, MURAMATSU M, HAKATA M, et al. Ectopic overexpression of the transcription factor OsGLK1 induces chloroplast development in non-green rice cells[J]. Plant Cell Physiol, 2009, 50(11): 1933-1949. DOI:10.1093/pcp/pcp138 |
| [24] |
HAO X Y, ZHANG W F, LIU Y, et al. Pale green mutant analyses reveal the importance of CsGLKs in chloroplast developmental regulation and their effects on flavonoid biosynthesis in tea plant[J]. Plant Physiol Biochem, 2020, 146: 392-402. DOI:10.1016/j.plaphy.2019.11.036 |
| [25] |
LI W X, YANG S B, LU Z G, et al. Cytological, physiological, and transcriptomic analyses of golden leaf coloration in Ginkgo biloba L.[J]. Hort Res, 2018, 5(1): 12. DOI:10.1038/s41438-018-0015-4 |
| [26] |
YANG Y X, CHEN X X, XU B, et al. Phenotype and transcriptome analysis reveals chloroplast development and pigment biosynthesis together influenced the leaf color formation in mutants of Anthurium andraeanum 'Sonate'[J]. Front Plant Sci, 2015, 6: 139. DOI:10.3389/fpls.2015.00139 |
| [27] |
LI Y, ZHANG Z Y, WANG P, et al. Comprehensive transcriptome analysis discovers novel candidate genes related to leaf color in a Lagerstroemia indica yellow leaf mutant[J]. Genes Genom, 2015, 37(10): 851-863. DOI:10.1007/s13258-015-0317-y |
| [28] |
GANG H X, LI R H, ZHAO Y M, et al. Loss of GLK1 transcription factor function reveals new insights in chlorophyll biosynthesis and chloroplast development[J]. J Exp Bot, 2019, 70(12): 3125-3138. DOI:10.1093/jxb/erz128 |
 2022, Vol. 30
2022, Vol. 30



