兜兰属(Paphiopedilum)是兰科(Orchidaceae)植物中濒危程度最高的类群,野生种群小、个体数量少、分布区域有限,兜兰属所有种均被列入野生动植物濒危物种国际贸易公约(CITES)附录I的保护范围[1-2]。由于兜兰的自然繁殖力极低,成苗缓慢,导致兜兰产业发展进程迟缓。几乎所有的兰科植物都与菌根真菌有着共生关系。已有的研究表明,菌根真菌对兰科植物具有独特的生态功能,如促进种子萌发和幼苗的形态建成,帮助兰科植物的生态入侵,影响生物群落组成及制备特定功效的生物诱导子,利于生态系统的保护、恢复或重建等方面[3]。究其机理,近年来的研究发现,菌根真菌通过消化菌丝为胚细胞提供必需的营养,刺激植物产生赤霉素、IAA等激素,烟酸和烟酰胺等维生素,此外, 菌根真菌可在植物体内合成植保素,进一步激发SOD、POD、CAT和PAL等的活性[4],增强宿主植物的抗性[5-6],同时,当菌根真菌定殖成功并成为有益的优势菌群后,释放的拮抗物质将有效增强兰科植物的抗病能力,对于提高幼苗的成活率和促进植株的生长具有重要意义。近年来,兰科菌根真菌成为新的研究热点,特别是在园艺学和植物保护学中的应用和功效引起高度重视[7-9],利用兰科菌根真菌提高珍稀种类组培苗的移栽成活率、促进植株生长及保育等方面已有研究报道[10-14],如石斛属(Dendrobium)、金线莲属(Anoectochillus)、兜兰属、兰属(Cymbidium)、五唇兰属(Doriti)等,将菌根化育苗技术引入人工栽培后,显著提高了幼苗移栽成活率、鲜质量增长率、干物质积累和矿质元素吸收[7, 15-16],部分菌根真菌的代谢产物可分泌赤霉素、IAA等植物生长调节剂[17]。目前,兜兰属植物有关菌根真菌的研究主要在内生真菌的分离、鉴定[18-24]、共生萌发[25]、专一性和多样性[26]等方面,而兰科菌根真菌与兜兰属植物共生的生长和生理效应等研究鲜有报道。本研究将分离筛选到的兰科菌根真菌与带叶兜兰试管苗及营养钵苗分别进行共生培养,探讨菌根真菌对带叶兜兰各生长阶段生长和生理指标的影响,明确兰科菌根真菌的促生机理,应用于菌根化育苗实践中,促进兜兰种苗的快速繁育, 并缩短成苗周期,为珍稀濒危植物的保育提供理论基础,并为促进兜兰产业的规模化发展提供技术支撑。
1 材料和方法 1.1 材料试管苗共生培养采用带叶兜兰(Paphiopedilum hirsutissimum)壮苗期生长健壮在DE培养基[10]中培养的无菌组培苗,具有3~4条根和3~4片叶。营养钵苗共生培养采用生根期的试管苗,具有5~6条根和4~5片叶,营养钵苗移栽基质为松树皮∶火山岩∶木炭(体积比)=4∶2∶1。
菌株PF01、PF02、PF06和PF07,其中PF01、PF06和PF07分离自广西天峨县野生带叶兜兰新鲜营养根中,PF02分离自广西那坡县野生紫纹兜兰(P. purpuratum)新鲜营养根中,经筛选均为带叶兜兰幼苗的益生菌株,经根部重分离验证为菌根真菌。经16S rDNA序列测定和分析,PF01为Cladosporium perangustum、PF02为Kirschsteiniothelia tectonae、PF06为Phialophora sp.、PF07为Cyphellophora sp.。
1.2 方法菌株活化 将4个菌株接种到PDA培养基平板上,置入光照培养箱28 ℃暗培养5~7 d活化菌株。
液体菌剂制备 用直径5 mm的打孔器于活化的4个菌株菌落边缘打孔制作成菌饼,将菌饼移入到盛有150 mL PDA液体培养基的三角瓶中,每瓶接种菌饼2~3块,置于28 ℃ 140 r/min的摇床上培养10 d,然后过滤菌丝体,无菌水冲洗3~5次后,添加无菌水定容至300 mL,用组织捣碎机破碎5 min,最后用无菌水稀释5倍, 即制成菌悬液。
营养钵苗处理 将生根60 d的试管苗置于大棚内炼苗7~10 d后,洗去根部附着的培养基, 并用稀释1 000倍的50%多菌灵可湿性粉剂水溶液浸泡10 min,置于阴凉处摊开晾干表面的水分,移栽入1.5寸塑料透明软杯(口径×高×底径=5 cm×5 cm× 3.5 cm)。
试管苗接种菌株 将活化菌株用直径5 mm的打孔器于菌落边缘打孔取菌饼,无菌条件下将菌饼接种到HT-220组培瓶(220 mL,口径×胸径×高5.6 cm×6.9 cm×9.1 cm)中心,在周边接种幼苗。培养室温度为(25±2) ℃,光照强度为25 μmol/(m2·s), 光照时间为12 h/d。2株/瓶,每处理30瓶,3次重复。共生培养120 d后,以瓶为单位统计鲜质量、叶长、叶宽和平均根长等生长指标。
营养钵苗接种菌株 于试管苗移栽当天浇施第1次菌液10 mL/杯,以浇施等量无菌水为对照,以后每隔20 d浇施1次菌液,共浇施3~4次,期间停止施肥及用农药。移栽后隔5~7 d淋1次无菌水,期间视空气湿度情况适当进行叶面喷雾,保持温度(26±2) ℃,相对湿度70%~85%,遮阴率70%~ 80%。2株/杯,每处理30杯,3次重复。共生培养120 d后,统计幼苗移栽成活率、鲜质量、叶长、叶宽和新根数等生长指标。
生理指标的测定 共生培养120 d后,采集新鲜叶片测定保护酶活性。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的测定采用李合生[26]的方法;叶绿素含量用丙酮提取法[26]测定。均设3次重复。
兰科菌根真菌的重分离 分别取接种菌株和不接种的带叶兜兰试管苗和营养钵苗若干,挑选新生根系,用0.1%的HgCl2溶液表面消毒1 min后,用无菌水清洗4次,然后采用组织块分离法进行菌根真菌的重分离,置于含1 μL/mL庆大霉素的PDA培养基上,28 ℃暗培养7~10 d,观察根段的菌落生长情况。
1.3 数据的统计分析采用Excel对数据进行统计,并采用DPS 7.05软件对数据进行Duncan’s新极复差检验。
单叶叶面积(cm2)采用长宽系数法测定,校正系数采用复印称重法[27]测定, 叶面积=叶长×叶宽×校正系数(0.8317)。
2 结果和分析 2.1 共生关系的建立共培养120 d后,从接种菌株的试管苗根部重分离出相应的4个原接种菌株,分离率为83.0%~ 92.5%,且未分离出其他菌株,而试管苗对照则未分离出任何菌株。从接种菌株的营养钵苗根部也重分离出相应的原接种菌株,分离率为50.0%~65.0%, 接种PF02菌株的营养钵苗中还分离出少量的镰刀菌菌株(5.5%),而在对照植株中主要分离到镰刀菌菌株(Fusarium),分离率达37.5%。说明原接种菌株与带叶兜兰幼苗形成了共生关系,确定为带叶兜兰的兰科菌根真菌。
2.2 对生长的影响共生培养120 d后,不同处理的带叶兜兰试管苗长势、叶片和根系的表现明显不同,且接种菌株试管苗显示出明显优势,但不同菌株间的鲜质量增加不存在显著差异(图 1),然而接种菌株试管苗鲜质量与对照的差异极显著(P < 0.01),提高了320.0%~ 380.0%。植株长势表现出明显差异,接种菌株的试管苗生长旺盛,而对照植株矮小(图 2)。接种菌株试管苗的根系明显发达,长且粗壮,黄褐色,接种不同菌株的根系长度存在显著或极显著差异(图 3)。其中,接种PF07试管苗根系最长,达2.8 cm,其次是PF01和PF06,分别为2.3和2.2 cm,与对照的差异极显著,比对照分别提高了129.5%、88.5%和80.3%,对照的根系短细,黄绿色。接种菌株试管苗的叶面积差异不显著(图 4),但接种PF01的叶面积增长量最大,叶片油绿且舒展,达1.11 cm2,其次是PF06和PF02,分别比对照提高了37.0%、22.2%和12.3%,叶片油绿,略下垂,而CK处理的叶片黄绿色。接种菌株后,试管苗快速生长,鲜质量、新根长度和叶面积增长极显著,接种PF01、PF07和PF06对带叶兜兰试管苗生长促进效果最佳,其中,PF01极大提高了试管苗对培养基中水分的吸收, PF07显著促进了新根的生长,PF06促进了试管苗叶片和新根的生长。
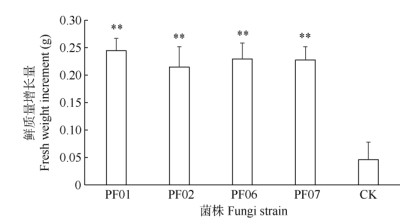
|
图 1 野生兜兰有益真菌对带叶兜兰试管苗鲜质量增长量的影响。**: P < 0.01; *: P < 0.05。 Fig. 1 Effects of mycrrhizal fungi on fresh weight increment of Paphio- pedilum hirsutissimum seedlings in vitro. **: P < 0.01; *: P < 0.05. |

|
图 2 带叶兜兰试管菌根苗和非菌根苗(CK) Fig. 2 Paphiopedilum hirsutissimum seedlings in vitro with and without (CK) mycrrhizal fungi |

|
图 3 野生兜兰有益真菌对带叶兜兰试管苗新根长度的影响。**: P < 0.01; *: P < 0.05. Fig. 3 Effects of mycrrhizal fungi on new root length of Paphiopedilum hirsutissimum seedlings in vitro. **: P < 0.01; *: P < 0.05. |
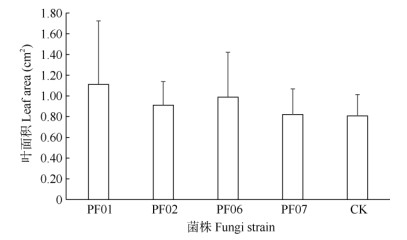
|
图 4 野生兜兰有益真菌对带叶兜兰试管苗叶面积的影响 Fig. 4 Effects of mycrrhizal fungi on leaf area of Paphiopedilum hirsute- ssimum seedlings in vitro |
试管苗移栽与菌株共培养120 d后,带叶兜兰营养钵苗的生长表现显著差异。接种PF06的鲜质量增长最多,达到1.90 g,比对照提高了360.3%, 差异极显著,比接种PF01的提高了66.4%,差异显著(P < 0.05),植株生长旺盛,根系粗壮,叶片深绿色、斜立且舒展;而接种PF02、PF07间的鲜质量增长差异不显著,但与对照的差异极显著,分别提高了330.1%和261.6%。对照植株弱小,部分叶片出现黑斑病和软腐病,根系短,叶片黄绿色、略翻卷且细长(图 5)。接种菌株的营养钵苗根系长度差异较大, 接种PF02菌株的营养钵苗根系最长,达6.47 cm, 比PF01和对照分别提高了102.8%和71.6%, 差异极显著,且根系粗壮,分支较多;接种PF06和PF07的根系长度与接种PF01和对照的差异不显著,每株3~5条根,根较细,分支较少(图 6)。接种菌株的营养钵苗叶面积差异显著,以接种PF06的叶片最大,深绿色且舒展,达5.72 cm2,比CK提高了52.1%,差异极显著,比接种PF07的提高了37.2%, 差异显著;其次是接种PF07菌株的叶面积为5.41 cm2, 比对照提高了43.9%,差异显著,叶片略外弯,细长(图 7)。由此可见,生根试管苗移栽后,通过多次浇施菌株可较好的建立菌-苗共生关系,营养钵苗快速生长(图 8),鲜质量显著增加,抵抗力增强。PF02和PF06对带叶兜兰营养钵苗生长的促进效果最佳,PF02可促进新根的伸长生长,PF06菌株的菌丝有利于扩大根系对水分的吸收范围,促进生物量积累。

|
图 5 野生兜兰有益真菌对带叶兜兰营养钵苗鲜质量增长量的影响。**: P < 0.01; *: P < 0.05. Fig. 5 Effects of mycrrhizal fungi on fresh weight increment of Paphio- pedilum hirsutissimum seedlings in pot. **: P < 0.01; *: P < 0.05. |
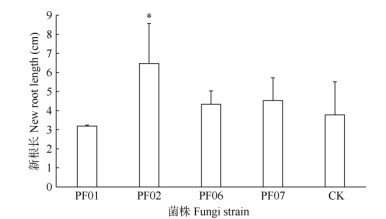
|
图 6 野生兜兰有益真菌对带叶兜兰营养钵苗新根长度的影响。*: P < 0.05. Fig. 6 Effects of mycrrhizal fungi on new root length of Paphiopedilum hirsutissimum seedlings in pot. *: P < 0.05. |
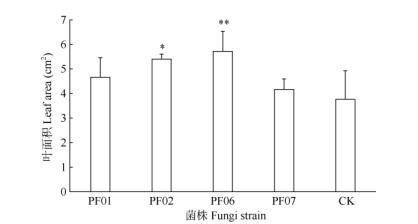
|
图 7 野生兜兰有益真菌对带叶兜兰营养钵苗叶面积的影响。**: P < 0.01; *: P < 0.05. Fig. 7 Effects of mycrrhizal fungi on leaf area of Paphiopedilum hirsutis- simum seedlings in pot. **: P < 0.01; *: P < 0.05. |

|
图 8 带叶兜兰营养钵菌根苗与非菌根苗(CK) Fig. 8 Paphiopedilum hirsutissimum seedlings in pot with and without (CK) mycrrhizal fungi |
带叶兜兰试管苗与菌株共生培养120 d后,叶片POD、CAT、SOD活性和叶绿素总量均显著提高,与对照有差异显著或极显著(表 1)。接种PF06植株叶片的POD、CAT、SOD活性和叶绿素总量增长较大, 分别为116.40 U/g、263.07 nmol/g、1748.70 U/g和0.76 mg/g, 分别比对照提高344.1%、472.8%、256.4%和68.9%;接种PF01植株叶片的POD、CAT、SOD活性和叶绿素总量分别为60.36 U/g、512.98 nmol/g、1452.91 U/g和0.73mg/g,比对照分别提高130.3%、1016.9%、196.1%和62.2%,说明接种菌株有利于提高植株叶片的保护酶活性和叶绿素含量。可见, 带叶兜兰试管苗接种菌株后形成菌根,保护酶活性呈动态变化,植株的免疫效应和光合效率提高, PF01与PF06对带叶兜兰试管苗生理指标的促进效应最佳,PF01提高了CAT和SOD活性,PF06菌株提高了POD和SOD活性,且在显著促进植株鲜质量增加时,光合效率也提高,保证了植株基本代谢进程的稳定。
| 表 1 接种兜兰有益真菌对带叶兜兰试管苗生理指标的影响 Table 1 Effect of mycrrhizal fungi on physiological indexes of Paphiopedilum hirsutissimum seedlings in vitro |
带叶兜兰营养钵苗与菌株共生培养120 d后, 各生理指标也不同程度的提高,说明菌株处理营养钵苗可显著或极显著增强3种保护酶活性,尤其是POD活性,但叶绿素总量的差异不显著(表 2)。接种PF06菌株的营养钵苗叶片POD、CAT和SOD活性大幅提高,分别为365.04 U/g、132.63 nmol/g和252.34 U/g,分别比对照提高了263.5%、242.4%和170.4%,差异极显著;接种PF02的叶片POD、CAT、SOD活性分别为349.52 U/g、71.25 nmol/g和172.81U/g,比对照分别提高了248.1%、83.9%和85.2%,差异显著或极显著。这表明,带叶兜兰营养钵苗在与菌根形成共生过程中,营养钵苗叶片保护酶活性激发,提高了植株的免疫效应,PF02与PF06对带叶兜兰营养钵苗生理指标的促进效应最佳, PF06优于PF02。然而在自然遮阴条件下, 活菌对营养钵苗叶绿素含量的促进作用不显著。
| 表 2 接种兜兰有益真菌对带叶兜兰营养钵苗生理指标的影响 Table 2 Effect of mycrrhizal fungi on physiological indexes of Paphiopedilum hirsutissimum seedlings in pot |
在长期的协同进化过程中,兰科植物与兰科菌根真菌形成特异的菌物体系,许多真菌能够与植物形成菌根,相互共生,彼此依赖。菌根真菌从兰科植物根部获取所需的碳水化合物和其他营养元素, 同时也为兰科植物的生长发育提供必需的营养物质、酶等。菌根的有益作用能否充分发挥,决定于菌根真菌能否对宿主植物进行有效侵染、定殖,以及菌根真菌的作用效果[5]。研究表明,庞大的菌丝网络增加了植物根系的吸收面积,菌根的代谢活动提高了兰科植物对难溶不易被作物吸收矿物元素的吸收,产生的植物激素、维生素、氨基酸等代谢产物既能促进植株生长,又可作为诱导因子激活并增强植株体内保护酶活性及抗性[27-34]。SOD、POD和CAT是植物体膜系统的3大保护酶,其活性是鉴定植物抗逆性强弱的主要指标[5-6]。
在本试验中,DE培养基作为试管苗共生培养基,碳氮含量低,营养相对贫瘠,带叶兜兰试管苗接种菌株后,生长加快,尤其是提高了试管苗的水分吸收能力,鲜质量增长极显著,说明保持真菌和幼苗适当的营养平衡是兜兰属植物适应自然生境的关键。PF01与PF06对带叶兜兰试管苗生长和生理指标的促进效应最佳,PF01极大提高了试管苗对于培养基中水分的吸收,激发了叶片CAT和SOD活性;PF06菌株促进了试管苗叶片和新根的生长,激发了叶片POD和SOD活性,且提高了试管苗叶绿素总量。
而试管苗出瓶移栽后,PF02与PF06对带叶兜兰营养钵苗的生长和生理指标的促进效应最佳, PF02促进营养钵苗新根的伸长生长,PF06扩大了根系对水分的吸收范围,促进生物量的积累,且提高了POD、CAT和SOD活性。这说明不同菌根真菌虽然对带叶兜兰不同生长阶段幼苗的生长和生理指标的促进作用存在差异,但均有效提高了幼苗的生物量增长,同时激发了叶片保护酶活性,并也提高了植株的光合作用。这与前人[7, 14, 35-37]的研究结果一致,即不同菌根真菌对兰科植物的促生效果不同,基质水分含量和光照强度也会影响植株的生长与生理代谢[34, 36]。
此外,本研究结果表明,4个菌株对带叶兜兰均不致病,但不同菌株对其生长的影响存在差异, PF06为瓶霉属菌株,在2个苗期均表现出较稳定的促生效果,大部分生长指标显著高于对照,说明该菌株的促生作用较为稳定。PF01对营养钵苗的促生效果不明显,但对试管苗的促生效果显著,说明各菌株有最适宜的生长环境,PF01更适宜干扰较少的瓶内菌苗共生条件。此外,PF06对营养钵苗生长指标的促进效应比试管苗的大,这可能与营养钵苗植株较大,正处于旺盛生长期,再加上受户外环境影响,可更多地吸收空气中的水分和养分。这与谢玲等[11]对铁皮石斛(Dendrobium officinale)共生研究的结果一致,深色有隔内生真菌24L-4对组培苗和盆栽苗均表现出显著的促生作用,但盆栽苗表现更好。因此,生产中可优选在试管苗移栽后接种兰科菌根真菌,此阶段开展规模化菌根育苗,不仅可高效建立共生关系,而且可操作强,生产效率高。
在本研究中,对植株促生效果最佳的菌株也有较好的生理效应,保护酶活性和光合色素含量均提高,呈正相关效应,可能是共生关系的建立促进了带叶兜兰根系对养分和水分的吸收,兰科菌根真菌分泌的淀粉酶能够提高带叶兜兰的碳水化合物利用水平,加快营养吸收,生物量增长迅速,进一步提高叶片的光合作用和光合产物的同化能力,从而提高了兜兰幼苗的光合性能,同时,兰科菌根真菌的合成功能促使菌丝团产生多种植物生长调节剂、酶前体等有利于兜兰生长发育的活性物质[38],这些又极大的促进了植株的茁壮生长。
带叶兜兰对生长环境要求严格,今后应进一步深入研究了解兜兰菌根特点,筛选优良的兜兰菌根真菌资源,尤其是PF06有望开发为兜兰幼苗生长的通用菌株,进一步研究其生物学特性,开展微生物互作、抗性和不同生长阶段的保护酶活性研究, 以及探明活菌与菌株发酵液活性成分对兜兰生长的促生机理,研发兜兰的微生物菌肥,可提高带叶兜兰的种苗质量,增强环境适应性,扩大生产和栽培区域,开展高效种植,将极大促进兜兰产业的规模化发展,同时,可为兜兰的保育研究提供技术支撑。
| [1] |
LUO Y B, JIA J S, WANG C L. Conservation strategy and potential advantages of the Chinese Paphiopedilum[J]. Biodiv Sci, 2003, 11(6): 491-498. 罗毅波, 贾建生, 王春玲. 初论中国兜兰属植物的保护策略及其潜在资源优势[J]. 生物多样性, 2003, 11(6): 491-498. DOI:10.3321/j.issn:1005-0094.2003.06.009 |
| [2] |
LIU Z J, CHEN X Q, CHEN L J, et al. The Genus Paphiopedilum in China[M]. Beijing: Science Press, 2009: 1-10. 刘仲健, 陈心启, 陈利君, 等. 中国兜兰属植物[M]. 北京: 科学出版社, 2009: 1-10. |
| [3] |
GAI X G, XING X K, GUO S X. Ecological research of orchid mycorrhizae: A review[J]. Mycosystema, 2014, 33(4): 753-767. 盖雪鸽, 邢晓科, 郭顺星. 兰科菌根的生态学研究进展[J]. 菌物学报, 2014, 33(4): 753-767. DOI:10.13346/j.mycosystema.140024 |
| [4] |
HOU P Y, GUO S X. Influences of fungus Mycenae sp. on activities of some enzymes and extracellular pH of protocorms of Dendrobium candidum[J]. Microbiol China, 2004, 31(2): 26-29. 侯丕勇, 郭顺星. 真菌对铁皮石斛原球茎酶活性和胞外pH的影响[J]. 微生物学通报, 2004, 31(2): 26-29. |
| [5] |
XU C, WU X Q. Drought resistance of Pinus massoniana seedlings inoculated with ectomycorrhizal fungi[J]. J W China For Sci, 2012, 41(6): 43-47. 徐超, 吴小芹. 菌根化马尾松植株抗旱性研究[J]. 西部林业科学, 2012, 41(6): 47-51. DOI:10.3969/j.issn.1672-8246.2012.06.008 |
| [6] |
DENG Y, CHANG M S, ZHU Y Z, et al. Protective enzyme activity in leaves of different Camellia oleifera cultivars[J]. J S Agric, 2016, 47(5): 686-689. 邓艳, 常明山, 朱英芝, 等. 不同油茶品种叶片3种保护酶活性分析[J]. 南方农业学报, 2016, 47(5): 686-689. DOI:10.3969/j:issn.2095-1191.2016.05.686 |
| [7] |
ZHU X M, HU H, LI S Y, et al. Interaction between endophytic fungi and seedlings of two species of Paphiopedilum during symbiotic culture[J]. Plant Div Resour, 2012, 34(2): 171-178. 朱鑫敏, 胡虹, 李树云, 等. 内生真菌与两种兜兰共培养过程中的相互作用[J]. 植物分类与资源学报, 2012, 34(2): 171-178. DOI:10.3724/SP.J.1143.2012.11144 |
| [8] |
RASMUSSEN H N, RASMUSSEN F N. Trophic relationships in orchid mycorrhiza: Diversity and implications for conservation[J]. Lankesteriana, 2007, 7(1/2): 334-341. DOI:10.15517/LANK.V7I1-2.19560 |
| [9] |
ZETTLER L W, POULTER S B, MCDONALD K I, et al. Conser- vation: Driven propagation of an epiphytic orchid (Epidendrum noctur- num) with a mycorrhizal fungus[J]. HortScience, 2007, 42(1): 135-136. DOI:10.21273/HORTSCI.42.1.135 |
| [10] |
CHEN B L. Re-introduction technology based on mycorrhizal fungi in the conservation of an endangered orchid: Dendrobium loddigesii[D]. Haikou: Hainan University, 2010: 20-56. 陈宝玲. 濒危植物美花石斛基于菌根真菌的再引入技术初步研究[D]. 海口: 海南大学, 2010: 20-56. |
| [11] |
XIE L, ZHANG W L, QIN L P, et al. Inoculation effects of dark septate endophytes (DSE) on the growth of Dendrobium candidum seedling[J]. J S Agric, 2014, 45(6): 1010-1014. 谢玲, 张雯龙, 覃丽萍, 等. 深色有隔内生真菌(DSE)引进菌株对铁皮石斛的接种效应[J]. 南方农业学报, 2014, 45(6): 1010-1014. DOI:10.3969/j:issn.2095-1191.2014.6.1010 |
| [12] |
HOU T W, JIN H, LIU H X, et al. Mycorrhizal specificity of Doritis pulcherrima in in-vitro research[J]. Acta Phytoecol Sin, 2010, 34(12): 1433-1438. 侯天文, 金辉, 刘红霞, 等. 实验室条件下五唇兰菌根真菌专一性研究[J]. 植物生态学报, 2010, 34(12): 1433-1438. DOI:10.3773/j.issn.1005-264x.2010.12.009 |
| [13] |
WU H F, SONG X Q, YANG F S, et al. Effects of symbiotic fungi on the physiological characteristics of Dendrobium catenatum Lindley (Orchidaceae)[J]. Plant Sci J, 2011, 29(6): 738-742. 吴慧凤, 宋希强, 杨福孙, 等. 共生真菌对铁皮石斛幼苗生理特性的影响[J]. 植物科学学报, 2011, 29(6): 738-742. DOI:10.3724/SP.J.1142.2011.60738 |
| [14] |
LIU S, CHEN C L, LIU M, et al. Comparing the symbiotic effects of two endophytes on growth of Cymbidium hybridum[J]. J Huazhong Agric Univ, 2016, 35(1): 43-49. 刘舒, 陈春黎, 刘敏, 等. 两种内生真菌对大花蕙兰的共生效应比较[J]. 华中农业大学学报, 2016, 35(1): 43-49. |
| [15] |
JIN H, XU Z X, CHEN J H, et al. Interaction between tissue-cultured seedlings of Dendrobium officinale and mycorrhizal fungus (Epulor- hiza sp.) during symbiotic culture[J]. Chin J Plant Ecol, 2009, 33(3): 433-441. 金辉, 许忠祥, 陈金花, 等. 铁皮石斛组培苗与菌根真菌共培养过程中的相互作用[J]. 植物生态学报, 2009, 33(3): 433-441. DOI:10.3773/j.issn.1005-264x.2009.03.002 |
| [16] |
ZHAO Y J, GUO S X, GAO W W, et al. The symbiosis of three endophytic fungi with Cymbidium sp. and its effects on the mineral nutrition absorption[J]. Acta Hort Sin, 1999, 26(2): 110-115. 赵杨景, 郭顺星, 高薇薇, 等. 三种内生真菌与大花蕙兰共生对矿质营养吸收的影响[J]. 园艺学报, 1999, 26(2): 110-115. DOI:10.3321/j.issn:0513-353X.1999.02.009 |
| [17] |
NONTACHAIYAPOOM S, SASIRAT S, MANOCH L. Isolation and identification of Rhizoctonia-like fungi from roots of three orchid genera, Paphiopedilum, Dendrobium, and Cymbidium, collected in Chiang Rai and Chiang Mai Provinces of Thailand[J]. Mycorrhiza, 2010, 20(7): 459-471. DOI:10.1007/s00572-010-0297-3 |
| [18] |
WANG X G, LU J S, ZHOU Z G, et al. Isolation and preliminary identification of mycorrhizal fungi from Paphiopedilum hirsutissimun (Orchidaceae)[J]. SW China J Agric Sci, 2016, 29(2): 316-320. 王晓国, 卢家仕, 周主贵, 等. 带叶兜兰菌根真菌分离和初步鉴定[J]. 西南农业学报, 2016, 29(2): 316-320. DOI:10.16213/j.cnki.scjas.2016.02.020 |
| [19] |
YI J, CHENG J, ZHANG Q X. Composition and diversity analysis on mycorrhizal fungi from four Paphiopedilum species in Xingyi, Guizhou[C]//Advances in Ornamental Horticulture of China. Chengdu: Chinese Society of Horticultural Science, 2017: 84-89. 裔景, 程瑾, 张启翔. 贵州兴义四种兜兰属植物菌根真菌的组成与多样性分析[C]//中国观赏园艺研究进展. 成都: 中国园艺学会, 2017: 84-89. |
| [20] |
TIAN F, ZHU G S, GUI Y, et al. Study on isolation and culture charac- teristics of Paphiopedilum micranthum mycorrhizal fungi[J]. N Hort, 2012(7): 61-64. 田凡, 朱国胜, 桂阳, 等. 硬叶兜兰菌根真菌的分离及培养特性研究[J]. 北方园艺, 2012(7): 61-64. |
| [21] |
TIAN F, LIAO X F, YAN F X, et al. Structure and spatial distribution of mycorrhizal fungi in Paphiopedilum rigida[J]. Jiangsu Agric Sci, 2019, 47(2): 105-108. 田凡, 廖小锋, 颜凤霞, 等. 硬叶兜兰菌根结构及菌根真菌空间分布特征[J]. 江苏农业科学, 2019, 47(2): 105-108. DOI:10.15889/j.issn.1002-1302.2019.02.024 |
| [22] |
TIAN F, LIAO X F, WANG L H, et al. Classification and identifition of mycorrhizal fungi of Paphiopedilum micranthum[J]. N Hort, 2017(24): 116-122. 田凡, 廖小锋, 王莲辉, 等. 硬叶兜兰菌根真菌的分类鉴定[J]. 北方园艺, 2017(24): 116-122. DOI:10.11937/bfyy.20171417 |
| [23] |
YANG J, REN J F, JIANG D Q, et al. Morphological characteristics and identification of mycorrhizal fungi from Paphiopedilum convolu- tum in Hainan[J]. Agric Inf China, 2015(22): 30-32. 杨珺, 任军方, 姜殿强, 等. 海南卷萼兜兰菌根真菌形态学特征与鉴定[J]. 中国农业信息, 2015(22): 30-32. DOI:10.3969/j.issn.1672-0423.2015.11.010 |
| [24] |
SUN X Y, ZHANG W F, LIU H X. In situ symbiotic seed germination, isolation and identification of effective mycorrhizal fungus in Paphio- pedilum hirsutissimum (Orchidaceae)[J]. J Trop Subtrop Bot, 2015, 23(1): 59-64. 孙晓颖, 张武凡, 刘红霞. 带叶兜兰种子原地共生萌发及有效菌根真菌的分离与鉴定[J]. 热带亚热带植物学报, 2015, 23(1): 59-64. DOI:10.11926/j.issn.1005-3395.2015.01.009 |
| [25] |
SUN X Y. Diversity of mycorrhizal fungi Isolated from five species of the genus Paphiopedilum [D]. Beijing: Beijing Forestry University, 2014: 10-38. 孙晓颖. 五种野生兜兰植物菌根真菌多样性研究[D]. 北京: 北京林业大学, 2014: 10-38. |
| [26] |
YUAN L, YANG Z L, LI S Y, et al. Mycorrhizal specificity, prefe- rence, and plasticity of six slipper orchids from South Western China[J]. Mycorrhiza, 2010, 20(8): 559-568. DOI:10.1007/s00572-010-0307-5 |
| [27] |
HU J F, GUO Y, LI M, et al. Research on correction coefficient from leaf area for different soybean leaf forms[J]. J Beijing Univ Agri, 2012, 27(1): 9-11. 胡家峰, 郭远, 李梦, 等. 大豆不同叶形叶面积校正系数的研究[J]. 北京农学院学报, 2012, 27(1): 9-11. DOI:10.3969/j.issn.1002-3186.2012.01.003 |
| [28] |
LI H S. Modern Plant Physiology[M]. 3rd ed. Beijing: Higher Education Press, 2012: 330-340. 李合生. 现代植物生理学[M]. 第3版. 北京: 高等教育出版社, 2012: 330-340. |
| [29] |
HUANG Q L, YUAN Z S, LIU Y L, et al. Effect of combined inducing bacteria inoculation on the growth of Cinnamomum camphora var. inaloolifera seedlings[J]. J SW For Univ, 2020, 40(5): 40-47. 黄秋良, 袁宗胜, 刘酉琳, 等. 促生菌组合接种对芳樟苗生长的影响[J]. 西南林业大学学报, 2020, 40(5): 40-47. DOI:10.11929/j.swfu.201908024 |
| [30] |
CHEN M M, CHEN B D, WANG X J, et al. Influences of arbuscular mycorrhizal fungi (AMF) on the growth and ecological stoichiometry of clover and ryegrass grown in monoculture or in mixture at different phosphorus (P) levels[J]. Acta Ecol Sin, 2009, 29(4): 1980-1986. 陈梅梅, 陈保冬, 王新军, 等. 不同磷水平土壤接种丛枝菌根真菌对植物生长和养分吸收的影响[J]. 生态学报, 2009, 29(4): 1980-1986. DOI:10.3321/j.issn:1000-0933.2009.04.043 |
| [31] |
RANIERI A, CASTAGNA A, BALDAN B, et al. Iron deficiency differently affects peroxidase isoforms in sunflower[J]. J Exp Bot, 2001, 52(354): 25-35. DOI:10.1093/jexbot/52.354.25 |
| [32] |
CHEN H J. Application and functional species and effect evaluation in microbial fertilizers[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013: 12-46. 陈慧君. 微生物肥料菌种应用与效果分析[D]. 北京: 中国农业科学院, 2013: 12-46. |
| [33] |
VESSEY J K. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant Soil, 2003, 255(2): 571-586. DOI:10.1023/A:1026037216893 |
| [34] |
DING C Y, QIAO H Y, SHEN Q R, et al. Control effect and action mechanism research of bio-organic fertilizer on eggplant bacterial wilt[J]. Sci Agric Sin, 2012, 45(2): 239-245. 丁传雨, 乔焕英, 沈其荣, 等. 生物有机肥对茄子青枯病的防治及其机理探讨[J]. 中国农业科学, 2012, 45(2): 239-245. DOI:10.1023/A:1026037216893 |
| [35] |
ZHOU Y J, YANG F S, SONG X Q, et al. Effects of mycorrhizal fungi on seedling's growth and photosynthetic capability of Dendrobium sinense, endemic to Hainan[J]. N Hort, 2009(12): 11-15. 周玉杰, 杨福孙, 宋希强, 等. 菌根真菌对华石斛幼苗生长及光合性能的影响[J]. 北方园艺, 2009(12): 11-15. |
| [36] |
CHEN J H, WANG C, HUANG S R, et al. Effects of three kinds of mycorrhizal fungi on growth of Rhynchostylis gigantea seedling[J]. Guangdong Agric Sci, 2017, 44(4): 46-52. 陈金花, 王存, 黄素荣, 等. 3株菌根真菌对海南钻喙兰幼苗生长的影响[J]. 广东农业科学, 2017, 44(4): 46-52. DOI:10.16768/j.issn.1004-874X.2017.04.008 |
| [37] |
LI J L, ZHAO Z, LUO C L, et al. Comprehensive evaluation of the effects of different light intensity and water content on the growth and physiology of Dendrobium nobile[J]. J Chin Med Mat, 2017, 40(10): 2262-2265. 李金玲, 赵致, 罗春丽, 等. 不同光照强度和水分对金钗石斛生长与生理影响的综合评价[J]. 中药材, 2017, 40(10): 2262-2265. DOI:10.16768/j.issn.1004-874X.2017.04.008 |
| [38] |
WU Y D, DU C M, SHEN J, et al. Effects of mycorrhizal fungi on seed germination and seedling growth of orchids[J]. S China Agric, 2017, 11(30): 97. 吴玉德, 杜春梅, 申健, 等. 兰科植物菌根真菌对种子萌发苗木生长的影响研究[J]. 南方农业, 2017, 11(30): 97. DOI:10.13863/j.issn1001-4454.2017.10.005 |
 2022, Vol. 30
2022, Vol. 30


