2. 湖南会同森林生态系统国家野外科学观测研究站, 湖南 会同 418307;
3. 中国林业科学研究院热带林业实验中心, 广西友谊关森林生态系统国家定位观测研究站, 广西 凭祥 532600;
4. 中国科学院西双版纳热带植物园, 元江干热河谷生态系统研究站, 云南 元江 653300;
5. 中国科学院华南植物园植物资源保护与可持续利用重点实验室, 广州 510650
2. Huitong National Research Station of Forest Ecosystem, Huitong 418307, Hunan, China;
3. Experimental Center of Tropical Forestry, Chinese Academy of Forestry, Guangxi Youyiguan Forest Ecosystem Research Station, Pingxiang 532600, Guangxi, China;
4. Yuanjiang Research Station for Savanna Ecosystems, Xishuangbana Tropical Botanical Garden, Chinese Academy of Sciences, Yuanjiang 653300, Yunnan, China;
5. Key Laboratory of Plant Resources Conservation and Sustainable Utilization, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China
土壤是陆地生态系统最大的C库[1],土壤C库的大小和稳定性取决于植物残体碳输入和微生物矿化土壤有机碳(SOC)输出之间的平衡[2-3]。陆地生态系统超过50%的净初级生产力通过叶凋落物分解归还到土壤中,凋落物分解在全球C循环中扮演着重要角色,影响养分循环、SOC动态以及生态系统C平衡[4-5]。凋落物分解主要受气候条件、凋落物质量和分解者等因素的调控[6-7]。尽管在全球尺度上,气候条件是控制凋落物分解的主导因素[6, 8-9],但是凋落物质量因植物种类不同而具有较大变化,被认为是区域尺度上控制凋落物分解的关键因素[10-11]。凋落物化学特征与凋落物分解速率具有较高的相关性[12-13],具有低木质素含量、高N和离子含量(K、Ca、Mg),低单宁含量的叶凋落物能够增加凋落物的分解速率[6, 14-15]。因此,了解凋落物化学性质对于研究凋落物分解过程至关重要。
随着全球气候变化加剧,极端天气事件(冰雪灾害、台风、干旱、火灾等)会对森林生态系统C循环产生重大影响[16]。极端天气事件会导致森林生态系统产生大量的新鲜凋落物,比如2008年初,我国南方地区遭遇了百年罕见的冰雪灾害,超过1.80× 107 hm2的森林遭到不同程度的破坏[17-18],大量的树叶、断枝和倒木等滞留林地,这不仅影响森林生态系统生物和非生物环境,而且对林地养分分配和物质循环过程也产生极大影响[19-20]。此外,近年来,极端干旱发生的频率、强度和面积呈增加趋势,导致区域或全球范围内森林树木死亡事件增加[21-23]。树木在干旱条件下,可以通过减小叶面积、降低蒸腾、提高资源利用效率等来适应干旱胁迫[24],但在极端干旱条件下,植物叶片会出现枯萎死亡并脱落[25]。极端天气、火灾或地质灾害等发生时,在外力作用下产生的植物个体或植物器官的新鲜残体被称为非正常凋落物[17],非正常凋落物与植物自然凋落物在化学性质(诸如C和N含量)方面可能存在差异,从而导致非正常凋落物和自然凋落物分解过程及其控制因素不同。热带雨林地区45种新鲜叶片和凋落叶化学性质的研究表明,与植物绿叶相比,自然凋落叶N和P含量分别降低了30%和65%[26]。通常情况下同一物种绿叶和自然凋落叶的化学组成存在较大差异,比如与自然凋落叶相比, 苜蓿(Medicago sativa)、针茅(Stipa capillata)绿叶具有更高的C和N含量[27],此外,研究也表明新鲜绿叶与自然凋落叶物理化学性质之间具有较好的相关性[28]。然而,我们对于极端干旱引起树木叶片死亡并脱落,即极端干旱死亡叶片与自然凋落叶的化学性质是否存在差异的研究鲜有报道。在全球极端干旱导致树木死亡现象普遍存在的情况下,研究干旱死亡叶片化学性质对于了解干旱对生态系统物质循环过程的影响至关重要,也为预测干旱死亡叶片分解及其对土壤C库稳定性的影响提供前提条件。
云南元江干热河谷2019年极端干旱事件为研究干旱死亡叶片和自然凋落叶提供了契机,本研究以干热河谷遭遇极端干旱时,叶片出现枯萎并脱落的5种树种为对象,对干旱死亡叶片与自然凋落叶的C和养分化学性质的差异性进行了比较研究,并分析了两者化学性质间的相关性,为研究极端气候下凋落物分解过程及其对土壤C库稳定性的影响提供科学参考。
1 材料和方法 1.1 研究区概况研究区位于云南省元江国家级保护区的中国科学院西双版纳植物园元江干热河谷生态站,地理位置为(23°27' N,102°10' E),地形以低丘为主,海拔481 m,地势相对平缓,土壤少且土层薄,以燥红土为主,岩石裸露达70%。年均温24.7 ℃,年均降雨量786.6 mm,干湿季鲜明,80%以上的降水集中于雨季(5—10月)。2019年元江干热河谷发生极端干旱事件,年均温达27.2 ℃,5月均温32.4 ℃,最高温达45 ℃,为建站以来历史最高气温,12月均温最低(18.9 ℃),年降雨量390 mm,60%的降水集中在7—9月,2—5月的降水量仅占6%。植被为典型的干热河谷植被类型,以稀树灌丛为主,乔木层以厚皮树(Lannea coromandelica)和细基丸(Poly- althia cerasoides)为优势种,灌木层以霸王鞭(Eu- phorbia royleana)、疏序黄荆(Vitex negundo)、三叶漆(Terminthia paniculata)占优势,草本层主要以扭黄茅(Heteropogon contortus)为主。
1.2 方法叶片采集 2019年8月,在干热河谷选择干旱导致植物叶片出现死亡的5种树种,分别为鞍叶羊蹄甲(Bauhinia brachycarpa)、白皮乌口树(Tarenna depauperata)、灰毛浆果楝(Cipadessa bacci- fera)、细基丸和九里香(Rubus pungens),采集干旱死亡叶片,每树种选取3~4株成熟个体; 在12月采集相应树种的刚刚掉落的、没有损坏的新鲜凋落叶,剔除那些明显被动物啃食、磨损、真菌侵染或者仍然为绿叶的叶片。每树种各采集200 g干旱死亡叶片或自然凋落叶,收集完成后,将叶片放置于35 ℃下烘干,然后每树种取100 g叶片放入球磨仪研磨,研磨后密封保存,用于测定相关化学指标。
化学性质的测定 叶片的C和N含量采用C、N元素分析仪测定(ElementarVario, Hanau, Germany)。取2 g样品中加入60 mL去离子水,在振荡器上振荡30 min,将过滤后的浸提液放入TOC分析仪(Vario TOC cube, Elementar Analysis system GmbH, Langenselbold, Germany)中进行凋落物可溶性C测定。木质素、半纤维素和纤维素依据美国国家可再生能源实验室标准[29]测定,采用酸水解法进行分馏,水解的液体用于量化纤维素和半纤维素, 采用高效液相色谱方法(HPLC) (Agilent-1260, Agilent Technologies, Santa, Clara, CA, USA)测定。木质素分馏的2种形式(酸不溶性组分和酸溶性组分),采用紫外-可见光吸收光谱测定(Lambda 25, PerkinElmer, Singapore)。单宁含量参照Hagerman[30]的酸-丁醇法测定。将凋落物样品放入硫酸和高氯酸中进行酸化,用电感耦合等离子质谱(ICP-MS) (Elan DRC-e; PerkinElmer, Norwalk, CT, USA)测定凋落物中的P、Ca、K、Mg和Mn含量。
1.3 数据的统计分析采用单因素方差(One-Way ANOVA)分析不同树种间叶片化学性质的差异性,用Turkey HSD进行显著性检验(α=0.05),应用配对t检验比较干旱死亡与自然凋落叶片化学性质间的差异性;运用线性回归分析两种叶片化学性质的相关关系。运用SPSS 16.0 (SPSS Inc., Chicago, Illinois, USA)对数据进行统计分析,用OriginPro 2016绘制图表。
2 结果和分析 2.1 两种叶片的化学特征5种树种干旱死亡叶片的化学性质表现出较大程度的变异,且不同树种间的C和养分化学性质具有极显著差异(表 1,P < 0.001)。变异最大的是单宁含量,变异系数为121%,其次为半纤维素、N、P和Mn含量,变异系数为32%~47%,其余化学性质, 如可溶性C、木质素、纤维素含量等的变异系数较小(< 30%),变异最小的是C含量,变异系数仅为3%。
| 表 1 5种植物干旱死亡和自然凋落叶片的化学性质 Table 1 Chemical properties of drought-dead and natural litter leaves |
5种植物自然凋落叶的C和养分化学特征同样表现出较大程度的变异,且不同树种间达极显著差异(表 1, P < 0.001)。变异最大的是单宁含量,变异系数为148%,其次为可溶性C、半纤维素、P和Ca含量,变异系数为56%~74%,最小的为C含量, 变异系数仅为2%。
2.2 两种叶片化学性质的差异干旱死亡叶片和自然凋落叶的可溶性C、木质素、半纤维素含量、C/N、N和Mg含量有显著差异,而C、纤维素、单宁、木质素/N、P和K、Ca、Mn含量的差异未达显著水平(图 1),干旱死亡叶片的平均可溶性C含量为543.8 g/kg,显著高于自然凋落叶(369.7 g/kg)(P < 0.05);干旱死亡叶片的C/N为30.3,显著高于自然凋落叶;此外干旱死亡叶片的Mg含量也显著高于自然凋落叶(P=0.04)。但干旱死亡叶片的木质素和N含量显著低于自然凋落叶(P < 0.05),半纤维素含量(74 g/kg)极显著低于自然凋落叶(98.3 g/kg)(P < 0.01)。

|
图 1 干旱死亡叶片与自然凋落叶的化学性质。*: P < 0.05; **: P < 0.01。 Fig. 1 Chemical traits in drought-dead and natural litter leaves. *: P < 0.05; **: P < 0.01. |
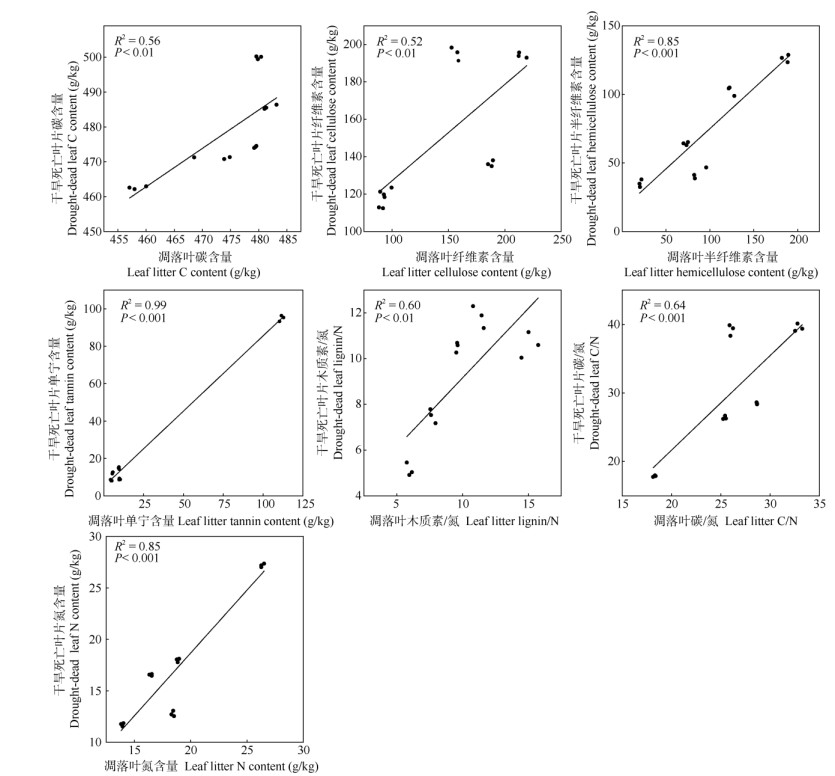
相关性分析表明(表 2),干旱死亡叶片与自然凋落叶化学性质具有较好的相关性,两种叶片的半纤维素、单宁、N含量和C/N均呈极显著正相关关系(r > 0.80,P < 0.001),此外,C、纤维素含量和木质素/N也具有较高的相关性(r > 0.7,P < 0.01)。但两种叶片的DOC、木质素、P、K、Ca、Mg和Mn含量没有相关性(P > 0.05)。回归分析结果表明(图 2),自然凋落叶的C、纤维素、半纤维素、单宁、木质素/ N、C/N和N含量可以很好的解释干旱死亡叶片的化学性质,其中自然凋落叶的半纤维素、单宁和N含量可以解释干旱死亡叶片半纤维素和N含量85%以上的变异。
| 表 2 干旱死亡叶片与自然凋落叶间化学性质的相关性 Table 2 Pearson correlations between dry dead leaves and litter chemistry |
|
图 2 干旱死亡叶片和凋落叶间化学性质的关系 Fig. 2 Relationship of chemistry traits between drought-dead and natural litter leaves |
不同树种干旱死亡叶片和自然凋落叶的化学性质具有显著差异,植物叶片中的C具有不同的化学形态,从可溶的低分子量化合物到不溶性脂质、单分子化合物(纤维素)和更为复杂的聚合物(木质素)[31],尽管不同树种干旱死亡叶片和自然凋落叶中C含量变化不大,但是不同形态C化合物含量具有较大差异。C化学性质的差异性也主要表现在不同形态C化合物上,如可溶性C、半纤维素、木质素等。干旱死亡叶片并没有衰老,而是植物为了维持生存对极端干旱的一种响应机制,在极端干旱条件下,植物通过关闭气孔以停止蒸腾作用,当干旱威胁植物生存时,植物会选择加速部分器官的死亡,比如叶片,以尽可能维持自身的存活。本研究中干热河谷植物叶片在干旱环境下的死亡凋落正是其维持生存的被动适应策略[32]。因此,干旱死亡叶片的理化性质与自然衰老形成的凋落叶会存在很大差异。
Li等[33]对亚热带森林常见的9种树种的绿叶和自然凋落叶化学性质进行了分析,与自然凋落叶相比,绿叶具有更高的N、P、可溶性糖和木质素含量,但C/N和木质素/N更低;此外,绿叶和自然凋落叶的C、纤维素和单宁含量之间差异不显著。绿叶和自然凋落叶化学性质的差异,一方面是由于绿叶具有光合能力,因此其非结构性C、N含量会比凋落叶高;另一方面,叶片在自然衰老过程中, 植物会回收N、P等矿质营养元素。然而,极端干旱事件导致植物叶片的脱落与冰雪灾害、台风等极端天气产生大量的非正常凋落物具有一定的差异性, 植物遭遇干旱胁迫时会经历由轻度干旱、中度干旱、再到重度干旱转变的一个过程,植物会通过调节其一系列生理过程来适应干旱胁迫,当重度干旱威胁整株植物存活时,会以牺牲部分器官的死亡(比如叶片)来延长植物存活的时间;而冰雪灾害、台风等极端天气通常具有突发性特点,在短期内对植物产生破坏性影响,如断枝、倒伏、连根拔起等。本研究中,干旱死亡叶片比自然凋落叶具有更高的可溶性C、C/N、Mg含量,而木质素、半纤维素和N含量则更低, 这与前人研究绿叶N、木质素含量比自然凋落叶更高的结论不同,表明极端干旱引起植物叶片死亡凋落与冰雪灾害、台风等极端天气产生大量绿叶对生态系统C和养分循环具有不同的影响。有关元江干热河谷木本植物的物候研究表明, 3—6月随着植物枝条的不断抽出,叶片数量也逐步增加[34],而2019年3—6月干热河谷温度高(月均温达29.7 ℃),降水稀少(仅45.2 mm),该时期严重干旱导致枯萎凋亡的叶片多为幼嫩叶片,木质化程度相对较低,另外干旱胁迫时,植物光合作用降低, 光合产物向叶片的分配也会相应下降,也会影响叶片中N含量的积累,从而导致本研究中干旱死亡叶片可溶性C含量比自然凋落叶更高,而木质素、半纤维素和N含量要显著低于自然凋落叶。此外, 干旱胁迫时,植物叶片是否加速N等矿质养分的回收, 从而导致干旱死亡叶片N含量显著低于自然凋落叶有待于进一步验证。Mg元素是叶绿素的核心成分,干旱死亡叶片是具有光合作用能力的绿叶在极端干旱条件下的萎蔫凋落,因此其Mg含量显著高于自然凋落叶。
然而,干旱死亡叶片与自然凋落叶的单宁、P和K、Ca、Mn含量没有显著差异。单宁是植物产生的次生代谢产物(防御化合物),能够与细胞质中的蛋白质结合,形成结构复杂稳定的单宁-蛋白质络合物[35],这可能是干旱死亡叶片与自然凋落叶单宁含量没有差异的原因。干旱死亡叶片P含量略低于自然凋落叶,但差异未达显著水平,这与前人报道的叶片P含量随土壤水分含量的减少而降低的结果相类似,极端干旱显著降低土壤水分,从而降低土壤中P的有效性,进而影响植物对P的吸收[36-37]。K、Ca、Mn等元素对植物的新陈代谢具有重要影响, K可以调节细胞的渗透压和气孔开关[38],Ca离子能够调节酶的活性,提高植物的保水能力,增强植物的抗旱性[39],Mn是锰超氧化物歧化酶(Mn-SOD)的重要辅助因子,Mn-SOD能够清除干旱条件下植株中产生损害植物代谢功能的活性氧[40]。干旱是元江干热河谷植物最主要的胁迫因子,植物叶片K、Ca、Mn等离子含量的稳定有利于应对干旱胁迫, 这可能是干旱死亡叶片与自然凋落叶K、Ca、Mn含量较为稳定的原因之一。
干旱死亡叶片与自然凋落叶的化学性质具有较好的相关性,因此可以根据自然凋落叶的化学性质来预测未来极端干旱条件下干旱死亡叶片的化学性质。研究表明,绿叶与自然凋落叶间的化学性质也具有相关性,其C、N、P含量和C/N具有显著的相关关系,但两者的木质素含量不相关[26, 28]。干旱死亡叶片的化学性质与凋落叶间有高度相关性,如自然凋落叶木质素/N和N含量分别可以解释干旱死亡叶片木质素/N和N含量60%和85%的变异。未来应关注干旱死亡叶片与自然凋落叶分解对比研究,尽管两者化学性质具有较高的相关性, 控制其分解速率的因素是否不同还需进一步研究。
综上所述,云南元江干热河谷干旱死亡叶片与自然凋落叶化学性质(可溶性C、木质素、半纤维素、C/N、N和Mg含量)存在显著差异,而单宁、木质素/N、P、K、Ca和Mg含量没有显著差异。此外,干旱死亡叶片与自然凋落叶的C含量、纤维素、半纤维素、单宁、木质素/N、C/N和N含量呈显著正相关关系。可见,根据自然凋落叶化学性质可以预测未来极端干旱条件下干旱死亡叶片化学性质。
致谢 感谢中国科学院西双版纳热带植物园元江干热河谷生态站和中心实验室的大力支持,以及刀万有科研助理在野外采样过程中的帮助。
| [1] |
LIN J J, ZHU B, CHENG W X. Decadally cycling soil carbon is more sensitive to warming than faster-cycling soil carbon[J]. Glob Change Biol, 2015, 21(12): 4602-4612. DOI:10.1111/gcb.13071 |
| [2] |
AVERILL C, HAWKES C V. Ectomycorrhizal fungi slow soil carbon cycling[J]. Ecol Lett, 2016, 19(8): 937-947. DOI:10.1111/ele.12631 |
| [3] |
FANG Y Y, NAZARIES L, SINGH B K, et al. Microbial mechanisms of carbon priming effects revealed during the interaction of crop residue and nutrient inputs in contrasting soils[J]. Glob Change Biol, 2018, 24(7): 2775-2790. DOI:10.1111/gcb.14154 |
| [4] |
HUANG S D, HUANG Y R, GAO W, et al. Dynamics of litterfall and nutrient return in three typical forests of Wuyi Mountain along altitudinal gradient[J]. J Trop Subtrop Bot, 2020, 28(4): 394-402. 黄石德, 黄雍容, 高伟, 等. 沿海拔梯度武夷山3种典型森林凋落物及养分归还动态[J]. 热带亚热带植物学报, 2020, 28(4): 394-402. DOI:10.11926/jtsb.4146 |
| [5] |
XU Y X, WANG Z C, ZHU W K, et al. Litterfall and nutrient cycling of eucalyptus plantation with different ages on Leizhou peninsula[J]. J Trop Subtrop Bot, 2019, 27(4): 359-366. 许宇星, 王志超, 竹万宽, 等. 雷州半岛桉树人工林凋落物量和养分循环研究[J]. 热带亚热带植物学报, 2019, 27(4): 359-366. DOI:10.11926/jtsb.3986 |
| [6] |
MAKKONEN M, BERG M P, HANDA I T, et al. Highly consistent effects of plant litter identity and functional traits on decomposition across a latitudinal gradient[J]. Ecol Lett, 2012, 15(9): 1033-1041. DOI:10.1111/j.1461-0248.2012.01826.x |
| [7] |
SUSEELA V, THARAYIL N. Decoupling the direct and indirect effects of climate on plant litter decomposition: Accounting for stress-induced modifications in plant chemistry[J]. Glob Change Biol, 2018, 24(4): 1428-1451. DOI:10.1111/gcb.13923 |
| [8] |
AERTS R. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: A triangular relationship[J]. Oikos, 1997, 79(3): 439-449. DOI:10.2307/3546886 |
| [9] |
ZHOU G Y, GUAN L L, WEI X H, et al. Factors influencing leaf litter decomposition: An intersite decomposition experiment across China[J]. Plant Soil, 2008, 311(1-2): 61-72. DOI:10.1007/s11104-008-9658-5 |
| [10] |
CORNWELL W K, CORNELISSEN J H C, AMATANGELO K, et al. Plant species traits are the predominant control on litter decomposition rates within biomes worldwide[J]. Ecol Lett, 2008, 11(10): 1065-1071. DOI:10.1111/j.1461-0248.2008.01219.x |
| [11] |
BHATNAGAR J M, PEAY K G, TRESEDER K K. Litter chemistry influences decomposition through activity of specific microbial func- tional guilds[J]. Ecol Monogr, 2018, 88(3): 429-444. DOI:10.1002/ecm.1303 |
| [12] |
MELILLO J M, ABER J D, MURATORE J F. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics[J]. Ecology, 1982, 63(3): 621-626. DOI:10.2307/1936780 |
| [13] |
SCHMIDT M W I, TORN M S, ABIVEN S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478(7367): 49-56. DOI:10.1038/nature10386 |
| [14] |
ZHANG D Q, HUI D F, LUO Y Q, et al. Rates of litter decomposition in terrestrial ecosystems: Global patterns and controlling factors[J]. J Plant Ecol, 2008, 1(2): 85-93. DOI:10.1093/jpe/rtn002 |
| [15] |
PAUDEL E, DOSSA G G O, DE Blécourt M, et al. Quantifying the factors affecting leaf litter decomposition across a tropical forest distur- bance gradient[J]. Ecosphere, 2015, 6(12): 1-20. DOI:10.1890/ES15-00112.1 |
| [16] |
YU G C, ZHAO H B, CHEN J, et al. Soil microbial community dynamics mediate the priming effects caused by in situ decomposition of fresh plant residues[J]. Sci Total Environ, 2020, 737: 139708. DOI:10.1016/j.scitotenv.2020.139708 |
| [17] |
WU Z M, LI Y D, ZHOU G Y, et al. Abnormal litterfall and its ecological significance[J]. Sci Silv Sin, 2008, 44(11): 28-31. 吴仲民, 李意德, 周光益, 等. "非正常凋落物"及其生态学意义[J]. 林业科学, 2008, 44(11): 28-31. DOI:10.3321/j.issn:1001-7488.2008.11.006 |
| [18] |
CAO K F, CHANG J. The ecological effects of an unusual climatic disaster: The destruction to forest ecosystems by the extremely heavy glaze and snow storms occurred in early 2008 in southern China[J]. Chin J Plant Ecol, 2010, 34(2): 123-124. 曹坤芳, 常杰. 突发气象灾害的生态效应: 2008年中国南方特大冰雪灾害对森林生态系统的破坏[J]. 植物生态学报, 2010, 34(2): 123-124. DOI:10.3773/j.issn.1005-264x.2010.02.002 |
| [19] |
GUO S H, XUE L. Effects of ice-snow damage on forests[J]. Acta Ecol Sin, 2012, 32(16): 5242-5253. 郭淑红, 薛立. 冰雪灾害对森林的影响[J]. 生态学报, 2012, 32(16): 5242-5253. DOI:10.5846/stxb201201120072 |
| [20] |
LIU L Y, XUE L. Effects of ice-snow damage on forest soils properties[J]. World For Res, 2018, 31(6): 10-15. 刘落鱼, 薛立. 冰雪灾害对森林土壤性质的影响[J]. 世界林业研究, 2018, 31(6): 10-15. DOI:10.13348/j.cnki.sjlyyj.2018.0069.y |
| [21] |
DUAN H L, WU J P, LIU W F, et al. Water relations and carbon dynamics under drought stress and the mechanisms of drought-induced tree mortality[J]. Sci Silv Sin, 2015, 51(11): 113-120. 段洪浪, 吴建平, 刘文飞, 等. 干旱胁迫下树木的碳水过程以及干旱死亡机理[J]. 林业科学, 2015, 51(11): 113-120. DOI:10.11707/j.1001-7488.20151115 |
| [22] |
MALIK A A, SWENSON T, WEIHE C, et al. Drought and plant litter chemistry alter microbial gene expression and metabolite production[J]. ISME J, 2020, 14(9): 2236-2247. DOI:10.1038/s41396-020-0683-6 |
| [23] |
ZHOU G Y, LI L, WU A C. Effect of drought on forest ecosystem under warming climate[J]. J Nanjing Univ Inf Sci Technol, 2020, 12(1): 81-88. 周国逸, 李琳, 吴安驰. 气候变暖下干旱对森林生态系统的影响[J]. 南京信息工程大学学报, 2020, 12(1): 81-88. DOI:10.13878/j.cnki.jnuist.2020.01.010 |
| [24] |
YE L H, HUANG X L, XUE L. Effects of drought on leaf traits and drought-resistant physiology of trees[J]. World For Res, 2014, 27(1): 29-34. 叶龙华, 黄香兰, 薛立. 干旱对树木叶片性状及抗旱生理的影响[J]. 世界林业研究, 2014, 27(1): 29-34. DOI:10.13348/j.cnki.sjlyyj.2014.01.006 |
| [25] |
LIU Y B, ZHANG T G, LI X R, et al. Protective mechanism of desiccation tolerance in Reaumuria soongorica: Leaf abscission and sucrose accumulation in the stem[J]. Sci China Ser C, 2006, 36(1): 15-21. 刘玉冰, 张腾国, 李新荣, 等. 红砂(Reaumuria soongorica)忍耐极度干旱的保护机制: 叶片脱落和茎中蔗糖累积[J]. 中国科学C辑生命科学, 2006, 36(4): 328-333. DOI:10.3321/j.issn:1006-9259.2006.04.005 |
| [26] |
HÄTTENSCHWILER S, AESCHLIMANN B, COUTEAUX M M, et al. High variation in foliage and leaf litter chemistry among 45 tree species of a neotropical rainforest community[J]. New Phytol, 2008, 179(1): 165-175. DOI:10.1111/j.1469-8137.2008.02438.x |
| [27] |
XIE C. Impact of nitrogen addition on decomposition of leaf litter and fresh leaves in a semiarid grassland ecosystem[D]. Lanzhou: Lanzhou University, 2017: 15-17. 谢婵. 氮添加对黄土高原半干旱区两种植物的新鲜和自然凋落叶片分解的影响[D]. 兰州: 兰州大学, 2017: 15-17. |
| [28] |
BAKKER M A, CARREÑO-ROCABADO G, POORTER L. Leaf economics traits predict litter decomposition of tropical plants and differ among land use types[J]. Funct Ecol, 2011, 25(3): 473-483. DOI:10.1111/j.1365-2435.2010.01802.x |
| [29] |
SLUITER A, HAMES B, RUIZ R, et al. Determination of structural carbohydrates and lignin in biomass[R]. Golden: National Renewable Energy Laboratory, 2008.
|
| [30] |
HAGERMAN A E. The Tannin Handbook[M]. Oxford: Miami University, 2011.
|
| [31] |
COTRUFO M F, SOONG J L, HORTON A J, et al. Formation of soil organic matter via biochemical and physical pathways of litter mass loss[J]. Nature Geosci, 2015, 8(10): 776-779. DOI:10.1038/ngeo2520 |
| [32] |
AN Y Y, LIANG Z S. Staged strategy of plants in response to drought stress[J]. Chin J Appl Ecol, 2012, 23(10): 2907-2915. 安玉艳, 梁宗锁. 植物应对干旱胁迫的阶段性策略[J]. 应用生态学报, 2012, 23(10): 2907-2915. DOI:10.13287/j.1001-9332.2012.0403 |
| [33] |
LI R S, ZHANG Y Z, YU D, et al. The decomposition of green leaf litter is less temperature sensitive than that of senescent leaf litter: An incubation study[J]. Geoderma, 2021, 381: 114691. DOI:10.1016/j.geoderma.2020.114691 |
| [34] |
ZHANG J L, HAO G Y, CAO K F. Phenology of woody species in Yuanjiang Dry-hot Valley in Yunnan Province[J]. Wuhan Bot Res, 2009, 27(1): 76-82. 张教林, 郝广友, 曹坤芳. 云南元江干热河谷木本植物的物候[J]. 武汉植物学研究, 2009, 27(1): 76-82. DOI:10.3969/j.issn.2095-0837.2009.01.012 |
| [35] |
CHOMEL M, GUITTONNY-LARCHEVÊQUE M, FERNANDEZ C, et al. Plant secondary metabolites: A key driver of litter decomposition and soil nutrient cycling[J]. J Ecol, 2016, 104(6): 1527-1541. DOI:10.1111/1365-2745.12644 |
| [36] |
FU Y W, TIAN D S, NIU S L, et al. Effects of nitrogen, phosphorus addition and drought on leaf stoichiometry in dominant species of alpine meadow[J]. J Beijing For Univ, 2020, 42(5): 115-123. 符义稳, 田大栓, 牛书丽, 等. 氮磷添加和干旱对高寒草甸优势植物叶片化学计量的影响[J]. 北京林业大学学报, 2020, 42(5): 115-123. DOI:10.12171/j.1000-1522.20190469 |
| [37] |
LUO W T, ZUO X A, GRIFFIN-NOLAN R J, et al. Long term experimental drought alters community plant trait variation, not trait means, across three semiarid grasslands[J]. Plant Soil, 2019, 442(1/2): 343-353. DOI:10.1007/s11104-019-04176-w |
| [38] |
SU W, LIU J, WANG B, et al. Research progress on the HAK function of plant high affinity potassium ion transporter[J]. Biotechnol Bull, 2020, 36(8): 144-152. 苏文, 刘敬, 王冰, 等. 植物高亲和钾离子转运蛋白HAK功能研究进展[J]. 生物技术通报, 2020, 36(8): 144-152. DOI:10.13560/j.cnki.biotech.bull.1985.2020-0152 |
| [39] |
KARABOURNIOTIS G, HORNER H T, BRESTA P, et al. New insights into the functions of carbon-calcium inclusions in plants[J]. New Phytol, 2020, 228(3): 845-854. DOI:10.1111/nph.16763 |
| [40] |
RAO L S, WANG P, ZHANG J J, et al. Mn-SOD gene expression in Chinese fir under different stress[J]. J NE For Univ, 2018, 46(6): 19-22. 饶丽莎, 王培, 张家君, 等. 不同逆境胁迫下杉木Mn-SOD基因表达[J]. 东北林业大学学报, 2018, 46(6): 19-22. DOI:10.13759/j.cnki.dlxb.2018.06.004 |
 2022, Vol. 30
2022, Vol. 30



