2. 广东石油化工学院生物与食品工程学院, 广东 茂名 525000
2. School of Biological and Food Engineering, Guangdong University of Petrochemical Technology, Maoming 525000, Guangdong, China
外来植物自身生物学特性,是其能够成功入侵的先天优势。如入侵植物通常具有较强的适应性, 对各种环境因子具有较宽的生态幅[1-2]。大部分入侵植物与同科、属的近缘植物相比,都表现出了更广的适应范围,能够快速进行调节,从而具有更大的入侵潜力[3-4]。随光照强度的降低,空心莲子草(Alternanthera philoxeroides)的分枝强度、基株株长、茎节长度下降,总生物量及根、茎、叶生物量显著减少;弱光下生长迟缓,呈直立状[5]。光照是限制北美森林入侵植物葱芥(Alliaria petiolata)种群建立的重要因素之一,低光条件下幼苗存活率下降,但可以通过产生大量种子增加繁殖体压力从而入侵低光环境[6-7]。原产美洲热带地区的马樱丹(Lantana camara)通过增大叶片、叶生物量和叶面积指数等来适应弱光从而成功入侵[8]。植物对光的适应性主要体现在地上部分和地下部分生物量分配格局上的变化[9],草本攀缘植物在变化的光环境中会对生物量的分配做出改变使其表现出较高的形态可塑性, 进而有效地寻觅高光条件[10-11]。
薇甘菊(Mikania micrantha)是菊科(Compositae)假泽兰属的一种藤本植物,原产热带美洲[12],现已成为我国华南地区危害最严重的外来入侵杂草之一,可以入侵多种生境,但备受人们关注的主要是农林生态系统,特别是薇甘菊对森林群落的危害。薇甘菊对森林群落的危害通常是通过攀爬作用实现的,在树冠顶部形成一层厚厚的覆盖层,使树木缺乏阳光无法进行光合作用而死亡,故薇甘菊也被称作“绿色杀手”[13]。薇甘菊的种子萌发通常在林下进行,幼苗在林下低光环境下成长,但薇甘菊是一种强阳性植物[14],如何克服低光限制,在低光下快速伸长,攀爬至林冠层并在林冠层扩展而入侵成功的,这是一个非常有趣而值得探讨的科学问题。
目前有关薇甘菊入侵的光合生理研究主要集中在叶片上,而对茎的研究相对较少。前期观察发现,与楼顶天台(全光)环境相比,在温室中(低光)薇甘菊主茎更长,推测可能与其光合生理特征和生长调节剂合成有关。因此,本文以全光照为对照, 研究薇甘菊在低光照(遮阴处理)条件下的茎伸长特征、光合特性及其调节物质的变化,以期为了解薇甘菊从林下低光攀爬至林冠层的入侵过程机制提供理论依据。
1 材料和方法 1.1 材料和设计试验材料为薇甘菊(Mikania micrantha)扦插苗和油白豆角(Vigna unguiculata)实生苗。从采自深圳内伶仃岛(22°24'37.52'' N,113°48'28.63'' E)的薇甘菊进行无性繁殖,即取薇甘菊茎段进行水培扦插(至少有2个节)培养扦插苗。油白豆角种子购自广州科田种苗有限公司。以本地土壤∶园艺土=1∶1混匀后填充至直径21 cm、高12 cm的塑料花盆中,填充量为花盆高度的2/3,保证每盆土壤质量基本一致。选取生长健康,长势一致的生根扦插苗(约培养1周)移栽至花盆中,每盆1株。将油白豆角直播在花盆中育苗,每个花盆播5粒种子,待萌发至长出2片真叶时,间苗至1棵。将花盆放置在华南师范大学生命科学学院楼顶进行培养。
薇甘菊和油白豆角经2周的适应性培养健康生长后,进行2种光照处理:全光(透光率100%)和低光(透光率30%)[15],30%光照用遮阴网实现。每种植物每处理设置30盆重复,花盆完全随机摆放, 生长周期约4周。
1.2 生长指标的测定处理后每5 d统计测量1次植物的主茎长、分枝数和叶片数, 处理结束后对植株进行收获,冲洗干净,分开茎、叶、根3部分,分装入信封中,置于75 ℃烘箱中烘干,称量茎、叶、根的生物量, 并计算茎、叶、根生物量在总生物量中的占比。每种植物每处理选取10片成熟叶,用YMJ-C叶面积测定仪测定叶面积,将叶片烘干,测定干质量,计算比叶面积=叶面积/叶干质量。
1.3 气体交换参数与光响应曲线观察到薇甘菊的茎生长速率在处理20 d后达到最高,因此,在处理第20天用LI-6800便携式光合作用分析仪(LI-COR, Inc, USA)测定植物叶片和茎的气体交换参数。选取植株第3叶位的叶片和第3茎节进行测定,光源使用叶室(3 cm×3 cm)标配的LED红蓝光源,光强设置为800 μmol/(m2·s),CO2摩尔浓度设置为400 μmol/mol。叶片和茎均在800 μmol/(m2·s)光强下充分诱导,待光合作用达到最佳时记录数据。将光强设置为0 μmol/(m2·s), 分别测定叶片和茎的暗呼吸速率(Rd)。
测定净光合速率-光照强度响应曲线时,先用1 600 μmol/(m2·s)光强诱导茎,待稳定后再进行测量, 设定光照梯度为:1 800、1 500、1 200、900、600、300和0 μmol/(m2·s),每个光强的等待时间为150 s。光源由整合在叶室的LED红蓝(9∶1)光源提供。测量过程中控制参比室的CO2摩尔浓度为400 μmol/mol, 在上午8:30—12:00进行测量,连续测定2 d。仪器自动计算和储存气体交换参数,包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),光响应曲线使用非直角双曲线模型进行拟合[16]。
1.4 可溶性蛋白与Rubisco含量的测定称取约0.1 g茎节,加入0.4 mL预冷的Tirs缓冲液(0.1% NaCl、5% PVP聚乙烯吡咯烷酮和2%甘油, pH 8.5)充分研磨,再加0.6 mL Tirs缓冲液润洗, 充分混匀后,冰浴静置10 min,于4 ℃下16 241×g离心10 min,上清液转移至新的1.5 mL离心管(冰浴),即为蛋白提取液。可溶性蛋白含量采用Bradford试剂盒进行测定,取蛋白提取液250 μL稀释10倍后,加入250 μL Bradford工作液混匀, 以超纯水为空白对照,用紫外分光光度计于波长595 nm下测定反应液的吸光值,根据标准曲线计算可溶性蛋白含量。
Rubisco蛋白含量采用SDS-PAGE电泳法[17]进行测定。蛋白提取液与等体积的2×蛋白质上样缓冲液[10 mmol/L Tris, 2% (W/V) SDS, 24% (V/V)甘油, 2% (V/V) β-巯基乙醇和0.02% (W/V)溴酚蓝,pH 7.6]混合,沸水浴5 min后,于4 ℃保存备用。取10 μL蛋白提取液与蛋白质上样缓冲液混合液上样, SDS-PAGE电泳分析使用4%浓缩胶和12.5%分离胶,浓缩电压为80 V,时间为30 min,分离电压为110 V,时间为80 min。电泳结果进行显色后拍照, 根据分子量和蛋白丰度识别Rubisco蛋白的大小亚基(分子量分别为55和15 kD),使用Total Lab Quant软件(Total Lab, Newcastle upon Tyne, UK)分析Rubisco蛋白条带的灰度值。
1.5 生长调节剂含量的测定取0.1 g薇甘菊茎,加入0.4 mL预冷的PBS缓冲液(0.04 mol/L Na2HPO4,0.01 mol/L KH2PO4, pH= 7.4)充分研磨,再加0.6 mL PBS缓冲液润洗, 充分混匀后,于4 ℃下1 537×g离心10 min,取上清液。细胞分裂素(CTK)、赤霉素(GA)和生长素(Auxin)采用ELISA酶联免疫试剂盒(深圳子科生物技术有限公司)测定。在预先包被激素抗体的包被微孔中,依次加入待测样品、标准品、辣根过氧化物酶(HRP)标记的检测抗体,经温育并彻底洗涤,加入底物3, 3′, 5, 5′-四甲基联苯胺(3, 3', 5, 5'-tetramethylbenzidine, TMB)显色反应15 min,最后加入反应终止液终止反应。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色,颜色的深浅和样品中的生长调节剂含量呈正相关。用酶标仪(En- Spire, PerkinElmer, USA)在450 nm波长下测定吸光度(OD值),计算生长调节剂含量。
1.6 数据处理采用SPSS 19.0进行单因素方差分析,控制变量为光照,设置2个水平(100%透光率和30%透光率),观察变量分别为生长指标(主茎长度、分枝数、叶数、总生物量等)、光合参数和生长调节剂含量等。2处理间使用t检验(P < 0.05)进行差异显著性分析。采用SigmaPlot 12.5和Origin 8.0进行绘图,数据均以平均值±标准差表示。
2 结果和分析 2.1 茎的伸长与生物量分配的变化与全光照相比,低光下薇甘菊生长指标的变化与油白豆角的有显著不同(表 1),薇甘菊的主茎长在低光下大于全光,显著增加了14.35% (P < 0.05);而油白豆角的则低于全光,显著降低了49.37% (P < 0.001)。薇甘菊的分枝数和叶片数在低光下均低于全光,分别显著降低了61.22%和69.98% (P < 0.001);而油白豆角的分枝数显著高于全光,叶片数则低于全光,显著降低了32.96% (P < 0.05)。薇甘菊和油白豆角的比叶面积在低光下均显著增加(P < 0.001)。可见,荫蔽环境有利于薇甘菊茎的伸长。
| 表 1 薇甘菊与油白豆角生长指标的变化 Table 1 Changes in growth indexes of Mikania micrantha and Vigna unguiculata |
低光处理的薇甘菊地上部分生物量比全光处理的减少了41.7%,但差异不显著;而低光下油白豆角则显著减少了85.8%,说明低光条件严重影响其地上部分生长。另外,与全光相比,低光下薇甘菊和油白豆角地下部分生物量均显著下降,且油白豆角(下降94.3%)比薇甘菊(下降63.9%)更为严重(表 2)。薇甘菊在低光下地上部分生物量下降较少,说明更能适应低光环境。
| 表 2 薇甘菊和油白豆角生物量分配的变化 Table 2 Changes in biomass allocation of Mikania micrantha and Vigna unguiculata |
为进一步了解薇甘菊在低光下茎和叶、根生物量的分配变化,对茎、叶、根的生物量分配进行了对比分析。结果表明,与全光相比,低光下薇甘菊叶和根生物量均显著下降,茎则无显著差异(P > 0.05)。低光下薇甘菊茎生物量占比和叶生物量占比分别升高了14.2%和8.8%,茎生物量占比增加的幅度是叶生物量占比的1.61倍(表 3)。可见, 低光下薇甘菊根的生物量分配显著减少,植株将更多的生物量分配投入到茎和叶,且分配到茎的生物量更大。
| 表 3 薇甘菊根、茎、叶生物量分配的变化 Table 3 Changes in biomass allocation of Mikania micrantha |
净光合速率(Pn) 处理20 d,全光和低光下薇甘菊茎的Pn均比处理前[幼苗期为580.6 μmol/(m2·s)]显著上升;与全光相比,低光下薇甘菊茎的Pn显著下降,但仍保持在较高水平,约为全光的63.2% (图 1: A)。全光下油白豆角茎的Pn比处理前(幼苗期)显著上升,而低光下却显著下降;与全光相比,低光下油白豆角茎的Pn由正变负,下降了246.4%。处理20 d后,低光下薇甘菊和油白豆角叶片的Pn分别比全光下显著下降了35.33%和26.09% (图 1: B, P < 0.05)。可见,薇甘菊茎的Pn变化对低光比油白豆角更不敏感。

|
图 1 薇甘菊和油白豆角净光合速率(Pn)的变化。n=5; A: 茎; B: 叶。柱子上不同字母表示差异显著(P < 0.05)。 Fig. 1 Changes in net photosynthetic rate (Pn) of Mikania micrantha and Vigna unguiculata. n=5; A: Stem; B: Leaf. Different letters upon column indicate significant differences at 0.05 level. |
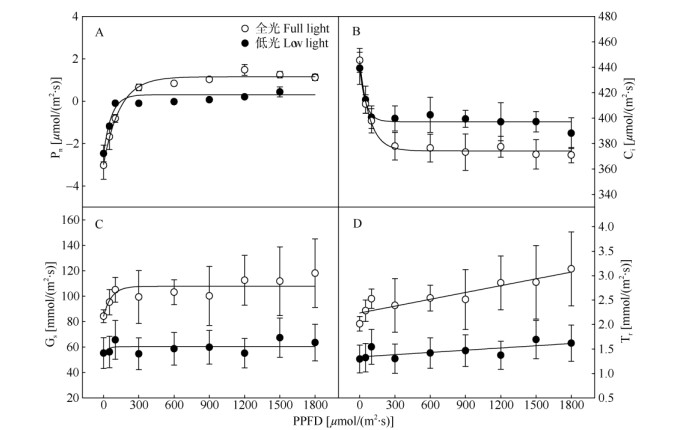
光响应曲线 处理20 d后,低光下薇甘菊茎的Pn、Gs和Tr均低于全光,Ci则高于全光(图 2)。不同光强下薇甘菊茎的Pn和Ci对光量子通量密度(photosynthetic photon flux density, PPFD)的响应存在差异,Pn和Ci均与PPFD呈曲线关系。当PPFD小于300 μmol/(m2·s)时,Pn呈上升趋势,Ci呈下降趋势;当PPFD在300~1 800 μmol/(m2·s)时,Pn和Ci变化趋于平缓,低光下Pn显著小于全光(图 2: A),Ci则显著高于全光(图 2: B)。不同光强下薇甘菊茎的Gs和Tr对PPFD的响应也存在显著差异,低光下Gs和Tr显著低于全光。当PPFD小于200 μmol/(m2·s)时,Gs随PPFD增加呈上升趋势;当PPFD为200~ 1 800 μmol/(m2·s)时,Gs变化趋于平缓(图 2: C);当PPFD为0~1 800 μmol/(m2·s)时,Tr随PPFD增加逐渐上升(图 2: D)。
|
图 2 薇甘菊茎的光响应曲线。n=5; PPFD: 光量子通量密度; Pn: 净光合速率; Gs: 气孔导度; Ci: 胞间CO2浓度; Tr: 蒸腾速率。 Fig. 2 Light response curve of Mikania micrantha stem. n=5; PPFD: Photosynthetic photon flux density; Pn: Net photosynthetic rate; Gs: Stomatal conductance; Ci: Intercellular CO2 concentration; Tr: Transpiration rate. |
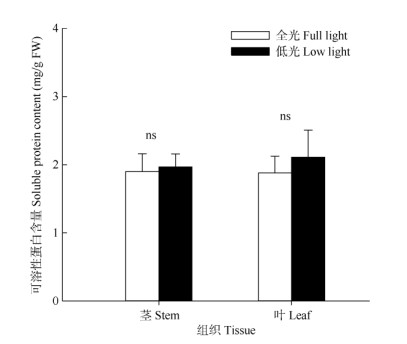
可溶性蛋白与Rubisco含量 相对于全光, 低光下薇甘菊叶片的可溶性蛋白含量上升了7.11% (P > 0.05), 茎的仅上升了1.05% (图 3)。2种光强下叶和茎的可溶性蛋白含量均无显著差异(P > 0.05)。植物处于逆境时会产生可溶性蛋白来抵抗逆境的损伤,这说明薇甘菊可以适应低光条件。
|
图 3 薇甘菊茎和叶可溶性蛋白含量的变化。n=5。 Fig. 3 Changes in soluble protein content in stem and leaf of Mikania micrantha. n=5. |
处理20 d,全光和低光下薇甘菊茎和叶的Rubisco蛋白含量存在差异。全光下薇甘菊叶片的Rubisco蛋白含量较高,低光下明显减少。而低光下薇甘菊茎的Rubisco蛋白含量有增加(灰度较深),但不明显(图 4)。

|
图 4 薇甘菊茎和叶Rubisco蛋白含量的变化。n=5; *: P < 0.05。 Fig. 4 Changes in Rubsico content in stem and leaf of Mikania micrantha. n=5; *: P < 0.05. |
不同光强下薇甘菊茎中的CTK、GA、Auxin含量存在显著差异。遮阴处理20 d,薇甘菊茎中的CTK含量随时间延长呈增加的趋势;且相同处理时间, 低光下CTK含量显著高于全光,在处理10、15、20 d分别增加15.8%、15%和61.5% (图 5: A)。低光下薇甘菊茎中的GA含量在处理15 d后显著大于全光,处理15和20 d分别增加6.0%和20.1% (图 5: B)。遮阴处理15~20 d,茎中的Auxin含量逐渐增加, 在20 d时显著高于全光,增加约33.3% (图 5: C)。可见,低光处理20 d薇甘菊茎中的CTK、GA、Auxin含量均显著高于全光。

|
图 5 薇甘菊茎中生长调节剂含量的变化。n=6; *: P < 0.05; **: P < 0.01; ***: P < 0.001; CTK: 细胞分裂素; GA: 赤霉素; Auxin: 生长素。 Fig. 5 Changes in growth regulator content in Mikania micrantha stem. n=6; *: P < 0.05; **: P < 0.01; ***: P < 0.001; CTK: Cytokini; GA: Gibberellin. |
与非入侵种相比,入侵种具有许多特定的性状(入侵性特征),使其在环境适应和资源获取等方面具有优势。作为一种典型的外来入侵植物,薇甘菊具有其独特的入侵性特征。从种子萌发、幼苗生长到成功攀爬至林冠层顶端,薇甘菊所处的光环境存在显著差异。本研究分析了薇甘菊在低光下的主茎伸长优先策略,阐释了支持主茎优先伸长的物质基础和植物激素调节物质对生物量分配的影响。通过激素调节和光合作用,主茎在低光下快速伸长是薇甘菊克服低光限制从而入侵成功的重要机制之一。
3.1 低光下主茎伸长优先策略在植物生长发育过程中,生物量的快速积累及其分配模式的及时调整是外来入侵植物适应光环境变化的一种策略[18]。加拿大一枝黄花(Solidago canadensis)在低光下克隆分株减少, 重度遮荫抑制克隆生长和繁殖能力,难以通过克隆生长占据生境, 不易形成入侵;同时其克隆生长构型由根茎较长、分株个体距离较远的“游击型”向根茎较短使得分株个体距离很近的“密集型”变化,从而提高其资源竞争力适应低光环境[19],然而其依然不能很好的突破光限制实现入侵。三叶鬼针草(Bidens pilosa)和大狼耙草(Bidens frondosa)在低光下,通过增加对叶的投入同时减少对茎和根的投入来提高了入侵种对资源的捕获和利用能力[20]。而火炬树(Rhus typhina)和毛竹(Phyllostachys edulis)在低光限制下,投入更多资源用于植株高度生长上,从而克服森林树冠对光遮挡不利因素成功入侵[21-22]。
本研究中,薇甘菊在低光下茎的生物量没有显著减少(与全光相比),且茎的生物量分配增加幅度较大,主茎长度显著增加。另一方面,低光下分枝数和叶片数显著减少,比叶面积增加,对光的捕获能力增强,为薇甘菊主茎的优先生长提供了保障。低光下主茎的快速伸长,有利于薇甘菊向上攀爬以获取光源,缓解因光照不足对植物光合作用的不利影响。低光下主茎伸长优先,这是薇甘菊对资源获取和分配的一种适应。
3.2 低光下主茎伸长较快的物质基础胞间CO2浓度增加是判断光合作用受非气孔限制的最可靠的依据之一[23]。有研究表明,鹅掌楸(Liriodendron chinense)幼苗经短期遮阴处理,对CO2的同化速率降低,进而引起叶肉细胞中的CO2浓度升高[24],而本研究结果表明,遮阴处理也会导致茎Pn的下降及胞间CO2浓度积累。光响应曲线表明, 低光下薇甘菊茎的Pn、Gs和Tr均显著降低,Ci反而升高,表明低光条件下薇甘菊茎Pn的降低是由非气孔限制因素引起的,与气孔导度降低导致CO2供应减少无关。此外,本研究发现薇甘菊的茎在低光下仍具有较高的光合能力,显著高于油白豆角,这为薇甘菊茎在低光下的快速伸长提供了物质基础。
Rubisco即核酮糖-1, 5-二磷酸羧化酶/加氧酶, 是植物光合作用中卡尔文循环的关键酶,决定着碳同化的速率[25-26]。有研究表明低光能够使叶片变薄从而导致较低的叶片Rubisco含量[27],在本研究中,低光下薇甘菊叶片中的Rubisco含量显著下降,与之相反,茎的Rubisco含量则上升,说明低光下薇甘菊的茎通过增加Rubisco蛋白含量来弥补光照不足以提升碳同化速率。此外,可溶性蛋白质含量的高低与植物的抗逆性密切相关,逆境可以诱导糖类和蛋白质转变成可溶性化合物[28]。在本研究中,全光与低光下薇甘菊茎、叶中的可溶性蛋白含量均无显著差异,说明低光对薇甘菊的影响较小,薇甘菊对低光环境有较强的适应性,这与薇甘菊茎Pn的变化对低光不敏感相一致。
3.3 低光下主茎伸长的调节物质为在短时间内突破低光环境的限制,薇甘菊主茎伸长显著加快,这与植物生长相关激素的分泌密切相关。CTK、GA和Auxin是调控植物生长发育的关键激素[29-30]。生长素的主要作用是促进细胞分裂、维管束分化以及茎的伸长[31],除此以外生长素还参与叶绿体发育、氧化还原调节和色素合成,与植物的光合作用密切相关[32-33]。GA已被证明参与植物光形态建成,与光信号关系紧密[34],对外施GA的毛白杨(Populus tomentosa)群体进行转录组分析,表明20多个光合作用光反应相关的基因表达上调[35],并且在茎细胞的伸长中也发挥着重要的作用[36-37]。CTK调节植物许多重要的发育过程,对细胞的扩大和分裂具有重要的促进作用[38],同时也与叶片发育的最后阶段(衰老)密切相关,CTK通过诱导细胞抗氧化和抗衰老途径来延长细胞的寿命, 同时也与叶绿素分解、光合器官解体和氧化损伤密不可分[39-40]。在本研究中,低光条件下薇甘菊茎中的CTK、GA、Auxin含量在处理20 d时均显著大于全光,该结果与20 d时薇甘菊在低光下的主茎长度显著增加相一致。可见,3种激素含量的增加一方面通过调节薇甘菊的光合作用,为主茎伸长奠定物质基础,另一方面促进了主茎细胞分裂伸长,最终主茎得以快速伸长,从而在短时间内缓解了光照不足对植株生长的负面影响。
总的来说,薇甘菊茎在低光下植物激素含量的增加,调控了物质的再分配,使更多的生物量分配到茎。茎(比叶)在低光下适应性更强,主要是因为茎在低光下有更高的光能利用效率,这为低光下茎的快速伸长提供了物质基础。但是,这种作用可能是薇甘菊在低光下的一种短期内的应激反应,因为,如果薇甘菊不能在短期内突破荫蔽环境,不能快速攀爬至林冠层,它就不能入侵成功。因此,植物激素的调节和茎的光合能力在薇甘菊从林下低光攀爬至林冠层的入侵过程中扮演着极为重要的作用。薇甘菊在林下低光环境下,通过保持茎较高的光合效率以及合成更多生长调节剂(CTK、GA和Auxin)使更多的生物量分配到茎,促使薇甘菊的茎能快速伸长,突破林冠层对光的阻碍,从而获取更多光能实现其快速扩张进而成功入侵森林群落。
| [1] |
HE Y, MA M. Responses of seed germination of the invasive plant Xanthium italicum to environmental factors[J]. Acta Ecol Sin, 2018, 38(4): 1226-1234. 何影, 马淼. 入侵植物意大利苍耳种子萌发对环境因子的响应[J]. 生态学报, 2018, 38(4): 1226-1234. DOI:10.5846/stxb201701120098 |
| [2] |
BRADLEY B A, BLUMENTHAL D M, WILCOVE D S, et al. Predicting plant invasions in an era of global change[J]. Trends Ecol Evol, 2010, 25(5): 310-318. DOI:10.1016/j.tree.2009.12.003 |
| [3] |
DAVIDSON A M, JENNIONS M, NICOTRA A B. Do invasive species show higher phenotypic plasticity than native species and, if so, is it adaptive? A meta-analysis[J]. Ecol Lett, 2011, 14(4): 419-431. DOI:10.1111/j.1461-0248.2011.01596.x |
| [4] |
HESS M C M, BUISSON E, JAUNATRE R, et al. Using limiting similarity to enhance invasion resistance: Theoretical and practical concerns[J]. J Appl Ecol, 2020, 57(3): 559-565. DOI:10.1111/1365-2664.13552 |
| [5] |
XU K Y, YE W H, LI G M, et al. Phenotypic plasticity in response to light intensity in the invasive species Alternanthera philoxeroides[J]. J Wuhan Bot Res, 2005, 23(6): 560-563. 许凯扬, 叶万辉, 李国民, 等. 入侵种喜旱莲子草对光照强度的表型可塑性反应[J]. 武汉植物学研究, 2005, 23(6): 560-563. DOI:10.3969/J.ISSN.2095-0837.2005.06.012 |
| [6] |
PHILLIPS-MAO L, LARSON D L, JORDAN N R. Effects of native herbs and light on garlic mustard (Alliaria petiolata) invasion[J]. Invas Plant Sci Mana, 2017, 7(2): 257-268. DOI:10.1614/IPSM-D-13-00003.1 |
| [7] |
MEEKINS J F, MCCARTHY B C. Responses of the biennial forest herb Alliaria petiolata to variation in population density, nutrient addition and light availability[J]. J Ecol, 2000, 88(3): 447-463. DOI:10.1046/J.1365-2745.2000.00461.X |
| [8] |
CARRIóN-TACURI J, RUBIO-CASAL A E, DE CIRES A, et al. Lan- tana camara L.: A weed with great light-acclimation capacity[J]. Photo- synthetica, 2011, 49(3): 321-329. DOI:10.1007/S11099-011-0039-6 |
| [9] |
SWIFT C C, JACOBS S M, ESLER K J. Drought induced xylem embolism in four riparian trees from the Western Cape Province: Insights and implications for planning and evaluation of restoration[J]. S Afr J Bot, 2008, 74(3): 508-516. DOI:10.1016/j.sajb.2008.01.169 |
| [10] |
den Dubbelden K C, Oosterbeek B. The availability of external support affects allocation Patterns and morphology of herbaceous climbing plants[J]. Funct Ecol, 1995, 9(4): 628-634. DOI:10.2307/2390154 |
| [11] |
PAUL G S, YAVITT J B. Tropical vine growth and the effects on forest succession: A review of the ecology and management of tropical climbing plants[J]. Bot Rev, 2011, 77(1): 11-30. DOI:10.1007/s12229-010-9059-3 |
| [12] |
DAY M D, CLEMENTS D R, GILE C, et al. Biology and impacts of pacific islands invasive species: 13. Mikania micrantha Kunth. (Asteraceae)[J]. Pac Sci, 2016, 70(3): 257-285. DOI:10.2984/70.3.1 |
| [13] |
CHENG H T, FAN Z W, HUANG Q Q, et al. Ecophysiology of Mikania micrantha H. B. K. under different light conditions[J]. Chin J Trop Crops, 2012, 33(3): 523-528. 程汉亭, 范志伟, 黄乔乔, 等. 薇甘菊在不同光环境下的生理生态研究[J]. 热带作物学报, 2012, 33(3): 523-528. DOI:10.3969/j.issn.1000-2561.2012.03.024 |
| [14] |
WEN D Z, YE W H, FENG H L, et al. Comparison of basic photo- synthetic characteristics between exotic invader weed Mikanla micrantha and its companion species[J]. J Trop Subtrop Bot, 2000, 8(2): 139-146. 温达志, 叶万辉, 冯惠玲, 等. 外来入侵杂草薇甘菊及其伴生种基本光合特性的比较[J]. 热带亚热带植物学报, 2000, 8(2): 139-146. DOI:10.3969/j.issn.1005-3395.2000.02.010 |
| [15] |
ZHANG T J, ZHENG J, YU Z C, et al. Variations in photoprotective potential along gradients of leaf development and plant succession in subtropical forests under contrasting irradiances[J]. Environ Exp Bot, 2018, 154: 23-32. |
| [16] |
MARSHALL B, BISCOE P V. A model for C3 leaves describing the dependence of net photosynthesis on irradiance: Ⅱ. Application to the analysis of flag leaf photosynthesis[J]. J Exp Bot, 1980, 31(1): 41-48. DOI:10.1093/jxb/31.1.41 |
| [17] |
ZHANG T J, CHOW W S, LIU X T, et al. A magic red coat on the surface of young leaves: Anthocyanins distributed in trichome layer protect Castanopsis fissa leaves from photoinhibition[J]. Tree Physiol, 2016, 36(10): 1296-1306. DOI:10.1093/treephys/tpw080 |
| [18] |
ZHANG W Y, WANG B S, LIAO W B, et al. Progress in studies on an exotic vicious weed Mikania micrantha[J]. Chin J Appl Ecol, 2002, 13(12): 1684-1688. 张炜银, 王伯荪, 廖文波, 等. 外域恶性杂草薇甘菊研究进展[J]. 应用生态学报, 2002, 13(12): 1684-1688. DOI:10.3321/j.issn:1001-9332.2002.12.039 |
| [19] |
SUN X F, REN M X, WANG G, et al. Photosynthetic physiology and clonal growth of Solidago canadensis at different light intensities: Implications for invasive mechanism[J]. J Wuhan Bot Res, 2008, 26(6): 620-626. 孙晓方, 任明迅, 王钢, 等. 光强对入侵植物加拿大一枝黄花光合指标与克隆生长的影响[J]. 武汉植物学研究, 2008, 26(6): 620-626. DOI:10.3969/j.issn.2095-0837.2008.06.012 |
| [20] |
PAN Y M, TANG S C, WEI C Q, et al. Comparison of growth, photo- synthesis and phenotypic plasticity between invasive and native Bidens species under different light and water conditions[J]. Biodiv Sci, 2017, 25(12): 1257-1266. 潘玉梅, 唐赛春, 韦春强, 等. 不同光照和水分条件下鬼针草属入侵种与本地种生长、光合特征及表型可塑性的比较[J]. 生物多样性, 2017, 25(12): 1257-1266. DOI:10.17520/biods.2016366 |
| [21] |
TAN X F, GUO X, GUO W F, et al. Invasive Rhus typhina invests more in height growth and traits associated with light acquisition than do native and non-invasive alien shrub species[J]. Trees, 2018, 32(4): 1103-1112. DOI:10.1007/s00468-018-1698-8 |
| [22] |
WANG Y X, BAI S B, BINKLEY D, et al. The independence of clonal shoot's growth from light availability supports moso bamboo invasion of closed-canopy forest[J]. For Ecol Manag, 2016, 368: 105-110. DOI:10.1016/j.foreco.2016.02.037 |
| [23] |
XU D Q. Some problems in stomatal limitation analysis of photo- synthesis[J]. Plant Physiol Commun, 1997, 33(4): 241-244. 许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯, 1997, 33(4): 241-244. DOI:10.13592/j.cnki.ppj.1997.04.001 |
| [24] |
HOLMGREN M. Combined effects of shade and drought on tulip poplar seedlings: Trade-off in tolerance or facilitation?[J]. Oikos, 2000, 90(1): 67-78. DOI:10.1034/j.1600-0706.2000.900107.x |
| [25] |
VON CAEMMERER S. Rubisco carboxylase/oxygenase: From the enzyme to the globe: A gas exchange perspective[J]. J Plant Physiol, 2020, 252: 153240. DOI:10.1016/j.jplph.2020.153240 |
| [26] |
HE S, CHOU H T, MATTHIES D, et al. The structural basis of Rubisco phase separation in the pyrenoid[J]. Nat Plants, 2020, 6(12): 1480-1490. DOI:10.1038/s41477-020-00811-y |
| [27] |
NⅡNEMETS Ü. Photosynthesis and resource distribution through plant canopies[J]. Plant Cell Environ, 2007, 30(9): 1052-1071. DOI:10.1111/j.1365-3040.2007.01683.x |
| [28] |
AHMAD P, OZTURK M, SHARMA S, et al. Effect of sodium carbonate- induced salinity-alkalinity on some key osmoprotectants, protein profile, antioxidant enzymes, and lipid peroxidation in two mulberry (Morus alba L.) cultivars[J]. J Plant Interact, 2014, 9(1): 460-467. DOI:10.1080/17429145.2013.855271 |
| [29] |
BENJAMINS R, SCHERES B. Auxin: The looping star in plant deve- lopment[J]. Annu Rev Plant Biol, 2008, 59: 443-465. DOI:10.1146/annurev.arplant.58.032806.103805 |
| [30] |
MCCOURT P. Genetic analysis of hormone signaling[J]. Annu Rev Plant Phys, 1999, 50: 219-243. DOI:10.1146/annurev.arplant.50.1.219 |
| [31] |
WOODWARD A W, BARTEL B. Auxin: Regulation, action, and inter- action[J]. Ann Bot, 2005, 95(5): 707-735. DOI:10.1093/aob/mci083 |
| [32] |
SALAZAR-IRIBE A, DE-LA-PEÑA C. Auxins, the hidden player in chloroplast development[J]. Plant Cell Rep, 2020, 39(12): 1595-1608. DOI:10.1007/s00299-020-02596-y |
| [33] |
LEYSER O. Auxin signaling[J]. Plant Physiol, 2018, 176(1): 465-479. DOI:10.1104/pp.17.00765 |
| [34] |
ALABADÍ D, GIL J, BLÁZQUEZ M A, et al. Gibberellins repress photomorphogenesis in darkness[J]. Plant Physiol, 2004, 134(3): 1050-1057. DOI:10.1104/pp.103.035451 |
| [35] |
XIE J B, TIAN J X, DU Q Z, et al. Association genetics and trans- criptome analysis reveal a gibberellin-responsive pathway involved in regulating photosynthesis[J]. J Exp Bot, 2016, 67(11): 3325-3338. DOI:10.1093/jxb/erw151 |
| [36] |
ITOH H, TANAKA-UEGUCHI M, KAWAIDE H, et al. The gene encoding tobacco gibberellin 3β-hydroxylase is expressed at the site of GA action during stem elongation and flower organ development[J]. Plant J, 1999, 20(1): 15-24. DOI:10.1046/j.1365-313X.1999.00568.x |
| [37] |
HEDDEN P. A novel gibberellin promotes seedling establishment[J]. Nat Plants, 2019, 5(5): 459-460. DOI:10.1038/s41477-019-0427-7 |
| [38] |
KIEBER J J, SCHALLER G E. Cytokinin signaling in plant deve- lopment[J]. Development, 2018, 145(4): dev149344. DOI:10.1242/dev.149344 |
| [39] |
WANG S G. Roles of cytokinin on stress-resistance and delaying senescence in plants[J]. Chin Bull Bot, 2000, 17(2): 121-126. 王三根. 细胞分裂素在植物抗逆和延衰中的作用[J]. 植物学通报, 2000, 17(2): 121-126. DOI:10.3969/j.issn.1674-3466.2000.02.004 |
| [40] |
HÖNIG M, PLÍHALOVÁ L, HUSIČKOVÁ A, et al. Role of cyto- kinins in senescence, antioxidant defence and photosynthesis[J]. Int J Mol Sci, 2018, 19(12): 4045. DOI:10.3390/ijms19124045 |
 2022, Vol. 30
2022, Vol. 30


