2. 浙江省中医药研究院药用资源研究中心, 杭州 310007;
3. 温州市农业科学研究院, 浙江 温州 325006;
4. 浙南作物育种重点实验室, 浙江 温州 325006
2. Center for Medicinal Resources Research, Zhejiang Academy of Traditional Chinese Medicine, Hangzhou 310007, China;
3. Wenzhou Academy of Agricultural Sciences, Wenzhou 325006, Zhejiang, China;
4. Key Laboratory of Crop Breeding in Southern Zhejiang, Wenzhou 325006, Zhejiang, China
白花前胡(Peucedanum praerupterum)为伞形科(Umbelliferae)前胡属多年生草本植物,主要分布于浙江、湖南、湖北、四川、重庆、安徽、贵州等地。白花前胡是中药前胡的唯一来源,具有宣散风热、止咳化痰的功效,常用于感冒、头痛、咳嗽、哮喘、胸闷的治疗[1]。近年来,随着市场需求的增大,野生资源日渐枯竭,已难以满足市场的需要,人工栽培品成为前胡商品的主流。目前关于白花前胡的研究主要重点集中在化学成分和药理作用等方面[2]。光合作用是植物干物质累积的基础和决定生产力高低的重要因素,又是一个对环境变化很敏感的生理过程[3]。光强是植物生长发育、形态建成中重要的环境调控因子之一,对植物的生长发育[4]、光合特性[5]、生理代谢[6]、品质形成[7]等具有重要的影响。植物只有在合适的光强下才能更好地生长,光强过弱,植物会出现徒长、叶片变大、变薄等不良症状[8]; 光强过强,植物则会出现萎蔫、叶片变小、变厚等不良症状[9]。适当改变光照强度可在一定程度上促进植物的生长发育和次生代谢产物的合成,如弱光有利于喜树碱的合成与积累[10];低光照可提高长春花(Catharanthus roseus)叶片中文朵灵碱和长春质碱含量,而抑制长春碱的合成[11];75%光照可促进喜树(Camptotheca acuminata)植株生长,提高光合速率[12]。因此,研究不同光照对植物生长和光合特性的影响对提高植物产量、品质及人工栽培的可实现性尤为重要,在栽培过程中要充分考虑植物的光合特性和所处的光环境。
然而,往往由于不同栽培地的环境条件千差万别,同时试验设置的遮光处理间距较大,所得出的合理遮光度也只是个大致范围,缺乏精确定量研究[13]。而根据光合速率对光强的响应曲线,结合光响应模型可精确给出饱和光强[14]。为此,本研究对不同光强下白花前胡的净光合速率、电子传递速率、光能利用效率和水分利用效率进行了比较,为实现白花前胡规范种植,提高药材产量和品质提供理论支撑。
1 材料和方法 1.1 材料白花前胡于2017年冬播种于浙江大盘山药用植物科研驯化繁育基地,统一常规管理。繁育基地位于山脚下,海拔470 m。2018年3月下旬在嫩芽出土约5 cm时,随机选择4个小区,通过控制绿色遮阳网四周封闭情况和层数设置3个遮阳处理: 1层遮阳网且四周未封闭(约为20%遮阳)、1层遮阳网且四周封闭(40%遮阳)和2层遮阳网且四周封闭(60%遮阳),以无遮阳网为对照(CK),共计4个处理。4个处理的夏季中午最大光强分别为1 400、1 000、700和1 750 μmol/(m2·s)。
遮阳处理5个月后,于2018年8月底测量光合参数。此时株高约40 cm,长势良好。选取生长一致的植株,对自下而上第4复叶的顶叶进行挂牌标记。
1.2 方法利用便携式光合仪(LI-6400-40, LI-COR INC., USA)在晴天8:30-16:30对叶片的净光合速率和电子传递速率-光响应曲线进行同步测定。测量时,流速设定为500 μmol/s, CO2浓度设置为400 μmol/mol, 叶室温度控制在(34.0±0.9)℃,光合有效辐射(photo- synthetically active radiation, PAR)为2 000、1 800、1 600、1 400、1 200、1 000、700、400、200、150、100、50和0 μmol/(m2·s),测量净光合速率(net photo- synthetic rate, Pn)、电子传递速率(electron transfer rate, ETR)等光合荧光参数,最小等待时间2 min, 最大等待时间3 min。采用光响应机理模型[15]拟合白花前胡叶片电子传递速率和净光合速率对光的响应曲线,采用光能利用效率模型[16]拟合光能利用效率(light use efficiency, LUE)对光的响应曲线,采用水分利用效率模型[17]拟合瞬时水分利用效率(water use efficiency, WUE)对光的响应曲线,获得相应的光合参数。
1.3 数据处理所有数据采用光合计算软件4.1.1处理,由Excel 2010软件作图。
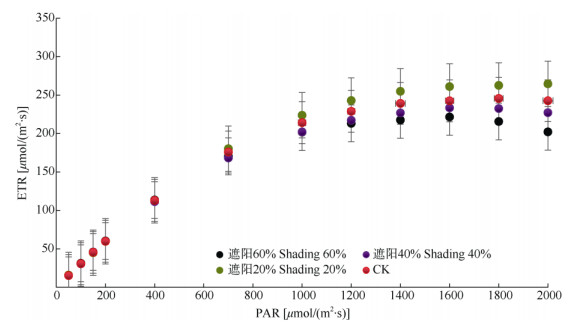
2 结果和分析 2.1 电子传递速率-光的响应曲线从图 1可知,当PAR低于700 μmol/(m2·s)时, 4种遮阳处理的白花前胡叶片电子传递速率(ETR)均随PAR的增加几乎呈直线增加,之后缓慢增长, CK、遮阳20%、40%和60%处理分别在1 600、1 600、1 800和1 800 μmol/(m2·s)时达到最大;此后则随PAR增加而下降,4种处理均发生较为明显的PSII动力学下调现象[18],其中以遮阳60%的最为明显。
|
图 1 4种光照下白花前胡叶片的电子传递速率对光的响应曲线。PAR: 光合有效辐射; ETR: 电子传递速率。下图同。 Fig. 1 ETR-I curves of Peucedanum praerupterum leaves under four light intensities. PAR: Photosynthetically active radiation; ETR: Electron transfer rate. The same is followed Figures. |
由表 1可见,采用的光响应机理模型[15]可很好地拟合4种光照条件下白花前胡叶片电子传递速率对光的响应曲线,且确定系数(R2)均大于0.999。20%遮阳下白花前胡叶片的最大电子传递速率最高,显著高于遮阳40%和60%处理(P < 0.05)。CK、遮阳20%和40%处理的饱和光强相近,约为1 700 μmol/(m2·s),而遮阳60%处理为1 479.43 μmol/(m2·s),显著较低(P < 0.05)。
| 表 1 4种光照条件下白花前胡叶片电子传递速率对光的响应曲线参数 Table 1 ETR-I curve parameter of Peucedanum praerupterum leaves under 4 light intensities |
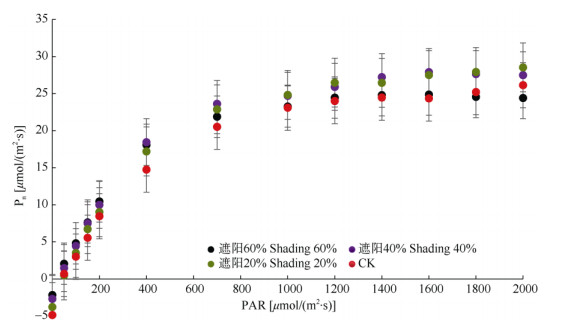
从图 2可见,当PAR < 400 μmol/(m2·s)时,净光合速率(Pn)随PAR的增加几乎呈直线升高;当光强为2 000 μmol/(m2·s)时,遮阳40%和60%的Pn略有下降,而遮阳20%和CK的Pn未出现下降。4种光照处理中以遮阳20%的Pn较高。
|
图 2 4种光照强度下白花前胡叶片净光合速率对光的响应。Pn: 净光合速率。 Fig. 2 Pn-I curves of Peucedanum praerupterum under 4 light intensities. Pn: Net photosynthetic rate. |
利用光响应机理模型[15]拟合4种光照条件下的净光合速率-光响应曲线(表 2),拟合值与实测值高度符合,确定系数均大于0.99。以遮阳20%的最大光合速率(Pnmax)最高,为28.167 μmol/(m2·s)。CK和遮阳20%处理的饱和光强(Isat)显著高于遮阳40%和60%的(P < 0.05)。
| 表 2 4种光照条件下白花前胡叶片光合作用对光的响应曲线参数 Table 2 Pn-I curve parameters of Peucedanum praerupterum leaves under 4 light intensities |
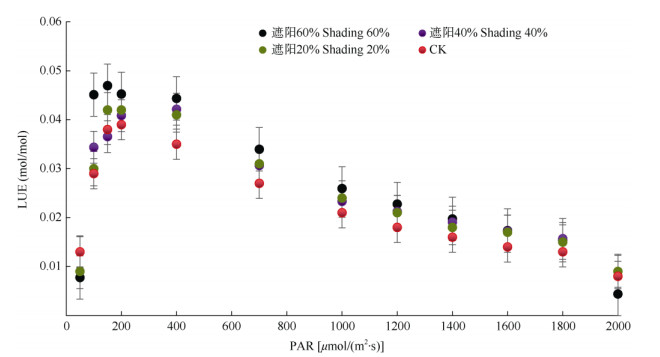
在低光强[PAR < 200 μmol/(m2·s)]下,光能利用效率(LUE)均随PAR的升高而快速上升并达到峰值, 此后则呈直线下降趋势(图 3)。4种光照条件下,CK的LUE最低,遮阳60%处理的最高,两者间达显著差异(P < 0.05)。此外,光能利用效率模型也可较好拟合白花前胡叶片的光能利用效率对光强的响应,确定系数均大于0.8。
|
图 3 4种光照强度下白花前胡叶片的光能利用效率对光的响应曲线。LUE: 光能利用效率。 Fig. 3 LUE-I curves of Peucedanum praerupterum leaves under 4 light intensities. LUE: Light use efficiency. |
光能利用效率模型[16]拟合的结果表明(表 3), 遮阳40%和60%处理的光能利用效率最大(0.047 mol/mol), CK的最小(0.036 mol/mol),两者差异达显著水平(P < 0.05)。除遮阳60%的饱和光强(IL-sat)较低外(P < 0.05),其余处理的相近,约为300 μmol/(m2·s)。
| 表 3 4种光照强度下白花前胡叶片光能利用效率对光的响应曲线参数 Table 3 LUE-I curve parameters of Peucedanum praerupterum leaves under 4 light intensities |
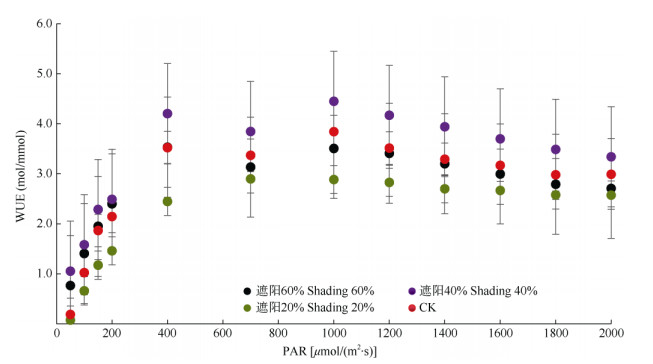
由图 4可知,较低光强[PAR < 700 μmol/(m2·s)]下,水分利用效率(WUE)随PAR的升高而快速上升至峰值,此后呈下降趋势,且除遮阳20%处理外, 其余处理几乎呈直线下降。4种光照条件下,以遮阳40%处理的WUE最高,而遮阳20%处理的最低。
|
图 4 4种光照强度下白花前胡叶片的水分利用效率对光的响应曲线。WUE: 水分利用效率。 Fig. 4 WUE-I curves of Peucedanum praerupterum leaves under 4 light intensities. WUE: Water use efficiency. |
由表 4可见,水分利用效率模型[17]拟合的结果表明,遮阳40%处理的叶片最大水分利用效率(WUEmax)最大(4.14 mol/mmol),遮阳20%处理的最小(3.041 mol/mmol);相应的饱和光强以遮阳20%处理的最高,为942.13 μmol/(m2·s),显著高于遮阳40%和60%处理(P < 0.05)。
| 表 4 4种光照强度下白花前胡叶片水分利用效率对光的响应曲线参数 Table 4 WUE-I curve parameters of Peucedanum praerupterum leaves under 4 light intensities |
由图 5可知,4种遮阳处理的白花前胡叶片光化学猝灭系数(qP)均随光强的升高而降低,不同处理间的qP差异不显著(P > 0.05);而非光化学猝灭系数(qN)随光强的升高均呈先略升后下降的趋势,不同处理间的qN差异也不显著(P > 0.05)。
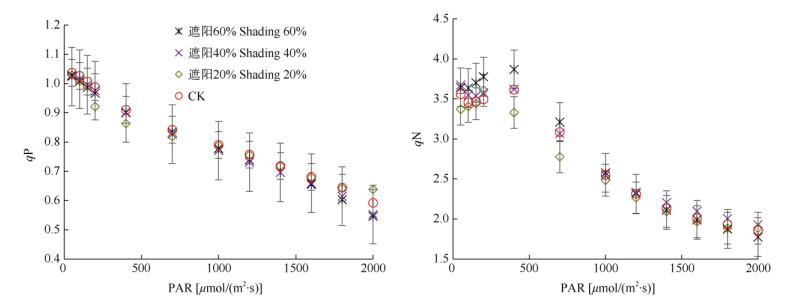
|
图 5 4种光照强度下白花前胡叶片的光化学猝灭系数(qP)和非光化学猝灭系数(qN)对光的响应 Fig. 5 Photochemical quenching coefficient (qP) and non-photochemical quenching coefficient (qN) response to light of Peucedanum praerupterum leaves under 4 light intensities |
全面了解植物的光合速率和光饱和点等光合特性,对植物的高效栽培至关重要。本研究结果表明,光响应机理模型可很好地拟合4种光照条件下白花前胡叶片的电子传递速率和净光合速率对光的响应曲线,而且获得的主要光合参数与实测值高度符合(R2 > 0.998),这与前人[19-21]的研究结果相同。全光(CK)和遮阳20%下白花前胡叶片的最大电子传递速率和最大净光合速率及相应的饱和光强均相对较高,说明白花前胡为典型的阳生植物。这与白花前胡野外自然分布生境的光照条件一致。另外,遮阳40%和60%处理的白花前胡叶片光补偿点显著降低,说明白花前胡可通过生理调节主动适应弱光环境。这与杨亚男等[22]对四季桂(Osmanthus fragrans)的研究结果相一致。
叶片光能利用效率(LUE)在微观尺度上被定义为叶片的净光合速率与吸收PAR的比值[23],是植物非常重要的生理生态指标之一[24]。LUE随PAR的升高而快速上升到最大值,然后逐渐下降,这与前人[25-26]的研究结果相似,叶子飘等[26]的研究表明,不同CO2浓度下植物的LUE对光强的响应均表现出先迅速增加后逐渐下降的趋势,在弱光下[光强100 μmol/(m2·s)]就可达到最大值。白花前胡叶片的LUEmax随遮阳强度的增加而增大,反映出白花前胡对弱光具有较好的适应性。这与王凯等[27]对黄波罗(Phellodendron amurense)幼苗的研究结果相似。
WUE研究不仅可揭示植物叶片内在的耗水机制,明确自身光合能力大小,还能反映其有效利用水分的能力[28-29]。遮阳40%处理的WUEmax值最大, 说明适当遮阳有利于提高白花前胡的水分利用效率,认为与高光强下的温度较高和空气湿度相对较小有关。这与钟平安等[30]对辣椒(Capsicum annuum)的研究结果一致。然而,遮阳60%处理下白花前胡叶片的WUEmax有所降低,认为主要是由于白花前胡是典型阳生植物,较阴环境不利于其光合作用。不同光强条件下白花前胡叶片的WUE对PAR的响应相似,即在较低PAR[小于200 μmol/(m2·s)]时, WUE随PAR的升高快速增大,然后缓慢升高至最大值。除遮阳20%处理外,当超过饱和光强后, WUE均随PAR的升高而快速下降,这与前人[31-33]的研究结果相似。叶子飘等[34]的研究表明,在PAR < 400 μmol/(m2·s)时,不同CO2浓度下大豆(Glycine max)叶片的WUE均随PAR的增加而快速增大,然后缓慢增长,除CO2浓度为300 mol/mol外,当超过饱和光强[约1 000 μmol/(m2·s)]后,叶片的WUE随PAR的增加而下降。
光化学淬灭系数(qP)反映PSⅡ天线色素吸收的光能用于光化学电子传递的份额,体现PSⅡ反应中心的开放程度和电子传递活性的大小。苏金等[35]对遮阴紫珠(Callicarpa bodinieri)叶片的研究表明, 遮阴处理的qP比全日照的显著降低。本研究结果表明,不同遮阳处理下白花前胡叶片的qP无显著差异,表明遮阳处理对白花前胡的PSⅡ反应中心的开放比例,以及电子传递活性影响较小。另外,除用于光合作用的光能外,还有一部分光能可通过非光化学猝灭(qN)过程耗散以减少过量能量, 从而保护PSⅡ反应中心免受伤害。不同遮阳处理下白花前胡叶片的qN均无显著差异,说明遮阳处理并未减低PSⅡ吸收的光能以热能形式消耗的比例。由此可见,白花前胡光合作用对光强的可塑性较强。
白花前胡对光强具有较好的适应性。然而,白花前胡为典型的阳生植物,在较高的光环境下(CK和遮阳20%)具有更高的最大电子传递速率、最大净光合速率和相应的饱和光强;而较阴环境不利于白花前胡的光合作用。因此在栽培时应选择光强充足的田地。
| [1] |
XUE J C. Review on active ingredients and related pharmacological action of Peucedanum praeruptorum[J]. Strait Pharm J, 2012, 24(2): 34-38. 薛俊超. 白花前胡化学成分及相关药理作用的研究进展[J]. 海峡药学, 2012, 24(2): 34-38. DOI:10.3969/j.issn.1006-3765.2012.02.013 |
| [2] |
HE D M, WU F H, KONG L Y. Review on pharmacological action of Peucedanum praeruptorum[J]. Pharm Clin Res, 2007, 15(3): 167-170. 何冬梅, 吴斐华, 孔令义. 白花前胡药理作用的研究进展[J]. 药学与临床研究, 2007, 15(3): 167-170. DOI:10.3969/j.issn.1673-7806.2007.03.001 |
| [3] |
GAO C, YAN W D, TIAN D L, et al. Diurnal change in photosynthetic rate of Eucommia ulmoides and its relationship with environmental factors[J]. J CS Univ For Technol, 2011, 31(5): 100-104. 高超, 闫文德, 田大伦, 等. 杜仲光合速率日变化及其与环境因子的关系[J]. 中南林业科技大学学报, 2011, 31(5): 100-104. DOI:10.3969/j.issn.1673-923X.2011.05.018 |
| [4] |
Zavala J A, Ravetta D A. Allocation of photoassimilates to biomass, resin and carbohydrates in Grindelia chiloensis as affected by light intensity[J]. Field Crops Res, 2001, 69(2): 143-149. DOI:10.1016/S0378-4290(00)00136-2 |
| [5] |
Rezai S, Etemadi N, Nikbakht A, et al. Effect of light intensity on leaf morphology, photosynthetic capacity, and chlorophyll content in sage (Salvia officinalis L.)[J]. Kor J Hort Sci Technol, 2018, 36(1): 46-57. DOI:10.12972/kjhst.20180006 |
| [6] |
Higashiuchi K, Uno Y, Kuroki S, et al. Effect of light intensity and light/dark period on iridoids in Hedyotis diffusa[J]. Environ Contr Biol, 2016, 54(2): 109-116. DOI:10.2525/ecb.54.109 |
| [7] |
Li A M, Li S H, Wu X J, et al. Effect of light intensity on leaf photosynthetic characteristics and accumulation of flavonoids in Litho-carpus litseifolius (Hance) Chun. (Fagaceae)[J]. Open J For, 2016, 6(5): 445-459. DOI:10.4236/ojf.2016.65034 |
| [8] |
ZHAN J C, HUANG W D, WANG L J. Research of weak light stress physiology in plants[J]. Chin Bull Bot, 2003, 20(1): 43-50. 战吉宬, 黄卫东, 王利军. 植物弱光逆境生理研究综述[J]. 植物学通报, 2003, 20(1): 43-50. DOI:10.3969/j.issn.1674-3466.2003.01.005 |
| [9] |
Matos F S, Wolfgramm R, Gonçalves F V, et al. Phenotypic plasticity in response to light in the coffee tree[J]. Environ Exp Bot, 2009, 67(2): 421-427. DOI:10.1016/j.envexpbot.2009.06.018 |
| [10] |
ZHOU X, WANG G B, LIU L, et al. Effects of light intensity on the growth of Camptotheca acuminata seedlings and camptothecin contents[J]. J Nanjing For Univ (Nat Sci), 2016, 40(3): 9-14. 周昕, 汪贵斌, 刘琳, 等. 光强对喜树幼苗生长及喜树碱含量的影响[J]. 南京林业大学学报(自然科学版), 2016, 40(3): 9-14. DOI:10.3969/j.issn.1000-2006.2016.03.002 |
| [11] |
Tang Z H, GUO X R, YU J H, et al. Effects of low light intensity on changes of soluble sugars, alkaloids and phytohormones in Catharan-thus roseus seedlings[J]. Acta Ecol Sin, 2007, 27(11): 4419-4424. 唐中华, 郭晓瑞, 于景华, 等. 弱光对长春花(Catharanthus roseus)幼苗中可溶性糖、生物碱及激素含量的影响[J]. 生态学报, 2007, 27(11): 4419-4424. DOI:10.3321/j.issn:1000-0933.2007.11.006 |
| [12] |
Ma X H, Song L L, Yu W W, et al. Growth, physiological, and biochemical responses of Camptotheca acuminata seedlings to different light environments[J]. Front Plant Sci, 2015, 6: 321. DOI:10.3389/fpls.2015.00321 |
| [13] |
MORFOPOULOS C, SPERLICH D, Peñuelas J, et al. A model of plant isoprene emission based on available reducing power captures responses to atmospheric CO2[J]. New Phytol, 2014, 203(1): 125-139. DOI:10.1111/nph.12770 |
| [14] |
SUN J S, SUN J D, FENG Z Z. Modelling photosynthesis in flag leaves of winter wheat (Triticum aestivum) considering the variation in photosynthesis parameters during development[J]. Funct Plant Biol, 2015, 42(11): 1036-1044. DOI:10.1071/FP15140 |
| [15] |
Ye Z P, Suggett D J, Robakowski P, et al. A mechanistic model for the photosynthesis-light response based on the photosynthetic electron transport of photosystem II in C3 and C4 species[J]. New Phytol, 2013, 199(1): 110-120. DOI:10.1111/nph.12242 |
| [16] |
Ye Z P, Kang H J, Yang X L. Light-use efficiency of tomato seedling leaves at different CO2 concentrations[J]. Chin J Appl Ecol, 2016, 27(8): 2543-2550. DOI:10.13287/j.1001-9332.201608.035 |
| [17] |
Ye Z P, Yang X L, Kang H J. Comparison of light-use and water-use efficiency for C3 and C4 species[J]. Acta Agric Zhejiang, 2016, 28(11): 1867-1873. 叶子飘, 杨小龙, 康华靖. C3和C4植物光能利用效率和水分利用效率的比较研究[J]. 浙江农业学报, 2016, 28(11): 1867-1873. DOI:10.3969/j.issn.1004-1524.2016.11.10 |
| [18] |
WHITE A J, CRITCHLEY C. Rapid light curves: A new fluorescence method to assess the state of the photosynthetic apparatus[J]. Photo-synth Res, 1999, 59(1): 63-72. DOI:10.1023/A:1006188004189 |
| [19] |
LIU Z B, CHENG R M, XIAO W F, et al. Light response charac-teristics of photosynthesis and model comparison of Distylium chinense in different flooding durations[J]. Chin J Appl Ecol, 2015, 26(4): 1083-1090. |
| [20] |
WU A J, XU W Z, GUO Y L, et al. Photosynthetic light-response curves of Lespedeza davurica under different water and fertilization conditions[J]. Acta Agrest Sin, 2015, 23(4): 785-792. 吴爱姣, 徐伟洲, 郭亚力, 等. 不同水肥条件下达乌里胡枝子的光合-光响应曲线特征[J]. 草地学报, 2015, 23(4): 785-792. DOI:10.11733/j.issn.1007-0435.2015.04.018 |
| [21] |
ZHANG F Q, YANG H X, XU B, et al. Photosynthesis light response characteristics of Camellia azalea and fitting of application models[J]. Ecol Environ Sci, 2015, 24(10): 1599-1603. 张方秋, 杨会肖, 徐斌, 等. 杜鹃红山茶的光响应特性及其最适模型筛选[J]. 生态环境学报, 2015, 24(10): 1599-1603. DOI:10.16258/j.cnki.1674-5906.2015.10.002 |
| [22] |
YANG Y N, PAN Y Z, QI Y C, et al. Effect of shading on physiological and ecological characteristics of Osmanthus fragrans[J]. J Trop Subtrop Bot, 2017, 25(1): 57-64. 杨亚男, 潘远智, 齐豫川, 等. 遮阴对四季桂生理生态特性的影响[J]. 热带亚热带植物学报, 2017, 25(1): 57-64. DOI:10.11926/jtsb.3634 |
| [23] |
Jenkins J P, Richardson A D, Braswell B H, et al. Refining light-use efficiency calculations for a deciduous forest canopy using simultaneous tower-based carbon flux and radiometric measurements[J]. Agric For Meteor, 2007, 143(1/2): 64-79. DOI:10.1016/j.agrformet.2006.11.008 |
| [24] |
CosenTino S L, Patanè C, Sanzone E, et al. Leaf gas exchange, water status and radiation use efficiency of giant reed (Arundo donax L.) in a changing soil nitrogen fertilization and soil water availability in a semi-arid Mediterranean area[J]. Eur J Agron, 2016, 72: 56-69. DOI:10.1016/j.eja.2015.09.011 |
| [25] |
ZHANG L, LIU W Z, XIN G S, et al. Photosynthesis light response curves of three sweet-potato varieties and model fitting[J]. Chin Agric Sci Bull, 2015, 31(15): 71-77. 张磊, 刘维正, 辛国胜, 等. 3种专用型甘薯光合光响应曲线及其模型拟合研究[J]. 中国农学通报, 2015, 31(15): 71-77. |
| [26] |
YE Z P, ZHANG H L, HUANG Z A, et al. Model construction of light use efficiency and water use efficiency based on a photosynthetic mechanistic model of light response[J]. Plant Physiol Commun, 2017, 53(6): 1116-1122. 叶子飘, 张海利, 黄宗安, 等. 叶片光能利用效率和水分利用效率对光响应的模型构建[J]. 植物生理学报, 2017, 53(6): 1116-1122. DOI:10.13592/j.cnki.ppj.2017.0059 |
| [27] |
WANG K, ZHU J J, YU L Z, et al. Effects of shading on the photo-synthetic characteristics and light use efficiency of Phellodendron amurense seedlings[J]. Chin J Plant Ecol, 2009, 33(5): 1003-1012. 王凯, 朱教君, 于立忠, 等. 遮阴对黄波罗幼苗的光合特性及光能利用效率的影响[J]. 植物生态学报, 2009, 33(5): 1003-1012. DOI:10.3773/j.issn.1005-264x.2009.05.020 |
| [28] |
Ogutu B O, Dash J, Dawson T P. Developing a diagnostic model for estimating terrestrial vegetation gross primary productivity using the photosynthetic quantum yield and earth observation data[J]. Glob Change Biol, 2013, 19(9): 2878-2892. DOI:10.1111/gcb.12261 |
| [29] |
SHI R, SU P X, ZHOU Z J, et al. Photosynthetic characteristics of Potentilla anserine in three different meadow ecosystems[J]. Chin J Ecol, 2018, 37(7): 1943-1951. 侍瑞, 苏培玺, 周紫鹃, 等. 三种不同类型草甸生态系统下鹅绒委陵菜的光合特性[J]. 生态学杂志, 2018, 37(7): 1943-1951. DOI:10.13292/j.1000-4890.201807.004 |
| [30] |
ZHONG P A, SHAO D, HUANG Y J, et al. The photosynthesis characteristics and instantaneous water-use efficiency of Capsicum annuum under different light conditions[J]. Chin J Ecol, 2019, 38(7): 2065-2071. 钟平安, 邵东, 黄英金, 等. 不同光环境下辣椒光合特性和瞬时水分利用效率[J]. 生态学杂志, 2019, 38(7): 2065-2071. DOI:10.13292/j.1000-4890.201907.025 |
| [31] |
BAI L N, WANG Z L, HE K N, et al. Responses of water use efficiency of 4 drought resistant tree species to water and light in Qinghai[J]. Chin Agric Sci Bull, 2016, 32(16): 12-17. 白灵娜, 王占林, 贺康宁, 等. 青海4种抗旱树种水分利用效率对水分和光照的响应[J]. 中国农学通报, 2016, 32(16): 12-17. DOI:10.11924/j.issn.1000-6850.casb16010149 |
| [32] |
Schull M A, Anderson M C, Houborg R, et al. Thermal-based modeling of coupled carbon, water, and energy fluxes using nominal light use efficiencies constrained by leaf chlorophyll obser-vations[J]. Biogeosci, 2015, 12(5): 1511-1523. DOI:10.5194/bg-12-1511-2015 |
| [33] |
MENG F C, ZHANG J H, HAO C, et al. Effects of elevated CO2 and different irrigation on photosynthetic parameters and yield of maize in northeast China[J]. Acta Ecol Sin, 2015, 35(7): 2126-2135. 孟凡超, 张佳华, 郝翠, 等. CO2浓度升高和不同灌溉量对东北玉米光合特性及产量的影响[J]. 生态学报, 2015, 35(7): 2126-2135. DOI:10.5846/stxb201306041336 |
| [34] |
YE Z P, DUAN S H, KANG H J. Comparison of water use efficiency for Glycine max leaves under different CO2 concentration[J]. J Nucl Agric Sci, 2019, 33(5): 1006-1015. 叶子飘, 段世华, 康华靖. 不同CO2浓度下大豆叶片的水分利用效率比较[J]. 核农学报, 2019, 33(5): 1006-1015. DOI:10.11869/j.issn.100-8551.2019.05.1006 |
| [35] |
SU J, FANG Y M, ZHANG Q, et al. Effects of shading on photo-synthetic characteristics of Callicarpa bodinieri Levl[J]. J NE For Univ, 2019, 47(11): 47-51. 苏金, 方炎明, 张强, 等. 遮阴对紫珠光合特性的影响[J]. 东北林业大学学报, 2019, 47(11): 47-51. DOI:10.13759/j.cnki.dlxb.2019.11.010 |
 2021, Vol. 29
2021, Vol. 29


