嘉宝果(Myrciaria cauliflora)又名树葡萄、珍宝果,为桃金娘科(Myrtaceae)拟爱神木属常绿灌木, 分布于热带亚热带地区,一年四季均可开花结果。研究表明,嘉宝果叶片富含多酚类化合物,如杨梅苷、鞣花酸、没食子酸、单宁等[1-3],具有良好的抗氧化、抗菌、降血糖、降血脂等功效[1, 4-5]。本课题组前期研究表明,嘉宝果叶片多酚与生物活性显著相关[1],但采用的是叶片粗提液,粗提液中的杂质对准确评价生理活性有一定影响,难以判断其生物活性的构效关系,因此探讨合适的分离纯化方式以获得纯度较高的目标物,评价其生理活性及进行结构鉴定是重要的研究方向。
大孔树脂综合了机械筛分与化学吸附的优点, 被广泛用于天然产物活性成分的分离和纯化,具有吸附容量大、选择性高、可重复循环利用等特点, 植物提取物中的有效成分可以通过氢键或者范德华力等分子间作用力吸附于大孔树脂上,又在溶剂作用下溶解于溶液中,达到分离纯化的目的[6-7]。不同大孔树脂由于化学性质与物理结构不同,对不同的多酚具有选择吸附性。岑叶盛等[8]比较了AB-8、D-101、HPD-100、HPD-400和HPD-600等5种大孔树脂对白簕(Acanthopanan trifoliates)叶多酚的吸附-解吸性能,认为HPD-100最佳,多酚纯度从12.5%上升为54.5%;Ma等[9]比较了X-5、D-4020、D-101、AB-8、LS-46D、LS305、NKA-9、NKA-2等8种大孔树脂对迷果芹(Sphallerocarpus gracilis)茎叶多酚的吸附-解吸性能,认为X-5的纯化效果最好; 巫永华等[10]考察了4种树脂对黄精(Polygonatum sibiricum)多酚粗提物的吸附-解吸特性,筛选出最佳纯化树脂AB-8,多酚纯度从16.65%提高到68.38%。采用大孔树脂对嘉宝果叶片的多酚类化合物进行分离纯化的研究鲜见报道, 本研究选取NKA-2、HPD-826、NKA-9和HPD-400A等4种树脂,探讨树脂对嘉宝果叶片粗多酚的纯化效果,筛选最佳纯化树脂并优化纯化工艺,对嘉宝果叶片多酚纯化前后的抗氧化能力、体外降糖活性和多酚组成进行了比较,为嘉宝果叶片多酚生物活性的构效分析及其在功能性食品的利用提供理论依据。
1 材料和方法 1.1 材料、试剂和仪器嘉宝果(Myrciaria cauliflora)‘沙巴’品种采自福建省农业科学院亚热带农业研究所国家闽台特色作物种质资源圃,随机选取30株15 a生的健康植株,剪取枝条顶部的嫩叶,叶片质地柔嫩且叶脉不清晰,颜色嫩绿或淡红。
4种树脂(NKA-2、NKA-9、HPD-826和HPD- 400A)、多酚标准品均购自北京索莱宝科技有限公司;α-葡萄糖苷酶(α-glucosidase, G5003-100UN)、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG, N1377-1G)、猪胰腺α-淀粉酶(V900486-100G)、1, 1-苯基-2-苦肼基自由基(DPPH·)、2, 2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS+)、邻二氮菲(P9375-5G)均为Sigma产品;阿卡波糖水合物、没食子酸、芦丁为日本东京化成工业株式会社产品,纯度>98%;抗坏血酸、磷酸二氢钾、磷酸氢二钾、碳酸钠、无水乙醇、淀粉、双氧水、硫酸亚铁、碳酸钠为国药集团化学试剂有限公司产品,分析纯。
L5S型紫外可见分光光度计(上海仪电分析仪器有限公司);FD-1冷冻干燥机(北京博医康实验仪器有限公司);KQ-300DE数控超声波清洗仪(昆山市超声仪器有限公司);THZ-300C恒温培养摇床(上海一恒科学仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);iMARK酶标仪(Bio-Rad); Ultimate 3000高效液相色谱仪(Thermo);BSZ-100自动部份收集器(上海沪西分析仪器厂有限公司)。
1.2 叶片多酚粗提液的制备嫩叶用60℃热风烘至恒定质量,粉碎过40目筛,备用。按料液比1 g粉末∶160 mL 40%乙醇, 在功率120W、40℃下用超声波辅助提取10 min, 然后离心(5 170×g)取上清液,上清液旋转蒸发至无醇味,得到叶片多酚浓缩液,4℃保存,备用,其质量浓度以1 mL粗提液中含原材料质量计,单位为mg/mL。
1.3 总多酚测定采用福林酚法,以没食子酸为对照品,标准曲线参照Tohidi等[11]的方法测定,根据没食子酸标准曲线y=11.7608x-0.0048 (R2=0.9991),计算样品总多酚质量浓度,单位为mg/mL。取叶片多酚粗提液与洗脱液,减压蒸馏至无醇味,冻干,称量,重新溶解,总多酚纯度P=(C×V/m)×100%, 式中, C为多酚质量浓度(mg/mL),V为液体体积(mL),m为冻干粉质量(mg)。
1.4 大孔树脂筛选参照冯宇等[12]的方法并稍作修改,对大孔树脂进行预处理。取适量树脂加入2倍体积无水乙醇浸泡24 h后,用超纯水洗至无醇味,加入2倍体积的4% HCl溶液继续浸泡5 h后以超纯水洗至中性,最后加入2倍体积的4% NaOH溶液继续浸泡5 h, 以超纯水洗至中性后浸泡于超纯水中,备用。大孔树脂的筛选参照巫永华等[10]的方法并略有改动。10.00 g预处理的大孔树脂放入带塞锥形瓶中,加入100 mL 2.00 mg/mL的粗提液,于恒温振荡仪中28℃、150 r/min下振荡24 h,测定上清液的总多酚含量(C1)。吸附饱和的树脂抽滤除去上清液,超纯水清洗2遍,加入100 mL 70%乙醇,于恒温振荡仪中继续振荡洗脱24 h,测上清液的总多酚含量(C2)。树脂的吸附率=(C0-C1)/C0×100%; 解吸率=C2/ (C0-C1)×100%, 式中, C0为初始多酚质量浓度,单位为mg/mL。
1.5 NKA-9树脂的静态、动态吸附-解吸试验参照巫永华等[10]的方法并稍作修改。称取预处理的NKA-9树脂10.00 g于250 mL的带塞锥形瓶中,加入100 mL 2.00 mg/mL的叶片多酚粗提液, 塞上瓶塞,于28℃、150 r/min下振荡,每隔一段时间取上清液测定总多酚质量浓度,至浓度无明显变化时停止取样。吸附饱和的树脂抽滤除去上清液,超纯水清洗2遍后加入100 mL 70%乙醇,于28℃、150 r/min下振荡,每隔一段时间取上清液测定总多酚质量浓度,计算吸附率与解吸率,确定最佳吸附和解吸时间。
采用最佳吸附和解吸时间,在其余条件不变的情况下,分别设置上样液质量浓度(0.50、1.00、2.00、3.00、4.00 mg/mL)、乙醇体积分数洗脱液(50%、60%、70%、80%、90%)、上样流速(0.50、1.00、1.50、2.00 mL/min)、洗脱流速(0.60、0.90、1.20、1.50 mL/min)等处理,研究各因素对树脂静态吸附和解吸效果的影响,确定最佳上样液质量浓度、乙醇体积分数、上样流速和洗脱流速,并根据曲线计算不同上样流速的泄漏点(浓度比=10%),确定上样体积。其中,浓度比=(流出液多酚质量浓度/上样液多酚质量浓度)×100%。
根据NKA-9树脂纯化叶片多酚的最优条件进行优化工艺验证和放大试验。将树脂装柱量扩大20倍,上样量为4 080 mL,装于2.6 cm×60 cm的层析柱中,按照纯化工艺,测定冻干粉中的总多酚含量,计算多酚纯度。
1.6 自由基清除能力称取适量粗提液及洗脱液冻干粉,加入纯水溶解获得质量浓度为4.00 mg/mL的样品储备液。参照Tang等[13]的方法测定DPPH·自由基清除能力, 并根据拟合的质量浓度-抑制率直线方程计算样品对自由基的半数清除浓度(EC50值)。参照林宝妹等[14]的方法,测定样品对ABTS+和·OH自由基的清除率,并根据拟合的质量浓度-抑制率直线方程计算EC50值。
1.7 体外降糖活性测定α - 葡萄糖苷酶抑制活性 参照Sichaem等[15]的方法并稍作修改,取样品或阿卡波糖和α-葡萄糖苷酶(0.4 U/mL)各10 μL,混匀后于37℃温箱中反应10 min,加入50 μL PNPG (5.0 mmol/L)后再于37℃温箱反应20 min,最后加入100 μL Na2CO3 (0.2 mol/L)终止反应,于酶标仪上405 nm波长处测吸光度A1,同时测定吸光度值A0 (样品为超纯水)、吸光度值A2 (样品和反应试剂以相应溶剂替代)和吸光度值A3 (反应试剂以相应溶剂替代)。α-葡萄糖苷酶活性抑制率=[A0-(A1-A3)]/(A0-A2)×100%。根据拟合的质量浓度-抑制率曲线方程计算样品对酶的半数抑制浓度(IC50值)。
猪胰α - 淀粉酶抑制活性 参照林宝妹等[16]的方法,测定样品对猪胰α-淀粉酶的抑制率,并根据拟合的质量浓度-抑制率曲线方程计算IC50值。
1.8 多酚成分分析称取新绿原酸、咖啡酸、对香豆酸、阿魏酸、异绿原酸A、杨梅苷、金丝桃苷、芦丁、鞣花酸标准品各10.00 mg,用甲醇溶解,配成质量浓度为2.00 mg/mL的标准溶液,各取适量混合配成9种物质的混合标准品,新绿原酸和咖啡酸的质量浓度为0.05 mg/mL,对香豆酸为0.20 mg/mL,其余物质为0.10 mg/mL,样品冻干粉用甲醇溶解,用0.22 μm滤膜过滤后用于HPLC检测。采用Thermo Ultimate 3000系统,紫外检测器,检测波长350 nm,Welch C18色谱柱(5 μm, 4.6 mm×250 mm);流动相A为0.4%磷酸,B相为甲醇,柱温40℃,进样量5 μL, 流速0.8 mL/min。流动相(75% A+25% B, 10 min; 60% A+40% B, 25 min; 40% A+60% B, 55 min)依次洗脱。
1.9 数据处理采用Microsoft Excel 2003对数据进行计算与曲线拟合;所有数据以平均值±标准差表示。
2 结果和分析 2.1 4种大孔树脂的比较4种型号的树脂对叶片多酚的吸附和解吸能力有所差异,NKA-2树脂对叶片多酚的吸附率最高, 达到(92.83±0.39)%,其他3种树脂的吸附率从高到低依次为HPD-826、NKA-9和HPD-400A,其中HPD- 826和NKA-9的吸附率接近,分别为(83.83±0.74)%和(82.48±0.23)%。吸附率较高的为极性较大的树脂,如NKA-2、NKA-9和HPD-826, 而极性较小的HPD-400A吸附率较低。采用70%乙醇解吸, 4种大孔树脂的解吸率依次为HPD-400A [(93.78±1.34)%] > NKA-9 [(84.89±0.361.34)%] > HPD-826 (77.51±0.32)%] > NKA-2 [(56.20±0.92)%]。因此,NKA-2对叶片多酚吸附率最高,但解吸率最低;HPD400A的解吸率最高,但吸附率最低;NKA-9和HPD-826的吸附率居中,而NKA-9的解吸率高于HPD-826,能够将大部分的多酚洗脱下来,因此,采用NKA-9树脂对嘉宝果叶片多酚进行纯化。
2.2 NKA-9树脂的纯化工艺优化吸附与解吸时间 NKA-9树脂对叶片多酚的吸附率-时间曲线呈先上升后平稳的趋势(图 1: A), 0~20 min,树脂对叶片多酚的吸附率迅速上升至(77.68±0.64)%,此后,吸附率缓慢上升,至4 h的吸附率达最大(83.38±0.54)%,随后趋于平稳。因此,4 h后树脂对总多酚达到吸附饱和。NKA-9树脂对叶片多酚的解吸率-时间曲线(图 1: B)与吸附率-时间曲线类似, 呈先上升后平稳趋势,在0~2 h内, 叶片多酚的解吸率迅速上升至(83.07±1.36)%,此后趋于平稳。在解吸后期,解吸率出现轻微降低,说明2 h后总多酚的解吸达到平衡。
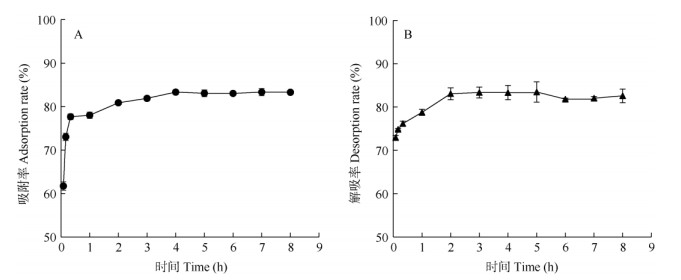
|
图 1 时间对吸附率(A)和解吸率(B)的影响 Fig. 1 Effect of time on adsorption rate (A) and desorption rate (B) |
上样液质量浓度 由图 2可见,随上样液质量浓度增加,树脂的吸附率呈先上升后下降的趋势。当浓度低于2.00 mg/mL时,吸附率呈缓慢上升,最高可达(82.07±0.76)%;当高于2.00 mg/mL时,吸附率呈明显下降趋势,最低至(78.27±0.18)%。因此,嘉宝果叶片总多酚上样液质量浓度选择2.00 mg/mL较为适宜。
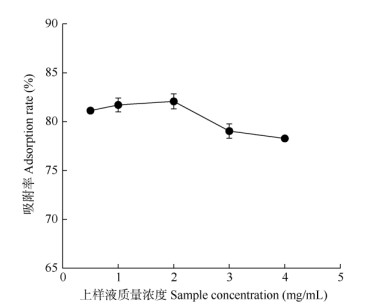
|
图 2 上样液质量浓度对吸附率的影响 Fig. 2 Effect of sample mass concentration on adsorption rate |
乙醇体积分数 从图 3可见,乙醇体积分数为50%~70%时,多酚解吸率随乙醇体积分数的增加迅速上升,当乙醇体积分数为70%时,解吸率达到最大值(81.61±1.46)%;乙醇体积分数继续增加, 解吸率略有降低。乙醇体积分数过小会造成洗脱不完全而浪费原材料,乙醇体积分数过大也会造成杂质过多,故选择乙醇体积分数70%作为后续试验洗脱液浓度。
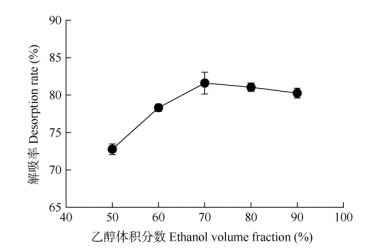
|
图 3 乙醇体积分数对解吸率的影响 Fig. 3 Effect of ethanol volume fraction on desorption rate |
上样流速 当流出液中的多酚质量浓度为初始上样液多酚质量浓度的10%时,为树脂的泄漏点。泄漏点越早出现表明上样液流经大孔树脂出现吸附不充分的现象越早。由图 4可见,随着流出液体积的增加,流出液中的多酚质量浓度在不断上升,树脂的吸附率在不断下降;当洗脱流速为1.0、1.5、2.0 mL/min时,大孔树脂出现泄漏点时累积上样体积分别为204、134、108 mL,说明当上样液流速为1.0~2.0 mL/min时,随着洗脱流速降低,多酚与树脂间的接触更充分并能有效吸附,泄漏点推迟出现,继续降低流速至0.5 mL/min,泄漏点处累积上样体积开始降低,为196 mL,说明继续降低流速已不能进一步推迟泄漏点的出现。故选择1.0 mL/min为上样液流速,此流速下最佳上样体积为204 mL。
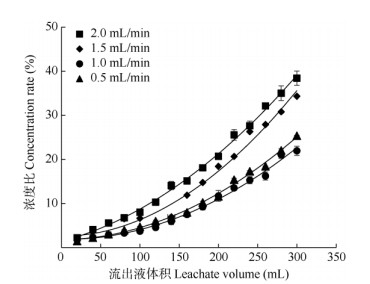
|
图 4 上样流速对吸附效果的影响 Fig. 4 Effect of sample flow velocity on adsorption rate |
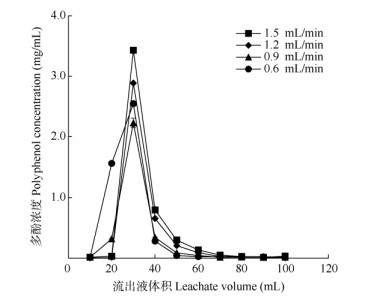
洗脱流速 从图 5可见,以1.2、1.5 mL/min流速进行洗脱,得到的峰形较宽,且有较明显的拖尾现象,说明流速过快导致洗脱不完全,洗脱效果差; 以0.6、0.9 mL/min流速进行洗脱,得到的峰无明显拖尾现象,洗脱效果较好,但洗脱流速过慢,所需洗脱时间增加,延长生产周期使生产成本增加, 且0.6 mL/min流速下的峰宽略大于0.9 mL/min。故选择0.9 mL/min作为洗脱流速,洗脱液体积为70 mL。
|
图 5 洗脱流速对解吸效果的影响 Fig. 5 Effect of elution velocity on desorption efficiency |
验证和放大试验 嘉宝果叶片多酚提取物纯化验证试验表明,纯化前叶片粗提物的总多酚纯度为(30.81±0.36)%,经NKA-9树脂纯化后的总多酚纯度为(69.86±0.35)%。工艺放大试验表明,纯化前叶片粗提物的总多酚纯度为(28.68±0.74)%,经NKA-9树脂纯化后的纯度为(64.44±0.30)%,说明NKA-9树脂对嘉宝果叶片多酚提取物总多酚的纯化效果在工艺放大20倍后仍保持稳定。
2.3 叶片多酚的抗氧化和体外降糖活性从表 2可见,经NKA-9树脂纯化后叶片的总多酚纯度由(30.81±0.36)%提高到(69.86±0.35)%, 提高了近1.3倍,说明叶片粗提液中的杂质得到有效去除,实现叶片多酚的富集和纯化。纯化后的叶片多酚对DPPH·、ABTS+和·OH等3种自由基的半数清除浓度(EC50)均极显著低于纯化前(P < 0.01),纯化前后的叶片多酚对这3种自由基的清除能力均极显著高于Vc,说明叶片多酚具有良好的抗氧化能力, 且纯化后抗氧化能力进一步提高。
| 表 2 嘉宝果叶片多酚抗氧化(EC50值)与体外降糖活性(IC50值) Table 2 Antioxidant effects (EC50) and hypoglycemic activity (IC50) of polyphenol in Myrciaria cauliflora leaves |
同时,纯化后的叶片多酚抑制α-葡萄糖苷酶活性极显著高于纯化前(P < 0.01),对酶的半数抑制浓度(IC50)低于纯化前,说明纯化后对α-葡萄糖苷酶有抑制活性的物质得到富集;纯化后的叶片多酚对猪胰α-淀粉酶的抑制活性极显著低于纯化前,说明NKA-9树脂纯化后可能丢失了部分对猪胰α-淀粉酶有较强抑制作用的物质;纯化前后的叶片多酚对α-葡萄糖苷酶的抑制活性高于阿卡波糖,IC50仅分别为阿卡波糖的10.22%和7.05%,表现出较强的α-葡萄糖苷酶抑制活性,但纯化前后的叶片多酚对猪胰α-淀粉酶的抑制活性均低于阿卡波糖,IC50分别为阿卡波糖的3.93和5.64倍,说明叶片多酚对猪胰α-淀粉酶的抑制活性较弱。
2.4 叶片多酚组成及含量分析图 6为叶片多酚纯化前后的HPLC色谱图,纯化前后的叶片多酚在350 nm处的液相谱图接近, 色谱峰数量一致,但纯化后的峰信号增强,峰面积增大。采用单一标准品确定出峰时间,并以9种单体多酚为混合标样,通过与标准品吸收峰保留时间对比,初步确定嘉宝果叶片中有4种多酚单体成分, 分别为杨梅苷、金丝桃苷、芦丁和鞣花酸。纯化前后的叶片多酚提取物均以鞣花酸为主,其次为杨梅苷、金丝桃苷和芦丁(表 3)。

|
图 6 多酚标准品及嘉宝果叶片多酚的HPLC图。A: 粗提液; B: 纯化液; C: 标准品; 1: 新绿原酸; 2: 咖啡酸; 3: 对香豆酸; 4: 阿魏酸; 5: 异绿原酸A; 6: 杨梅苷; 7: 金丝桃苷; 8: 芦丁; 9: 鞣花酸。 Fig. 6 HPLC of polyphenol standard and extract from Myrciaria cauliflora leaves. A: Crude extract; B: Purified extract; C: Standard. 1: Neochlorogenic acid; 2: Caffeic acid; 3: 4-Hydroxycinnamic acid; 4: 4-Hydroxy-3-methoxycinnamic acid; 5: Isochlorogenic acid A; 6: Myricitrin; 7: Hyperoside; 8: Rutin; 9: Ellagic acid. |
| 表 3 嘉宝果叶片多酚提取物成分及含量(mg/g) Table 3 Composition and contents of phenols in Myrciaria cauliflora leaves |
不同的大孔树脂吸附-解吸性能不同,需根据目标分离物进行筛选。根据前期研究结果,嘉宝果叶片含有较多中极性~极性的酚类物质[17],因此本研究选择NKA-2、HPD-826、NKA-9和HPD-400A等4种中级性~极性大孔树脂,结果表明,极性树脂NKA-9对嘉宝果叶片多酚的吸附和解吸能力均较好,能够有效吸附叶片多酚,同时叶片多酚也能较好地被洗脱下来,经过纯化,嘉宝果叶片多酚提取物中多酚纯度从30.81%提高至69.86%。许多研究表明NKA-9树脂适用于多种植物多酚的分离纯化,如苦菜多酚经过NKA-9树脂纯化后纯度从14.72%上升为72.38%[18]。NKA-9树脂对沙枣多酚表现出较好的吸附性能与解吸效果,能很好地富集纯化沙枣多酚,纯化后,纯度从17.14%上升至82.67%[19]。朱洁等[20]采用5种大孔吸附树脂分离纯化梨幼果多酚,认为NKA-9大孔树脂性能较好,最适合用来纯化梨幼果多酚,纯化后梨幼果多酚的纯度从6.23%提高到30.68%。朱怡霖等[21]比较了8种大孔树脂对横山老黑豆酚类化合物的静态吸附和解吸特性,筛选出NKA-9树脂,其吸附和解吸效果最好,且分离纯化前后的横山老黑豆酚类物质种类没有变化,含量降低很少。本研究也表明NKA-9大孔树脂适用于嘉宝果叶片多酚的分离纯化。
大孔树脂的动态吸附-解吸试验参数,如上样液质量浓度、上样流速、洗脱液体积分数、洗脱速度等,均可影响大孔树脂的吸附-解吸效果。邵佩等[22]研究了猕猴桃多酚的纯化工艺,结果表明多酚质量浓度2 mg/mL、洗脱液乙醇体积分数90%、上样量350 mL、洗脱液体积200 mL时,树脂对多酚的吸附-解吸效果最好。Park等[23]研究表明,昆布多酚的最佳纯化参数为上样流速2.46 mL/min、洗脱剂乙醇体积分数50%和洗脱流速1.64 mL/min。本研究中,在相同流速下,NKA-9树脂对叶片多酚的吸附率随上样液质量浓度的增加呈先上升后下降趋势,可能是由于大孔树脂表面吸附随上样液质量浓度的增加而趋于饱和,达最大吸附量后,继续提高上样液质量浓度, 反而因为传质速率低、杂质量增多导致吸附率降低[24], 因此选择2 mg/mL为上样液质量浓度。上样流速是影响NKA-9树脂吸附嘉宝果叶片多酚的重要因素之一,上样速度过快,多酚类成分与大孔树脂接触时间过短,未充分吸附便随流出液流出;上样速度过慢,吸附耗时长,生产效率低[25],因此选择1.0 mL/min为上样流速。乙醇体积分数过低无法将多酚与树脂间形成的氢键打断,洗脱率低;乙醇体积分数过高,水含量少,致使水溶性多酚难以被洗脱下来,同时可能导致其他杂质洗脱增加[25-26]。当洗脱液体积分数为70%时,嘉宝果叶片多酚的解吸率最高,可能是由于嘉宝果叶片多酚与70%乙醇极性相近,易将多酚从大孔树脂中洗脱下来[25]。洗脱速度也是多酚解吸的重要因素,采用过快或者过慢流速进行洗脱,得到的洗脱峰形较宽,呈前沿或拖尾,洗脱效果差。洗脱速率过快,洗脱剂未与树脂充分接触,洗脱不完全;洗脱速率过慢,洗脱下来的多酚可能出现复吸、杂质增多并且生产周期延长[26]。因此,根据洗脱曲线选择0.9 mL/min为洗脱流速。
3.2 嘉宝果叶片多酚生物活性嘉宝果叶片多酚经NKA-9树脂纯化后,纯化物的自由基(DPPH·、ABTS+、·OH)清除能力高于粗提物。油茶叶多酚经HPD-600树脂纯化后,对油脂的抗氧化能力提高[27];山楂叶多酚经AB-8树脂纯化后,对DPPH·、·OH自由基的清除能力,总还原力及Fe2+螯合能力均提高[25],这与本研究结果一致,可能是因为大孔树脂对多酚类物质起到纯化和富集作用,而抗氧化能力与总酚含量正相关[1, 27]。纯化后的嘉宝果叶片多酚对ɑ-葡萄糖苷酶的抑制作用增强,该结果与黑豆皮多酚纯化前后的ɑ-葡萄糖苷酶抑制活性变化一致,不同的是,嘉宝果叶片多酚对ɑ-淀粉酶的抑制活性相比纯化前下降,而黑豆皮多酚的则随多酚纯度升高而增强[28]。这可能是因为ɑ-淀粉酶和ɑ-葡萄糖苷酶为结构不同的两种消化酶,活性抑制成分不同,嘉宝果叶片多酚经极性树脂纯化后,弱极性多酚丢失导致对ɑ-淀粉酶的抑制活性降低,且除多酚外,可能还有其他非酚类成分也有ɑ-淀粉酶抑制作用,在纯化过程中被除去也可导致嘉宝果叶片多酚对ɑ-淀粉酶的抑制活性减弱。但从结果上看,嘉宝果叶片多酚纯化前后对ɑ-淀粉酶IC50值仍较为接近,说明仅有少部分酶抑制活性成分丢失。
3.3 嘉宝果叶片多酚组成成分从嘉宝果叶片提取物中检测出杨梅苷、金丝桃苷、芦丁和鞣花酸等4种单酚物质,其中含量最高的是鞣花酸。据报道,嘉宝果叶片含有杨梅苷、鞣花酸、没食子酸和邻香豆酸等酚类化合物[2]。检测方法、仪器和成分的提取方法不同都可能导致检测到的成分存在一定差异[29-30]。本研究采用与标准品比对保留时间的方法,仅检出提取物中含有杨梅苷、金丝桃苷、芦丁和鞣花酸,未检测到没食子酸和邻香豆酸。本研究通过9种标准品来鉴定嘉宝果叶片的酚类物质组成,但对成分的进一步确认需要更进一步的纯化以制备出单体组分,并通过HPLC- MS、核磁共振等手段进行鉴定。
因此,NKA-9大孔树脂分离纯化嘉宝果叶片多酚的最佳工艺条件为上样液质量浓度2.00 mg/mL、洗脱液乙醇体积分数70%、上样流速1.0 mL/min、上样量204 mL、洗脱流速0.9 mL/min、洗脱量70 mL,此条件下嘉宝果叶片多酚纯度为69.86%。纯化后的嘉宝果叶片多酚抗氧化活性及对α-葡萄糖苷酶的抑制活性提高,对α-淀粉酶的抑制作用略降低。嘉宝果叶片多酚提取物主要组成成分为鞣花酸,此外还含有杨梅苷、金丝桃苷和芦丁。试验结果对嘉宝果叶片多酚的进一步研究和开发利用提供了一定的理论基础。在后续的研究中,将进一步分离纯化嘉宝果叶片多酚,获得多酚单体,进一步确认组成成分。
| [1] |
LIN B M, QIU S L, ZHANG S P, et al. Antioxidant capacities of different leaf extracts of jaboticaba cultivars[J]. J NW Agric For Univ (Nat Sci), 2018, 46(9): 121-130. 林宝妹, 邱珊莲, 张少平, 等. 不同品种嘉宝果叶片提取物的抗氧化活性[J]. 西北农林科技大学学报(自然科学版), 2018, 46(9): 121-130. DOI:10.13207/j.cnki.jnwafu.2018.09.016 |
| [2] |
ZHI J Z, QIAN Y, CHEN H J. The advances in research of Myrciaria cauliflora and its prospects for application[J]. Trop Agric Sci Technol, 2018, 41(3): 35-39. 只佳增, 钱云, 陈鸿洁. 嘉宝果研究进展及利用前景[J]. 热带农业科技, 2018, 41(3): 35-39. DOI:10.16005/j.cnki.tast.20180525.005 |
| [3] |
DUARTE A R, SANTOS S C, SERAPHIN J C, et al. Environmental influence on phenols and essential oils of Myrciaria cauliflora leaves[J]. J Braz Chem Soc, 2010, 21(9): 1672-1680. DOI:10.1590/S0103-50532010000900011 |
| [4] |
LIN B M, ZHENG K B, ZHANG S, et al. Studies on antioxidant and α-glucosidase inhibitory activities of ethanol extracts from peels and seeds of jaboticaba at different maturities[J]. J Trop Subtrop Bot, 2018, 26(3): 233-240. 林宝妹, 郑开斌, 张帅, 等. 不同成熟度树葡萄果实醇提取物抗氧化和抑制α-葡萄糖苷酶活性研究[J]. 热带亚热带植物学报, 2018, 26(3): 233-240. DOI:10.11926/jtsb.3831 |
| [5] |
CARVALHO C M, MACEDO-COSTA M R, PEREIRA M S V, et al. In vitro antimicrobial effect of jabuticaba[Myrciaria cauliflora (Mart.) O. Berg] extract on Streptococcus from the oral cavity[J]. Rev Bras Plantas Med, 2009, 11(1): 79-83. DOI:10.1590/S1516-05722009000100013 |
| [6] |
ZHOU P, FANGMA Y, JIN W F, et al. Response surface optimization of the water immersion extraction and macroporous resin purification processes of anhydrosafflor yellow B from Carthamus tinctorius L.[J]. J Food Sci, 2020, 85(10): 3191-3201. DOI:10.1111/1750-3841.15374 |
| [7] |
WANG H W, LIU Y Q. Progress in the application of macroporous adsorption resin[J]. J Chin Med Mat, 2005, 28(4): 353-356. 汪洪武, 刘艳清. 大孔吸附树脂的应用研究进展[J]. 中药材, 2005, 28(4): 353-356. DOI:10.3321/j.issn:1001-4454.2005.04.040 |
| [8] |
CEN Y S, LI X L, CHEN S J, et al. Optimization of purification of total polyphenols from Acanthopanan trifoliates leaves by macro-porous resin[J]. Chin Trad Herb Drugs, 2019, 50(13): 3071-3076. 岑叶盛, 李小龙, 陈淑娟, 等. 大孔吸附树脂纯化白簕叶总多酚的工艺优化[J]. 中草药, 2019, 50(13): 3071-3076. DOI:10.7501/j.issn.0253-2670.2019.13.012 |
| [9] |
MA T T, SUN X Y, TIAN C R, et al. Enrichment and purification of polyphenol extract from Sphallerocarpus gracilis stems and leaves and in vitro evaluation of DNA damage-protective activity and inhibitory effects of α-amylase and α-glucosidase[J]. Molecules, 2015, 20(12): 21442-21457. DOI:10.3390/molecules201219780 |
| [10] |
WU Y H, ZHANG J P, ZHAO J C, et al. Antioxidantion and compo-sition analysis of purified polygonatum sibiricum polyphenols using macroporous resin[J]. Trans Chin Soc Agric Eng, 2020, 36(1): 318-326. 巫永华, 张建萍, 赵节昌, 等. 大孔树脂纯化黄精多酚及其抗氧化性与组成分析[J]. 农业工程学报, 2020, 36(1): 318-326. DOI:10.11975/j.issn.1002-6819.2020.01.038 |
| [11] |
TOHIDI B, RAHIMMALEK M, ARZANI A. Essential oil composition, total phenolic, flavonoid contents, and antioxidant activity of Thymus species collected from different regions of Iran[J]. Food Chem, 2017, 220: 153-161. DOI:10.1016/j.foodchem.2016.09.203 |
| [12] |
FENG Y, LIU X M, LUO W S, et al. Study on purification of total flavonoids from Litchi Semen by macroporous resin[J]. Chin Trad Herb Drugs, 2019, 50(9): 2087-2093. 冯宇, 刘雪梅, 罗伟生, 等. 大孔树脂纯化荔枝核总黄酮工艺研究[J]. 中草药, 2019, 50(9): 2087-2093. DOI:10.7501/j.issn.0253-2670.2019.09.012 |
| [13] |
TANG W, XING Z Q, LI C, et al. Molecular mechanisms and in vitro antioxidant effects of Lactobacillus plantarum MA2[J]. Food Chem, 2017, 221: 1642-1649. DOI:10.1016/j.foodchem.2016.10.124 |
| [14] |
LIN B M, ZHANG S, HONG J M, et al. Antioxidant activities of different solvent extracts from Portulaca oleracea L.[J]. Food Ind, 2020, 41(3): 141-145. 林宝妹, 张帅, 洪佳敏, 等. 马齿苋不同溶剂提取物的抗氧化活性[J]. 食品工业, 2020, 41(3): 141-145. |
| [15] |
SICHAEM J, AREE T, LUGSANANGARM K, et al. Identification of highly potent α-glucosidase inhibitory and antioxidant constituents from Zizyphus rugosa bark: Enzyme kinetic and molecular docking studies with active metabolites[J]. Pharm Biol, 2017, 55(1): 1436-1441. DOI:10.1080/13880209.2017.1304426 |
| [16] |
LIN B M, HONG J M, QIU S L, et al. In vitro studies on the hypo-glycemic effect of jaboticaba peel extract[J]. J S Agric, 2020, 51(2): 376-384. 林宝妹, 洪佳敏, 邱珊莲, 等. 嘉宝果果皮提取物体外降糖活性研究[J]. 南方农业学报, 2020, 51(2): 376-384. DOI:10.3969/j.issn.2095-1191.2020.02.018 |
| [17] |
QIU S L, LIN B M, ZHANG S P, et al. Antioxidant and α-glucosidase inhibitory activities of different polarity fractions of the extracts of the young leaves of Myrciaria cauliflora[J]. Chin J Trop Crops, 2019, 40(7): 1373-1378. 邱珊莲, 林宝妹, 张少平, 等. 嘉宝果嫩叶提取物不同极性部位抗氧化及抑制α-葡萄糖苷酶活性研究[J]. 热带作物学报, 2019, 40(7): 1373-1378. DOI:10.3969/j.issn.1000-2561.2019.07.018 |
| [18] |
ZHENG C P, TIAN C R, MA T T, et al. Purification and composition analysis on polyphenols from Sonchus oleraceus L. by macroporous resin[J]. Food Mach, 2016, 32(4): 176-180, 186. 郑翠萍, 田呈瑞, 马婷婷, 等. 大孔树脂纯化苦菜多酚及其组成分析[J]. 食品与机械, 2016, 32(4): 176-180, 186. DOI:10.13652/j.issn.1003-5788.2016.04.041 |
| [19] |
WANG Y, FAN M T, ZHAO P, et al. Dynamic absorption and desorption of polyphenols from Elaeagnus angustifolia L. by macro-porous absorbent resins[J]. J NW Agric For Univ (Nat Sci), 2010, 38(12): 215-220. 王雅, 樊明涛, 赵萍, 等. 大孔树脂对沙枣多酚的动态吸附解析性能研究[J]. 西北农林科技大学学报(自然科学版), 2010, 38(12): 215-220. DOI:10.13207/j.cnki.jnwafu.2010.12.028 |
| [20] |
ZHU J, WANG H B, KONG J J, et al. Purification and antioxidant activity of polyphenols from young pear fruits[J]. Food Sci, 2017, 38(5): 14-20. 朱洁, 王红宝, 孔佳君, 等. 梨幼果多酚的纯化及其抗氧化性[J]. 食品科学, 2017, 38(5): 14-20. DOI:10.7506/spkx1002-6630-201705003 |
| [21] |
ZHU Y L, ZHANG H S, ZHAO X S, et al. Separation and purification of polyphenol in hengshan black soybean by macroporous resin[J]. J Food Sci Biotechnol, 2019, 38(9): 103-110. 朱怡霖, 张海生, 赵鑫帅, 等. 大孔树脂分离纯化横山老黑豆酚类物质[J]. 食品与生物技术学报, 2019, 38(9): 103-110. DOI:10.3969/j.issn.1673-1689.2019.09.015 |
| [22] |
SHAO P, CHEN S, LUO W, et al. Purification process and component analysis of kiwifruit polyphenols[J]. Food Sci Technol, 2019, 44(12): 260-265. 邵佩, 陈胜, 罗威, 等. 猕猴桃多酚的纯化工艺及组分分析[J]. 食品科技, 2019, 44(12): 260-265. DOI:10.13684/j.cnki.spkj.2019.12.044 |
| [23] |
Park J J, LEE W Y. Adsorption and desorption characteristics of a phenolic compound from Ecklonia cava on macroporous resin[J]. Food Chem, 2021, 338: 128150. DOI:10.1016/j.foodchem.2020.128150 |
| [24] |
WU J, GONG J N. Purification of total flavonoids from Flos lonicerae by the macroporous resins and its inhibitory activity on α-glucosidase[J]. J Agric Sci Technol, 2019, 21(10): 89-97. 吴婕, 宫江宁. 大孔树脂纯化金银花总黄酮及其对α-葡萄糖苷酶抑制活性的研究[J]. 中国农业科技导报, 2019, 21(10): 89-97. DOI:10.13304/j.nykjdb.2019.0001 |
| [25] |
WU Y H, LIU E Q, ZHANG J P, et al. Purification, antioxidant capacity and component analysis of hawthorn leaf polyphenols[J]. Food Ferment Ind, 2020, 46(2): 165-172. 巫永华, 刘恩岐, 张建萍, 等. 山楂叶多酚的纯化及其抗氧化特性与组分分析[J]. 食品与发酵工业, 2020, 46(2): 165-172. DOI:10.13995/j.cnki.11-1802/ts.021842 |
| [26] |
LI Z C, FU Y M, ZHANG S, et al. Macroporous resin purification process and component analysis of Pithecellobium clypearia poly-phenols[J]. Chin J Trop Crops, 2021, 42(4): 1127-1135. 李志超, 傅咏梅, 张蜀, 等. 猴耳环多酚的大孔树脂纯化工艺及其组分分析[J]. 热带作物学报, 2021, 42(4): 1127-1135. DOI:10.3969/j.issn.1000-2561.2021.04.032 |
| [27] |
LAN W T, WU X H, ZHANG W. Optimization of purification process of polyphenols from Camellia oleifera Abel leaves and its antioxidant activity in oils[J]. J S Agric, 2019, 50(9): 2058-2064. 蓝梧涛, 吴雪辉, 章文. 油茶叶多酚纯化工艺优化及其对油脂的抗氧化作用[J]. 南方农业学报, 2019, 50(9): 2058-2064. DOI:10.3969/j.issn.2095-1191.2019.09.23 |
| [28] |
HAO F L, LIANG X, FAN Y, et al. Effects of polyphenol extracts from black soybean seed coat on the activity of α-amylase and α-glucosidase in vitro[J]. J Food Saf Qual, 2017, 8(9): 3359-3364. 郝飞龙, 梁骁, 范莹, 等. 黑豆皮多酚提取物体外对α-淀粉酶和α-葡萄糖苷酶活性的影响[J]. 食品安全质量检测学报, 2017, 8(9): 3359-3364. DOI:10.3969/j.issn.2095-0381.2017.09.014 |
| [29] |
ZHOU W E, ZHOU X F, WANG Y Y, et al. Research progress on pretreatment and analysis methods for polysaccharides in traditional Chinese medicine[J]. J Instrum Anal, 2020, 39(9): 1168-1175. 周伟娥, 周学锋, 王宇阳, 等. 中药多糖成分前处理及检测方法研究进展[J]. 分析测试学报, 2020, 39(9): 1168-1175. DOI:10.3969/j.issn.1004-4957.2020.09.017 |
| [30] |
ZHANG S Y, LI Y H, LI J, et al. Comparison of components in the volatile oil extracted from Cortex moutan by five methods[J]. Mod Food Sci Technol, 2020, 36(12): 103-110. 张淑雅, 李勇慧, 李佳, 等. 五种方法提取的牡丹皮挥发油成分比较[J]. 现代食品科技, 2020, 36(12): 103-110. DOI:10.13982/j.mfst.1673-9078.2020.12.0514 |
 2021, Vol. 29
2021, Vol. 29


