2. 厦门市园林植物园, 福建 厦门 361003;
3. 福建省亚热带植物研究所, 福建 厦门 361005
2. Xiamen Botanical Garden, Xiamen 361003, Fuiian, China;
3. Fujian Institute of Subtropical Botany, Xiamen 361005, Fuiian, China
姜花属(Hedychium)隶属于姜科(Zingiberaceae), 为多年生草本植物,原产于热带和亚热带地区[1]。由于含有多种功效成分,该属植物最早以其在民间医药和香料中的重要地位闻名[2],如今也被广泛运用于观赏植物栽培以及精油、香水等领域,是极具发展潜力的重要观赏植物。该属植物喜高温高湿的环境,大多数物种和品种的最适生长温度为25℃~30℃,冬季最低气温不得低于16℃,当温度达到10℃左右时进入休眠状态[3]。低温是造成植株直接伤害的非生物胁迫因子之一[4],而姜花属植物抗寒性则是制约其由南至北产业发展及市场推广的重要因素。
植物的抗寒性是一个复杂的生理生化过程,表现为抗氧化酶活性、渗透调节物质等生理指标的变化[5],目前多应用主成分分析和隶属函数法对它们的抗寒性进行综合评价[6-7]。但目前有关姜科植物抗寒性的研究甚少,通过测定生理指标对姜花属品种进行抗寒性综合评价的研究未曾见报道。朱丽霞等对自然降温过程中姜荷花(Curcuma alsimatifolia)叶片的部分生理指标进行测定,认为姜荷花各指标值在11月中旬较大,建议在此之前采取抗寒措施[8]。何雪娇等对40份热带花卉资源在自然低温下的生理指标进行测定,认为'白雪公主'姜荷花('Snow White')属弱抗冷型[6]。本研究以14个姜花属植物材料为研究对象,对越冬过程中与抗寒性密切相关的生理指标进行测定,同时结合隶属函数法、主成分分析法进行抗寒性综合评价与聚类分析,以期为姜花属植物的抗寒品种选育、抗寒性评价,以及优良的抗寒种类或品种资源的推广与应用提供理论和实践依据。
1 材料和方法 1.1 材料试验材料姜花属3种植物和11个品种均采自厦门市园林植物园姜目园,地处117°53'~118°15' E,24°13'~24°46' N,属南亚热带海洋性季风气候,年均温20.8℃,最冷月(2月)均温12℃,最热月(7月)均温28.7℃。姜花属3种植物为白姜花(Hedychium coronarium)、黄白姜花(H. chrysoleucum)和峨眉姜花(H. flavescens),11个品种分别为'橙塔'姜花(H. coccineum var. aurantiacum 'Orange Brush')、'塔拉'金姜花(H. gardnerianum 'Tara')、'橙汁'姜花(H. 'Orange Crush')、'西里岛'金姜花(H. gardnerianum 'Kahili')、'美梦成真'姜花(H. 'Fireflies')、'活宝'姜花(H. 'Clown Suit')、'星爆'姜花(H. coronarium 'White Starburst')、'粉红色'姜花(H. 'Pink V')、'绝色'姜花(H. 'Tarissima')、'伊丽莎白'姜花(H. coronarium 'Elizabeth')和'白星'姜花(H. stenopetalum 'White Stars')。
经田间观察,厦门地区12月气温较高,日温仍处于姜花属植物生长的适宜温度,此时植株并未在形态上表现出胁迫症状,之后随着气温逐渐下降, 植株逐渐出现叶缘反卷、叶片枯黄的现象,因此分别于2019年12月、2020年2、3和5月进行越冬期取样,采样当日的平均气温分别为21.5℃、10.5℃、18℃和25℃。每个品种或种随机选取10株多年生长势一致、无病虫害的样株,采集顶部以下第3至4片完全展开的叶片,3次重复。取样后以湿纱布包裹,迅速带回实验室,用去离子水洗净并擦干。相对电导率取材后即测定。其余指标测定使用的材料放入液氮中,研磨标记后置于-80℃冰箱中保存备用。
1.2 方法细胞膜透性采用电导法测定,以膜电解质外渗率表示[9];可溶性蛋白质含量采用考马斯亮蓝比色法测定[9];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)显色法测定,以抑制NBT光还原为对照50%的酶量为1个酶活性单位(U)[9];过氧化物酶(POD)活性采用愈创木酚比色法测定,以1 min内OD470变化0.01为1个酶活性单位(U)[9];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)比色法测定[9]。
1.3 数据处理采用Excel 2019整理数据并绘制图表,利用SPSS 24.0对5个指标间的相关性分析,用Duncan检验法进行显著性分析。将标准化后的数据进行主成分分析[6]:以特征值大于1,累计贡献率达到80%为标准保留主成分,通过Varimax法进行因子旋转,得到各主成分的得分值[C(x)]和贡献率,分别计算隶属函数值(U)、主成分权重值和最终抗寒性综合评价值(D),D值为0~1,值越大则抗寒性越强[5]。最后根据D值利用欧氏距离对14个姜花属种质进行聚类分析[6-7]。Uij=(Xij-Xjmin)/(Xjmax-Xjmin),式中, Uij表示i种质在j主成分的隶属函数值,Xij表示i种质在j主成分的得分值,Xjmin表示所有种质j主成分的最小值,Xjmax表示所有种质j主成分的最大值。Wj=Pj/∑Pj, 式中,Wj表示第j个主成分的权重, Pj表示j主成分的贡献率。Di=∑(Uij×Wj),式中, Di表示i种质的综合评价值,Uij表示i种质j主成分的隶属函数值,Wj表示j主成分的权重。
2 结果和分析 2.1 叶片生理指标的变化相对电导率 14个姜花属种质叶片的相对电导率随越冬期均呈先上升后下降的变化趋势,且于气温最低的2月达到峰值(表 1)。4个采样期姜花属种质叶片的电导率分别为9.47%~20.42%、17.61%~ 55.27%、16.57%~45.08%和14.13%~32.73%。越冬期从12月到翌年2月,除'西里岛'金姜花外,其余种质叶片的相对电导率均显著增加,增幅达20.6%~ 75.3%,以'美梦成真'姜花增幅最大,'西里岛'金姜花的最小;2020年2月,'星爆'姜花叶片的相对电导率最大,其次是'绝色'姜花、'塔拉'金姜花、峨眉姜花,比2019年12月的增幅均接近50%,说明温度下降叶片的细胞膜受到显著伤害,导致细胞膜透性增大,电解质外渗。而'西里岛'金姜花、'橙汁'姜花、'橙塔'姜花的相对电导率较低,说明对低温有一定的适应能力。从2月至5月气温回升,各种质叶片的相对电导率均下降。方差分析表明,'西里岛'金姜花越冬期的相对电导率变化不显著,其余种质的相对电导率的差异显著,且相同时间不同种质间的差异也显著。
| 表 1 自然越冬期姜花属种质叶片的相对电导率(%) Table 1 Relative electrical conductivity (%) in leaves of Hedychium germplasms during natural overwintering period |
可溶性蛋白含量 各种质的可溶性蛋白含量随越冬期呈先上升后下降的变化趋势(图 1), 除峨眉姜花外,其余种质均于2月达到最大值,表明自然低温诱导产生的膜蛋白或信号蛋白等保护蛋白,促进了植株抗寒性的提高。同一时期抗寒性强的种质可溶性蛋白含量高、增幅大,抗寒性弱的则相反。在12、2、3和5月姜花的可溶性蛋白含量分别为0.236~0.756、0.301~0.830、0.205~0.700和0.146~0.669 mg/g。2月时,除'星爆'姜花、'西里岛'金姜花、'粉红色'姜花和'绝色'姜花与12月的差异不显著外,其余种质均显著增加,其中,'橙汁'姜花可溶性蛋白含量最大,'黄白'姜花、'橙塔'姜花次之,'美梦成真'姜花、'星爆'姜花最小,各种质的可溶性蛋白含量增幅为0.9%~28.2%,增幅最大的为'白星'姜花,最小的为'西里岛'金姜花。方差分析表明,除'橙汁'姜花和'黄白'姜花、'西里岛'金姜花和'粉红色'姜花间的差异较不显著外,其余种质间的差异均显著。2至5月气温回升,各种质的可溶性蛋白含量均有显著下降,且基本能够恢复正常。
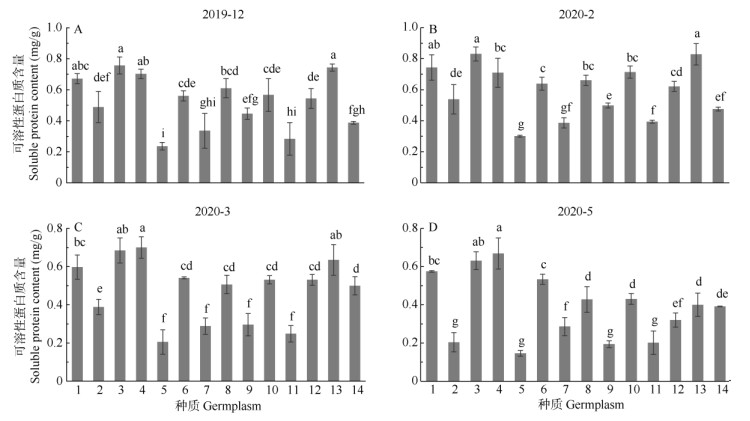
|
图 1 自然越冬期姜花属植物叶片可溶性蛋白含量的变化。1~14见表 1。 Fig. 1 Changes in soluble protein content in leaves of Hedychium germplasm during natural overwintering period. 1-14 see Table 1. |
超氧化物歧化酶活性 姜花属不同种质叶片的超氧化物歧化酶(SOD)活性整体上呈先升后降的趋势(表 2)。各种质在12、2、3和5月的SOD活性分别为89.51~184.97、97.72~188.06、81.87~187.57和76.83~178.84 U/g,均于2020年2月达到最高值, 且除峨眉姜花、'活宝'姜花外,其余种质相对于越冬前(12月)均显著增强,增加幅度为1.7%~26.4%, 其中'星爆'姜花的增幅最大,'橙汁'姜花的最小,说明2月植株叶片的清除超氧化物阴离子能力增强, 从而维持了体内活性氧代谢的平衡。SOD活性的高低能间接说明种质耐寒性的强弱[4],2月'橙汁'姜花的SOD活性最强,'橙塔'姜花、'黄白'姜花次之,'白星'姜花、'美梦成真'姜花最小。越冬后(2-5月), 各种质叶片的SOD活性逐渐降低,低于或与越冬前水平相当。同时,除5月时各种质间的SOD活性差异不显著外,其余时期各种质SOD活性均差异显著(P < 0.05)。
| 表 2 自然越冬期姜花属植物叶片超氧化物歧化酶活性(U/g)的变化 Table 2 Changes in superoxide dismutase activity in leaves of Hedychium germplasm during natural overwintering period |
过氧化物酶活性 过氧化物酶(POD)与SOD酶同为植物体内的保护性酶,能够通过酶促降解清除H2O2,避免细胞膜的过氧化,从而起到保护作用。越冬期姜花属种质的POD活性变化与SOD活性的变化趋势基本一致,12、2、3、5月各种质叶片的POD活性分别为885.6~3 370.8、943.3~3 570.2、677.9~ 3 054.2和558.5~2 286.0 U/g (图 2)。14个种质叶片的POD活性均于2月达到最大值,除'白星'姜花、'美梦成真'姜花、'橙汁'姜花、'西里岛'金姜花外, 其余种质叶片的POD活性均显著增加(P < 0.05),增幅为3.2%~50.3%,其中,'星爆'姜花的增幅最小,白姜花的最大,除'美梦成真'姜花和'白星'姜花外,其余种质间的POD活性均差异显著(P < 0.05),其中, '橙汁'姜花的POD活性最大(3 570.2 U/g),'白星'姜花的最小(943.3 U/g),说明'橙汁'姜花的抗氧化能力较'白星'姜花强。越冬后(2-5月),各种质的POD活性均下降且能恢复正常。
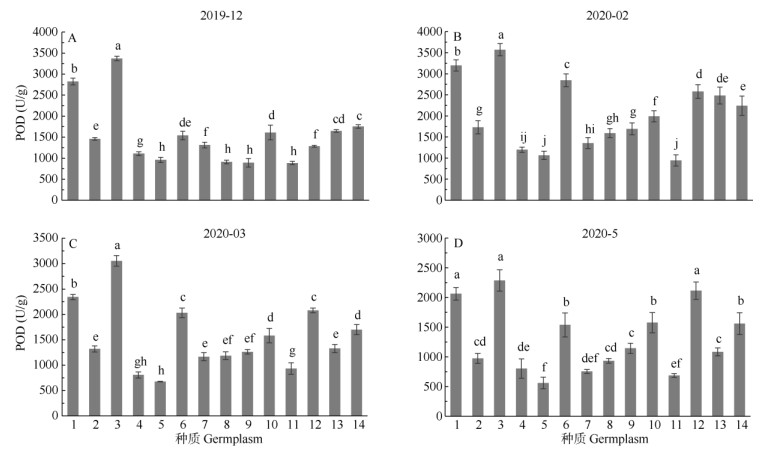
|
图 2 自然越冬期姜花属植物叶片过氧化物酶(POD)活性的变化 Fig. 2 Changes in peroxidase (POD) activity in leaves of Hedychium during natural overwintering period |
丙二醛含量 越冬期各种质叶片的丙二醛(MDA)含量均呈先增长后下降的变化趋势(表 3)。14个种质叶片在12、2、3、5月的MDA含量分别为3.63~20.92、5.24~25.26、5.38~19.62和2.94~13.43 μmol/g。除'星爆'姜花、峨眉姜花、'活宝'姜花、'橙汁'姜花、'黄白'姜花、'白星'姜花、'塔拉'金姜花和'粉红色'姜花于2月达到最大值外,其余种质均于3月才达到峰值,这可能是由于种质的抗寒性不同所导致。各采样期'星爆'姜花叶片的MDA含量均最高,'西里岛'金姜花的最低。各种质叶片的MDA含量最大值比初始值增加11.2%~45.8%。方差分析表明, 除'橙汁'姜花、'白星'姜花叶片的MDA含量变化不显著外,其余12个种质的均差异显著,其中,'西里岛'金姜花的增幅最大,'粉红色'姜花、峨眉姜花次之,'橙塔'姜花的最小。越冬后各种质叶片的MDA含量均下降,说明植物机体细胞膜结构可能发生了变化,阻止了膜脂过氧化程度的加剧,而大部分种质出现了甚至低于越冬前(12月)的值,说明14个种质均能较好的适应冬季的自然降温,并基本能够通过自我调节恢复。
| 表 3 自然越冬期姜花属植物叶片丙二醛含量的变化 Table 3 Changes in malondialdehydecontent in leaves of Hedychium during natural overwintering period |
在5项生理指标中,POD与SOD活性、可溶性蛋白含量呈极显著正相关关系;SOD活性与MDA含量、可溶性蛋白含量分别呈显著负相关和极显著正相关关系;MDA含量与可溶性蛋白含量呈极显著负相关关系;相对电导率与MDA含量呈极显著正相关关系(表 4)。其中,POD、SOD活性、可溶性蛋白含量间的相关系数较高,均大于0.6,说明在越冬过程中,植物的抗氧化酶系统和渗透调节物质共同发挥作用,起到正向协同的效果。各指标之间均存在一定程度的相关性,说明指标间存在信息重叠,因此不能仅用单一指标来确定种质间的抗寒性大小, 因此,需要结合多个指标进行综合评价[13]。
| 表 4 自然越冬过程中姜花属植物叶片生理指标间的相关性分析 Table 4 Correlation analysis of physiological indexes of Hedychium germplasm in natural overwintering period |
主成分分析 对自然越冬过程中14个姜花属种质叶片的5项生理指标进行标准化处理,然后进行主成分分析。由表 5可见,前两个主成分贡献率分别为54.76%和26.53%,累积贡献率达到81.29%,说明变量之间高度相关,基本可代表 5个生理指标的变量信息,因此只选择前两个主成分进行综合评价。由表 6可见,第一主成分主要包含POD、SOD、可溶性蛋白,反映抗氧化酶活性和渗透调节物质与抗寒能力间的关系;第二主成分主要为相对电导率和MDA,反映植物抗寒性与渗透调节物质和细胞膜透性间的关系,即通过降低MDA含量,从而降低膜脂过氧化程度来维持细胞膜的稳定,提高植物的抗寒能力。
| 表 5 姜花属植物抗寒性的主成分贡献率 Table 5 Contribution rate of main components of cold resistance of Hedychium |
| 表 6 综合评价主成分生理指标系数 Table 6 Comprehensive evaluation of principal component physiological index coefficient |
隶属函数分析及综合评价 通过主成分得分值[C(x)]和隶属函数值[U(x)],得出前两个主成分的权重系数分别为0.674和0.326,最终获得14个姜花属种质越冬期的综合评价值(D)(表 7),除'星爆'姜花、'白星'姜花和'塔拉'金姜花在12月的D值已达到最大,其余种质的D值均随越冬期呈先升后降的趋势。根据4个月份的平均D值对14个姜花属种质的抗寒能力进行排序[7],由强到弱依次为'橙汁'姜花、'橙塔'姜花、'活宝'姜花、'黄白'姜花、白姜花、'西里岛'金姜花、'伊丽莎白'姜花、'粉红色'姜花、峨眉姜花、'塔拉'金姜花、'绝色'姜花、'美梦成真'姜花、'白星'姜花、'星爆'姜花。
| 表 7 自然越冬过程中姜花属植物叶片生理指标的主成分分析 |
以自然越冬期姜花属种质抗寒性综合评价值(D)为依据,利用欧氏距离进行聚类分析[6, 14],14个姜花属种质可分为6类(图 3)。第1类为强抗寒,包括'橙汁'姜花、'橙塔'姜花;第2类为较抗寒,包括'活宝'姜花、'黄白'姜花;第3类为中等抗寒,包括峨眉姜花、'粉红色'姜花、'伊丽莎白'姜花、'西里岛'金姜花、白姜花;第4类为弱抗寒,包括'绝色'姜花、'塔拉'金姜花;第5类为较不抗寒,包括'白星'姜花、'美梦成真'姜花;第6类为不抗寒,有'星爆'姜花。
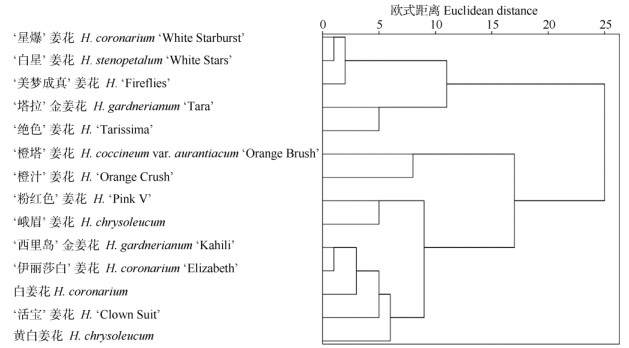
|
图 3 基于综合评价值的姜花属植物抗寒性的系统聚类分析 Fig. 3 Hierarchical cluster analysis of cold resistance of Hedychium based on comprehensive evaluation value |
本研究对14个姜花属种质越冬过程中叶片的相对电导率、可溶性蛋白含量、SOD活性、POD活性、MDA含量等5个生理指标进行了测定,整体上看,各指标随越冬期均呈先上升后下降的变化趋势,但各种质各指标的变化幅度、到达峰值的速率和数值均有所不同,抗寒性强的种质叶片的抗氧化物酶(POD、SOD)活性和渗透调节物质(可溶性蛋白)含量更高,相对电导率和MDA含量则更低,这与何雪娇[6]、李叶云[7]、何海旺[14]等的研究结果一致,也反映了植物是通过膜系统、抗氧化酶系统、渗透调节物质等的共同作用来抵御逆境的胁迫。膜系统是植物受温度影响的最初部位[7],植物受低温伤害越大,细胞膜透性越大,电解质渗出越多,相对电导率则越大[15]。同时,细胞膜中的不饱和脂肪酸会在活性氧的作用下发生膜脂过氧化反应,有毒过氧化产物MDA含量便会升高,从而破坏细胞内多种反应的进行[16],也使膜透性进一步增大;而SOD、POD是植物体内能够清除活性氧自由基的酶,SOD主要通过歧化反应将超氧阴离子
在厦门,2月为气温最低月,采样当日气温为10.5℃,14个姜花属种质在形态上没有表现出明显的寒害症状,但其抗寒生理指标达到最大值,这与杜兴锋等[3]的研究结果吻合。本研究采用主成分分析和隶属函数法相结合,根据综合评价值(D)进行排序及聚类分析,14个姜花属种质可分为强抗寒、较抗寒、中等抗寒、弱抗寒、较不抗寒和不抗寒六类,抗寒性由强到弱依次为'橙汁'姜花、'橙塔'姜花、'活宝'姜花、'黄白'姜花、白姜花、'西里岛'金姜花、'伊丽莎白'姜花、'粉红色'姜花、峨眉姜花、'塔拉'金姜花、'绝色'姜花、'美梦成真'姜花、'白星'姜花和'星爆'姜花。因此,在姜花属植物栽培应用推广中,若冬季温度在10℃以上,大多种类或品种可以露地安全越冬;而在冬季温度为10℃以下的地区栽培姜花属植物,露地栽培则需要采取防寒措施越冬,也可以选择强抗寒性的种类或品种,逐步由南向北推广应用。鉴于本研究中,仅有14个姜花属种质的自然越冬期生理指标测定和抗寒性评价,种类和品种较少,还需要进一步扩大该属植物种类与品种的抗寒性研究,才能够出筛选更多的强抗寒性种类或品种,以利于扩大栽培应用范围。
| [1] |
Morikawa T, Matsuda H, Sakamoto Y, et al. New farnesane-type sesquiterpenes, hedychiols A and B 8, 9-diacetate, and inhibitors of degranulation in RBL-2H3 cells from the rhizome of Hedychium coronarium[J]. Chem Pharm Bull (Tokyo), 2002, 50(8): 1045-1049. DOI:10.1248/cpb.50.1045 |
| [2] |
Shanmugam P V, Yadav A, Chanotiya C S. Enantiomer diffe-rentiation of key volatile constituents from leaves, stems, rhizome and flowers of cultivated Hedychium coronarium Koenig from India[J]. J Essent Oil Res, 2015, 27(2): 101-106. DOI:10.1080/10412905.2014.987929 |
| [3] |
DU X F, ZHAO J H. Characteristics of Hedychium coronarium in northern China and greenhouse cultivation techniques[J]. Mod Agric Sci Technol, 2012, 41(9): 206. 杜兴锋, 赵济红. 北方地区白姜花特征特性及温室栽培技术[J]. 现代农业科技, 2012, 41(9): 206. DOI:10.3969/j.issn.1007-5739.2012.09.136 |
| [4] |
JI S X, DAI S J, LIU W. The advances of plants in response and adaption to low temperature stress[J]. Chin Bull Life Sci, 2010, 22(10): 1013-1019. 计淑霞, 戴绍军, 刘炜. 植物应答低温胁迫机制的研究进展[J]. 生命科学, 2010, 22(10): 1013-1019. DOI:10.13376/j.cbls/2010.10.006 |
| [5] |
ZENG L, GU Y K, WU Y, et al. Effect of cryopreservation on structure, physiology and biochemical characteristics of Dipterocarpus turbi-natus seeds[J]. J Trop Subtrop Bot, 2018, 26(3): 249-254. 曾琳, 顾雅坤, 吴怡, 等. 超低温冷冻对羯布罗香种子结构和生理生化特性的影响[J]. 热带亚热带植物学报, 2018, 26(3): 249-254. DOI:10.11926/jtsb.3824 |
| [6] |
HE X J, YU Z C, LIN J S, et al. Comprehensive evaluation on cold resistance of forty tropical flower resources[J]. J NW Agric For Univ (Nat Sci), 2018, 46(8): 89-98. 何雪娇, 余智城, 林金水, 等. 40份热带花卉种质资源的抗冷性综合评价[J]. 西北农林科技大学学报(自然科学版), 2018, 46(8): 89-98. DOI:10.13207/j.cnki.jnwafu.2018.08.012 |
| [7] |
LI Y Y, SHU X T, ZHOU Y Q, et al. Change in physiological charac-teristics and cold resistance evaluation of three cultivars of Camellia sinensis during natural overwintering period[J]. J Plant Resour Environ, 2014, 23(3): 52-58. 李叶云, 舒锡婷, 周月琴, 等. 自然越冬过程中3个茶树品种的生理特性变化及抗寒性评价[J]. 植物资源与环境学报, 2014, 23(3): 52-58. DOI:10.3969/j.issn.1674-7895.2014.03.07 |
| [8] |
ZHU L X, SHEN X H, LU L M, et al. Part physiological index of Curcuma alismatifolia influenced by natural falling temperature[J]. Fujian Sci Technol Trop Crops, 2020, 45(1): 3-5. 朱丽霞, 沈小华, 陆銮眉, 等. 自然降温对姜荷花部分生理指标的影响[J]. 福建热作科技, 2020, 45(1): 3-5. |
| [9] |
LIU Z Q, ZHANG S C. Physiology of Plant Resistance[M]. Beijing: China Agriculture Press, 1994: 39-60. 刘祖祺, 张石城. 植物抗性生理学[M]. 北京: 中国农业出版社, 1994: 39-60. |
| [10] |
GAO J F. Experimental Guidance for Plant Physiology[M]. Beijing: Higher Education Press, 2006: 142. 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 142. |
| [11] |
LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 1-8, 164, 167-168, 184, 260-261. 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 1-8, 164, 167-168, 184, 260-261. |
| [12] |
ZHANG Z L, QU W J, LI X F. Experimental Guidance of Plant Physiology[M]. 4th ed. Beijing: Higher Education Press, 2009: 1-3, 123, 159, 268, 274. 张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 第4版. 北京: 高等教育出版社, 2009: 1-3, 123, 159, 268, 274. |
| [13] |
ZENG X L, FANG S G, CHEN W H, et al. Comprehensive evaluation on heat tolerance of various Chinese cabbage seedlings[J]. Fujian J Agric Sci, 2010, 25(2): 183-186. 曾小玲, 方淑桂, 陈文辉, 等. 不同大白菜品种苗期耐热性的综合评价[J]. 福建农业学报, 2010, 25(2): 183-186. DOI:10.3969/j.issn.1008-0384.2010.02.013 |
| [14] |
HE H W, ZHAO M, WU P, et al. Evaluation on cold resistance of 18 banana germplasm seedlings[J]. SW China J Agric Sci, 2017, 30(2): 315-321. 何海旺, 赵明, 武鹏, 等. 18个香蕉种质幼苗的抗寒性鉴定[J]. 西南农业学报, 2017, 30(2): 315-321. DOI:10.16213/j.cnki.scjas.2017.2.013 |
| [15] |
TIAN X, FAN J F, ZHANG J M. Evaluation of cold resistance of 8Populus deltoids clones[J]. J SW For Univ, 2018, 38(3): 80-86. 田星, 樊军锋, 张锦梅. 8种美洲黑杨无性系抗寒性评价[J]. 西南林业大学学报, 2018, 38(3): 80-86. DOI:10.11929/j.issn.2095-1914.2018.03.012 |
| [16] |
YU H X, JIANG C Y, WANG C, et al. Physiological response of high quality forage Desmodium intortum to low temperature stress and rapid identification of its cold tolerance[J]. J Trop Subtrop Bot, 2019, 27(6): 649-658. 余涵霞, 姜朝阳, 王纯, 等. 优质牧草旋扭山绿豆对低温胁迫的生理响应及其耐寒性快速鉴定[J]. 热带亚热带植物学报, 2019, 27(6): 649-658. DOI:10.11926/jtsb.4046 |
| [17] |
CHEN J X, ZHANG L L, ZHANG G Q, et al. Drought tolerance of six garden species[J]. J Trop Subtrop Bot, 2020, 28(3): 310-316. 陈嘉欣, 张玲玲, 张国庆, 等. 6种园林植物耐旱性分析[J]. 热带亚热带植物学报, 2020, 28(3): 310-316. DOI:10.11926/jtsb.4128 |
| [18] |
CHEN X, ZHOU Z H, WANG R Q, et al. Effect of low temperature stress on antioxidant ability in Ilex verticillata leaves[J]. J Trop Subtrop Bot, 2016, 24(6): 689-695. 陈茜, 周之涵, 王瑞琪, 等. 低温处理对北美冬青叶片抗氧化能力的影响[J]. 热带亚热带植物学报, 2016, 24(6): 689-695. DOI:10.11926/j.issn.1005-3395.2016.06.013 |
| [19] |
GAO Z Z, LI J N, YU F Y. Differences of physiological parameters of cold hardiness in Styrax suberifolius, Styrax tonkinensis and Styrax dasyanthus seedlings[J]. J CS Univ For Technol, 2018, 38(2): 36-42. 高振洲, 李洁宁, 喻方圆. 安息香属3个树种苗木抗寒生理差异研究[J]. 中南林业科技大学学报, 2018, 38(2): 36-42. DOI:10.14067/j.cnki.1673-923x.2018.02.006 |
 2021, Vol. 29
2021, Vol. 29


