弹性蛋白酶具有降解胶原蛋白、弹性蛋白等多种蛋白质的能力。皮肤组织中的弹性蛋白被弹性蛋白酶降解与皮肤衰老发生过程密切相关,因此对抗弹性蛋白酶对弹性蛋白的降解,恢复皮肤弹性是延缓皮肤衰老的重要途径之一[1]。研究表明,很多植物提取物如芦丁、黄芩素、高良姜素(又名3, 5, 7-三羟基黄酮)、虎杖苷等是天然弹性蛋白酶抑制剂[2–5]。白茶是我国六大茶类之一,富含多酚类物质,具有清凉、退热、降火、祛暑等功效。近年来,随着人们对健康的追求日益高涨,白茶逐渐步入大众视野,其独特的风味品质和保健功效引起了国内外消费者的关注和喜爱。有研究表明,白茶水提取物对弹性蛋白酶的抑制率高达89%[6],且当其作用于体外培养的人皮肤成纤维细胞时,可有效缓解H2O2诱导造成的细胞凋亡损伤[7], 但对于白茶提取物中可能起作用的有效成分尚未见报道。本研究测定了6个白茶样品水提液及其不同萃取层对猪胰弹性蛋白酶(PPE, porcine pancreatic elastase)的抑制活性,并分析其化学组成,同时测定了没食子酸(GA, gallic acid)、表没食子儿茶素没食子酸酯(EGCG, epigallocatechin gallate)和咖啡碱(CAF, caffeine)的酶活抑制率,推测可能起作用的有效成分,以期为白茶延缓皮肤衰老研究提供理论依据, 为其在女性抗皮肤衰老化妆品领域的应用提供数据支撑。
1 材料和方法 1.1 试剂和材料刚果红-弹性蛋白(德国Ruibio)与PPE (德国Ruibio, 活性≥30 U/mg)购自合肥博美生物科技有限责任公司;0.2 mol/L硼酸盐缓冲液(pH 8.8); 0.5 mol/L磷酸盐缓冲液(pH 6.0);GA (上海生工生物, 纯度 > 98%)、EGCG与CAF (上海阿拉丁,纯度 > 99%)标准品;白茶样品6份(表 1),市售,系白牡丹等级,分别记作CB1~CB6。
| 表 1 茶样信息 Table 1 Information of white tea samples |
SKY-200B摇床(上海苏坤)、VARIOSKAN LUX多功能酶标仪(美国Thermo scientific)、ACD-0502-U超纯水机(重庆艾科浦)、PB-10酸度计(德国Sarto- rius)、MS 3 basic旋涡混匀器(德国IKA)、5418R小型台式离心机(德国Eppendorf)、CVE-3000型离心浓缩仪(日本EYELA)。
1.3 白茶水提液及其萃取层制备称取白茶样品4 g,加100 mL沸水,沸水浴提取15 min,滤纸抽滤制得白茶水提液,当日使用。参照杨子银等[8]的方法制备CB4萃取层,依次得到氯仿层(WEC)、乙酸乙酯层(WEA)、正丁醇层(WEB)和剩余水层(WER)。各萃取层浓缩至干(呈浸膏状),–20℃冷冻保存备用。
1.4 对PPE抑制率的测定参照姚亚红等[3]的方法,稍作修改。准确称取20 mg刚果红-弹性蛋白至50 mL离心管内,加入5 mL 37℃预热的0.2 mol/L硼酸盐缓冲液(pH 8.8),充分涡旋混匀,水浴20 min,加入2 mL经37℃预热的用硼酸盐缓冲液配制的PPE溶液(浓度为0.5、1、2、4、6 mg/mL),充分涡旋混匀,在37℃、400 r/min摇床振荡20 min,立即加入pH 6.0的0.5 mol/L磷酸盐缓冲液5 mL,涡旋混匀,取混匀液适量至2 mL离心管内, 在9 391×g下离心10 min,精密吸取上清液200 μL至96孔板内,在波长495 nm处测定吸光度。以PPE浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
取2 mg/mL PPE溶液2 mL,加入酶抑制剂(CB1~ CB6水提液或CB4各萃取层) 2 mL,充分涡旋混匀,在37℃、400 r/min摇床振荡20 min,立即加入pH 6.0的0.5 mol/L磷酸盐缓冲液5 mL,涡旋混匀,取混匀液适量至2 mL离心管内,在9 391×g下离心10 min,精密吸取上清液200 μL至96孔板内,在波长495 nm处测定吸光度,同时进行400~800 nm光谱扫描。以底物加酶溶液为空白对照组,底物加酶和茶溶液为酶抑制组,底物加茶不加酶溶液作扣茶汤背景用。每组均设2复孔。抑制率(%)=[1– (An–An′)/(A0–A0′)]×100%, 式中, A0为加酶不加茶的吸光度,A0′为仅加底物不加茶和酶的吸光度,An为仅加茶溶液的吸光度,An′为加茶不加酶的吸光度。若An′ > An,则表现为促进作用,促进率(%)=[1– (An′–An)/(A0–A0′)]×100%。
1.5 白茶水提液与萃取层的组分分析多酚(TPs, tea polyphenols)总量测定采用福林酚比色法[9];黄酮类(Fs, flavones)总量测定采用三氯化铝比色法[10];GA、儿茶素组分[没食子儿茶素(GC, gallocatechin)、表没食子儿茶素(EGC, epigallocate-chin)、表儿茶素(EC, epicatechin)、没食子儿茶素没食子酸酯(GCG, gallocatechin gallate)、EGCG、表儿茶素没食子酸酯(ECG, epicatechin gallate)]和生物碱[可可碱(TB, theobromine)、CAF]含量测定采用HPLC法[11]。
1.6 GA、EGCG、CAF标准品对PPE活性作用用超纯水配制GA、EGCG、CAF标准品母液, 分装,–70℃保存,现取现用,忌反复冻融。用硼酸盐缓冲液稀释成浓度分别为0.1、0.25、0.5、1.0、2.0 mg/mL EGCG,0.05、0.25、0.5、1.0、2.0 mg/mL GA和CAF溶液,用于测定酶抑制率或促进率(%)。
1.7 数据的统计分析所有数据以平均值±标准差(n=3)表示。采用origin 2018对数据进行处理和作图。采用SPSS 21.0软件进行单因素方差分析(One-Way ANOVA),显著性差异分析采用SNK法,显著水平为0.01;双变量分析酶活抑制率与组分含量的相关性,显著性采用双侧t-检验,相关系数采用Pearson相关性分析。
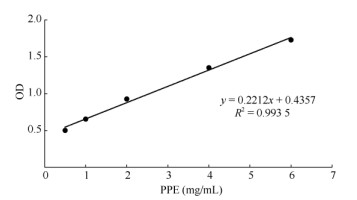
2 结果和分析 2.1 白茶对PPE的抑制活性PPE标准曲线制作 以浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到方程y=0.2212x+ 0.4357,R2=0.993 5。结果表明,PPE在1~ 6 mg/mL范围内,PPE对底物(弹性蛋白)的水解活性呈现良好的线性关系,相关系数达到0.993 5 (图 1)。
|
图 1 PPE对弹性蛋白的水解作用 Fig. 1 Hydrolysis of elastin by PPE |
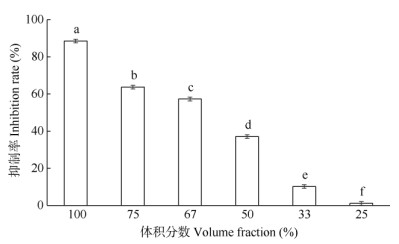
白茶水提液 从图 2可见,白茶水提液用硼酸盐缓冲液稀释成体积分数75%后,CB4对PPE活性的抑制率最大,达69.73%,CB1的抑制效果最差;CB2~CB6抑制PPE的水解活性与CB1的差异达极显著水平(P < 0.01)。从图 3可见,CB4水提液用硼酸盐缓冲液稀释成体积分数100%、75%、67%、50%、33%和25%,不同体积分数的CB4对PPE活性呈剂量依赖性抑制,且随体积分数降低,抑制率逐渐下降;体积分数为25%~75%的CB4对PPE的抑制活性与100%的差异达极显著水平(P < 0.01)。

|
图 2 白茶水提液对PPE的抑制活性。柱上不同字母表示差异极显著(P < 0.01)。下图同。 Fig. 2 Inhibition effect of white tea aqueous on elastase activity. Different letters upon column indicate significant differences at 0.01 level. The same is following Figures. |
|
图 3 不同体积分数CB4水提液对PPE的抑制活性 Fig. 3 Inhibition effect of CB4 with different volume fractions on elastase activity |
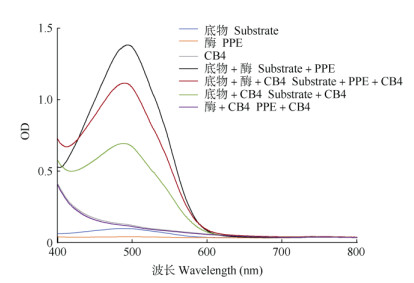
400~800 nm光谱扫描结果表明(图 4),PPE水解底物在495 nm波长附近出现最大吸收峰,底物+酶+CB4以及底物+CB4混合溶液亦是如此,因此选择495 nm测定酶活,但底物+CB4混合溶液有背景干扰,需要扣除其OD值。底物、酶、CB4以及酶+CB4的混合溶液在495 nm处的OD值很低,可忽略不计。
|
图 4 PPE水解底物的光谱扫描图 Fig. 4 Spectral scan of PPE hydrolyzed substrate |
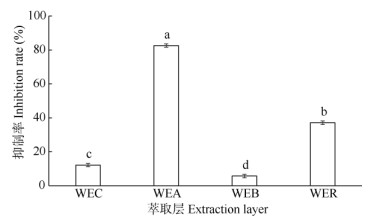
CB4萃取层 CB4水提液的WEC、WEA、WEB、WER萃取层用0.5 mL超纯水溶解,再用硼酸盐缓冲液稀释10倍后进行测定,从图 5可见, WEA的抑制率最高,达到82.58%,且与其他萃取层的差异达极显著水平。
|
图 5 图 5 CB4不同萃取层对PPE的抑制活性。WEC: 三氯甲烷萃取层; WEA: 乙酸乙酯萃取层; WEB: 正丁醇萃取层; WER: 剩余水层。图 6和表 4同。 Fig. 5 Inhibition effect of different extraction layers of CB4 on elastase activity. WEC: Chloroform extraction layer; WEA: Ethyl acetate extraction layer; WEB: n-butyl alcohol extraction layer; WER: Residual water extraction layer. The same is Fig. 6 and Table 4. |
白茶水提液 CB6水提液中的多酚(TPs)总量最高,其次是CB4,但两者相近(表 2)。同时, CB6的黄酮总量最高,其次是CB1。从表 3可见,CB4水提液中表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)、儿茶素总量(TC)、咖啡碱(CAF)和生物碱总量(TA)含量均最高,其次是CB5与CB6 (表 3)。CB6水提液中没食子酸(GA)含量最高。
| 表 2 白茶水提液中多酚与黄酮总量 Table 2 Contents of polyphenols and flavones in white tea aqueous |
| 表 3 白茶水提液中没食子酸、儿茶素与生物碱组分含量(mg/g) Table 3 Contents of gallic acid, catechins and alkloids of white tea aqueous |
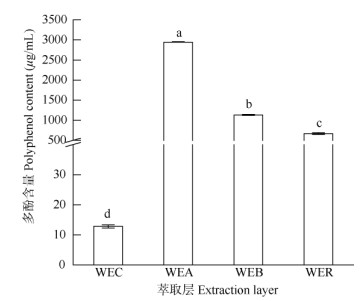
CB4萃取层 分别取WEC、WEA、WEB、WER母液用超纯水稀释10、500、100和100倍后,测定多酚含量,为使各萃取层中多酚含量具可比性,统一折算成酶活作用浓度(10倍稀释液)。WEA、WEB、WER、WEC中的多酚含量分别为3 000、1 100、667和13 mg/mL。可见WEA中的多酚含量最高, WEC最低,两者相差200倍以上(图 6)。各萃取层10倍稀释液中没食子酸、儿茶素与生物碱组分含量见表 4,WEC主要含有CAF,约为1 243 μg/mL,儿茶素含量极低,总量仅4.57 μg/mL;WEA中以儿茶素类为主,包括EGCG、ECG、ECG和GCG等,总量达3 000 μg/mL以上,CAF含量仅93 μg/mL; WEB中仍含有儿茶素,而WER中含量较少,二者均含有少量的生物碱;且GA含量以WER最高。这表明WEA中多酚和儿茶素类含量最高,而WEC主要含有CAF。
|
图 6 不同萃取层中的多酚含量 Fig. 6 Content of polyphenols in different extraction layers |
| 表 4 不同萃取层中没食子酸、儿茶素和生物碱含量(g/mL) Table 4 Contents of GA, catechins and alkaloids in different extraction layers |
相关性分析表明,PPE活性抑制率与白茶的TPs、EGCG、TC、CAF含量的相关系数分别为0.94、0.97、0.04和0.98,均呈极显著正相关(P < 0.01); 而与EC、GC含量的相关系数为负值,分别为-0.93和-0.88,呈显著负相关;与Fs和GA相关系数分别为0.73和0.21,但不具有显著性。
2.4 EGCG、GA、CAF标准品对PPE活性的抑制作用TPs和CAF是茶叶的特征性物质,而儿茶素是TPs的主体成分,其中EGCG约占总量的70%~ 80%[12]。GA是TPs含量测定中常用的标准物质。由表 3和表 4换算可知,测定酶活抑制率所用的白茶水提液与CB4不同萃取层中约含有0~2.0 mg/mL EGCG、0~0.15 mg/mL GA和0.05~1.5 mg/mL CAF。分别用0.1~2.0 mg/mL EGCG、0.05~2.0 mg/mL GA和0.05~2.0 mg/mL CAF标准品对PPE活性的抑制率进行测定,结果表明,EGCG在0.1~1.0 mg/mL范围内对PPE活性无抑制作用,仅2.0 mg/mL EGCG对PPE活性的抑制率约为11.71%;0.05~2.0 mg/mL CAF和0.05~2.0 mg/mL GA标准品对PPE活性均表现为促进作用,且GA的促进作用与其浓度呈正比(表 5)。较高浓度(≥4.0 mg/mL) CAF与底物的混合溶液在相同条件下反应后呈现红色,且浓度越高,红色越深,这说明CAF和底物混合后表现出与酶水解底物同样的效果。可见CAF+底物背景色干扰极其明显,故无法准确计算其抑制率。高浓度的EGCG (≥2.0 mg/mL)同样也出现这种情况。
| 表 5 EGCG、GA、CAF标准品对PPE的抑制或促进活性 Table 5 Elastase inhibitory or promoting activity of EGCG, GA and CAF |
在开展天然弹性蛋白酶抑制剂筛选试验中,通常选用的底物有化学合成的,如AAAPVN (N-琥珀酰-丙氨酸-丙氨酸-丙氨酸-p-硝基苯胺),也有天然底物刚果红-弹性蛋白,选用的弹性蛋白酶有PPE、人中心粒弹性蛋白酶(HNE)和人白细胞弹性蛋白酶(HLE)等。不同试验中选用的底物与酶存在差异, 导致酶抑制剂的作用效果也有所不同。Thring等[6]采用PPE水解底物AAAPVN,当加入酶抑制剂EGCG后,直接测定405 nm波长下水解产物硝基苯胺(p- nitroaniline)的生成量,得出250 μmol/L EGCG对酶的抑制率约为35%。EGCG对HNE的半抑制浓度(IC50)为12.9 μmol/L[13]。Shoko等[14]研究表明, 5~ 20 μg/mL EGCG (约为11~44 μmol/L)对HLE的抑制活性很低,抑制率在35%以下。然而在实际应用中,该波长检测灵敏度不够理想,同时许多天然产物本身可能具有405 nm特征吸收,因而直接测定法易受到待测样品自身颜色的影响而降低测定结果的准确性[15]。
本研究以刚果红-弹性蛋白为底物,PPE水解弹性蛋白后使刚果红染料脱落到溶液中,此时溶液呈现红色,当加入酶抑制剂茶样后,酶活性受到抑制,红色变浅,且抑制能力与红色深浅程度呈负相关, 采用酶标仪测定495 nm处的吸光度可间接得出抑制率,结果表明,CB4水提液及其乙酸乙酯层对PPE抑制活性最强,也就是说,白茶中抑制PPE水解的有效组分主要集中在乙酸乙酯层。组分测定结果表明乙酸乙酯层中多酚总量及EGCG、ECG、ECG和GCG等儿茶素组分含量最高。儿茶素类物质具有显著的DPPH (1, 1-diphenyl-2-picrylhydrazyl)和ABTS [2, 2ʹ-azinobis-(3-ethylbenzthiazoline-6-sulphonate)]清除活性,常作为重要的天然抗氧化剂用于化妆品领域[16]。然而本研究结果表明,0~1 mg/mL EGCG、0.05~2.0 mg/mL CAF和0.05~2.0 mg/mL GA对PPE活性几乎无抑制作用,Demeule等[17]的研究同样表明,以结合荧光染料的明胶为底物,1 μmol/L儿茶素(C、EC、EGC、ECG、EGCG)对PPE活性无抑制作用,100 μmol/L的抑制率也低于15%,绿茶多酚对PPE活性的抑制率也极低。那么乙酸乙酯层中对PPE活性发挥强抑制作用的物质是否为儿茶素类以外的单体成分,或者是包括儿茶素在内的多种物质的协同效应,亟待进一步研究探讨。原花青素由(+)-儿茶素、(-)-表儿茶素、(-)-表儿茶素没食子酸酯聚合而成。据报道,在pH 8.25、37℃的Tris-HCl缓冲溶液中,250 μmol/L原花青素和250 μmol/L儿茶素分别处理不溶弹性蛋白24 h后,原花青素对PPE和HLE的抑制率分别为86.6%和100%,而儿茶素对PPE的抑制率为27.8%,对HLE无抑制作用[18]。从红茶中提取的茶黄素双没食子酸酯(TFDG, theaflavin 3, 3ʹ-di-O-gallate)能抑制HNE诱导的气道黏液分泌,在阻滞HNE诱导的气道黏蛋白5AC合成中有一定作用,但阻断途径尚不清楚[19]。侧柏(Thuja orientalis)果甲醇提取物中的3种黄酮类物质柏木双黄酮(cupressuflavone)、穗花杉双黄酮(amen- toflavone)和罗波斯塔双黄酮(robustaflavone)对HNE活性有显著抑制作用,IC50分别为8.09、1.27和1.33 μmol/L,阳性对照EGCG为51.15 μmol/L, 而(+)-儿茶素(catechin)、槲皮素(quercitrin)、异槲皮素(isoquercitrin)和杨梅素(myricitrin)的抑制浓度较低[20]。沈新锋等[4]采用硅胶柱层析分离蜂胶乙酸乙酯萃取物,获得高良姜素(3, 5, 7-三羟基黄酮)和球松素等活性组分,其中高良姜素抑制HLE活性的IC50为6.88 μmol/L,极显著高于熊果酸(49.50 μmol/L)。由此推测,茶叶中含有的黄酮、花青素类物质可能对PPE活性有一定抑制作用。‘福云6号’和‘黄旦’品种制成的白茶中芦丁含量是其制成绿茶、红茶、乌龙茶的1.5~2倍[21]。因此后续有必要对CB4乙酸乙酯层进一步分离纯化,以期得到生物活性(抑制PPE水解活性)强、纯度较高的单体化合物,为茶叶抗皮肤老化研究及抗衰除皱护肤品研发提供科学依据。
从400~800 nm光谱扫描结果来看,作为酶活抑制剂的白茶水提液本身存在背景色的干扰,故本研究测定了白茶样品与底物混合后在同等反应条件下的吸光度,用作自身背景的扣除,从而提高了检测准确性。此外,底物溶液几乎不具颜色,在适宜条件下经PPE水解后溶液呈鲜红色;CAF水溶液为无色,较高浓度的CAF(≥4.0 mg/mL)与底物的混合溶液在相同条件下反应后溶液也变红,可见CAF背景色干扰极其明显,故无法准确计算其抑制率。高浓度的EGCG (≥2.0 mg/mL)同样也出现这种情况,可能是这2种物质在无PPE作用下也可使刚果红染料从刚果红-弹性蛋白上脱落下来,发生这一现象的原因尚待进一步研究探讨。
| [1] |
Wei S M. Elastase degradation, skin aging and the development of skin care products[J]. China Surfact Deterg Cosmet, 1997(5): 32-34. 魏少敏. 弹性蛋白降解与皮肤衰老及其护肤品开发[J]. 日用化学工业, 1997(5): 32-34. DOI:10.13218/j.cnki.csdc.1997.05.012 |
| [2] |
CHEN L P, YIN X L, FANG Y C, et al. Establishment of assay for screening of elastase inhibitor and inhibitory effect of natural products on activity of elastase[J]. J Yantai Univ (Nat Sci Eng), 2011, 24(3): 209-213. 陈立平, 尹相利, 方玉春, 等. 弹性蛋白酶抑制剂筛选方法的建立及天然产物对其抑制活性观察[J]. 烟台大学学报(自然科学与工程版), 2011, 24(3): 209-213. DOI:10.3969/j.issn.1004-8820.2011.03.008 |
| [3] |
YAO Y H, XUE S P, ZHANG L W. Study on extraction by enzymic dissolution and inhibition of porcine pancreatic elastase of baicalein[J]. Chin J Spectrosc Lab, 2009, 26(4): 993-996. 姚亚红, 薛淑萍, 张立伟. 黄芩素的酶解提取工艺及其抑制弹性蛋白酶活性研究[J]. 光谱实验室, 2009, 26(4): 993-996. DOI:10.3969/j.issn.1004-8138.2009.04.057 |
| [4] |
SHEN X F. Studies on the inhibitory effects of active components separated from propolis on human leukocyte elastase[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012: 33-34. 沈新锋. 蜂胶中抑制人白细胞弹性蛋白酶活性成分的研究[D]. 福州: 福建农林大学, 2012: 33-34. |
| [5] |
LI X J. Study on the extracts from Polygonum cuspidatum and its inhibitory effect to elastase[D]. Wuxi: Jiangnan University, 2012: 33-34. 李小晶. 虎杖的提取及其对弹性蛋白酶的抑制作用研究[D]. 无锡: 江南大学, 2012: 33-34. |
| [6] |
Thring T S A, Hili P, Naughton D P. Anti-collagenase, antielastase and anti-oxidant activities of extracts from 21 plants[J]. BMC Compl Altern Med, 2009, 9(1): 27. DOI:10.1186/1472-6882-9-27 |
| [7] |
Thring T S A, Hili P, Naughton D P. Antioxidant and potential anti-inflammatory activity of extracts and formulations of white tea, rose, and witch hazel on primary human dermal fibroblast cells[J]. J Inflamm, 2011, 8(1): 27. DOI:10.1186/1476-9255-8-27 |
| [8] |
YANG Z Y. Isolation, identification of polyphenols in black tea and tea (Camellia sinensis) flower and studies on their antioxidant function and mechanism[D]. Hangzhou: Zhejiang University, 2007: 80. 杨子银. 茶(红茶)与茶(Camellia sinensis)花多酚类物质的分离鉴定及其抗氧化机理研究[D]. 杭州: 浙江大学, 2007: 80. |
| [9] |
ZHOU W L, XU J F, XU L. GB/T 8313-2008 Determination of total polyphenols and catechins content in Tea[S]. Beijing: Standards Press of China, 2008: 1-7. 周卫龙, 徐建峰, 许凌. GB/T 8313-2008茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京: 中国标准出版社, 2008: 1-7. |
| [10] |
HUANG Y H. Experimental Technology of Tea Science[M]. Beijing: China Agriculture Press, 1995: 124. 黄意欢. 茶学实验技术[M]. 北京: 中国农业出版社, 1995: 124. |
| [11] |
WANG L L, YANG J G, CHEN J, et al. Effects of microfiltration on HPLC determination of catechins and alkaloids in tea[J]. Tea Sci Technol, 2014(3): 29-33. 王丽丽, 杨军国, 陈键, 等. 微孔过滤对茶叶儿茶素类和生物碱HPLC检测的影响[J]. 茶叶科学技术, 2014(3): 29-33. DOI:10.3969/j.issn.1007-4872.2014.03.006 |
| [12] |
TANG H M, CAI L H, LI H J, et al. The quantum chemistry calculation on the antioxidative activity of polyphenols in tea[J]. S China Agric, 2012, 6(7): 7-13. 唐华明, 蔡伦红, 李惠君, 等. 茶叶中多酚类物质抗氧化活性的量子化学计算研究[J]. 南方农业, 2012, 6(7): 7-13. DOI:10.3969/j.issn.1673-890X.2012.04.002 |
| [13] |
XU G H, KIM Y H, CHOO S J, et al. Isodeoxyhelicobasidin, a novel human neutrophil elastase inhibitor from the culture broth of Volvariella bombycina[J]. J Antibiot, 2009, 62(6): 333-334. DOI:10.1038/ja.2009.24 |
| [14] |
Shoko T, Maharaj V J, Naidoo D, et al. Anti-aging potential of extracts from Sclerocarya birrea (A. Rich.) Hochst and its chemical profiling by UPLC-Q-TOF-MS[J]. BMC Compl Altern Med, 2018, 18(1): 54. DOI:10.1186/s12906-018-2112-1 |
| [15] |
SONG G, HU X T, KONG L C, et al. Optimization research on in vitro screening model for human leukocyte elastase inhibitor[J]. Acad J Second Milit Med Univ, 2011, 32(6): 640-644. 宋歌, 胡显腾, 孔令超, 等. 人白细胞弹性蛋白酶抑制剂体外筛选模型的建立及优化[J]. 第二军医大学学报, 2011, 32(6): 640-644. DOI:10.3724/SP.J.1008.2011.00640 |
| [16] |
LIU Y H, LIN L D, YE Y S, et al. Flavonoids from the stems of Alpinia hainanensis 'Shengzhen'[J]. J Trop Subtrop Bot, 2017, 25(5): 517-522. 刘友花, 林立东, 叶育石, 等. 升振山姜茎的黄酮类成分[J]. 热带亚热带植物学报, 2017, 25(5): 517-522. DOI:10.11926/jtsb.3736 |
| [17] |
Demeule M, Brossard M, Pagé M, et al. Matrix metalloproteinase inhibition by green tea catechins[J]. Biochim Biophys Acta, 2000, 1478(1): 51-60. DOI:10.1016/S0167-4838(00)00009-1 |
| [18] |
DUAN Y Q, XIE B J. The current research and development of procyanidins in cosmetics[J]. Flav Frag Cosmet, 2002(6): 23-26. 段玉清, 谢笔钧. 原花青素在化妆品领域的研究与开发现状[J]. 香料香精化妆品, 2002(6): 23-26. |
| [19] |
WU H Q, DING Y P, ZHOU X D. Roles of theaflavins in inflammatory airway mucus hypersecretion[J]. J Shanghai Jiaotong Univ (Med Sci), 2009, 29(2): 126-129, 144. 邬海桥, 丁阳平, 周向东. 红茶提取物在炎性气道黏液高分泌中的作用[J]. 上海交通大学学报(医学版), 2009, 29(2): 126-129, 144. |
| [20] |
XU G H, RYOO I J, KIM Y H, et al. Free radical scavenging and antielastase activities of flavonoids from the fruits of Thuja orientalis[J]. Arch Pharm Res, 2009, 32(2): 275-282. DOI:10.1007/s12272-009-1233-y |
| [21] |
LI X L, YU X M, GONG Z H, et al. Difference in main metabolites contents in green tea, black tea, oolong tea and white tea[J]. J Fujian Agric For Univ (Nat Sci), 2019, 48(5): 559-566. 李鑫磊, 俞晓敏, 龚智宏, 等. 绿茶、红茶、乌龙茶和白茶中主要代谢产物的差异[J]. 福建农林大学学报(自然科学版), 2019, 48(5): 559-566. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2019.05.004 |
 2021, Vol. 29
2021, Vol. 29


