2. 贵州师范大学生命科学学院, 贵阳 550025
2. College of Life Science, Guizhou Normal University, Guiyang 550025, China
Redfield比值[1]是指养分不受限制时,藻类健康生长和生理平衡的元素比值关系为C/N/P=106/ 16/1。然而,许多研究[2-3]表明,有机体的化学计量C/N/P比值在不同的环境中存在差异。N和P是浮游植物生长所必需的营养元素,不仅绝对浓度能够影响藻类的生长,其比率(N/P)也直接影响藻类生长、细胞组成及其对营养的摄取效率。宋玉芝等[4]报道N/P为25时浮游藻类及附着植物的生物量随水体N浓度的升高而显著增加;Stockner等[5]报道,N/P比值从15提高到25时水体中的优势种从鱼腥藻(Anabaena sp.)逐渐发展为聚球藻(Synechococcus sp.);纯种或混合培养体系中,N/P比不仅影响藻类的最大现存量,还影响藻类种间竞争的抑制参数、比生长速率等[6-7]。研究表明,在一定范围内,N/P的降低有利于甲藻占优势,高N/P (256/1)则对硅藻生长有明显促进作用[8],而蓝藻水华更容易出现在低N/P下的超富营养水库中[9-10]。因此水体N、P供应及其比率影响着浮游植物种间竞争,对浮游植物群落的结构和演替有重要的决定作用[11]。
广东省地处热带亚热带北沿,区域季节性降雨较充足,水体常年温度较高,辐射较强,有助于浮游植物的全年生长,同时也提高了浮游植物对营养盐的需求[12]。然而,热带亚热带水库中磷酸盐长期维持在低浓度水平,P成为浮游植物生长的限制因子[13-15]。浮游植物在生长繁殖过程中可以通过调整其化学计量比(C/N/P)来改变生长速率,从而适应营养盐限制环境[16-17],还能通过分泌胞内外碱性磷酸酶,通过裂解水体中的有机磷为无机磷[18], 供自身生长所需;此外,一些水华藻类如拟柱胞藻[19]对低磷环境有着特殊的适应机制,能超额富集水体中较低浓度的P,这些特性使得这些水华蓝藻能够在P限制的水体中大量生长。本研究选取了一座典型低磷水平的南亚热带水库,其全年水体的平均N/P比接近90/1[20],通过氮磷营养盐的添加试验来探究自然磷限制水体中浮游植物群落对不同氮磷比营养盐的响应。本研究从群落水平研究了营养盐的相对浓度对浮游植物的影响,为广东省热带亚热带水库的湖沼学研究和水质管理提供理论参考。
1 材料和方法 1.1 试验藻种来源和试验设计2019年2月20日于广东省流溪河水库取表层原水,经60 µm滤网过滤浮游动物以及悬浮大颗粒物后,置于容量桶中带回实验室,测定原水的溶解态N浓度、溶解态P浓度、碱性磷酸酶活性(APA)、藻细胞C、N、P等指标作为初始值;原水为试验培养用水,原水中的浮游植物即为试验浮游植物群落的来源。取摇晃均匀的原水400 mL分装于T175细胞培养瓶(TC-Flasche T175,Stand,Vent. Cap), 为避免其他营养元素限制,事先已加入无N、P的WC培养基[21]。
基于经典的Redfield比值,即N/P比为16的阈值,我们认为该水库浮游植物主要受到P盐的限制,N盐十分充足。处理组N/P浓度的设置中N最低为原水本身的浓度,即N1浓度(41.1 µmol/L),N绝对浓度以20 µmol/L为梯度增加,而P最低是高于原水的P3浓度(0.8 µmol/L),P绝对浓度以1.2 µmol/L为梯度增加,共设计9组N/P处理组, 1组空白对照(表 1)。每组设3个平行, 试验期间不再添加营养元素。培养条件:温度为(25±1)℃、光周期为12 h/12 h、光照强度为40 µmol/(m2·s),每天定时摇动藻液1次,随机移动藻瓶位置,避免光照不均匀。
| 表 1 试验设计的N、P浓度和N/P Table 1 Concentrations of N, P and N/P in tests |
隔天摇匀藻液,并移取于离心管中,用分光光度计在680 nm波长下测定OD值,以天数为横坐标、OD值为纵坐标绘制浮游植物生长曲线来确定浮游植物生长时期,最终确定试验开始的第1天为初始期, 第13天为指数期,第21天为稳定期。
1.3 藻细胞胞内C、N、P含量测定藻液过滤到酸化预处理后的玻璃纤维滤膜(Whatman GF/C,孔径1.2 μm)上,烘干储存于干燥器中。使用元素分析仪(型号Vario EL)进行C、N含量分析;藻细胞P含量采用钼酸铵分光光度法(GB 11893-89)。
1.4 碱性磷酸酶活性的测定采用对硝基磷酸苯二钠法[22]测定水样碱性磷酸酶活性(APA),反应条件为pH 8.4、温度35℃、反应体积2 mL、反应时间4 h、测量波长410 nm。依据对硝基苯酚的标准曲线,计算水解反应产生的对硝基苯酚的量。计算公式:APA=C/(T×V), 式中,APA为碱性磷酸酶活性[nmol/(L·min)];C为对硝基苯酚的变化量(nmol),即水解反应的产生对硝基苯酚量;T为水解反应的时间(min);V为测试水样的体积(L)。
水样不经过过滤测定的酶活性值为总的碱性磷酸酶活性(TAPA),经Whatman GF/C滤膜(孔径1.2 μm)过滤后测定的酶活值为细菌+溶解性碱性磷酸酶活性(BAPA+DAPA),则浮游植物的碱性磷酸酶活性为PAPA=TAPA-(BAPA+DAPA)。为校正因生物量的增加引起的总体活性增长,PAPA与生物量指标的比值即浮游植物单位生物量所表现的酶活性,也称作酶的特异性活性(specific activity),能更好地反映酶的内在催化效力[23]。本试验中,单位生物量酶活性(单位生物量APA)=PAPA/藻类总生物量,以nmol/(min·mg)表示。
1.5 浮游植物的种类和定量分析采用Utermöhl计数法于倒置显微镜下对浮游植物进行分类鉴定和计数[24],每个样品分别镜检多于400个浮游植物个体,其丰度计算公式为:N=(C× D2)/(V×n×d), 式中,N为藻细胞丰度(cells/L),V为沉降水样的体积(L),D为载玻片直径(mm),d为计数镜头直径(mm),n为计数镜头数,C为计数细胞数(cells)。浮游植物种类鉴定主要参照《中国淡水藻类——系统、分类及生态》[25]和有关文献。根据浮游植物形态和大小计算各种浮游植物对应的生物量,本文选择粗分法进行生物量计算[26]。
1.6 数据处理运用IBM SPSS Statistics 22S统计软件对数据进行显著性分析(One-Way ANONA),采用LSD法进行验后比较,差异显著性水平设为α=0.05,两个变量之间进行Pearson相关性分析。
2 结果和分析 2.1 浮游植物群落的组成试验共观察到浮游植物6门72种(属),其中绿藻门47种(属)、硅藻门10种(属)、蓝藻门9种(属)、甲藻门2种(属)、金藻门2种(属)、隐藻门2种(属),浮游植物群落主要以蓝藻、绿藻和硅藻为主。原水浮游植物群落经培养后发生了变化(图 1)。初始期原水中的浮游植物较少,总丰度为1.11×106 cells/L, 优势类群为硅藻门,占51.50%,其次为蓝藻门31.60%;指数期,浮游植物总丰度下降到0.89×106 cells/L, 而稳定期总丰度上升为1.23×106 cells/L。指数期和稳定期群落主要以绿藻、硅藻为主,在稳定期金藻丰度明显上升。原水浮游植物总丰度先降低后升高,逐渐由硅、蓝藻转变为绿、硅藻为优势的群落结构。
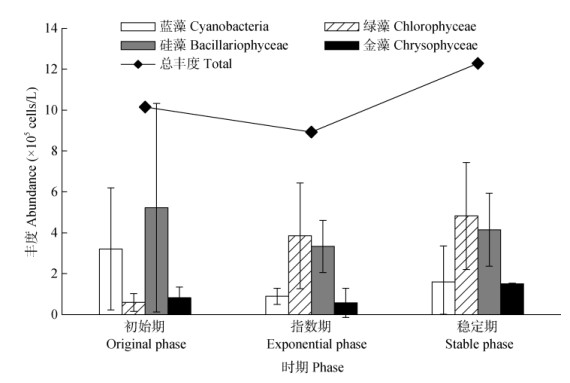
|
图 1 原水中的主要浮游植物丰度 Fig. 1 Abundances of main phytoplankton in original water |
添加N、P营养盐后,浮游植物总丰度均显著上升(图 2)。指数期,浮游植物总丰度为2.93×107~ 1.22×108 cells/L,以N2P1处理的丰度最高、N2P3的最低;在N1水平下,不同P浓度的浮游植物总丰度差异不大,而在N2、N3水平下,P1的总丰度显著高于P2,稍高于P3,表明N、P盐越高,浮游植物的生长越快。稳定期,浮游植物总丰度为3.33× 107~1.19×108 cells/L,N3P2处理的丰度最高,N2P2的最低,且大多组比指数期有明显上升,而N2P1、N2P2和N3P1总丰度降低,这可能是营养盐浓度较高促进浮游植物迅速生长,提前进入了衰亡期,导致丰度出现下降。Pearson相关分析表明,指数期、稳定期浮游植物总丰度与N/P比值的相关性不显著(P > 0.05)。
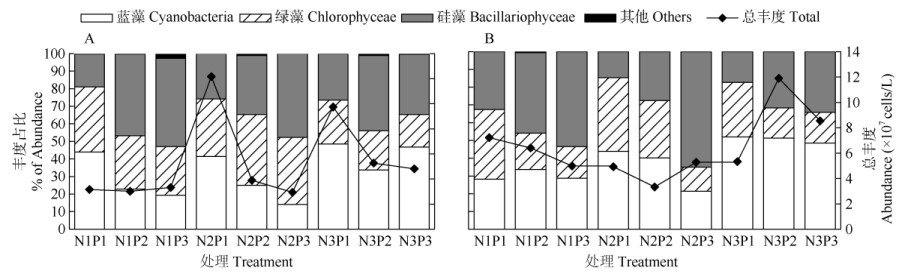
|
图 2 不同N/P处理对浮游植物丰度的影响。A:指数期; B:稳定期; N1P1~N3P3见表 1。下图同。 Fig. 2 Effect of N/P on phytoplankton abundance. A: Exponential phase; B: Stable phase. N1P1-N3P3 see Table 1. The same is following Figures. |
不同营养条件下,浮游植物丰度组成有明显差异(图 2)。指数期,在N1水平下,蓝、绿藻占比为P1 > P2 > P3,硅藻占比则相反,蓝、绿藻优势随P的增加更为明显;在N2水平下,蓝藻占比以P1 > P2 > P3,硅藻占比则相反,绿藻占比P2、P3均大于N1、N3水平下的P2、P3,表明相比于低、高N环境,中N水平下绿藻优势更大;在N3水平下, 绿藻占比以P1 > P2 > P3,硅藻占比以P2 > P3 > P1, 蓝藻占比均高于N1、N2水平的同P水平。稳定期, 相同N水平下绿藻占比均为P1 > P2 > P3,硅藻占比则相反,而蓝藻在N3水平下均高于N1、N2水平下的各处理,与指数期一样,表明蓝藻在高N条件下的优势,而绿藻在高P下占比更大。
不同时期的蓝藻、绿藻和硅藻丰度存在差异(图 3)。指数期时,同一N水平下,P1的蓝藻丰度明显高于P2、P3;同一P水平下,N3的蓝藻丰度高于N1、N2,但N2P1的丰度最高,这可能是误差造成的;同一N水平下,绿藻丰度以P1 > P2 > P3,同一P水平下,N2的绿藻丰度最高;N1水平下, 硅藻丰度以P3 > P2 > P1,在N2、N3水平下则相反。稳定期时,不同N/P下藻类的丰度变化与指数期有差异,进入衰亡期的时间不同。综合可知,蓝藻在高N、P下的优势更明显,而绿藻在中N高P下生长更好;N、P浓度的升高,均能促进硅藻的生长, 但优势上没有蓝、绿藻明显。
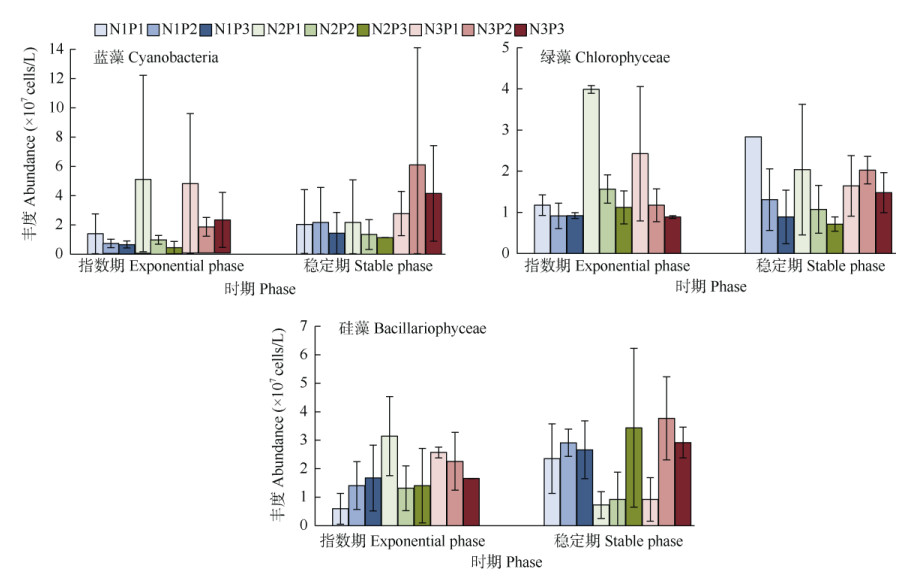
|
图 3 不同N/P处理下蓝藻、绿藻和硅藻的丰度变化 Fig. 3 Changes in abundances of Cyanobacteria, Chlorophyceae and Bacillariophyceae under different N/P treatments |
不同营养条件下浮游植物优势种不同(图 4)。指数期时,对照组优势种为小环藻,其次是微小四角藻(Teraëdron minimum)和锥囊藻(Dinobryon sp.);而处理组的优势种主要为曲壳藻、隐球藻和双对栅藻,在N1、N2水平下,曲壳藻占比以P3 > P2 > P1, 在P2、P3为第1优势种,而P1的隐球藻占比超过曲壳藻成为第1优势种,小环藻远不及曲壳藻,双对栅藻则在N2水平有一定优势;在N3水平,P1和P3的第1优势种分别为假鱼腥藻和隐球藻,而P2的第1优势种为曲壳藻,其次为镰形纤维藻(Ankistrodesmus falcatus)。稳定期时,对照组第1优势种为小环藻,其次为曲壳藻、锥囊藻;处理组的主要优势种为曲壳藻、假鱼腥藻和拟柱胞藻。曲壳藻占比与指数期相比有所上升,均呈P3 > P2 > P1,并以N2P3为最大,N1水平下曲壳藻均为第1优势种, 在N2P3、N3P3下为第1优势种;N2水平下P1和P2的第1优势种分别为拟柱胞藻、假鱼腥藻,N3水平下第1优势种主要为假鱼腥藻,占比大于曲壳藻。
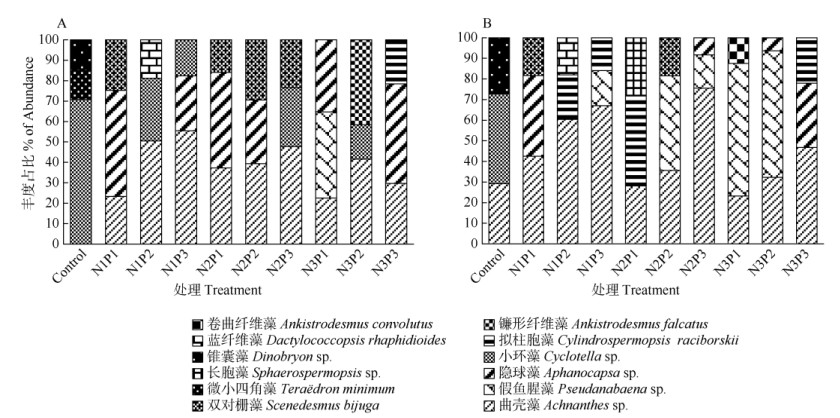
|
图 4 不同N/P处理下优势物种丰度的变化。A:指数期; B:稳定期。 Fig. 4 Changes in abundance of dominant species under different treatments. A: Exponential phase; B: Stable phase. |
原水中浮游植物在初始期具有较高的碱性磷酸酶活性(APA),为2.17 nmol/(min·mg),到指数期和稳定期显著上升,分别为32.42和146.38 nmol/(min·mg), 且显著高于同时期处理组。指数期时,同一N水平下,P1和P2的APA明显低于P3,也低于初始期;稳定期时,同一N水平下,P3的APA高于P1和P2,而同一P水平下,N1的APA低于N2和N3。方差分析表明,APA与P浓度和N/P有显著相关性(P < 0.05),指数期APA与N/P的正线性相关较差,线性方程为y=0.0355x+0.5372 (R2=0.348 8),稳定期两者的正线性相关极高,线性方程为y=0.3719x- 5.3566 (R2=0.890 1)(表 2)。
| 表 2 浮游植物的APA、细胞元素比值及与水体N/P的线性方程 Table 2 Linear equation between phytoplankton APA, cellular element ratio and water N/P ratio |
初始期,浮游植物藻细胞的N/P、C/N和C/P分别为45±4、5±1和256±36,指数期与稳定期的细胞元素比值发生了明显变化(表 3)。指数期,对照组藻细胞N/P和C/P均显著高于处理组,而藻细胞的C/N显著低于处理组;同一N水平下,藻细胞的N/P显示P3组 > P2组 > P1组,各处理间的差异显著(P < 0.05);藻细胞的C/P在P3显著大于P2和P1,且P1与P2的差异不显著(P > 0.05);同一P水平下,藻细胞C/N在N1显著大于N2和N3,N2与N3间差异不显著(P > 0.05)。对浮游植物藻细胞元素计量值与N/P比值进行线性拟合(表 2),表明指数期的藻细胞N/P、C/P和C/N与水体N/P比值相关性不明显。
| 表 3 浮游植物的APA活性和细胞元素比值 Table 3 Phytoplankton APA activity, cellular elemental stoichiometry |
稳定期,对照藻细胞N/P显著高于各处理组, 藻细胞C/N低于各处理组,而藻细胞C/P显著高于处理组中的所有P1、P2组,而低于P3组;同一N水平下,藻细胞N/P在P3组均显著大于P2、P1组, P1组与P2组差异不显著(P > 0.05);不同处理组之间的藻细胞C/N差异不显著,均值为10±1。稳定期浮游植物元素各比值与N/P拟合线性相关, 藻细胞N/P、C/P与N/P比值的正线性相关强,而藻细胞C/N与N/P比值不相关(R2=0.001 6)。
试验中藻细胞C/N为4~15,较C/P的变化范围小,在Redfield值(6.6)附近变化;藻细胞C/P在稳定期差异较大,与P处理浓度表现出线性相关。指数期藻细胞N/P为7.65~26.85,稳定期为7.37~ 37.83。细胞内元素的组成对不同N和P处理水平的响应不同, 藻细胞N/P、C/P均受P和N/P影响显著(P < 0.01),而藻细胞C/N受N处理影响更明显; 在指数期,N和P处理的绝对浓度仅对细胞内N和P含量有显著的影响(P < 0.01);在稳定期,N水平的绝对浓度对细胞元素含量没有显著影响,P处理的绝对浓度对细胞C、N和P的含量均有显著影响(P < 0.01)(表 4)。
| 表 4 ANOVA检验C/N、C/P和N/P与水体N、P和N/P的相关性 Table 4 ANOVA test on the relationship of C/N, C/P and N/P with water N, P and N/P ratio |
南亚热带水库大多数为贫中营养型水体。在枯水期(11月-次年3月),水体滞留时间短,水位波动较大,春季浮游植物群落中,以适应这种环境生长的硅藻占比最大[14]。本研究中水库水体以小环藻为优势藻,因为它们对P有较低半饱和浓度[15],更适应自然的P限制环境,其次是以微囊藻为主的蓝藻。野外转移到室内,环境条件的变化导致部分不适应的藻类生长迟缓或停止,因此浮游植物的总丰度表现为初期急剧降低,到后期适应环境后上升。
与原水相比,添加N、P盐显著促进浮游植物的生长。然而,浮游植物总丰度与N/P比值(12~103)不相关,而与N、P的浓度有关,这表明水体N/P并不是影响藻细胞生长的唯一因素,而是应该结合N、P的绝对浓度来综合考虑[27-28]。水体N/P比能够指示水体中营养盐的不平衡以及对单个或多个藻种的N限制或P限制,但并不能指示群落所需营养情况。由于不同优势种对N、P浓度变化的响应不一致,即可能导致某种物种急剧上升,而其他物种急剧下降,这种补偿机制会掩盖群落总体丰度的变化,因而群落丰度与水体N/P比的相关性不明显。除了N、P营养物质外,光照、水温以及其他营养元素(铁、硅等)[29]都可能影响到浮游植物的生长,成为浮游植物生长的限制因子。
浮游植物对营养盐的变化和N/P比的响应具有种属特异性。本试验条件下,浮游植物群落对P盐的响应程度要比N盐显著。高N条件下浮游植物的生长并没有显著优于对照,一方面可能是热带亚热带水库浮游植物已对野外N充裕、P限制的环境有一定适应,另一方面是不同浮游植物利用营养盐的方式存在差异[30], 对N、P浓度变化的响应程度不一致导致群落的总体响应有差异。无论在指数期或稳定期,蓝藻在高N (81.1 mol/L)或高P (3.3 mol/L)的营养条件下生长更好并占据优势。在稳定期时, 高N组中蓝藻占据第1优势,但其丰度并不随P浓度升高而增加,这表明相对于P盐,蓝藻受N盐的影响更大。绿藻随P浓度的升高丰度增加, 说明绿藻更喜好高P环境。另外,绿藻在N2浓度下的优势更大,与蓝藻喜好高N高P环境特性不同,绿藻更适合在中N高P的条件下生长。低P环境下硅藻相对有优势,高N低P的环境可以促进硅藻丰度增加,但在与蓝藻、绿藻的竞争的优势不明显,因而硅藻在N1浓度下占比更高。营养盐的比例主要通过影响物种间的竞争对浮游植物群落产生影响。因此,研究N/P比值对浮游植物的显著影响应固定在某一营养盐浓度下进行探讨更具有意义。
3.2 优势种对不同营养盐的响应水体中的N、P浓度及比值能显著影响水体中优势类群-硅藻的种类和丰度[30]。原水中硅藻门的小环藻属始终为第1优势种类,其次为金藻门的锥囊藻;指数期以微小四角藻为主的绿藻在磷酸盐的竞争中为次优势种,到了稳定期则被曲壳藻替代。小环藻优势随生长逐渐下降,而锥囊藻的优势升高。硅藻相对丰度的减少与其对硅酸盐的需求有关,此外,以锥囊藻为优势种的金藻大量生长也会消耗水体中的硅酸盐。与原水不同,同为硅藻优势种之一的曲壳藻是N、P处理的绝对优势种,可能是由于曲壳藻相比小环藻对水体硅的增加更为敏感[31],添加N、P能促进曲壳藻吸收水体中的硅酸盐用于自身生长, 但在高浓度下效果降低,因此低N低P条件下曲壳藻占据优势,这种优势在稳定期更为明显。
蓝藻优势种隐球藻在指数期高N高P下明显占据优势,在稳定期则被假鱼腥藻、拟柱胞藻替代。由于后期营养盐消耗降低,而假鱼腥藻和拟柱胞藻具有固氮特性[32-33],在环境无机氮不足时可以进行固氮,从而满足生长要求,同时,还能够储存P以适应后期低营养盐环境,这些机制使得其能超越隐球藻成为稳定期的优势种之一。双对栅藻作为绿藻门的主要优势种,在N浓度为62.3 µmol/L下有较好的生长优势,镰形纤维藻的适应范围较窄,仅在N浓度为81.1 µmol/L、P浓度为2.0 µmol/L时占据第1优势,到了稳定期更适应低营养盐环境的假鱼腥藻可以通过消耗储存在体内的P盐而继续生长; 双对栅藻、卷曲纤维藻等绿藻优势度较低,说明在营养盐相对降低的条件蓝藻更占优势,生长后期一些绿藻竞争不过蓝藻[32],这与周起超[34]的研究结果相似。
3.3 浮游植物的碱性磷酸酶活性藻类在P限制条件下产生APA将有机磷转化为无机磷,是利用P元素的重要途径[18]。初始期就检测到较高的APA,表明浮游植物已经产生AP来利用有机磷。指数期时,N、P处理的DIP充足, 当P盐高于2.0 µmol/L时的APA降低,这是因为正磷酸盐抑制了AP的活性,这与APA特殊的抑制-诱导机制相关[18, 23, 35]。进入稳定期后,浮游植物数量增加,培养液中的磷酸盐被大量吸收,低P环境促进酶活性显著增强。DIP诱导激发APA需要达到一个阈值,其浓度高于某一界限时影响不显著[23]。P浓度≤0.8 µmol/L时,APA活性较高,P浓度≥2.0 µmol/L时APA活性差异不显著,因此可以推测该水体中浮游植物APA的P浓度阈值可能为0.8~ 2.0 µmol/L,即2.0 µmol/L时抑制酶活性。这与高光等[35]的研究结果类似。
3.4 浮游植物细胞的元素化学计量比南亚热带地区的水库营养盐普遍低于其他地区,这是由热带-亚热带红壤中营养盐组成的特点所决定的[20]。本研究中水库春季水体的N/P比为111,原水浮游植物细胞的元素化学计量N/P为45±5, 与水体的N/P并不一致。从野外转入室内培养后, 原水浮游植物细胞的N/P、C/P先上升后降低至与初始值相近,表明浮游植物细胞的元素组成在一定范围内具有可塑性。环境与有机体间的化学元素计量比存在复杂的关系[17]。当环境元素组成发生改变时,浮游植物为适应环境的变化,能够调节自身营养盐的需求和生长速率,从而改变自身的元素比值[2, 3]。本研究表明,浮游植物藻细胞的N/P、C/P受不同P浓度影响显著,而C/N受N影响较显著,当P浓度为2.0 µmol/L时,浮游植物细胞的化学元素计量比均接近于Redfield比值,因此2.0 µmol/L可能是浮游植物生长的最适P浓度。藻细胞N/P与不同处理组的关系显示该水库中浮游植物群落细胞为弱内稳态,藻细胞N/P随着处理的不同而变化。高P条件(≥2.0 µmol/L)下浮游植物细胞N/P比值随生长不再改变,表明浮游藻类的元素组成在一定的范围内与环境的养分供应保持一种相对稳定的平衡状态[36]。
藻细胞的N/P、C/P、C/N比值在稳定期高于指数期,可以归因于藻细胞C、N、P含量随藻类的生长而变化。根据生长速率假说,生长快速的有机体通常具有较低的N/P比,这是由于含P丰富的rRNA的增加,此时细胞需要大量的核糖体来快速合成蛋白质以支持有机体快速生长[16-17]。在生长速率较高的指数期,浮游植物吸收营养盐,其细胞内N、P含量增加,有机物不断积累,元素比值降低;到了培养后期营养盐不足,浮游植物开始消耗自身P盐以维持生长,同时积累更多的有机物,藻内P含量下降、N含量上升,浮游植物各元素计量比相应升高。水体N/P比与浮游植物细胞元素化学计量比的关系研究中,Bi等[37]认为,藻细胞的N/P比与水体N/P比呈显著正相关,但当藻的生长速率较高时,藻的N/P比与水体N/P比的关系不大,这与本研究结果相似,并且藻细胞的C/P与水体N/P比也有类似情况。另外,不同种类藻细胞的元素组成存在差异,对各类营养物质的需求不尽相同[2-3],但本试验仅探讨了浮游植物群落整体化学计量比的变化。
综上所述,N、P添加显著地促进了浮游植物的生长,浮游植物群落受P盐的影响要显著大于N盐;隐球藻、拟柱胞藻以及假鱼腥藻等蓝藻适合在高氮高磷条件下生长,而双对栅藻等绿藻优势种偏好于中氮高磷,而曲壳藻、小环藻等硅藻优势种更能适应低氮低磷的环境下生长;由于不同藻类对氮、磷盐响应情况不一致,浮游植物总体(丰度)与氮/磷比值变化不相关。P浓度为0.8~2.0 µmol/L时存在诱导激发浮游植物APA活性的阈值。2.0 µmol/L的P可能是该水库浮游植物生长的最适P浓度, 浮游植物元素计量比值均接近于Redfield值。藻细胞的N/P、C/P与水体P浓度、N/P比值呈显著正相关,而藻细胞的C/N受N浓度影响更明显。
| [1] |
REDFIELD A C. The biological control of chemical factors in the environment[J]. Amer Sci, 1958, 46(3): 205-221. DOI:10.1086/646891 |
| [2] |
MÉNDEZ M, KARLSSON P S. Nutrient stoichiometry in Pinguicula vulgaris:Nutrient availability, plant size, and reproductive status[J]. Ecology, 2005, 86(4): 982-991. DOI:10.1890/04-0354 |
| [3] |
GIORDANO M, PALMUCCI M, RAVEN J A. Growth rate hypothesis and efficiency of protein synthesis under different sulphate concen-trations in two green algae[J]. Plant Cell Environ, 2015, 38(11): 2313-2317. DOI:10.1111/pce.12551 |
| [4] |
SONG Y Z, QIN B Q, GAO G. Effect of nutrient on periphytic algae and phytoplankton[J]. J Lake Sci, 2007, 19(2): 125-130. 宋玉芝, 秦伯强, 高光. 氮及氮磷比对附着藻类及浮游藻类的影响[J]. 湖泊科学, 2007, 19(2): 125-130. DOI:10.18307/2007.0203 |
| [5] |
STOCKNER J G, SHORTREED K S. Response of Anabaena and Synechococcus to manipulation of nitrogen:Phosphorus ratios in a lake fertilization experiment[J]. Limnol Oceanogr, 1988, 33(6): 1348-1361. DOI:10.4319/lo.1988.33.6.1348 |
| [6] |
WANG J, QIU L P, FENG S L, et al. Effect of nitrogen and phosphorus ratios on growth and competition of Anabaena sp. and Chlorella vulgaris[J]. Jiangsu Agric Sci, 2014, 42(5): 316-320. 王菁, 裘丽萍, 孟顺龙, 等. 氮磷比对鱼腥藻和普通小球藻生长竞争的影响[J]. 江苏农业科学, 2014, 42(5): 316-320. DOI:10.15889/j.issn.1002-1302.2014.05.034 |
| [7] |
FENG S L, QIU L P, HU G D, et al. Effect of nitrogen and phosphorus ratios on growth and competition of two blue-green algae[J]. J Agro Environ Sci, 2012, 31(7): 1438-1444. 孟顺龙, 裘丽萍, 胡庚东, 等. 氮磷比对两种蓝藻生长及竞争的影响[J]. 农业环境科学学报, 2012, 31(7): 1438-1444. |
| [8] |
ZHU X Y, HUANG W, ZENG J N, et al. Effects of nitrogen and phosphorus ratios on phytoplankton community structure in winter[J]. Chin J Appl Environ Biol, 2013, 19(2): 293-299. 朱旭宇, 黄伟, 曾江宁, 等. 氮磷比对冬季浮游植物群落结构的影响[J]. 应用与环境生物学报, 2013, 19(2): 293-299. DOI:10.3724/SP.J.1145.2013.00293 |
| [9] |
XU H, ZHU G W, QIN B Q, et al. Influence of nitrogen-phosphorus ratio on dominance of bloom-forming cyanobacteria (Microcystis aeru-ginosa)[J]. Chin Environ Sci, 2011, 31(10): 1676-1683. 许海, 朱广伟, 秦伯强, 等. 氮磷比对水华蓝藻优势形成的影响[J]. 中国环境科学, 2011, 31(10): 1676-1683. DOI:10.1080/00405000.2010.522047 |
| [10] |
TRIMBEE A M, PREPAS E E. Evaluation of total phosphorus as a predictor of the relative biomass of blue-green algae with emphasis on Alberta lakes[J]. Can J Fish Aquat Sci, 1987, 44(7): 1337-1342. DOI:10.1139/f87-158 |
| [11] |
TILMAN D, KILHAM S S, KILHAM P. Phytoplankton community ecology:The role of limiting nutrients[J]. Ann Rev Ecol Syst, 1982, 13(1): 349-372. DOI:10.1146/annurev.es.13.110182.002025 |
| [12] |
HAN B P. Reservoir ecology and limnology in China:A retrospective comment[J]. J Lake Sci, 2010, 22(2): 151-160. 韩博平. 中国水库生态学研究的回顾与展望[J]. 湖泊科学, 2010, 22(2): 151-160. DOI:10.18307/2010.0201 |
| [13] |
LI Q H, HAN B P. Dynamics and structure of phytoplankton community in spring in a southern subtropical pumped-water reservoir[J]. J Trop Subtrop Bot, 2007, 15(4): 294-300. 李秋华, 韩博平. 南亚热带调水水库春季浮游植物群落的结构与动态[J]. 热带亚热带植物学报, 2007, 15(4): 294-300. DOI:10.3969/j.issn.1005-3395.2007.04.004 |
| [14] |
HU R, LIN Q Q, WANG Z H, et al. Phytoplankton composition and distribution in typical reservoirs of Guangdong Province[J]. Acta Ecol Sin, 2002, 22(11): 1939-1944. 胡韧, 林秋奇, 王朝晖, 等. 广东省典型水库浮游植物组成与分布特征[J]. 生态学报, 2002, 22(11): 1939-1944. DOI:10.3321/j.issn:1000-0933.2002.11.020 |
| [15] |
HU R, LIN Q Q, DUAN S S, et al. Distribution of chlorophyll-a and phosphorus in subtropical reservoirs, south China[J]. Ecol Sci, 2002, 21(4): 310-315. 胡韧, 林秋奇, 段舜山, 等. 热带亚热带水库浮游植物叶绿素a与磷分布的特征[J]. 生态科学, 2002, 21(4): 310-315. DOI:10.3969/j.issn.1008-8873.2002.04.006 |
| [16] |
ELSER J J, ACHARYA K, KYLE M, et al. Growth rate-stoichiometry couplings in diverse biota[J]. Ecol Lett, 2003, 6(10): 936-943. DOI:10.1046/j.1461-0248.2003.00518.x |
| [17] |
ZENG D H, CHEN G S. Ecological stoichiometry:A science to explore the complexity of living systems[J]. Acta Phytoecol Sin, 2005, 29(6): 1007-1019. 曾德慧, 陈广生. 生态化学计量学:复杂生命系统奥秘的探索[J]. 植物生态学报, 2005, 29(6): 1007-1019. DOI:10.17521/cjpe.2005.0120 |
| [18] |
ZHANG S H, CHANG J J, SUN P S. Phosphorus cycle of algae during its growth and death process:phosphorus uptake and release[J]. Ecol Environ Sci, 2013, 22(7): 1250-1254. 张胜花, 常军军, 孙珮石. 水体藻类磷代谢及藻体磷矿化研究进展[J]. 生态环境学报, 2013, 22(7): 1250-1254. DOI:10.3969/j.issn.1674-5906.2013.07.027 |
| [19] |
ISTVÁNOVICS V, SHAFIK H M, PRÉSING M, et al. Growth and phosphate uptake kinetics of the cyanobacterium, Cylindrospermopsis raciborskii (Cyanophyceae) in throughflow cultures[J]. Freshwater Biol, 2000, 43(2): 257-275. DOI:10.1046/j.1365-2427.2000.00549.x |
| [20] |
LIN G E, WANG T, LIN Q Q, et al. Spatial pattern and temporal dynamics of limnological variables in Liuxihe Reservoir, Guangdong[J]. J Lake Sci, 2009, 21(3): 387-394. 林国恩, 望甜, 林秋奇, 等. 广东流溪河水库湖沼学变量的时空动态特征[J]. 湖泊科学, 2009, 21(3): 387-394. DOI:10.3321/j.issn:1003-5427.2009.03.012 |
| [21] |
GUILLARD R R L, LORENZEN C J. Yellow-green algae with chlorophyllide C[J]. J Phycol, 1972, 8(1): 10-14. DOI:10.1111/j.1529-8817.1972.tb03995.x |
| [22] |
HONG H S, DAI M H, ZHENG X C. Measurement of alkaline phosphatase activity in seawater substrates and investigation on the role of alkaline phosphatase in the cycling of phosphorus[J]. Oceanol Limnol Sin, 1992, 23(4): 415-420. 洪华生, 戴民汉, 郑效成. 海水中碱性磷酸酶活力的测定及其在磷的循环中的作用初探[J]. 海洋与湖沼, 1992, 23(4): 415-420. |
| [23] |
ZHOU Y Y, FU Y Q. Phosphatases in natural water:Origin, charac-teristics and ecological significance[J]. J Lake Sci, 1999, 11(3): 274-282. 周易勇, 付永清. 水体磷酸酶:来源、特征及其生态学意义[J]. 湖泊科学, 1999, 11(3): 274-282. DOI:10.18307/1999.0313 |
| [24] |
NIU H Y, XIAO L J, HAN B P. Data quality analysis of phytoplankton counted with the inverted microscopy-based method[J]. J Lake Sci, 2016, 28(1): 141-148. 牛海玉, 肖利娟, 韩博平. 采用倒置显微镜法定量浮游植物的数据稳定性[J]. 湖泊科学, 2016, 28(1): 141-148. DOI:10.18307/2016.0116 |
| [25] |
HU H J, WEI Y X. The Freshwater Algae of China:Systematics, Taxonomy and Ecology[M]. Beijing: Science Press, 2006: 1-1051. 胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态[M]. 北京: 科学出版社, 2006: 1-1051. |
| [26] |
CHEN C, LI S J, HU R, et al. Comparative analysis of four methods for calculating biomass of phytoplankton community[J]. J Lake Sci, 2013, 25(6): 927-935. 陈纯, 李思嘉, 胡韧, 等. 四种浮游植物生物量计算方法的比较分析[J]. 湖泊科学, 2013, 25(6): 927-935. DOI:10.18307/2013.0617 |
| [27] |
LI J P, WU L B, DAI Y K, et al. Effects of different nitrogen-phosphorus ratio on the freshwater phytoplankton growth and the variations of environmental factors[J]. Ecol Environ, 2007, 16(2): 342-346. 李建平, 吴立波, 戴永康, 等. 不同氮磷比对淡水藻类生长的影响及水环境因子的变化[J]. 生态环境, 2007, 16(2): 342-346. DOI:10.3969/j.issn.1674-5906.2007.02.015 |
| [28] |
FENG M W, WU Y H, FENG S X, et al. Effect of different N/P ratios on algal growth[J]. Ecol Environ, 2008, 17(5): 1759-1763. 丰茂武, 吴云海, 冯仕训, 等. 不同氮磷比对藻类生长的影响[J]. 生态环境, 2008, 17(5): 1759-1763. DOI:10.16258/j.cnki.1674-5906.2008.05.007 |
| [29] |
YANG D F, CHEN S T, HU J, et al. Magnitude order of the effect of light, water temperature and nutrients on phytoplankton growth[J]. Marine Environ Sci, 2007, 26(3): 201-207. 杨东方, 陈生涛, 胡均, 等. 光照、水温和营养盐对浮游植物生长重要影响大小的顺序[J]. 海洋环境科学, 2007, 26(3): 201-207. DOI:10.3969/j.issn.1007-6336.2007.03.001 |
| [30] |
KILHAM P, HECKY R E. Comparative ecology of marine and fresh-water phytoplankton[J]. Limnol Oceanogr, 1988, 33(4): 776-795. DOI:10.4319/lo.1988.33.4part2.0776 |
| [31] |
ZHU G W, JIN Y W, REN J, et al. Characteristics of diatom blooms in a reservoir-water supply area and the countermeasures in Taihu Basin, China[J]. J Lake Sci, 2016, 28(1): 9-21. 朱广伟, 金颖薇, 任杰, 等. 太湖流域水库型水源地硅藻水华发生特征及对策分析[J]. 湖泊科学, 2016, 28(1): 9-21. DOI:10.18307/2016.0102 |
| [32] |
JIANG Q M, HOU W, GU J G, et al. Nutritional status and population characteristics of cyanobacteria in small and medium sized reservoirs in Guangzhou, southern China[J]. Ecol Environ Sci, 2010, 19(10): 2461-2467. 江启明, 侯伟, 顾继光, 等. 广州市典型中小型水库营养状态与蓝藻种群特征[J]. 生态环境学报, 2010, 19(10): 2461-2467. DOI:10.3969/j.issn.1674-5906.2010.10.035 |
| [33] |
DAI J J, PENG L, YU T, et al. The effects of phosphorus and nitrogen on the growth of Cylindrospermopsis raciborskii N8 isolated from the Zhenhai Reservoir[J]. Acta Hydrobiol Sin, 2015, 39(3): 533-539. 戴景峻, 彭亮, 于婷, 等. 镇海水库拟柱孢藻的分离鉴定和氮磷对其生长的影响[J]. 水生生物学报, 2015, 39(3): 533-539. DOI:10.7541/2015.70 |
| [34] |
ZHOU Q C, XIONG Q, LI L, et al. The physio-ecological charac-teristics of algae treated with low temperature and light intensity under different light intensity, nitrogen and phosphorus concentrations[J]. J Lake Sci, 2015, 27(6): 1059-1066. 周起超, 熊倩, 李林, 等. 经低温、低光处理的藻类在不同光强、氮磷浓度下的生理生态特征[J]. 湖泊科学, 2015, 27(6): 1059-1066. DOI:10.18307/2015.0610 |
| [35] |
GAO G, GAO X Y, QIN B Q, et al. Experimental study on the PO43- threshold of the alkaline phosphatase activity in Taihu Lake[J]. J Lake Sci, 2000, 12(4): 353-358. 高光, 高锡芸, 秦伯强, 等. 太湖水体中碱性磷酸酶的作用阈值[J]. 湖泊科学, 2000, 12(4): 353-358. DOI:10.18307/2000.0409 |
| [36] |
STERNER R W, ELSER J J, HESSEN D O. Stoichiometric relation-ships among producers, consumers and nutrient cycling in pelagic eco-systems[J]. Biogeochem, 1992, 17(1): 49-67. DOI:10.1007/BF00002759 |
| [37] |
BI R, ARNDT C, SOMMER U. Stoichiometric responses of phyto-plankton species to the interactive effect of nutrient supply ratios and growth rates[J]. J Phycol, 2012, 48(3): 539-549. DOI:10.1111/j.1529-8817.2012.01163.x |
 2021, Vol. 29
2021, Vol. 29


