2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
杨桃(Averrhoa carambola)为酢浆草科(Oxali- daceae)杨桃属植物,原产马来西亚和印度尼西亚, 我国广东、海南、广西、福建、台湾、云南有栽培, 其果实是一种常见水果[1]。据《中华本草》记载, 杨桃果实、花、叶和根均可入药,其中叶味涩、苦, 性寒;有祛风利湿,清热解毒,止痛功效,主治风热感冒,小便不利,产后浮肿,痈疽肿毒,漆疮, 跌打肿痛[2]。研究表明,杨桃叶有体内抗高血脂[3]、抗氧化[3]、降血糖[4]、降血压[5]和抗炎[6]等药理作用,从中分离得到的芹菜素6-C-β-D-岩藻糖苷和芹菜素6-C-(2-O-α-L-鼠李糖基)-β-D-岩藻糖苷能显著降低高血糖大鼠的血糖水平和提高大鼠比目鱼肌和肝糖原含量,表现出降血糖活性[7]。此外,从杨桃叶中还报道了异牡荆素、2''-O-L-鼠李糖基异牡荆素和β-谷甾醇[8-9]。杨桃叶具有多种药理作用,且化学成分的报道少,故我们对其成分进行了研究。前期报道了12个二氢查耳酮岩藻糖碳苷类、5个黄烷-3-醇类和2个邻羟基苯甲酸酯类化合物的结构及其抗氧化、α-葡萄糖苷酶和胰脂肪酶抑制活性[10-11]。本文报道5个芳基糖苷类、3个麦芽酚类、2个烷基糖苷类和1个三萜类化合物。
1 材料和方法 1.1 材料试验材料于2018年8月采自广州市海珠区小洲村某果园(23°37'55'' N, 113°33'7'' E),经中国科学院华南植物园叶华谷研究员鉴定为酢浆草科植物杨桃(Averrhoa carambola)的叶,样品凭证(AcL1808)存放于植物化学实验室。
青岛谱科分离材料公司柱层析硅胶(100~200目);瑞典Amersham Biosciences公司葡聚糖凝胶Sephadex LH-20;烟台江友硅胶开发试验厂薄层硅胶层析板(HSGF254)。
1.2 仪器和试剂日本岛津公司LC-20A高效液相色谱仪和SPD- M20A PDA检测器;北京创新通恒科技有限公司LC3000中压液相色谱和UV3000 UV-VIS检测器; 日本东京理化公司N-1100旋转蒸发仪;美国应用生物系统公司MDS SCIEX API 2000 LC-MS/MS质谱仪测电喷雾质谱(ESI-MS);瑞士布鲁克公司Bruker DRX-500 MHz超导核磁共振谱仪;青岛腾龙微波科技有限公司氘代甲醇(CD3OD)和氘代氯仿(CDCl3),化学位移值(δ, ppm)以溶剂峰为参照。
广州东巨化工公司食品级乙醇(提取用);天津富宇精细化工公司分析纯氯仿、甲醇、石油醚、正丁醇和丙酮;上海安谱公司色谱纯甲醇。
1.3 提取和分离杨桃鲜叶晾干后粉碎。取粉末15.45 kg,分别用60和45 L的90%乙醇浸提2次,再用50%乙醇(45 L)浸提1次,每次2 d。合并提取液,减压浓缩至15.6 L,倒入分液漏斗,用氯仿萃取3次,每次10.4 L,合并萃取液,减压浓缩至干,得氯仿萃取物820 g。水液用正丁醇萃取4次,每次10.4 L, 合并萃取液,减压浓缩至干,得正丁醇萃取物1 050 g。
取氯仿萃取物815 g,用适量氯仿-甲醇溶解, 加790 g硅胶拌匀,减压浓缩至干,研磨,过40目筛。将3 250 g硅胶用石油醚搅拌,装入层析柱(内径11.8 cm)中,敲实,加入样品,硅胶层(含样品)高101 cm,体积11.0 L。以石油醚-丙酮(10:0~2:8, V/V, 下同)洗脱,收集流份,每份1 L,经薄层色谱分析,合并为组分C1~C13。C1 (8.0 g)经硅胶柱层析,以石油醚-丙酮(1:0~7:3)洗脱,得化合物11 (9.0 mg)。取正丁醇萃取物1 045 g,用适量甲醇溶解,加1 340 g硅胶拌匀,减压浓缩至干,研磨, 过40目筛。将2 800 g硅胶用氯仿搅拌,装入层析柱(内径11.8 cm)中,加入样品,硅胶层高105 cm,体积11.5 L。以氯仿-甲醇(98:2~50:50)洗脱,收集流份,每份1 L,经薄层色谱分析,合并为组分F1~ F10。F3 (6.0 g)经硅胶柱层析,以氯仿-甲醇(1:0~ 0:1)洗脱,合并为亚组分F3-1~F3-7。F3-6经葡聚糖凝胶柱色谱分离,甲醇洗脱,合并为F3-6-1~F3- 6-5。F3-6-4经HPLC纯化,以甲醇-水(15:85)为流动相,流速7 mL/min, 得化合物6 (保留时间tR= 30 min, 1.6 mg)。F4 (18.0 g)经中压液相色谱分离, 以甲醇-水(2:8~10:0)洗脱,合并为亚组分F4-1~F4- 15。F4-5经葡聚糖凝胶柱色谱分离,甲醇洗脱,合并为F4-5-1~F4-5-4。F4-5-1经HPLC纯化,以甲醇-水(43:57)为流动相, 流速7 mL/min,得化合物8 (tR= 104 min, 4.0 mg)。F6 (20.7 g)经中压液相色谱分离, 以甲醇-水(2:8~10:0)洗脱,合并为亚组分F6-1~ F6-21。F6-1经葡聚糖凝胶柱色谱分离,甲醇洗脱,合并为F6-1-1~F6-1-5。F6-1-1经HPLC纯化,以甲醇-水(5:95)为流动相,流速7 mL/min, 得化合物7 (tR=32 min, 9.0 mg)和9 (tR=13 min, 20.2 mg)。F6-4经葡聚糖凝胶柱色谱分离,甲醇洗脱,合并为F6-4-1~F6-4-4。F6-4-1经HPLC纯化,以甲醇-水(1:9)为流动相,流速7 mL/min,得化合物10 (tR= 51 min, 7.0 mg)。F6-4-2经HPLC纯化,以甲醇-水(1:9)为流动相,流速7 mL/min,得化合物5 (tR= 24 min, 5.2 mg)。F6-5经葡聚糖凝胶柱色谱分离, 甲醇洗脱, 合并为F6-5-1~F6-5-5。F6-5-2经HPLC纯化,以甲醇-水(15:85)为流动相,流速7 mL/min,得化合物2 (tR=27 min, 11.7 mg)。F6-5-3经HPLC纯化,以甲醇-水(2:8)为流动相,流速7 mL/min, 得化合物1 (tR=32 min, 1.2 mg)。F6-6经葡聚糖凝胶柱色谱分离, 以甲醇洗脱,合并为F6-6-1~F6-6- 4。F6-6-3经HPLC纯化,以甲醇-水(2:8)为流动相, 流速7 mL/min, 得化合物3 (tR=51 min, 20.0 mg)。F8 (115.5 g)经硅胶柱层析,以氯仿-甲醇(1:0~0:1)洗脱, 合并为亚组分F8-1~F8-8。F8-7经中压液相色谱分离,甲醇-水(2:8~10:0)洗脱,合并为F8-7-1~F8-7-13。F8-7-5经葡聚糖凝胶柱色谱分离,甲醇洗脱, 主流份经HPLC纯化,以甲醇-水(27:73)为流动相, 流速7 mL/min, 得化合物4 (tR=95 min, 42.0 mg)(图 1)。
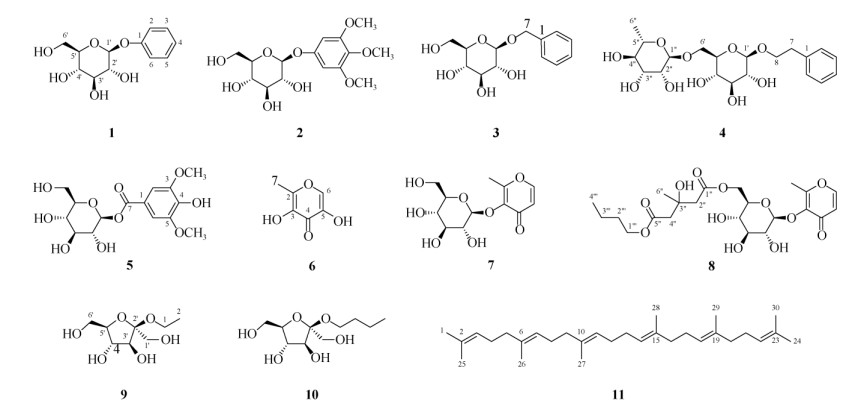
|
图 1 化合物1~11的结构 Fig. 1 Structures of compounds 1-11 |
化合物1 白色粉末;ESI-MS m/z: 279 [M + Na]+, 255 [M − H]−, 分子式C12H16O6; 1H NMR (500 MHz, CD3OD): δ 7.28 (2H, tt, J = 7.4, 1.1 Hz, H-3, 5), 7.09 (2H, dt, J = 7.4, 1.1 Hz, H-2, 6), 7.00 (1H, tt, J = 7.4, 1.1 Hz, H-4), 4.90 (1H, d, J = 7.7 Hz, H-1'), 3.89 (1H, dd, J = 12.0, 2.2 Hz, H-6'), 3.70 (1H, dd, J = 12.0, 5.4 Hz, H-6'); 13C NMR (125 MHz, CD3OD): δ 159.2 (C-1), 117.7 (C-2, 6), 130.4 (C-3, 5), 123.3 (C- 4), 102.3 (C-1'), 74.9 (C-2'), 78.0 (C-3'), 71.4 (C-4'), 78.1 (C-5'), 62.5 (C-6')。上述数据与文献[12]报道的一致,故鉴定为苯基β-D-葡萄糖苷。
化合物2 白色粉末;ESI-MS m/z: 345 [M − H]−, 381 [M + Cl]−, 分子式C15H22O9; 1H NMR (500 MHz, CD3OD): δ 6.49 (2H, s, H-2, 6), 4.81 (1H, d, J = 7.4 Hz, H-1'), 3.92 (1H, dd, J = 12.2, 2.1 Hz, H- 6'), 3.81 (6H, s, 3, 5-OCH3), 3.70 (3H, s, 4-OCH3), 3.66 (1H, dd, J = 12.2, 6.5 Hz, H-6'); 13C NMR (125 MHz, CD3OD): δ 156.0 (C-1), 96.1 (C-2, 6), 154.8 (C-3, 5), 134.4 (C-4), 56.5 (3, 5-OCH3), 61.2 (4-OCH3), 103.2 (C-1'), 74.9 (C-2'), 78.1 (C-3'), 71.7 (C-4'), 78.4 (C-5'), 62.7 (C-6')。上述数据与文献[13]报道的一致,故鉴定为3, 4, 5-三甲氧基苯基β-D-葡萄糖苷。
化合物3 白色粉末;ESI-MS m/z: 293 [M + Na]+, 269 [M − H]−, 305 [M + Cl]−, 分子式C13H18O6; 1H NMR (500 MHz, CD3OD): δ 7.42 (2H, br d, J = 7.1 Hz, H-2, 6), 7.32 (2H, br t, J = 7.1 Hz, H-3, 5), 7.27 (1H, br t, J = 7.1 Hz, H-4), 4.93 (1H, d, J = 11.8 Hz, H-7), 4.67 (1H, d, J = 11.8 Hz, H-7), 4.36 (1H, d, J = 7.8 Hz, H-1'), 3.90 (1H, dd, J = 12.0, 2.1 Hz, H-6'), 3.69 (1H, d, J = 12.0, 5.6 Hz, H-6'); 13C NMR (125 MHz, CD3OD): δ 139.1 (C-1), 129.3 (C-2, 6), 129.2 (C-3, 5), 128.7 (C-4), 71.7 (C-7), 103.3 (C-1'), 75.1 (C-2'), 78.0 (C-3'), 71.7 (C-4'), 78.1 (C-5'), 62.8 (C-6')。上述数据与文献[14]报道的一致,故鉴定为苄基β-D-葡萄糖苷。
化合物4 白色粉末;ESI-MS m/z: 453 [M + Na]+, 429 [M − H]−, 465 [M + Cl]−, 分子式C20H30O10; 1H NMR (500 MHz, CD3OD): δ 7.26 (4H, m, H-2, 3, 5, 6), 7.17 (1H, m, H-4), 4.76 (1H, d, J = 1.6 Hz, H-1''), 4.29 (1H, d, J = 7.8 Hz, H-1'), 4.03 (1H, ddd, J = 9.8, 7.9, 6.7 Hz, H-8), 3.98 (1H, dd, J = 11.2, 1.9 Hz, H-6'), 3.76 (1H, ddd, J = 9.8, 7.9, 6.7 Hz, H-8), 3.62 (1H, d, J = 11.2, 6.1 Hz, H-6'), 2.94 (2H, ddd, J = 7.9, 6.7, 3.2 Hz, H2-7), 1.26 (3H, d, J = 6.3 Hz, H3-6''); 13C NMR (125 MHz, CD3OD): δ 139.9 (C-1), 130.0 (C-2, 6), 129.3 (C-3, 5), 127.2 (C-4), 37.2 (C-7), 71.8 (C-8), 104.4 (C-1'), 75.0 (C-2'), 78.0 (C-3'), 71.6 (C- 4'), 76.8 (C-5'), 68.1 (C-6'), 102.2 (C-1''), 72.1 (C- 2''), 72.3 (C-3''), 74.0 (C-4''), 69.8 (C-5''), 18.0 (C- 6'')。上述数据与文献[15]报道的一致,故鉴定为2-苯乙基芸香糖苷。
化合物5 白色粉末;ESI-MS m/z: 383 [M + Na]+, 359 [M − H]−, 分子式C15H20O10; 1H NMR (500 MHz, CD3OD): δ 7.40 (2H, s, H-2, 6), 5.70 (1H, d, J = 7.8 Hz, H-1'), 3.90 (6H, s, 3, 5-OCH3), 3.86 (1H, dd, J = 12.2, 2.0 Hz, H-6'), 3.71 (1H, dd, J = 12.2, 4.8 Hz, H-6'); 13C NMR (125 MHz, CD3OD): δ 120.6 (C-1), 108.6 (C-2, 6), 148.9 (C-3, 5), 142.5 (C-4), 166.7 (C- 7), 96.2 (C-1'), 74.0 (C-2'), 78.1 (C-3'), 71.1 (C-4'), 78.9 (C-5'), 62.3 (C-6')。上述数据与文献[16]报道的一致,故鉴定为1-O-(3, 5-二甲氧基-4-羟基苯甲酰基)-β-D-葡萄糖。
化合物6 白色粉末;ESI-MS m/z: 143 [M + H]+, 165 [M + Na]+, 分子式C6H6O4; 1H NMR (500 MHz, CD3OD): δ 7.85 (1H, s, H-6), 2.32 (3H, s, H3-7); 13C NMR (125 MHz, CD3OD): δ 140.4 (C-2), 151.8 (C-3), 170.3 (C-4), 142.9 (C-5), 145.8 (C-6), 14.5 (C-7)。上述数据与文献[17]报道的一致,故鉴定为5-羟基麦芽酚。
化合物7 白色粉末;ESI-MS m/z: 287 [M − H]−, 323 [M + Cl]−, 分子式C12H16O8; 1H NMR (500 MHz, CD3OD): δ 8.01 (1H, d, J = 5.6 Hz, H-6), 6.45 (1H, d, J = 5.6 Hz, H-5), 4.81 (1H, d, J = 7.4 Hz, H- 1'), 3.83 (1H, dd, J = 12.0, 2.3 Hz, H-6'), 3.67 (1H, dd, J = 12.0, 5.4 Hz, H-6'), 2.47 (3H, s, H3-7); 13C NMR (125 MHz, CD3OD): δ 164.6 (C-2), 143.6 (C-3), 177.2 (C-4), 117.3 (C-5), 157.1 (C-6), 15.8 (C-7), 105.4 (C-1'), 75.4 (C-2'), 78.0 (C-3'), 71.1 (C-4'), 78.5 (C-5'), 62.5 (C-6')。上述数据与文献[18]报道的一致,故鉴定为麦芽酚苷。
化合物8 白色粉末;ESI-MS m/z: 511 [M + Na]+, 527 [M + K]+, 523 [M + Cl]−,分子式C22H32O12; 核磁共振氢谱和碳谱显示出1个麦芽酚苷(7)、1个3-羟基-3-甲基谷氨酰基(C-1'', 3'', 5''和CH2-2'', 4'')[19]和1个正丁醇基(CH2-1'''~3'''和CH3-4''')[20]的信号(表 1)。与麦芽酚苷(7)的碳谱数据比较,葡萄糖基6位碳(C-6')的δ值向低场位移了1.8 ppm,表明3-羟基-3-甲基谷氨酰基连接在C-6',形成化合物licoa- groside B[19]。此外,比较化合物8与licoagroside B[20]的碳谱数据发现,两者的明显差别在C-5''和C-4'', 分别为−2.0和+0.3 ppm,其它碳δ值的差别不超过0.1 ppm, 故推断正丁醇基连接在C-5'',即麦芽酚3-O-[6-O-(3-羟基-3-甲基-5-丁基戊二酰基)]-β-D-葡萄糖苷,是licoagroside B与正丁醇在加热浓缩时脱水形成的酯化物。
| 表 1 化合物8的核磁共振氢谱和碳谱数据(CD3OD) Table 1 1H and 13C NMR data of compound 8 in CD3OD |
化合物9 白色粉末;ESI-MS m/z: 231 [M + Na]+, 207 [M − H]−, 分子式C8H16O6; 1H NMR (500 MHz, CD3OD): δ 4.10 (1H, d, J = 8.1 Hz, H-3'), 3.95 (1H, t, J = 7.7 Hz, H-4'), 3.66 (1H, d, J = 11.8 Hz, H-6'), 3.56 (1H, d, J = 11.8 Hz, H-6'), 1.15 (3H, t, J = 7.1 Hz, H3-2); 13C NMR (125 MHz, CD3OD): δ 57.8 (C-1), 16.0 (C-2), 64.9 (C-1'), 105.3 (C-2'), 78.4 (C-3'), 77.3 (C-4'), 83.4 (C-5'), 61.9 (C-6')。上述数据与文献[21]报道的一致,故鉴定为乙基β-D-呋喃果糖苷。
化合物10 白色粉末;ESI-MS m/z: 259 [M + Na]+, 235 [M − H]−, 分子式C10H20O6; 1H NMR (125 MHz, CD3OD): δ 4.11 (1H, d, J = 8.1 Hz, H-3'), 3.92 (1H, t, J = 7.8 Hz, H-4'), 3.66 (1H, d, J = 11.8 Hz, H-6'), 3.53 (1H, d, J = 11.8 Hz, H-6'), 1.53 (2H, m, H2- 2), 1.38 (2H, m, H2-3), 0.93 (3H, t, J = 7.4 Hz, H3- 4); 13C NMR (125 MHz, CD3OD): δ 62.2 (C-1), 33.5 (C-2), 20.4 (C-3), 14.3 (C-4), 65.0 (C-1'), 105.2 (C-2'), 78.4 (C- 3'), 77.3 (C-4'), 83.4 (C-5'), 61.9 (C-6')。上述数据与文献[22]报道的一致,故鉴定为丁基β-D-呋喃果糖苷。
化合物11 黄色粉末;ESI-MS m/z: 409 [M − H]−, 分子式C30H50; 1H NMR (500 MHz, CDCl3): δ 5.12 (6H, m, H-3, 7, 11, 14, 18, 22), 2.10~1.96 (16H, m, H2-4, 5, 8, 9, 16, 17, 20, 21), 1.68 (6H, s, H3-1, 24), 1.61 (18H, s, H3-25~30); 13C NMR (125 MHz, CDCl3): δ 25.8 (C-1, 24), 131.2 (C-2, 23), 124.4 (C-3, 22), 26.8 (C-4, 21), 39.7 (C-5, 9, 16, 20), 134.9 (C-6, 19), 124.3 (C-7, 11, 14, 18), 26.7 (C-8, 17), 135.1 (C-10, 15), 28.3 (C-12, 13), 16.1 (C-26~29), 17.8 (C-25, 30)。上述数据与文献[23]报道的一致,故鉴定为鲨烯。
2 结果和讨论从杨桃叶的乙醇提取物中分离鉴定了苯基β-D-葡萄糖苷(1)、3, 4, 5-三甲氧基苯基β-D-葡萄糖苷(2)、苄基β-D-葡萄糖苷(3)、2-苯乙基芸香糖苷(4)、1-O-(3, 5-二甲氧基-4-羟基苯甲酰基)-β-D-葡萄糖(5)、5-羟基麦芽酚(6)、麦芽酚苷(7)、麦芽酚3-O- [6-O-(3-羟基-3-甲基-5-丁基戊二酰基)]-β-D-葡萄糖苷(8)、乙基β-D-呋喃果糖苷(9)和丁基β-D-呋喃果糖苷(10),其中化合物8为新的人工产物,除化合物2和3外,其余化合物均为首次从杨桃属植物中分离得到。
据报道,苯基β-D-葡萄糖苷(1)可抑制小鼠腹膜巨噬细胞中NO的产生(IC50=37.9 μmol/L),显示抗炎活性[24]。在细胞转录的表观遗传调控中,组蛋白的乙酰化和去乙酰化具有重要作用,其中去乙酰化受组蛋白脱乙酰酶(HDAC)的控制。3, 4, 5-三甲氧基苯基-β-D-葡萄糖苷(2)在100 μmol/L浓度下对HDAC的抑制率为(59.4±0.6)%,表现出中等抑制活性[25]。2-苯乙基芸香糖苷(4)对2, 2'-偶氮二异丁基脒二盐酸盐诱导产生的过氧自由基具有清除活性,并能抑制酒石酸酸性磷酸酶,显示抗氧化和抗骨质疏松活性[26]。5-羟基麦芽酚(6)对小鼠肺腺癌细胞LA795的增殖显示出弱抑制活性[27]。麦芽酚苷(7)可降低细胞间黏附分子-1、血管细胞黏附分子-1和E-选择素基因的转录水平,阻断肿瘤坏死因子α诱导的移位和核转录因子κB的激活,从而抑制细胞黏附分子的表达,阻断嗜中性粒细胞黏附在人内皮细胞单层上,起到抗炎作用[28]。由此可见,上述化合物参与杨桃叶的抗炎、抗氧化、抗肿瘤等药理作用。
| [1] |
LIU Q R. Florae Republicae Popularis Sinicae, Tomus 43(1)[M]. Beijing: Science Press, 1998: 4-6. 刘全儒. 中国植物志, 第43卷第1分册[M]. 北京: 科学出版社, 1998: 4-6. |
| [2] |
State Administration of Traditional Chinese Medicine. Chinese Materia Medica, Tomus 12[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1999: 713-715. 国家中医药管理局. 中华本草, 第12卷[M]. 上海: 上海科学技术出版社, 1999: 713-715. |
| [3] |
ALADAILEH S H, SAGHIR S A M, MURUGESU K, et al. Antihyper-lipidemic and antioxidant effects of Averrhoa carambola extract in high-fat diet-fed rats[J]. Biomedicines, 2019, 7(3): 72. DOI:10.3390/biomedicines7030072 |
| [4] |
LIU F Z, SONG X M, WANG X L, et al. Hypoglycemic effect of total flavones from carambola leaf[J]. Chin J Exp Tradit Med Form, 2013, 19(11): 279-281. 刘方洲, 宋献美, 王晓丽, 等. 杨桃叶总黄酮的降血糖作用[J]. 中国实验方剂学杂志, 2013, 19(11): 279-281. DOI:10.11653/syfj2013110279 |
| [5] |
SONCINI R, SANTIAGO M B, ORLAND L, et al. Hypotensive effect of aqueous extract of Averrhoa carambola L. (Oxalidaceae) in rats:An in vivo and in vitro approach[J]. J Ethnopharmacol, 2011, 133(2): 353-357. DOI:10.1016/j.jep.2010.10.001 |
| [6] |
CABRINI D A, MORESCO H H, IMAZU P, et al. Analysis of the potential topical anti-inflammatory activity of Averrhoa carambola L. in mice[J]. Evid Based Complement Alternat Med, 2011, 2011: 908059. DOI:10.1093/ecam/neq026 |
| [7] |
CAZAROLL L H, KAPPEL V D, PEREIRA D F, et al. Anti-hyper-glycemic action of apigenin-6-C-β-fucopyranoside from Averrhoa carambola[J]. Fitoterapia, 2012, 83(7): 1176-1183. DOI:10.1016/j.fitote.2012.07.003 |
| [8] |
MORESCO H H, QUEIROZ G S, PIZZOLATTI M G, et al. Chemical constituents and evaluation of the toxic and antioxidant activities of Averrhoa carambola leaves[J]. Rev Bras Farmacogn, 2012, 22(2): 319-324. DOI:10.1590/S0102-695X2011005000217 |
| [9] |
ARAHO D, MIYAKOSHI M, CHOU W H, et al. A new flavone C-glycoside from the leaves of Averrhoa carambola[J]. Nat Med, 2005, 59(3): 113-116. DOI:10.1016/j.apsusc.2004.03.089 |
| [10] |
YANG Y, XIE H H, JIANG Y M, et al. Flavan-3-ols and 2-diglycosyloxybenzoates from the leaves of Averrhoa carambola[J]. Fitoterapia, 2020, 140: 104442. DOI:10.1016/j.fitote.2019.104442 |
| [11] |
YANG Y, JIA X C, XIE H H, et al. Dihydrochalcone C-glycosides from Averrhoa carambola leaves[J]. Phytochemistry, 2020, 174: 112364. DOI:10.1016/j.phytochem.2020.112364 |
| [12] |
PU X Y, GAO L B, WANG W, et al. Chemical constituents from Hemiphragma heterophyllum and their α-glucosidase inhibitory activities[J]. J Yunnan Minzu Univ (Nat Sci), 2019, 28(5): 423-427. 普晓云, 高利斌, 王韦, 等. 鞭打绣球的化学成分及其α-葡萄糖苷酶抑制活性的研究[J]. 云南民族大学学报(自然科学版), 2019, 28(5): 423-427. |
| [13] |
ACHENBACH H, BENIRSCHKE G. Joannesialactone and other compounds from Joannesia princeps[J]. Phytochemistry, 1997, 45(1): 149-157. DOI:10.1016/s0031-9422(96)00777-7 |
| [14] |
YANG D, XIE H H. Aromatics and flavonoids from strawberry cv. Falandi[J]. J Trop Subtrop Bot, 2017, 25(6): 617-624. 杨丹, 谢海辉. 法兰地草莓的芳香类和黄酮类成分[J]. 热带亚热带植物学报, 2017, 25(6): 617-624. DOI:10.11926/jtsb.3758 |
| [15] |
JIA X C, YANG D, XIE H H. Chemical constituents from fresh sweet star fruit[J]. J Trop Subtrop Bot, 2017, 25(3): 309-314. 贾栩超, 杨丹, 谢海辉. 甜杨桃鲜果的化学成分研究[J]. 热带亚热带植物学报, 2017, 25(3): 309-314. DOI:10.11926/jtsb.3709 |
| [16] |
ZHANG W D, CHEN W S, KONG D Y, et al. Studies on the chemical constituents of Erigeron breviscapus[J]. Chin Pharm J, 2000, 35(8): 10-12. 张卫东, 陈万生, 孔德云, 等. 灯盏细辛化学成分的研究[J]. 中国药学杂志, 2000, 35(8): 10-12. |
| [17] |
PU S C, GUO Y Q, GAO W Y. Studies on the chemical constituents of Hydrocotyle sibthorpioides[J]. Chin Trad Herb Drugs, 2010, 41(9): 1440-1442. 蒲首丞, 郭远强, 高文元. 天胡荽化学成分的研究[J]. 中草药, 2010, 41(9): 1440-1442. |
| [18] |
CHU H B, HE W J, ZHANG Y M, et al. Flavonoids and nor-sesquiterpenes of Pedicularis densispica[J]. China J Chin Mat Med, 2011, 36(19): 2672-2675. 褚洪标, 贺文军, 张玉梅, 等. 密穗马先蒿中黄酮和降倍半萜成分[J]. 中国中药杂志, 2011, 36(19): 2672-2675. DOI:10.4268/cjcmm20111914 |
| [19] |
LI W, ASADA Y, YOSHIKAWA T. Flavonoid constituents from Glycyrrhiza glabra hairy root cultures[J]. Phytochemistry, 2000, 55(5): 447-456. DOI:10.1016/S0031-9422(00)00337-X |
| [20] |
XIANG M X, HE Y J, HE F, et al. Chemical composition of n-butanol fraction from Polygonum amplexicaule var. sinense[J]. J Chin Med Mat, 2015, 38(9): 1872-1874. 向梅先, 胡亚京, 何峰, 等. 血三七正丁醇部位化学成分研究[J]. 中药材, 2015, 38(9): 1872-1874. DOI:10.13863/j.issn1001-4454.2015.09.018 |
| [21] |
SUN G T, HU X J. Chemical constituents in Capparis masaikai Lévl Kernels[J]. J Kunming Univ Sci Technol (Nat Sci), 2017, 42(5): 85-89. 孙国太, 胡旭佳. 马槟榔种仁的化学成分研究[J]. 昆明理工大学学报(自然科学版), 2017, 42(5): 85-89. DOI:10.16112/j.cnki.53-1223/n.2017.05.013 |
| [22] |
YANG M H, YANG X Q, ZHANG F M, et al. Chemical constituents from Woodwardia unigemmate[J]. Chin Trad Herb Drugs, 2009, 40(10): 1546-1549. 杨明慧, 杨雪琼, 张凤梅, 等. 单芽狗脊蕨的化学成分[J]. 中草药, 2009, 40(10): 1546-1549. |
| [23] |
ZHOU X L, QIN C H, MEI Y, et al. Chemical constituents in leaf of Rhododendron anthopogon[J]. Chin Trad Herb Drugs, 2010, 41(2): 206-208. 周先礼, 秦长红, 梅莹, 等. 髯花杜鹃叶的化学成分研究[J]. 中草药, 2010, 41(2): 206-208. |
| [24] |
NI L, HUANG W, SHI Y, et al. Chemical constituents from the bark of Bauhinia purpurea and their NO inhibitory activities[J]. Nat Prod Res, 2018, 23: 1-6. DOI:10.1080/14786419.2018.1543672 |
| [25] |
KUMBOONMA P, SAENGLEE S, SENAWONG T, et al. Histone deacetylase inhibitors and antioxidants from the root of Gluta usitata[J]. Nat Prod Commun, 2019, 14(12): 1-7. DOI:10.1177/1934578X19895370 |
| [26] |
van THANH N, THAO N P, DAT L D, et al. Two new naphthalene glucosides and other bioactive compounds from the carnivorous plant Nepenthes mirabilis[J]. Arch Pharm Res, 2015, 38(10): 1774-1782. DOI:10.1007/s12272-015-0576-9 |
| [27] |
PU S C. Study on anti-tumor constituents from Hydrocotyle sibthor-pioides[J]. J Anhui Agric Sci, 2014, 42(11): 3238-3239. 蒲首丞. 天胡荽抗肿瘤活性成分研究[J]. 安徽农业科学, 2014, 42(11): 3238-3239. DOI:10.13989/j.cnki.0517-6611.2014.11.098 |
| [28] |
BALWANI S, NANDI D, JAISANKAR P, et al. 2-Methyl-pyran-4-one-3-O-β-d-glucopyranoside isolated from leaves of Punica granatum inhibits the TNFα-induced cell adhesion molecules expression by blocking nuclear transcription factor-κB (NF-κB)[J]. Biochimie, 2011, 93(5): 921-930. DOI:10.1016/j.biochi.2011.01.010 |
 2021, Vol. 29
2021, Vol. 29


