2. 四川农业大学林学院, 成都 611130
2. Faculty of Life Forestry, Sichuan Agricultural University, Chengdu 611130, China
香樟(Cinnammum camphora)是樟科(Lauraceae)樟属亚热带常绿树种,在我国南方地区被广泛用于行道绿化、风景园林,是一种集观赏、材用、药用及工业原料等于一身的珍贵树种[1],也是我国最早发现具有强烈化感现象的植物之一[2-3]。有研究表明,植物化感作用体现了个体及群体之间生化相克相生的关系,广泛存在于农业生态系统之中,并与植物对光、水分、养分和空间的竞争一起构成物种间以及与其他生物间的相互作用[4],特别在生物入侵、森林更新及农作物连作障碍等过程中扮演重要角色,对自然生态系统有着重要影响[5-6]。近年来,大量研究表明,樟脑、芳樟醇、桉叶油素和萜类化合物等均可从樟属植物的叶片、树枝等中提取[7], 而这些化学物质大多数已被证实对农作物、杂草或微生物的生长产生明显化感作用[8];李建勇等[9]报道香樟林下种植的蔬菜受到明显影响,并提出蔬菜品种选择和科学有效管理是发展香樟林下复合种植模式的有效方法。
自然界中,化感物质主要通过植物残体分解、根系分泌、淋洗、挥发4种途径进入周边环境[5], 特别是凋落叶作为植物残体的主要组成部分具有强烈的化感潜力[10],近年来越来越多的植物化感研究采用盆栽试验的方式模拟自然状态下植物凋落叶在土壤中分解对受试植物生长的影响[11-12],而在香樟凋落叶化感作用研究方面,陈洪等[11]研究表明香樟凋落叶分解对辣椒(Capsicum annuum)的营养生长及生殖生长均有明显的抑制作用;张如义等[12]的研究也发现香樟调落叶在土壤中分解显著抑制了两种间作作物的生长和光合作用。特别是在我国南方地区,香樟作为乡村四旁树广泛种植,与当地常见种植的农作物如小白菜、莴笋等蔬菜相邻,作物的生长、产量常受到邻近香樟对环境的竞争及凋落叶的化感胁迫的影响。但是,目前关于香樟叶片化感作用的研究仍多停留在采用植物组织提取液水培法[13],而鲜有对多种受试植物对香樟凋落叶化感作用的响应差异研究。本研究通过盆栽试验,模拟自然状态下香樟凋落叶在土壤中分解对3种常见作物茄子(Solanum melongena)、莴笋(Lactuca sativa)和小白菜(Brassica chinensis)的生长、生理特性和土壤微生物生物量的影响,探究香樟凋落叶影响农作物生长的内在原因及凋落叶分解是否会通过影响土壤微生物而间接地作用于受试植物生长,旨在为香樟与农作物复合种植模式的探索及林下凋落叶的管理利用研究提供科学依据。
1 材料和方法 1.1 研究区概况本试验在四川农业大学(雅安校区)科研农业园区的4号塑料阳光温室大棚中开展。研究区属亚热带湿润季风气候区,位于102°59ʹ55ʹʹ E,29°58ʹ48ʹʹ N,平均海拔600 m,年均气温16.1℃,≥10℃的年积温5231℃,平均最低温6.1℃ (1月),平均最高温25.3℃ (7月),年均日照时数1 039.6 h,年均有霜日9.2 d,最多年达20 d,年均雨日218 d,年均降水量1 732 mm,空气相对湿度78%。
1.2 材料香樟(Cinnammum camphora)凋落叶从四川农业大学老板山植物园内30 a生的香樟人工林下集中收集,选择新近凋落未分解的叶片(从颜色和质地判断),除杂、自然风干后,剪成约1~2 cm2的碎片(以利于与土壤充分混合),储备于密闭塑料袋中。
选择3种在四川雅安地区香樟叶凋落高峰期(春末夏初)常见农作物莴笋(Lactuca sativa)、茄子(Solanum melongena)和小白菜(Brassica chinensis)作为受试材料,种子购于当地种子经营部,挑选大小均匀、饱满的种子,浸种24 h后播种。
栽植土壤为当地农田沙壤土,pH为7.83,有机质、全氮、全钾、全磷含量分别为24.26、0.67、5.71和6.72 g/kg,速效磷和速效钾含量分别为12.63和15.27 mg/kg,预先过筛去除较大的石砾和草根,充分混匀,平铺晾晒备用。栽植容器为聚乙烯塑料盆,口径29 cm,底径25 cm,高26 cm。
1.3 试验设计参考Li等[14]和张如义等[12]的方法,采用单因素随机试验设计,以每盆50.0 g凋落叶作为基本添加量(记作A2),由于香樟林分和环境因素的影响, 凋落叶并不是均匀地分布在林下或林地边缘,因此,本研究另设0.5倍基本量(25.0 g,记作A1)和2.0倍基本量(100.0 g,记作A3),以不施加凋落叶为对照(0 g, CK),将香樟凋落叶碎片与10.0 kg土壤均匀混合后置于盆中,模拟自然条件下香樟凋落叶分解过程,每处理均设5次重复,共60盆。
播种前,先将盆中土壤浇透水,再将莴笋、茄子和小白菜种子均匀点播在各盆中,每盆20粒, 覆土后再浇少量水润湿表土,后期管理中及时去除杂草,并监控土壤含水量保持在18.0%左右(HH2便携式土壤水分测定仪-ML2x, GBR)。适时间苗,最后每盆保留作物2株。
1.4 方法采用电子天平(精度0.000 1 g)称量作物的生物量,分别在播种20、40、60和80 d,统计植株的叶片数量,叶面积参照肖强等[15]的方法测定。选取成熟叶片,采用硫代巴比妥酸加热显色法[16]测定可溶性蛋白(SP)、可溶性糖(SS)和丙二醛(MDA)含量。
播种30、50、70和90 d后,分别采集作物生长的土壤,除去凋落叶、植物根系,采用氯仿熏蒸-K2SO4提取法[17]测定土壤微生物生物量C、N含量。
1.5 数据的统计分析采用SPSS 16.0软件对数据进行单因素方差分析(One-Way ANOVA),以最小显著差数(LSD法)进行多重比较。使用Sigmaplot 10.0软件绘图, 用Excel 2007制表。
2 结果和分析 2.1 对作物生物量的影响在香樟凋落叶分解初期(20~40 d),随凋落叶剂量的增加,小白菜、莴笋和茄子的生物量均呈逐渐降低的趋势,A3处理的与对照(CK)间均达显著差异(P < 0.05),处理20 d时,A1、A2和A3分别比CK下降19.09%、24.14%和26.32%;处理40 d时分别下降7.44%、7.89%和15.76%;处理60 d时, 除小白菜生物量在A1处理下较CK增加了45.49%外, 而其他处理仍表现明显抑制,但较处理40 d的抑制作用有所减弱;到凋落叶分解末期(80 d),各处理对3种作物的抑制作用进一步减弱,甚至个别处理的作物生长表现促进作用,尤其是A1处理的茄子和A2处理的小白菜促进作用更明显,增幅分别达13.88%和15.05% (表 1)。
| 表 1 3种作物生物量(g)对香樟凋落叶分解的响应 Table 1 Effect of litter leaf decomposition of Cinnamomum camphora on biomass (g) of three crops |
由图 1可见,茄子、莴笋和小白菜的叶片数在凋落叶分解初期(20 d)均明显低于CK,A3处理的抑制作用最强,降幅分别达到60.06%、43.71%和57.89%;叶面积也随凋落叶剂量增加逐渐降低, A3处理的降幅最大,分别达到13.11%、9.20%和8.07%,说明叶片发育受到明显抑制。在香樟凋落叶分解中期(40~60 d),处理的作物叶片数、叶面积仍显著低于CK,说明叶片发育受到的抑制作用仍在持续。而到香樟凋落叶分解末期(80 d),3种作物各处理间的叶片数、叶面积差异明显缩小,说明此时叶片发育受抑制效应得到缓解,甚至表现出促进作用,其中小白菜最为明显,A1处理的叶片数为11片,比CK增加10.00%,A2、A3处理为8.33和7.00片,仍表现出受到抑制;叶面积在A1、A2处理下分别为577.69和397.31 cm2,比CK增加47.65%和1.55%,A3处理为231.05 cm2,仍表现出受到抑制。
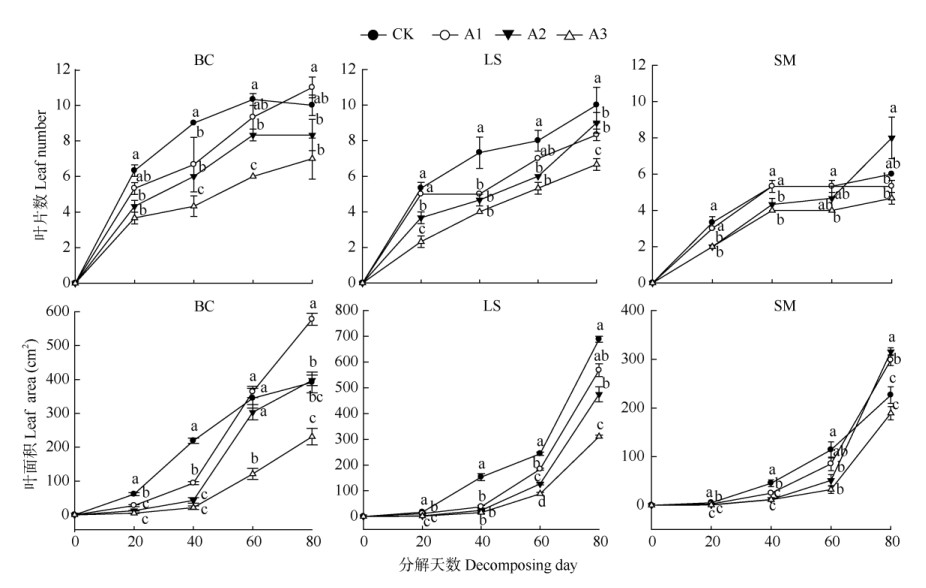
|
图 1 3种作物叶片数和叶面积对香樟凋落叶的响应。不同字母表示差异显著(P < 0.05); BC:白菜; LS:莴笋; SM:茄子; CK:对照; A1: 25 g; A2: 50 g; A3: 100 g。下图同。 Fig. 1 Effect of litter leaf decomposition of Cinnamomum camphora on leaf number and leaf area of three crops. Different letters indicate significant differences at 0.05 level. BC: Brassica chinensis; LS: Lactuca sativa; SM: Solanum melongena. CK: Control; A1: 25 g; A2: 50 g; A3: 100 g. The same is following Figures. |
由图 2可见,在香樟凋落叶分解初期(20 d),茄子、莴笋和小白菜叶片的丙二醛(MDA)含量随凋落叶剂量的增加呈显著上升的变化趋势,A3处理的小白菜、A2和A3处理的莴笋和茄子叶片MDA含量显著增加(P < 0.05)。处理40 d时,茄子、莴笋和小白菜叶片MDA含量随凋落叶剂量的增加呈逐渐降低的趋势,且3种作物处理间的差异不显著。处理60和80 d时,3种作物处理间叶片的MDA含量差异已不显著(P > 0.05),说明香樟凋落叶分解在早期或中期对3种作物叶片细胞造成明显的膜脂过氧化伤害,而后期这种伤害逐渐减弱。

|
图 2 3种作物叶片的丙二醛含量 Fig. 2 MDA content in leaves of three crops |
由图 3可见,在香樟凋落叶分解初期(20 d),3种作物叶片的可溶性蛋白(SP)和可溶性糖(SS)含量随凋落叶量的增加表现不同,叶片的SS含量逐渐增加,呈显著的促进作用,而SP含量逐渐减少,表现出抑制作用;但随处理时间延长,对SS含量的促进作用减弱,处理80 d时,各处理间的SS含量差异不显著(P > 0.05)。而对3种作物叶片SP含量的抑制作用随凋落叶剂量增大而加强,处理80 d时,除小白菜外,茄子和莴笋叶片的SP含量仍显著低于CK。
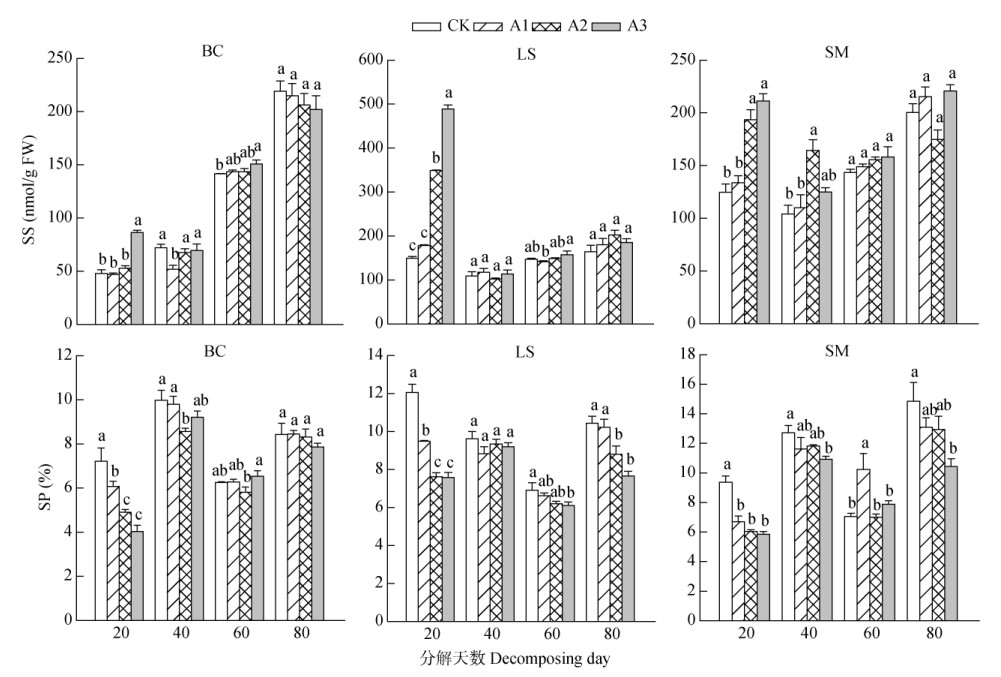
|
图 3 3种作物叶片的可溶性糖(SS)和可溶性蛋白(SP)含量 Fig. 3 Contents of soluble sugar (SS) and soluble protein (SP) in leaves of three crops |
由图 4可见,3种作物生长盆土中的土壤微生物生物量C和N含量在凋落叶处理下均明显增加,表明凋落叶的添加对土壤微生物有促进作用。土壤微生物生物量C和N含量随凋落叶剂量增加而增加;随凋落叶分解时间的延长,各处理土壤微生物量C和N含量均呈逐渐增加的趋势,尤其在凋落叶分解的前中期(20~60 d)。
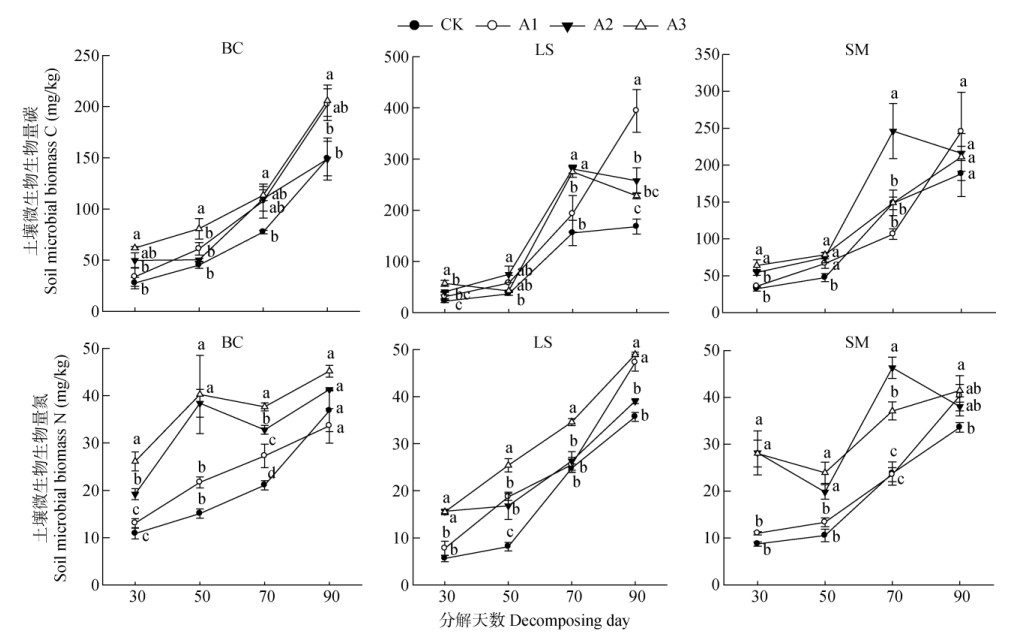
|
图 4 香樟凋落叶对土壤微生物量碳、氮的影响 Fig. 4 Effect of decomposition of camphor litter leaves on soil microbial biomass nitrogen and soil microbial biomass carbon |
植物形态指标和生物量积累的变化最能直观反映其生长状况。有研究表明,化感物质可以通过对植物茎生长的抑制使其植株矮小,进而影响其营养生长和生殖生长[18]。本研究结果表明,香樟凋落叶分解对3种作物的生物量积累和叶片发育(叶面积、叶片数)均有显著的抑制作用,且这种抑制效应在凋落叶分解初中期(20~40 d)表现尤为明显;但随分解时间延长,到分解后期(80 d),3种作物叶片发育和生物量积累受抑制程度逐渐减弱甚至个别作物表现出促进作用,这说明香樟凋落叶化感效应强度在时间上有先增强后减弱的变化规律,这与陈洪等[19]报道巨桉(Eucalyptus grandis)凋落叶分解对老芒麦(Elymus sibiricus)生长的研究结果一致。黄溦溦等[20]在银杏(Ginkgo biloba)凋落叶分解对小白菜生长的影响研究中也有相似规律。这可能是因为香樟凋落叶中的化感物质在分解初期释放量最多,表现出的化感抑制效应也最强,但随分解时间延长,因微生物大量增加加快了凋落叶的分解进度,导致凋落叶中的化感物质大量释放。而植物在分解后期受抑制程度逐渐减弱甚至表现出促进作用,可能是因为前期凋落叶化感物质充分释放后开始释放营养物质在一定程度上弥补了初期植物生长受到的抑制[20];亦或是植物后期自身已对化感效应产生适应能力,其代谢活力逐渐恢复正常,表现出补偿性生长的特征[21]。
3.2 香樟凋落叶分解对作物抗性生理的影响当植物受到外界环境胁迫时,其体内渗透调节物质如可溶性蛋白、可溶性糖均会被大量诱导合成,参与到生理恢复和修复过程[22-23]。本研究结果表明,3种作物叶片的可溶性糖(SS)含量随添加凋落叶量增加逐渐增加,可溶性蛋白(SP)含量却逐渐降低,这与陈洪等[19]的研究结果一致,可能是香樟凋落叶分解释放的化感物质妨碍了作物根系对外界水分的吸收,造成水分胁迫,而植物为了缓解由水分亏缺造成的生理代谢不平衡,细胞会大量积累一些小分子有机化合物, 如可溶性糖、脯氨酸、甜菜碱等[24]。而3种作物在凋落叶处理下SP含量降低,可能是由于香樟凋落叶分解释放的化感物质导致作物对矿物质离子的吸收和蛋白质与酶的合成与活性受到抑制,最终导致其含量减少;亦或是因为化感物质进入作物细胞后,破坏其蛋白质结构使其变性沉淀,导致SP含量降低[24];还有一种可能是因为化感物质促使作物体内SP转化成SS来维持细胞渗透势的平稳[25]。丙二醛(MDA)含量在一定程度上反映了植物在逆境条件下膜脂过氧化程度[26]。本研究结果,凋落叶处理对3种作物叶片的MDA含量均有显著的促进作用,这与秦红艳等[26]的研究结果一致;且这种促进作用在分解初期(20 d)高凋落叶剂量处理表现尤为明显,说明此时3种作物叶片细胞膜受到损伤程度最大,其生理完整性遭到破坏,但到80 d时,3种作物叶片MDA含量均明显降低,说明作物受到化感胁迫得到缓解,这也体现在其后期的生长上。因此,香樟凋落叶分解过程中释放的化感物质造成3种作物渗透调节物质的失调,致使其细胞膜脂受到活性氧伤害,进而影响到作物的细胞分裂和生长发育。
3.3 香樟凋落叶对土壤微生物量C、N含量的影响自然界中,植物以土壤为主要媒介来实现化感作用,土壤微生物是土壤有机物转化的执行者,其通过降解、转化等方式直接或间接地影响植物化感物质在土壤中的存在状态和可利用性,甚至对化感活性有决定性的影响[27]。有研究表明,人工林种植对土壤微生物生物量、数量都产生明显影响。魏圣钊等的研究表明,随巨桉的连栽代次增加,林下土壤微生物生物量C、N和土壤细菌、放线菌、真菌数量均递减[28]。陈洪等[19]报道巨桉凋落叶具有强烈的化感效应,可能是影响林下土壤微生物生物量、数量变化的重要原因。本研究结果表明,香樟凋落叶处理后3种作物生长的土壤微生物生物量C、N含量显著升高,尤其在凋落叶分解初期(20 d)表现最明显,这与王春阳等[29]和陈琴等[30]的研究结果一致,可能是由于植物凋落物的添加为土壤中微生物的生长提供了大量的有机物质来源,促进其大量繁殖,其数量得到明显增加[31];或者是凋落叶在土壤中分解释放的化感物质对土壤微生物的生长有一定的促进效应[32]。土壤微生物大量繁殖会影响其土壤养分的有效化过程[27],消耗土壤养分,从而影响作物的有效养分供应,这也表现在凋落叶分解初期(20 d)作物营养生长显著受抑制上。有研究表明,化感物质棕榈酸对茄子根际土壤微生物生物量C、N、P含量均有显著促进作用[32]。林雁冰等[33]的研究也证实了小麦(Triticum aestivuml)和玉米(Zea mays)根系代谢释放的化感物质能显著增加土壤微生物的数量。这表明化感物质对土壤微生物有拮抗或促进效应,土壤微生物可以通过改变化感物质浓度和种类来影响其化感效应,而化感物质也同样能影响土壤微生物区系,从而影响土壤养分循环和化学性质[34]。
3.4 综合评价香樟凋落叶在土壤中分解释放的化感物质可能一方面通过影响作物体内的可溶性蛋白、可溶性糖等渗透调节物质的平衡,使细胞膜脂受到活性氧伤害,从而影响到作物的细胞分裂;另一方面则可能通过土壤微生物来影响土壤养分的转化过程,从而影响作物的有效养分供应,在二者或者其他机制(如抗氧化酶活性、调节植物激素水平等)的共同作用下,茄子、莴笋和小白菜的生长受到显著抑制, 但这种抑制随着时间延长逐渐减弱甚至表现出促进效应。因此,在开展香樟农林复合模式经营生产时,应尽量将耕地表面的香樟凋落叶深翻分解,或是收集后集中堆沤充分分解腐熟后再还田,这样既可以有效降低香樟凋落叶对林下植物生长的影响, 也可以达到林木枯枝落叶的肥料化利用。本试验采用盆栽方法,比室内生物测试更贴近实际,相比于田间试验又解决了周期较长、干扰因子较多的问题,但其结果与大田实际仍存在着较大差距,但可为香樟凋落叶化感作用的大田试验提供参考。
| [1] |
MAO L S. Cultivation of Ornamental Trees[M]. Beijing: Chinese agriculture press, 2003: 134-144, 211-212. 毛龙生. 观赏树木栽培大全[M]. 北京: 中国农业出版社, 2003: 134-144, 211-212. |
| [2] |
GUO J Y, YANG X L. Herbicide and antibacterial activity of the extracts from leaves of Cinnamomum camphora[J]. Crops, 2012(1): 58-61. 郭金耀, 杨晓玲. 香樟叶提取液的除草与抑菌活性[J]. 作物杂志, 2012(1): 58-61. DOI:10.16035/j.issn.1001-7283.2012.01.046 |
| [3] |
WANG C, LIAO Y M, WU J, et al. Turfgrass evaluation and analysis of factors inhibiting turfgrass growth under camphor trees[J]. J Shanghai Jiaotong Univ (Agric Sci), 2010, 28(1): 1-8. 王琛, 廖琰明, 吴坚, 等. 香樟林下几种冷季型草坪草的适应性及其影响因子分析[J]. 上海交通大学学报(农业科学版), 2010, 28(1): 1-8. DOI:10.3969/j.issn.1671-9964.2010.01.001 |
| [4] |
YANG S S, WANG Q, HU T X, et al. Physiological responses to allelopathy of decomposing Cinnamomum septentrionale leaf litter of three crops (corn, cucumber, and cowpea)[J]. Chin J Appl Environ Biol, 2018, 24(2): 292-298. 杨珊珊, 王茜, 胡庭兴, 等. 3种农作物(玉米、黄瓜、豇豆)对银木凋落叶化感作用的生理响应[J]. 应用与环境生物学报, 2018, 24(2): 292-298. DOI:10.19675/j.cnki.1006-687x.2017.05016 |
| [5] |
RICE E L. Allelopathy[M]. 2nd ed. New York: Academic Press, 1984: 309-315.
|
| [6] |
INDERJIT, SEASTEDT T R, CALLWAY R M, et al. Allelopathy and plant invasions:Traditional, congeneric, and bio-geographical approaches[J]. Biol Invasions, 2008, 10: 875-890. DOI:10.1007/s10530-008-9239-9 |
| [7] |
WANG R L, PENG S L, ZENG R S, et al. Cloning, expression and wounding induction of β-caryophyllene synthase gene from Mikania micrantha H. B. K. and allelopathic potential of β-caryophyllene[J]. Allelopathy J, 2009, 24(1): 35-44. |
| [8] |
OKAMOTO Y, YAMAJI K, KOBAYASHI K. Allelopathic activity of camphor released from camphor tree (Cinnamomum camphora)[J]. Allelopathy J, 2011, 27(1): 123-132. DOI:10.2134/agronj2010.0146s |
| [9] |
LI J Y, YANG X H, AO Y S. Allelopathy of rhizosphere soil of Cinnamomum camphora (L.) Presl[J]. Ecol Environ, 2008, 17(2): 763-765. 李建勇, 杨小虎, 奥岩松. 香樟根际土壤化感作用的初步研究[J]. 生态环境, 2008, 17(2): 763-765. DOI:10.16258/j.cnki.1674-5906.2008.02.075 |
| [10] |
INDERJIT, NILSEN E T. Bioassays and field studies for allelopathy in terrestrial plants:Progress and problems[J]. Crit Rev Plant Sci, 2003, 22(3): 221-238. DOI:10.1080/713610857 |
| [11] |
CHENG H, HU T X, WANG Q, et al. Effect of decomposing leaf litter of Cinnamomum camphora on growth and development of Capsicum annuum[J]. Acta Bot Boreali-Occid Sin, 2014, 34(12): 2525-2534. 陈洪, 胡庭兴, 王茜, 等. 香樟凋落叶分解物对辣椒生长发育的影响[J]. 西北植物学报, 2014, 34(12): 2525-2534. DOI:10.7606/j.issn.1000-4025.2014.12.2525 |
| [12] |
ZHANG R Y, CHENG H, HU H L, et al. Allelopathic effect of Cinnamomum camphora leaf litter on growth and photosynthetic characteristics of two intercropping crops[J]. Acta Bot Boreali-Occid Sin, 2016, 36(1): 332-342. 张如义, 陈洪, 胡红玲, 等. 香樟凋落叶分解过程对两种间作作物生长和光合特性的影响[J]. 西北植物学报, 2016, 36(1): 332-342. DOI:10.7606/j.issn.1000-4025.2016.02.0332 |
| [13] |
WANG P, WANG Y, KONG C H. Allelopathy of plant volatile mono-terpenes mediated by soil:A case study of Ambrosia trifida L[J]. Acta Ecol Sin, 2008, 28(1): 62-68. 王朋, 王莹, 孔垂华. 植物挥发性单萜经土壤载体的化感作用——以三裂叶豚草(Ambrosia trifida L.)为例[J]. 生态学报, 2008, 28(1): 62-68. DOI:10.3321/j.issn:1000-0933.2008.01.007 |
| [14] |
LI Y Q, HU T X, DUAN X Y, et al. Effects of decomposing leaf litter of Eucalyptus grandis on the growth and photosynthetic characteristics of Lolium perenne[J]. J Agric Sci, 2013, 5: 123-131. DOI:10.5539/jas.v5n3p123 |
| [15] |
XIAO Q, YE W J, ZHU Z. A simple non-destructive method to measure leaf area using digital camera and Photoshop software[J]. Chin J Ecol, 2005, 24(6): 711-714. 肖强, 叶文景, 朱珠. 利用数码相机和Photoshop软件非破坏性测定叶面积的简便方法[J]. 生态学杂志, 2005, 24(6): 711-714. DOI:10.3321/j.issn:1000-4890.2005.06.026 |
| [16] |
XIONG Q E. Plant Physiology Experiment Course[M]. Chengdu: Sichuan Sci-technology Publishing House, 2003: 123-124, 126-127. 熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003: 123-124, 126-127. |
| [17] |
VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biol Biochem, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
| [18] |
LUO T, HUANG H P, LI F, et al. Allelopathy of Jatropha curcas aqueous extract on four crops[J]. J Sichuan Univ (Nat Sci), 2014, 51(6): 1325-1329. 罗通, 黄鹤平, 李凤姣, 等. 麻疯树叶水浸提液对4种农作物的化感作用[J]. 四川大学学报(自然科学版), 2014, 51(6): 1325-1329. DOI:10.3969/j.issn.0490-6756.2014.06.037 |
| [19] |
CHENG H, HU T X, YANG W Q, et al. Effects of Eucalyptus grandis leaf litter on growth and resistance physiology of Elymus sibiricus in the initial decomposition process of litter in soil[J]. Acta Prata Sin, 2011, 20(5): 57-65. 陈洪, 胡庭兴, 杨万勤, 等. 巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响[J]. 草业学报, 2011, 20(5): 57-65. DOI:10.11686/cyxb20110508 |
| [20] |
HUANG W W, HU T X, ZHANG N N, et al. Effects of leaf litter of Cinnamomum septentrionale on growth and resistance physiology of Brassica rapa in the decomposition process of litter[J]. Acta Ecol Sin, 2012, 32(12): 3883-3891. 黄溦溦, 胡庭兴, 张念念, 等. 银木凋落叶腐解过程对小白菜生长和抗性生理的影响[J]. 生态学报, 2012, 32(12): 3883-3891. |
| [21] |
HUANG J B, HU T X, WU Z L, et al. Effects of decomposing leaf litter of Juglans regia on growth and physiological characteristics of Triticum aestivum[J]. Acta Ecol Sin, 2014, 34(23): 6855-6863. 黄建贝, 胡庭兴, 吴张磊, 等. 核桃凋落叶分解对小麦生长及生理特性的影响[J]. 生态学报, 2014, 34(23): 6855-6863. DOI:10.5846/stxb201303070363 |
| [22] |
SAO Y J, SHAN L, LI G M. Comparison of osmotic regulation and antioxidation between sorghum and maize seedlings under soil drought stress and water recovering conditions[J]. Chin J Eco-Agric, 2006, 14(1): 68-70. 邵艳军, 山仑, 李广敏. 干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究[J]. 中国生态农业学报, 2006, 14(1): 68-70. |
| [23] |
GAO Y Z, WANG Y H, WANG J T, et al. Research advances in the responses of carbohydrates in grassland plants to environmental stress[J]. Chin J Appl Ecol, 2009, 20(11): 2827-2831. 高英志, 王艳华, 王静婷, 等. 草原植物碳水化合物对环境胁迫响应研究进展[J]. 应用生态学报, 2009, 20(11): 2827-2831. |
| [24] |
GUO G G. Basic Biochemistry[M]. Beijing: Higher Education Press, 2001: 59-60. 郭蔼光. 基础生物化学[M]. 北京: 高等教育出版社, 2001: 59-60. |
| [25] |
ZHANG Y B, DING S, TAO L H, et al. Effcts of La on soluble protein content and proline content under acid rain stress[J]. Environ Chem, 2009, 28(3): 387-391. 张一波, 丁爽, 陶丽华, 等. 镧对酸雨胁迫下水稻种子可溶性蛋白和脯氨酸含量的影响[J]. 环境化学, 2009, 28(3): 387-391. DOI:10.3321/j.issn:0254-6108.2009.03.014 |
| [26] |
QIN H Y, SHEN Y J, LI C Y, et al. Response of leaf lipid peroxidation and protective enzyme activity of different grape varieties to salt stress[J]. N Hort, 2010, 34(20): 4-9. 秦红艳, 沈育杰, 李昌禹, 等. 不同葡萄品种膜质过氧化和保护酶活性对盐胁迫的响应[J]. 北方园艺, 2010, 34(20): 4-9. |
| [27] |
LI X R, LI L. Review of the advances on plant allelochemicals and soil microorganisms[J]. Guangdong Agric Sci, 2013, 40(12): 178-181. 李小容, 李蕾. 植物化感物质与土壤微生物的研究进展[J]. 广东农业科学, 2013, 40(12): 178-181. DOI:10.3969/j.issn.1004-874X.2013.12.054 |
| [28] |
WEI S L, LI L, CAO Q, et al. Effect of continuous planting of Eucalyptus grandis on biomass and number of soil microbes[J]. J Trop Subtrop Bot, 2020, 28(1): 35-43. 魏圣钊, 李林, 曹芹, 等. 巨桉连栽对土壤微生物生物量和数量的影响[J]. 热带亚热带植物学报, 2020, 28(1): 35-43. DOI:10.11926/jtsb.4081 |
| [29] |
WANG C Y, ZHOU J B, XIA Z M, et al. Effects of mixed plant residues from the Loess Plateau on microbial biomass carbon and nitrogen in soil[J]. Acta Ecol Sin, 2011(8): 2139-2147. 王春阳, 周建斌, 夏志敏, 等. 黄土高原区不同植物凋落物搭配对土壤微生物量碳、氮的影响[J]. 生态学报, 2011(8): 2139-2147. |
| [30] |
CHENG Q, FANG S Z, TIAN Y. Effects of the decomposition of poplar and aider mixed leaf litters on soil microbial biomass[J]. Chin J Appl Ecol, 2012, 23(8): 2121-2128. 陈琴, 方升佐, 田野. 杨树和桤木落叶混合分解对土壤微生物生物量的影响[J]. 应用生态学报, 2012, 23(8): 2121-2128. |
| [31] |
XUE D, LIU G B, DAI Q H, et al. Dynamics of soil microbial biomass on the abandoned cropland in Loess Hilly Area[J]. Sci Agric Sin, 2009, 42(3): 943-950. 薛董, 刘国彬, 戴全厚, 等. 黄土丘陵区退耕撂荒地土壤微生物量演变过程[J]. 中国农业科学, 2009, 42(3): 943-950. DOI:10.3864/j.issn.0578-1752.2009.03.024 |
| [32] |
ZHOU B L, HAN L, YING Y L, et al. Effects of allelochemicals hexadecanoic acid on soil microbial composition and biomass in rhizo-sphere of eggplant[J]. J Shenyang Agric Univ, 2010, 41(3): 275-278. 周宝利, 韩琳, 尹玉玲, 等. 化感物质棕榈酸对茄子根际土壤微生物组成及微生物量的影响[J]. 沈阳农业大学学报, 2010, 41(3): 275-278. DOI:10.3969/j.issn.1000-1700.2010.03.004 |
| [33] |
LIN Y B, XUE Q H, YAN X. Effects of allelopathy of maize and wheat root on soil microorganism under the plastic film mulching condition[J]. Acta Agric Boreali-Occid Sin, 2010, 19(1): 92-5. 林雁冰, 薛泉宏, 颜霞. 覆膜条件下小麦和玉米根系化感作用对土壤微生物的影响[J]. 西北农业学报, 2010, 19(1): 92-95. DOI:10.3969/j.issn.1004-1389.2010.01.021 |
| [34] |
MARSCHNER P, TIMONEN S. Interactions between plant species and mycorrhizal colonization on the bacterial community composition in the rhizosphere[J]. Appl Soil Ecol, 2005, 28: 23-36. DOI:10.1016/j.apsoil.2004.06.007 |
 2021, Vol. 29
2021, Vol. 29


