植物甾醇是以环戊烷多氢菲组成的4个环为主要骨架的3-羟基碳氢化合物[1],不仅具有抗氧化和延缓衰老的功能[2-3],还可通过抑制肿瘤细胞生长和转移,改变信号传导,诱导细胞凋亡,刺激产生肿瘤免疫应答等作用机制,对多种肿瘤的发生和发展起到预防和治疗作用[4-7],是一类对人体非常有益的植物活性成分。
铁皮石斛(Dendrobium officinale)是名贵的传统中药材,具有益胃生津、滋阴清热、抗疲劳、提高免疫力、抗肿瘤等效果[8-9]。甾醇类物质是铁皮石斛的有效成分之一,已经从铁皮石斛干燥茎中检测到豆甾醇、22, 23-二氢豆甾醇、β-谷甾醇、γ-谷甾醇和油菜甾醇等植物甾醇,不同产地的铁皮石斛甾醇含量存在差异[10-11]。
植物甾醇的上游生物合成途径与三萜类化合物一致,2个分子的法尼基焦磷酸在鲨烯合酶(squa- lene synthase, SQS)、鲨烯环氧酶(squalene epoxidase, SE)的催化下生成2, 3-氧化鲨烯,环阿屯醇合酶(cycloartenol synthase, CAS)催化2, 3-氧化鲨烯生成环阿屯醇,代谢流往甾醇方向[12-13]。根据侧链C-24位上烷基的有无植物甾醇可分为无烷基甾醇、甲基甾醇和乙基甾醇3类。甾醇C-24甲基转移酶(sterol C-24-methyltransferase, SMT)修饰甾醇侧链C-24位, 根据其功能分为2个家族SMT1和SMT2。SMT1把1个甲基从S-腺苷甲硫氨酸转移到环阿屯醇的C- 24位上,形成C-24甲烯基环阿屯醇,进而形成C-24甲基甾醇,SMT2催化24-亚甲基胆甾烯醇形成24-亚乙基胆甾烯醇,产生新分支24-乙基甾醇[14-16]。SMT2是乙基甾醇合成限速酶,目前,已经从雷公藤(Tripterygium wilfordii)[17]、大豆(Glycine max)[18]、陆地棉(Gossypium hirsuturm)[19]等植物中克隆了SMT2基因,但有关铁皮石斛SMT2基因的研究还未见报道。
本课题组通过转录组测序,对铁皮石斛植物甾醇的生物合成途径和相关基因进行分析[20],从转录组数据中获得1条带5ʹ末端的铁皮石斛甾醇C- 24甲基转移酶基因(DoSMT2)片段。本研究通过3ʹ RACE技术克隆基因全长cDNA序列,对其编码的蛋白进行生物信息学、系统进化和原核表达分析,运用荧光定量PCR分析该基因在不同组织的表达模式,为进一步研究铁皮石斛DoSMT2基因功能,甲基化机制及甾醇化合物代谢途径改良奠定基础。
1 材料和方法 1.1 材料铁皮石斛(Dendrobium officinale)采自冠豸山崖壁,种植于福建省农业科学院亚热带农业研究所资源圃。于2018年8、10、12月取当年生茎和叶片用液氮速冻后,置于-70℃冰箱中保存,用于DoSMT2基因的克隆和组织表达特性分析。试验3次重复。
大肠杆菌(Escherichia coli)菌株DH5α、BL21 (DE3)和原核表达载体pET-29a由本实验室保存。克隆载体pMD19-T、T4 DNA连接酶、RNAiso Plus、PrimeScriptTM Reverse Transcriptase和TaKaRa TB GreenTM Premix Ex TaqTM II (TliRNaseH Plus)购自宝生物工程(大连)有限公司。DNA胶回收试剂盒、Dia Spin柱式质粒DNA小量抽提试剂盒和SanTaq PCR Mix购自上海生工生物工程技术服务有限公司。
1.2 总RNA提取和cDNA第1链合成利用RNAiso Plus提取铁皮石斛的总RNA,用超微量紫外可见光分光光度计(ND-1000)分析RNA的质量和浓度,然后按照PrimeScriptTM Reverse Transcriptase说明书,用随机引物进行cDNA第l链的合成。取10 μL茎和叶的cDNA混合,用于DoSMT2基因全长cDNA和ORF的克隆,余下cDNA用于DoSMT2基因表达分析。
1.3 DoSMT2基因的克隆根据转录组测序获得的DoSMT2基因片段序列信息设计3ʹRACE引物3SMT1和3SMT2及接头引物dT-adaptor和adaptor (表 1)。用引物3SMT1和dT-adaptor进行第一轮PCR,引物3SMT2和adaptor进行第二轮PCR。第一轮PCR以混合的cDNA为模板,第二轮PCR以第一轮PCR产物稀释10倍为模板。反应体系总体积25 μL:包括Sterilized ddH2O 8.5 μL,2×SanTaq PCR Mix 12.5 μL,引物各1 μL, 模板2 μL。PCR反应程序为94℃预变性5 min, 然后94℃变性30 s,52℃退火30 s,72℃延伸1 min, 30个循环,最后72℃延伸10 min。第二轮PCR产物经1.2%琼脂糖凝胶电泳检测,胶回收目的片段, 把目的片段与pMD19-T载体连接,连接产物转化大肠杆菌DH5α感受态细胞,复苏后把菌液涂在含100 mg/L氨苄青霉素的LB平板上,37℃倒置培养过夜。挑取单菌落,接种于含100 mg/L氨苄青霉素的液体LB培养基中过夜培养,利用引物3SMT2和adaptor进行菌落PCR,产物经电泳检测,阳性克隆送上海生工生物工程技术服务有限公司测序。用软件DNAMAN V 6.0对测序结果进行拼接和比对。
| 表 1 PCR引物 Table 1 PCR primers |
根据拼接获得的全长cDNA序列信息设计引物SMT-F (带EcoR I酶切位点)和SMT-R (带Xho I酶切位点),以2 μL混合的cDNA为模板,用引物SMT-F和SMT-R进行PCR扩增。PCR反应程序为: 94℃预变性5 min,然后94℃变性30 s,58℃退火30 s, 2℃延伸2 min,30个循环,最后72℃延伸10 min。PCR产物经胶回收,与pMD19-T载体连接、转化、菌落PCR验证后,阳性克隆送去测序。用软件DNAMAN V 6.0对测序结果进行比对分析。按DiaSpin柱式质粒DNA小量抽提试剂盒说明提取测序结果经比对正确的阳性克隆的质粒pMD19-T-DoSMT2,-20℃保存。
1.5 DoSMT2的生物信息学分析用ProtParam (https://web.expasy.org/protparam/)在线分析DoSMT2蛋白质的理化性质。利用在线工具SSPro (http://scratch.proteomics.ics.uci.edu/)和SWISS-MODEL (https://www.swissmodel.expasy.org/)预测DoSMT2蛋白的二级和三级结构。采用NCBI的BLAST P搜索DoSMT2的同源蛋白序列和保守结构域,用MEGA 6.0 (neighbor joining tree, boot- strap 1 000)构建系统发育进化树[21]。
1.6 表达分析根据DoSMT2基因全长cDNA序列信息设计荧光定量PCR引物SMT2-F和SMT2-R。选择铁皮石斛Actin基因为内参基因,引物为DoACT-F和DoACT-R, 把8、10、12月份采集的铁皮石斛茎和叶总RNA逆转录合成的cDNA,浓度定量为200 ng/μL。荧光定量PCR仪为Roche LightCycler 96,操作按照TaKaRa TB GreenTM Premix Ex TaqTM Ⅱ (TliRNaseH Plus)说明书进行。反应体系总体积为20 μL:包括TB GreenTM Premix Ex TaqTM Ⅱ (Tli-RNaseH Plus) 10 μL,上、下游引物各1 μL,cDNA模板2 μL, ddH2O补足。反应程序为95℃ 30 s;95℃ 10 s,60℃ 20 s, 45个循环;每处理设置3次生物学重复。利用2-∆∆CT法[22]计算相对表达量,方差分析采用DPS数据处理软件,多重比较采用新复极差法(Duncan’s法), 制图使用Excel软件。
1.7 原核表达载体的构建及诱导表达质粒pMD19-T-DoSMT2和载体pET-29a(+)经EcoR H I和Xho I双酶切,酶切产物经1.2%琼脂糖凝胶电泳检测后,胶回收DoSMT2基因目的片段和pET-29a(+)载体片段。用T4 DNA连接酶连接DoSMT2基因目的片段和pET-29a(+)载体片段,连接产物转化大肠杆菌DH5α感受态细胞,挑取单克隆过夜培养, 菌落PCR验证后送去测序。提取阳性克隆的质粒, 获得重组原核表达载体pET-29a-DoSMT2。
用冻融法将pET-29a-DoSMT2载体转化大肠杆菌BL21 (DE3)感受态细胞,在含有100 mg/L卡那霉素的LB平板上倒置培养过夜。挑取单克隆过夜培养,菌落PCR验证后吸取100 μL到3 mL含100 mg/L卡那霉素的LB液体培养基中,37℃下200 r/min振荡培养,蛋白诱导表达和SDS-PAGE电泳参照林江波等[23]的方法。
2 结果和分析 2.1 DoSMT2基因的3ʹRACE以随机引物反转录的混合cDNA为模板,利用引物组合3SMT1、dT-adaptor和3SMT2、adaptor进行两轮PCR扩增,PCR产物经1.2%的琼脂糖凝胶电泳,在880 bp左右处有1条亮带(图 1: A),利用DNAMAN V 6.0对测序结果和已经获得的DoSMT2基因片段进行序列拼接及ORF预测分析。结果表明,获得了全长为1 446 bp的DoSMT2基因cDNA序列,ORF长度为1 089 bp,编码362个氨基酸, 5ʹ末端非翻译区132 bp,3ʹ末端非翻译区225 bp (图 2)。

|
图 1 PCR产物电泳图。A: 3ʹRACE; B:开放阅读框; M: DNA marker Fig. 1 Electrophoresis of PCR products. A: 3ʹRACE; B: ORF; M: DNA marker |

|
图 2 铁皮石斛DoSMT2基因cDNA序列和推导的氨基酸序列。阴影部分为S-腺苷蛋氨酸结合位点; 黑色方框部分为底物结合位点 Fig. 2 cDNA sequence of DoSMT2 gene and deduced amino acid sequence from Dendrobium officinale. Shadows are S-adenosylmethionine binding sites; Black boxes are substrate binding sites |
以随机引物反转录的混合cDNA为模板,利用引物SMT-F和SMT-R进行PCR,扩增DoSMT2基因ORF,从图 1: B可见,在1 089 bp左右有1条亮带,大小与预测的DoSMT2基因ORF一致。PCR产物经过克隆及验证后送去测序,结果表明获得了带EcoR I和Xho I酶切位点的DoSMT2基因ORF。提取阳性克隆的质粒pMD19-T-DoSMT2, 供后续实验。
2.3 DoSMT2的生物信息学分析Protparam在线预测和分析结果表明,DoSMT2蛋白的分子量为40.345 kD,理论等电点为8.13, 负电荷的氨基酸残基数(Asp+Glu)为42,正电荷的氨基酸残基数(Arg+Lys)为44。不稳定系数是31.28, 脂肪系数是84.28,总平均疏水性是-0.143,属于一种稳定的亲水性蛋白。
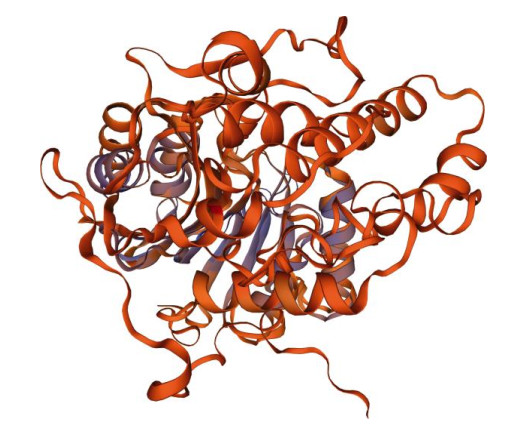
采用SSPro在线预测DoSMT2蛋白的二级结构,结果表明(图 3),有136个氨基酸残基形成无规则卷曲,占37.57%;176个氨基酸残基形成α螺旋,占48.62%;50个氨基酸残基形成β折叠,占13.81%。SWISS-MODEL在线预测DoSMT2蛋白3D结构, 结果见图 4,以5gm1.1.A为同源建模模板,序列一致性为28.42%,建模范围在63~248位氨基酸残基。

|
图 3 铁皮石斛DoSMT2蛋白的二级结构预测。大写字母:氨基酸序列; 小写字母:二级结构; c:无规则卷曲; h: α螺旋; e: β折叠 Fig. 3 Predicted secondary structure of DoSMT2 from Dendrobium officinale. Capital letters: Amino acid sequence; Small letters: Secondary structure; c: Random coil; h: α-Helix; e: β-Sheet |
|
图 4 预测的DoSMT2三维结构 Fig. 4 3D model prediction of DoSMT2 |
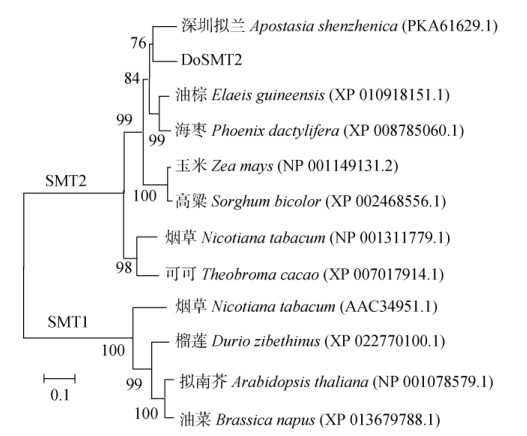
使用BLAST P检索DoSMT2氨基酸序列的同源性和保守结构域,结果表明,DoSMT2氨基酸序列与深圳拟兰(Apostasia shenzhenica, PKA61629.1)、油棕(Elaeis guineensis, XP_010918151.1)、海枣(Phoenix dactylifera, XP_008785060.1)等植物的SMT2氨基酸序列相似度分别为85%、84%和85%,属于AdoMet-MTases超级家族,含有4个S-腺苷蛋氨酸结合位点:VGCGVGG、TI、GNF和I等(图 1),在第129~224位有1个甲基转移酶保守结构域,E值为1.64×10-25,在第292~356位点有1个甾醇甲基转移酶C末端保守结构域,E值为1.10×10-26。此外, DoSMT2还含有3个底物结合位点(图 1):YEWGW- GQSFHF、YSIEATCH和KPGGLYVSYEW[24]。将DoSMT2蛋白的氨基酸序列与其他物种的SMT1和SMT2氨基酸序列进行系统进化分析,结果表明(图 5),SMT蛋白可分为SMT1和SMT2两大类,铁皮石斛DoSMT2与其他物种的SMT2归为同一类,与深圳拟兰(PKA61629.1)的亲缘关系最近,确定其属于SMT2家族。
|
图 5 不同物种间SMT1和SMT2蛋白的系统进化树 Fig. 5 Phylogenetic tree of SMT1 and SMT2 from different species |
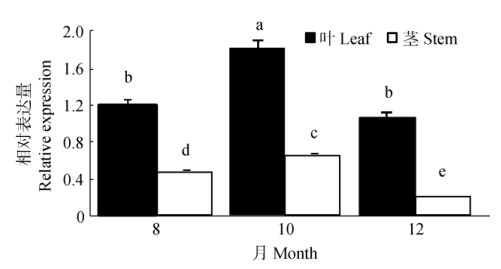
以铁皮石斛Actin基因为内参基因,利用qRT- PCR技术检测DoSMT2基因在8、10和12月份茎和叶中的表达情况。结果表明(图 6),茎和叶都能检测到DoSMT2基因的表达,DoSMT2基因在茎和叶中的表达量以10月份最高,10月份叶片DoSMT2基因的表达量与8、12月份的差异显著,8和12月份之间差异不显著,茎DoSMT2基因的表达量在8、10和12月间均差异显著;相同月份, 叶片DoSMT2基因的表达量都显著高于茎。
|
图 6 DoSMT2基因在茎和叶中的相对表达量。柱上不同字母表示差异显著(P < 0.05) Fig. 6 Relative expression of DoSMT2 in stems and leaves. Different letters upon column indicate significant difference at 0.05 level |
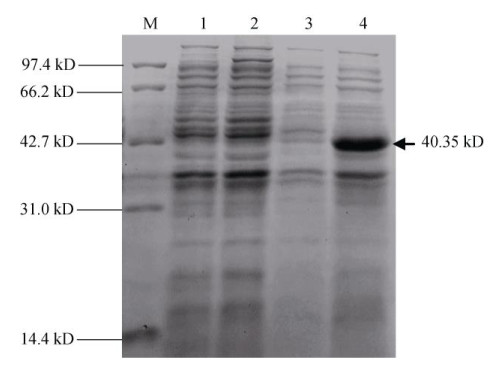
与BL21未诱导、BL21诱导和携带质粒pET-29a- DoSMT2的BL21未诱导表达相比较,携带重组质粒pET-29a-DoSMT2的大肠杆菌BL21经诱导表达后出现了1条约40.345 kD的蛋白条带,表明DoSMT2基因能在大肠杆菌中有效表达(图 7)。
|
图 7 DoSMT2基因在大肠肝菌中表达的SDS-PAGE。M: Marker; 1: BL21未诱导; 2: BL21诱导; 3:携带pET-29a-DoSMT2 BL21未诱导; 4:携带pET-29a-DoSMT2 BL21诱导 Fig. 7 SDS-PAGE of DoSMT2 expressed in Escherichia coli. M: Marker; 1: Non-induction (BL21); 2: Induction (BL21); 3: Non-induction (BL21 with pET-29a-DoSMT2); 4: Induction (BL21 with pET-29a-DoSMT2) |
本研究从铁皮石斛中克隆到DoSMT2基因, ORF长度1 089 bp,编码362个氨基酸,属于AdoMetMTases超级家族,含有4个S-腺苷蛋氨酸结合位点、1个甲基转移酶保守结构域、1个甾醇甲基转移酶C末端保守结构域,与深圳拟兰、油棕和海枣的SMT2氨基酸相似度高,分别为85%、84%和85%, 系统进化分析将其归为SMT2家族,与深圳拟兰的亲缘关系最近,推断其具有甲基化24-亚甲基胆甾烯醇形成24-亚乙基胆甾烯醇的酶活性。BOUVIERNAVE等[25]的研究表明,烟草NtSMT2-1除了甲基化24-亚甲基胆甾烯醇活性外,还有SMT1甲基化环阿屯醇的功能,但甲基化24-亚甲基胆甾烯醇活性是甲基化环阿屯醇活性的33倍。本研究把DoSMT2基因与原核表达载体pET-29a连接,并转化大肠杆菌BL21,IPTG成功诱导BL21表达出目的蛋白, 为进一步研究DoSMT2基因的催化功能和甲基化机制奠定基础。
植物甾醇是细胞膜的重要成分,帮助维持膜的完整性和渗透性[26]。植物甾醇还可以作为植物体内的信号分子,参与调节光合作用、生殖和免疫等多种生理活动[27]。24-亚甲基甾醇是油菜素甾醇生物合成的前体物质[28],含量的变化影响油菜素甾醇生物合成。油菜素甾醇合成缺陷会引起植物矮化[29], SITBON等[30]研究发现烟草AtSMT2转化株24-甲基甾醇含量减少,谷甾醇含量增加,但总甾醇含量没有明显的变化,开花期植株矮化,推测与油菜素甾醇合成的改变有关。铁皮石斛枝条一般10月份开始进入封顶期,停止营养生长。DoSMT2在10月份的上调表达,是否降低了24-甲基甾醇含量,引起油菜素甾醇水平下调;铁皮石斛封顶与油菜素甾醇含量下降之间是否存在关联,还有待于进一步对铁皮石斛油菜素甾醇代谢的研究来验证。
铁皮石斛叶片约占总生物量的38%,功效成分的研究主要集中在多糖和总黄酮等[31-32],植物甾醇方面的研究鲜有报道。本研究结果表明叶片的DoSMT2表达量显著高于茎,说明叶片植物甾醇代谢比茎活跃,今后应加强铁皮石斛叶片植物甾醇的研究与开发利用。
| [1] |
ZHANG B, YU T, LI L, et al. Recent advances in plant sterol[J]. Food Ferment Indust, 2015, 41(1): 190-195. 张斌, 郁听, 栗磊, 等. 植物甾醇的研究进展[J]. 食品与发酵工业, 2015, 41(1): 190-195. DOI:10.13995/j.cnki.11-1802/ts.201501036 |
| [2] |
WU S M, WU M C, MA L. Antioxidant effect of phytosterols in high grade rapeseed cooking oil (Ⅱ):Antioxidant effect at high temperature[J]. Chin Oil Fat, 2003, 28(5): 32-33. 吴时敏, 吴谋成, 马莉. 植物甾醇在菜籽高级烹调油中的抗氧化作用(Ⅱ)——高温下抗氧化作用的研究[J]. 中国油脂, 2003, 28(5): 32-33. DOI:10.3321/j.issn:1003-7969.2003.05.012 |
| [3] |
RUDKOWSKA I. Plant sterols and stanols for healthy ageing[J]. Maturitas, 2010, 66(2): 158-162. DOI:10.1016/j.maturitas.2009.12.015 |
| [4] |
ZHANG S, YUE W, WANG L, et al. Inhibitive effect of Stigmasterol from Hedyotis diffusa Willd. on hepatoma cells in vitro & vivo and its influence on transplanted H22 tumor cell's multiplication cycle, apoptosis[J]. Prog Mod Biomed, 2008, 8(11): 2016-2017, 2009. 张硕, 岳旺, 王蕾, 等. 白花蛇舌草豆甾醇对肝癌细胞的体内外抑制作用及对其增殖周期、凋亡的影响[J]. 现代生物医学进展, 2008, 8(11): 2016-2017, 2009. |
| [5] |
CAO M, OUYANG L. Study on development of anti-tumor effect of phytosterols[J]. Pract Pharm Clin Remed, 2015, 18(9): 1104-1107. 曹玫, 欧阳露. 植物甾醇的抗肿瘤作用及其机制研究进展[J]. 实用药物与临床, 2015, 18(9): 1104-1107. DOI:10.14053/j.cnki.ppcr.201509026 |
| [6] |
ZHOU L Y, XU C, WANG L Q, et al. Effect of β-sitosterol on proli-feration and apoptosis of lung cancer cell line A549[J]. Int J Lab Med, 2016, 37(7): 865-867. 周玲玉, 徐彩, 王乐琴, 等. β-谷甾醇对人肺癌A549细胞增殖及凋亡的影响[J]. 国际检验医学杂志, 2016, 37(7): 865-867. DOI:10.3969/j.issn.1673-4130.2016.07.001 |
| [7] |
CHENG X A, ZHOU X W, ZHANG S M, et al. Effects of phytosterol on growth inhibiting and apoptosis induction of melanoma cells[J]. Guangdong Agric Sci, 2014, 41(10): 94-97. 程杏安, 周晓武, 张淑明, 等. 植物甾醇对黑色素瘤细胞的生长抑制及凋亡诱导作用[J]. 广东农业科学, 2014, 41(10): 94-97. DOI:10.3969/j.issn.1004-874X.2014.10.023 |
| [8] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China, Volume I[M]. Beijing: China Medical Science Press, 2015: 282-283. 国家药典委员会. 中华人民共和国药典, 一部[M]. 北京: 中国医药科技出版社, 2015: 282-283. |
| [9] |
LIAO J J, LI W J, LI J J, et al. Advances in the constituents and pharmacological effects of Dendrobium candidum Wall. ex. Lind[J]. J Guangdong Indust Technol Coll, 2015, 14(3): 16-19, 26. 廖俊杰, 李文静, 李进进, 等. 铁皮石斛有效成分与功效研究进展[J]. 广东轻工职业技术学院学报, 2015, 14(3): 16-19, 26. DOI:10.3969/j.issn.1672-1950.2015.03.004 |
| [10] |
YANG L, LIU S J, HU J M, et al. Determination of volatile compo-nents from stem of Dendrobium officinale by GC-MS[J]. Modern Chin Med, 2013, 15(5): 362-364. 杨柳, 刘守金, 胡江苗, 等. GC-MS法检测铁皮石斛茎中挥发性成分[J]. 中国现代中药, 2013, 15(5): 362-364. DOI:10.3969/j.issn.1673-4890.2013.05.003 |
| [11] |
TONG J J, YU H, ZENG W B, et al. Study on functional components of Dendrobium officinale from different culturing areas[J]. J Yunnan Univ Trad Chin Med, 2017, 40(5): 81-84. 仝晶晶, 虞泓, 曾文波, 等. 6个不同产地铁皮石斛功效成分的分析研究[J]. 云南中医学院学报, 2017, 40(5): 81-84. DOI:10.19288/j.cnki.issn.1000-2723.2017.05.018 |
| [12] |
ZHANG X C, HAN Z H. Sterols biosynthesis and their physiological role in plants[J]. Plant Physiol Comm, 2001, 37(5): 452-457. 张喜春, 韩振海. 植物体内甾醇的合成和生理作用[J]. 植物生理学通讯, 2001, 37(5): 452-457. |
| [13] |
LIU Q, CONG L N, ZHANG Z S. Research progress in genetic analysis of the biosynthesis of phytosterols and triterpene saponins[J]. J Anhui Agric Sci, 2006, 34(19): 4844-4846. 刘强, 丛丽娜, 张宗申. 植物甾醇与三萜类皂苷生物合成基因调控的研究进展[J]. 安徽农业科学, 2006, 34(19): 4844-4846. DOI:10.3969/j.issn.0517-6611.2006.19.012 |
| [14] |
GUAN H Y, SU P, ZHAO Y J, et al. Cloning and functional analysis of two sterol-C24-methyltransferase 1(SMT1) genes from Paris poly-phylla[J]. J Asian Nat Prod Res, 2018, 20(7): 595-604. DOI:10.1080/10286020.2016.1271791 |
| [15] |
GUAN H Y, ZHAO Y J, SU P, et al. Molecular cloning and functional identification of sterol C24-methyltransferase gene from Tripterygium wilfordii[J]. Acta Pharm Sin B, 2017, 7(5): 603-609. DOI:10.1016/j.apsb.2017.07.001 |
| [16] |
SCHAEFFER A, BOUVIER-NAVÉ P, BENVENISTE P, et al. Plant sterol-C24-methyl transferases:Different profiles of tobacco trans-formed with SMT1 or SMT2[J]. Lipids, 2000, 35(3): 263-269. DOI:10.1007/s11745-000-0522-1 |
| [17] |
GUAN H Y, SU P, ZHAO Y J, et al. Cloning and protein expression of sterol-C-24-methyl transferase 2 in Tripterygium wilfordii[J]. Acta Pharm Sin, 2016, 51(11): 1799-1805. 关红雨, 苏平, 赵瑜君, 等. 雷公藤甾醇C-24甲基转移酶(Tw2MT2)的cDNA克隆及表达分析[J]. 药学学报, 2016, 51(11): 1799-1805. DOI:10.16438/j.0513-4870.2016-0320 |
| [18] |
NEELAKANDAN A K, SONG Z H, WANG J Q, et al. Cloning, functional expression and phylogenetic analysis of plant sterol 24C-methyltransferases involved in sitosterol biosynthesis[J]. Phyto-chemistry, 2009, 70(17/18): 1982-1998. DOI:10.1016/j.phytochem.2009.09.003 |
| [19] |
LUO M, TAN K L, XIAO Z Y, et al. Cloning and expression of two sterol C-24 methyltransferase genes from upland cotton (Gossypium hirsuturm L.)[J]. J Genet Genom, 2008, 35(6): 357-363. DOI:10.1016/S1673-8527(08)60052-1 |
| [20] |
LIN J B, WANG W Y, ZOU H, et al. Analysis of related genes in phytosterol biosynthesis in Dendrobium officinale based on transcri-ptome sequencing technology[J]. J Trop Subtrop Bot, 2019, 27(6): 693-701. 林江波, 王伟英, 邹晖, 等. 基于转录组测序的铁皮石斛植物甾醇生物合成相关基因分析[J]. 热带亚热带植物学报, 2019, 27(6): 693-701. DOI:10.11926/jtsb.4025 |
| [21] |
TAMURA K, STECHER G, PETERSON D, et al. MEGA6:Molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [22] |
SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nat Protoc, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [23] |
LIN J B, WANG W Y, LI H M, et al. Cloning and expression analysis of NtPLATZ1 gene from Narcissus tazetta var. chinensis[J]. J NW Agric For Univ (Nat Sci), 2016, 44(10): 165-170. 林江波, 王伟英, 李海明, 等. 中国水仙锌指蛋白NtPLATZ1的克隆与表达分析[J]. 西北农林科技大学学报(自然科学版), 2016, 44(10): 165-170. DOI:10.13207/j.cnki.jnwafu.2016.10.023 |
| [24] |
GANAPATHY K, JONES C W, STEPHENS C M, et al. Molecular probing of the Saccharomyces cerevisiae sterol 24-C methyltransferase reveals multiple amino acid residues involved with C2-transfer activity[J]. Biochim Biophys Acta, 2008, 1781(6/7): 344-351. DOI:10.1016/j.bbalip.2008.04.015 |
| [25] |
BOUVIER-NAVÉ P, HUSSELSTEIN T, BENVENISTE P. Two families of sterol methyltransferases are involved in the first and the second methylation steps of plant sterol biosynthesis[J]. Eur J Bio-chem, 1998, 256(1): 88-96. DOI:10.1046/j.1432-1327.1998.2560088.x |
| [26] |
WEETE J D, PARISH E J, NES W D. Chemistry, biochemistry, and function of sterols[J]. Lipids, 2000, 35(3): 241. DOI:10.1007/s11745-000-0517-y |
| [27] |
GREBE M, XU J, MÖBIUS W, et al. Arabidopsis sterol endocytosis involves actin-mediated trafficking via ARA6-positive early endo-somes[J]. Curr Biol, 2003, 13(16): 1378-1387. DOI:10.1016/S0960-9822(03)00538-4 |
| [28] |
SUN C, LI J. Biosynthesis, catabolism, and signal transduction of brassinosteroids[J]. Plant Physiol J, 2017, 53(3): 291-307. 孙超, 黎家. 油菜素甾醇类激素的生物合成、代谢及信号转导[J]. 植物生理学报, 2017, 53(3): 291-307. DOI:10.13592/j.cnki.ppj.2017.1002 |
| [29] |
CHOE S, DILKES B P, GREGORY B D, et al. The Arabidopsis dwarf1 mutant is defective in the conversion of 24-methylenecholesterol to campesterol in brassinosteroid biosynthesis[J]. Plant Physiol, 1999, 119(3): 897-907. DOI:10.1104/pp.119.3.897 |
| [30] |
SITBON F, JONSSON L. Sterol composition and growth of transgenic tobacco plants expressing type-1 and type-2 sterol methyltransferases[J]. Planta, 2001, 212(4): 568-572. DOI:10.1007/s004250000417 |
| [31] |
ZENG X J, SHEN T, HU J X, et al. Characteristics of biomass allocation and polysaccharide content in stem and leaf of different Dendrobium officinale strains[J]. SW China J Agric Sci, 2018, 31(1): 57-61. 曾学健, 沈涛, 胡继学, 等. 不同品系铁皮石斛茎叶生物量分配特征及多糖含量比较[J]. 西南农业学报, 2018, 31(1): 57-61. DOI:10.16213/j.cnki.scjas.2018.1.010 |
| [32] |
HUANG Y C, XIE Z S, REN J, et al. Comparison of HPLC charac-teristic spectrum of flavonoids on leaves of Dendrobium officinale from three provenance sources[J]. Chin J Exp Trad Med For, 2015, 21(24): 37-40. 黄月纯, 谢镇山, 任晋, 等. 3种种源铁皮石斛叶黄酮类成分HPLC特征图谱比较[J]. 中国实验方剂学杂志, 2015, 21(24): 37-40. DOI:10.13422/j.cnki.syfjx.2015240037 |
 2020, Vol. 28
2020, Vol. 28


