2. 中国科学院大学, 北京 100049;
3. 中国科学院核心植物园, 广州 510650;
4. 赣南师范大学, 江西 赣州 341000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Center of Economic Botany, Core Botanical Gardens, Chinese Academy of Sciences, Guangzhou 510650, China;
4. Gannan Normal University, Ganzhou 341000, Jiangxi, China
蛇床子别名野茴香、野胡萝卜子、蛇米、蛇栗等,是伞形科(Apiaceae)植物蛇床(Cnidium monnieri)的干燥成熟果实。蛇床是一年生草本植物,性喜温暖、湿润环境,不畏严寒和干旱,适应性广,在我国华东、中南等地区均有分布。蛇床子最早见于《神农本草经》:“味苦平。主妇人阴中肿痛,男子阳痿,湿痒,除痹气,利关节,癫痫恶创。久服轻身。一名蛇米。生川谷及田野。”蛇床子作为一种传统中药材,用途广泛,功效颇多,其主要活性成分是以蛇床子素为主的香豆素类化合物。香豆素(coumarin)是1, 2-苯并α-吡喃酮的衍生物,是一类具有多种分子结构的天然产物,广泛存在于伞形科、芸香科(Rutaceae)、豆科(Leguminosae)、菊科(Asteraceae)等高等植物中[1]。研究表明,蛇床子中的香豆素类化合物具有多种生物学活性,包括抗炎[2]、抗痉挛[3]、抗病毒[4]、抗肿瘤[1]、抗骨质疏松[5]、抗心律失常[6]等。其中,呋喃香豆素因其光敏特性被广泛应用于治疗白癜风和银屑病[7]。一些带有羟基和甲氧基的香豆素还具有抗氧化的功效[8],常被用于化妆品的生产。因此,蛇床子具有多种药理活性,应用范围广,具有较高的研究价值和经济价值。本文收集整理了国内外共1 414篇蛇床子的相关文献,其中83%的文献集中于蛇床子的药理作用研究,15%的文献与化学提取、鉴定分析相关,仅有1%为植物学相关研究,因此针对蛇床子的植物与分子生物学研究仍有广阔的空间。本文综述了蛇床的植物学特征、资源分布、栽培条件及环境对品质的影响、药材鉴别等,并展望了产学研结合的未来研究方向。
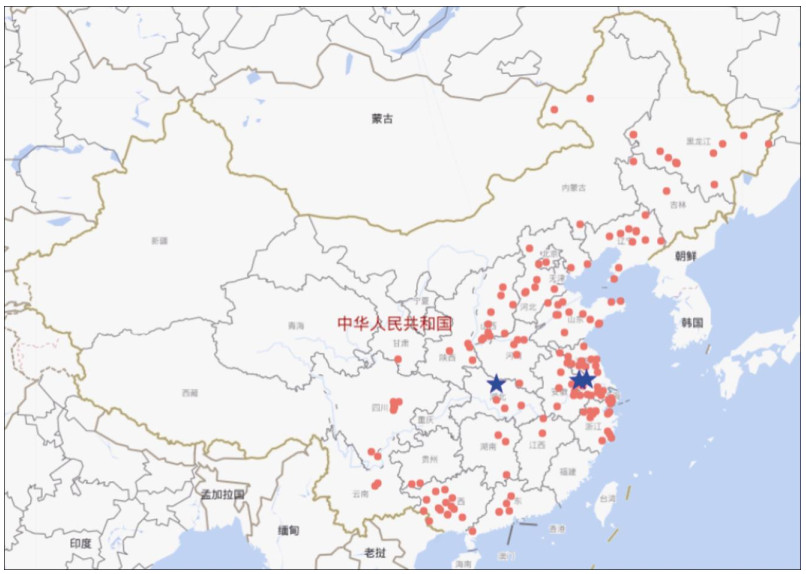
1 蛇床的生物学特性研究蛇床植物高30~80 cm,茎直立中空,有分枝,有疏柔毛;叶为二至三回羽状分裂,两面无毛;复伞形花序,5片花瓣,花白色;5枚雄蕊,2个花柱,子房下位[9]。其成熟果实为蛇床子,椭圆形灰黄色或灰褐色双悬果,长2~4 mm,直径约2 mm (图 1)。种子气香,味辛凉,微麻[10]。生长期因地理位置不同而有所差异,一般在5-6月开花,6-7月结果。蛇床性喜温暖、湿润,多生于海拔较低的河谷、田边、湿地、草地、丘陵及山区,在我国大部分地区均有分布[11]。张巧艳等[11]根据中国植物志、各地植物志和有关的书籍、论文记载、蛇床子标本采集地点记录和野外采集调查记录,总结出蛇床在我国的23个省区(直辖市)有分布(表 1)。据《本草经集注》记载,蛇床的产地在临淄,也就是现在的江苏省南京市六合县。在《本草品汇精要》中也提到蛇床子的道地产区为扬州、襄州、南京,因此认为蛇床子的道地产区是在江苏南京、扬州及湖北襄樊一带。图 2为蛇床在我国的地理分布。

|
图 1 蛇床的花、茎、叶(左, 周繇摄)和果实(右, 田琴摄) Fig. 1 Flowers, stems, leaves (Left, photoed by ZHOU Yao) and fruits (Right, photoed by TIAN Qin) of Cnidium monnieri |
|
图 2 蛇床在中国的地理分布。★:道地产区; ●:其他产区。 Fig. 2 Geographical distribution of Cnidium monnieri in China. ★: Genuine producing areas; ●: Other producing areas. |
有研究表明,蛇床居群间的亲缘关系与地理分布相关。曹晖等[12]根据蛇床的叶绿体matK基因序列建立了蛇床6个居群的亲缘关系,可以分为两组:来自湖南益阳(化学型Ⅰ)、江苏高淳(化学型Ⅰ)和河南原阳(化学型Ⅲ)的为一组,来自黑龙江哈尔滨(化学型Ⅱ)、河北衡水(化学型Ⅲ)和安国(化学型Ⅲ)的为另一组; 结合样品的地理分布与香豆素化学成分分析,说明蛇床居群间的亲缘关系与地理分布及香豆素化学型有一定的相关性。
2 蛇床子的化学成分蛇床子的主要化学成分为香豆素类和挥发油类,还有色原酮类、三萜、苷类、糖类等化合物, 其中,香豆素类化合物是蛇床子发挥药理作用的主要成分,目前已从蛇床子中分离鉴定出48种香豆素类化合物,包括22种简单香豆素、9种线型呋喃香豆素和17种角型呋喃香豆素[13]。其中含量较高, 普遍用于化学检测与鉴定的有6种香豆素类化合物,分别为蛇床子素、欧前胡素、异虎耳草素、花椒毒素、佛手柑内酯和异欧前胡素。蛇床子还富含挥发油,目前已从蛇床子中鉴定出237种挥发油, 包括β-桉叶醇、乙酸龙脑脂、反式罗勒烯、二戊烯等。蛇床子挥发油中含量最高的为倍半萜类化合物,含量大于85%,另有7%以上的脂类成分和2%以上的萜烯醇类成分[13]。
蛇床的适应性强,在我国大部分地区都有分布,但不同产地的蛇床子形状大小及所含化学成分有较大差异。张巧艳[14]根据果实大小和化学特征将不同产区的蛇床分为3种类型:分布于黑龙江、内蒙古、辽宁北部等地的为肇东型蛇床,果实较小, 直径为1.60~1.85 mm,含角型呋喃香豆素为主,不含蛇床子素和线性呋喃香豆素;分布于陕西、河北、河南等地的为大荔型蛇床,果实中等大小,直径为1.85~2.10 mm,含蛇床子素、线型呋喃香豆素和角型呋喃香豆素成分;分布于福建、浙江、江苏等地的为句容型蛇床,果实较大,直径为2.10~2.55 mm,以蛇床子素和线型呋喃香豆素为主要成分。
种质资源的多样性对种质选育有着重要作用, 但由于人类活动的影响,野生蛇床数量日益减少, 因此需要全面收集和评价蛇床的种质资源,为蛇床优良品种的选育奠定基础。
3 蛇床的栽培条件与环境影响不同产区的蛇床子化学成分的差异是由种质差异与外界环境因子共同决定的。有研究表明,外界环境因素对蛇床子香豆素类化合物的合成与积累有一定的影响。李义敏[13]将不同产地的蛇床子在上海异地栽培,比较了原产地和异地栽培蛇床子的香豆素类成分,同时比较原产区与上海的气候条件和栽培环境,探讨了环境因子与蛇床子香豆素成分含量的相关性。结果表明,在蛇床子的开花期(5月),降雨量与总简单香豆素和总线型呋喃香豆素含量呈显著的正相关关系;除7月份外,各月降雨量与总角香豆素含量呈负相关关系;除8月份外,各月日照时数与总角型香豆素含量呈正相关关系;温度是影响蛇床子香豆素成分变异的最重要气象因素, 与总简单香豆素和总线性呋喃香豆素含量呈正相关关系,与总角型香豆素含量呈负相关关系。由于蛇床子中含量最高、发挥主要药理作用的是以蛇床子素为主的简单香豆素和部分线型呋喃香豆素,因此土壤湿润、日照充足和气候温暖有利于蛇床子品质的提高。
随着蛇床野生资源的减少,要满足蛇床子的市场需求,就必须进行适当规模的人工种植。人工种植蛇床的方法目前已有报道[15-16],包括选地与整地、繁殖方法、田间管理、虫害防治、白粉病的防治以及采收加工方法等,对实际生产具有一定的指导意义。另外,董家行等[17]还建立了玉米(Zea mays)套种蛇床的立体种植模式,既不影响玉米的正常生长,又实现了蛇床子的高产,有效提高土地利用率和农民的经济效益,是一种值得推广的粮药双收的栽培技术。蛇床子的产量与品质的提高离不开科学的种植方法和合理、高效的田间管理等, 因此需要进一步改进蛇床子的种植技术,保证药材的高产稳产。
4 蛇床子的真伪鉴别蛇床子作为一种传统中药材,广泛应用于各种疾病的临床治疗上,其伪品对临床用药安全产生威胁。目前,在市场上售卖的蛇床子,存在以同科属植物果实冒充销售的情况。传统的鉴别方法有性状鉴别、显微鉴别、荧光鉴别和薄层色谱鉴别等。
性状鉴别 可从果实的形状、大小、颜色等方面的特征对蛇床子及其伪品进行区分,方法简便易行。蛇床子长2~4 mm,直径约2 mm,而旱芹(Apium graveolens)种子较小,长1~1.5 mm,直径约1.5 mm;蛇床子表面为灰黄色或灰褐色,而旱芹种子表面为灰黄色或灰绿色;蛇床子分果接合面平坦,而旱芹子接合面小,不平坦;蛇床子气香,味辛凉,尝之有麻舌感,而旱芹种子用手揉搓后有浓郁的芹菜香气,味辛凉,微苦等[10]。
显微鉴别 将药材切片置于显微镜下观察, 根据组织、细胞特征可区分药材的真伪。蛇床子横切片为半圆状锐五角形,外表皮有1列扁平细胞, 纵棱高,深波状突起,而旱芹子横切片为半圆状钝五角形,外表皮有1~2列扁形细胞,纵棱低、浅波状突出;蛇床子种皮为1列淡棕色扁平细胞,壁呈连珠状,而旱芹子种皮为1列棕色长扁形细胞;蛇床子胚乳较小,胚乳细胞糊粉粒中有细小的草酸钙簇晶,而旱芹子胚乳较大,胚乳细胞糊粉粒中有较大的草酸钙簇晶[10]。
荧光鉴别 根据中药中的某些成分在常光或紫外灯照射下会出现荧光的特性,可鉴别中药。这种方法简单、快速,结合性状鉴别等其它方法可以使鉴别更准确。蛇床子的乙醇提取液在紫外光灯(365 nm)下呈蓝紫色荧光[18]。
薄层色谱鉴别 蛇床子中蛇床子素含量较高,而伪品不含或仅含少量蛇床子素。取0.1 g蛇床子及旱芹子粉末,分别溶于10 mL乙醇中,超声处理5 min,将溶液点于0.8%羧甲基纤维素钠为粘合剂的硅胶G薄层板上,展开剂为石油醚(30℃~ 60℃)-乙酸乙酯(1:1),对照品为蛇床子素乙醇溶液,展距约7 cm,取出晾干后在365 nm紫外光灯下可以观察到蛇床子与对照品在相同的位置有蓝紫色斑点,而旱芹子仅在原点有浅黄色斑点[19]。
5 蛇床子的香豆素类成分鉴定蛇床子的品质影响了其用药及治疗效果,如何快速高效地鉴定蛇床子药材的品质也是目前存在的问题之一。《中华人民共和国药典》规定,入药的蛇床子按干燥品计算,含蛇床子素不得少于1.0%。除了蛇床子素外,蛇床子中还含有数十种香豆素类成分,对其药效也有一定的影响,因此香豆素类成分含量的测定是鉴定蛇床子品质的关键。但由于香豆素类化合物结构类似,且部分化合物含量较低,因此一般的化学检测手段无法满足蛇床子品质鉴定的需求。
目前,高效液相色谱(HPLC)是检测蛇床子中不同香豆素类化合物的主要方法。宋丽娇等[20]优化了传统的HPLC法,能同时检测蛇床子中6种主要香豆素类化合物,实现了快速鉴定并比较不同产地、批次的蛇床子药材品质。该方法使用Hedra ODS-2色谱柱,甲醇-0.1%甲酸水流动相,采用8个梯度洗脱,在1 h内分离鉴定蛇床子中的6种主要香豆素(花椒毒素、异虎耳草素、佛手柑内酯、欧前胡素、蛇床子素和异欧前胡素)。通过测定不同浓度的6种香豆素的标品,可以构建峰面积与香豆素成分浓度的标准曲线,从而计算各组分的含量。虽然该方法无法检测蛇床子中含量较低的香豆素类成分,但已经可以通过“一测多评”的方法实现对蛇床子品质的快速鉴定。
6 产学研相结合的研究前景蛇床子作为一种传统中药材,具有良好的应用前景。随着蛇床子总香豆素在美国完成治疗银屑病的三期临床,蛇床子作为药材,未来市场必定会出现较大的增长。然而近年来蛇床种植面积逐渐减少,要满足日益增长的市场需求,不可能仅仅寄希望于野生资源,必须开辟一条可持续发展的新路。
目前蛇床种植面临的主要问题在于种质资源退化严重,种植几代之后药效成分含量大大降低。未来市场随着新产品上市可能出现巨大需求,而种植面积缩小、品质下降则可能造成供需矛盾。目前,对蛇床子的药理作用研究已较为透彻,但相关的植物学研究较少,蛇床的栽培技术、资源收集与评价等仅有少量报道,其重要药效成分的合成途径及其调控的分子机制相关研究几乎空白。
为解决蛇床子产业化过程中的实际问题,我们可以从以下几个方面展开研究。首先,全面收集评价蛇床子野生资源,结合现代分子育种技术,选育药效成分含量高的新品种,保证优良种质资源的源头供应。其次,药材栽培技术需要系统研究,全面分析影响药效成分积累的环境因素,搭配合理、高效的水肥等田间管理,研发病虫害绿色防治技术, 保证药材的高产稳产。第三,结合蛇床植物本身的基因组、转录组、代谢组等生物信息学的综合分析,解析主要药效成分的生物合成途径及其调控的分子机制。第四,在前期研究的基础上,利用烟草(Nicotiana tabacum)、生菜(Lactuca sativa var. ramosa)等植物瞬时表达平台,以及酵母、细菌工程菌等平台,建立主要药效成分的高效生物合成体系,摆脱对药材种植的依赖。最后,开发DNA及化学标记,用最快速、准确的方法鉴定蛇床子药材真伪及品质,保证蛇床子市场有序发展。
蛇床子作为传统中药材,在传统用药的基础上新的功效发掘具有广阔的前景,其抗炎症、抗病毒等药用价值已经逐渐被医学界深入研究,未来的产业发展潜力不可估量。而中药材资源等相关研究却存在大量空白,未来需要更多的科研投入,培养更多的优秀人才,才能深入研发产业链各节点的关键技术,系统推动蛇床子产业化发展。
| [1] |
SHOKOOHINIA Y, JAFARI F, MOHAMMADI Z, et al. Potential anticancer properties of osthol:A comprehensive mechanistic review[J]. Nutrients, 2018, 10(1): 36. DOI:10.3390/nu10010036 |
| [2] |
LEE T H, CHEN Y C, HWANG T L, et al. New coumarins and anti-inflammatory constituents from the fruits of Cnidium monnieri[J]. Int J Mol Sci, 2014, 15(6): 9566-9578. DOI:10.3390/ijms15069566 |
| [3] |
SADRAEI H, SHOKOOHINIA Y, SAJJADI S E, et al. Antispasmodic effect of osthole and Prangos ferulacea extract on rat uterus smooth muscle motility[J]. Res Pharm Sci, 2012, 7(3): 141-149. |
| [4] |
TAMURA S, FUJITANI T, KANEKO M, et al. Prenylcoumarin with rev-export inhibitory activity from Cnidii Monnieris Fructus[J]. Bioorg Med Chem Lett, 2010, 20(12): 3717-3720. DOI:10.1016/j.bmcl.2010.04.081 |
| [5] |
LI Q N, LIANG N C, WU T, et al. Effects of total coumarins of Fructus Cnidii on skeleton of ovariectomized rats[J]. Acta Pharmaco Sin, 1994, 15(6): 528-532. |
| [6] |
ZHOU L, SHANGGUAN Z, LIAN Q S, et al. Experimental studies on the anti-arrhythmia effects of osthol[J]. J Mod Appl Pharm, 1996, 13(2): 11-13. 周俐, 上官珠, 连其深, 等. 蛇床子素抗心律失常作用实验研究[J]. 现代应用药学, 1996, 13(2): 11-13. DOI:10.13748/j.cnki.issn1007-7693.1996.02.005 |
| [7] |
CESKA O, CHAUDHARY S K, WARRINGTON P J, et al. Photo-active furocoumarins in fruits of some umbellifers[J]. Phytochemistry, 1986, 26(1): 165-169. DOI:10.1016/s0031-9422(00)81503-4 |
| [8] |
CHANG C I, HU W C, SHEN C P, et al. 8-alkylcoumarins from the fruits of Cnidium monnieri protect against hydrogen peroxide induced oxidative stress damage[J]. Int J Mol Sci, 2014, 15(3): 4608-4618. DOI:10.3390/ijms15034608 |
| [9] |
Delectis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Edita. Florae Reipublicae Popularis Sinicae, Tomus 55(2)[M]. Beijing: Science Press, 1985. 中国科学院中国植物志编辑委员会.中国植物志, 第55卷第2分册[M].北京: 科学出版社, 1985. |
| [10] |
China Pharmacopoeia Committee. Chinese Pharmacopoeia, Vol. 1[M]. Beijing: China Medical Science and Technology Press, 2010: 295-296. 国家药典委员会.中华人民共和国药典, 一部[M].北京: 中国医药科技出版社, 2010: 295-296. |
| [11] |
ZHANG Q Y, ZHENG H C, QIN L P, et al. Biological character and resources of Cnidium monnieri[J]. Chin Wild Plant Resour, 2001, 20(6): 25-26, 35. 张巧艳, 郑汉臣, 秦路平, 等. 蛇床的生物学特性及资源分布[J]. 中国野生植物资源, 2001, 20(6): 25-26, 35. DOI:10.3969/j.issn.1006-9690.2001.06.010 |
| [12] |
CAO H, CAI J N, LIU Y P, et al. Correlative analysis between geogra-phical distribution and nucleotide sequence of chloroplast matK gene of Cnidium monnieri fruit in China[J]. Chin Pharmacol J, 2001, 36(6): 373-376. 曹晖, 蔡金娜, 刘玉萍, 等. 蛇床子地理分布与叶绿体matK基因序列的相关性分析[J]. 中国药学杂志, 2001, 36(6): 373-376. DOI:10.3321/j.issn:1001-2494.2001.06.005 |
| [13] |
LI Y M. Study on the eco-geographical distribution and formation mechanism of coumarins in the fruits of Cnidium monnieri[D]. Shanghai: The Second Military Medical University, 2016: 1-115. 李义敏.蛇床果实香豆素类化学成分的生态地理分布及其形成机理[D].上海: 第二军医大学, 2016: 1-115. http://cdmd.cnki.com.cn/Article/CDMD-90030-1016165183.htm |
| [14] |
ZHANG Q Y. Studies on plant resources, intraspecific variations of Fructus cnidii and its antiosteoporotic effects[D]. Shanghai: The Second Military Medical University, 2001: 1-106. 张巧艳.中药蛇床子的植物资源、种内变异和抗骨质疏松研究[D].上海: 第二军医大学, 2001: 1-106. http://cdmd.cnki.com.cn/Article/CDMD-90024-2001003134.htm |
| [15] |
BI S, LI G L, JIANG Y. Cultivation of Fructus cnidii[J]. Spec Econ Anim Plant, 1999, 2(6): 24. 毕胜, 李桂兰, 蒋勇. 蛇床子的栽培[J]. 特种经济动植物, 1999, 2(6): 24. DOI:10.3969/j.issn.1001-4713.1999.06.028 |
| [16] |
LIAN L F, LOU F J, HUANG D H. Cultivation technique and application of Cnidium monnieri[J]. Jinlin Veget, 2002(3): 10. 连立峰, 娄风菊, 黄大海. 蛇床的栽培技术及应用[J]. 吉林蔬菜, 2002(3): 10. DOI:10.3969/j.issn.1672-0180.2002.03.006 |
| [17] |
DONG J H, ZHU X Y, WANG Z W, et al. High yield cultivation technique of maize intercropping Fructus cnidii[J]. Tianjin Agric For Sci Technol, 2016(2): 37-38. 董家行, 朱学勇, 王增旺, 等. 玉米套种蛇床子高产栽培技术[J]. 天津农林科技, 2016(2): 37-38. DOI:10.3969/j.issn.1002-0659.2016.02.014 |
| [18] |
SUN P. Fluorescence identification analysis of traditional Chinese medicine[J]. Elect J Clin Med Liter, 2018, 5(7): 196-197. 孙鹏. 常用中药荧光鉴别分析[J]. 临床医药文献电子杂志, 2018, 5(7): 196-197. DOI:10.16281/j.cnki.jocml.2018.07.160 |
| [19] |
SHI J L, LI Q, ZHANG C Y. Physical and chemical identification of Fructus cnidii and its false Apium graveolens fruits[J]. Chin J Mod Appl Pharm, 2001, 18(3): 196-197. 史建玲, 李琦, 张春雨. 蛇床子及其伪品旱芹果实的理化鉴别[J]. 中国现代应用药学, 2001, 18(3): 196-197. DOI:10.3969/j.issn.1007-7693.2001.03.012 |
| [20] |
SONG L J, LI J, JIANG Y, et al. Simultaneous determination of coumarins and fingerprint analysis in Cnidium monnieri (L.) Cuss[J]. Tianjin J Trad Chin Med, 2016, 33(6): 368-372. 宋丽娇, 李晋, 姜艳, 等. 蛇床子香豆素类成分的含量测定及指纹图谱研究[J]. 天津中医药, 2016, 33(6): 368-372. DOI:10.11656/j.issn.1672-1519.2016.06.13 |
 2020, Vol. 28
2020, Vol. 28


