2. 宜宾职业技术学院, 四川 宜宾 644003;
3. 中国科学院西双版纳热带植物园, 云南 勐腊 666302;
4. 中国热带农业科学院环境与植物保护研究所, 海口 570100;
5. 云南省红河州气象局, 云南 蒙自 661100;
6. 东方市大田中学, 海南 东方 572600
2. Yibin Vocational & Technical College, Yibin 644003, Sichuan, China;
3. Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Xishuangbanna 666100, Yunnan, China;
4. Environment and Plant Protection Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou 570100, China;
5. Honghe Meteorological Bureau, Mengzi 661100, Yunnan, China;
6. Datian Middle School, Dongfang 572600, Hainan, China
干热河谷是指高温、干旱、空气湿度低的河谷地带,大多分布于热带或亚热带地区。干热河谷与大陆中心沙漠、副热带稀疏草原共同构成世界典型的三大类干旱地区。干热河谷通常森林覆盖率较低,土壤裸露,水土流失严重,生态环境十分脆弱。我国的干热河谷集中分布在中国西南部长江、元江-红河、岷江、雅砻江等的中上游。加强干热河谷生态系统的研究,对于深入理解干旱区环境因子分布及变化规律,深入理解植物与环境之间的相互关系具有重要作用。在干热河谷环境因子的作用及影响方面已开展较多研究。Garnier等[1]认为区域气候环境和水热平衡变化是导致西非亚美干热河谷形成的首要因子。Jina等[2]认为干热河谷局地小气候复杂多样,光热资源普遍较丰富,而水分资源空间分布不均,从而导致植被破碎化,种群小型化。王学锋等[3]通过分析1961-2013年气温观测资料,认为在全球气温显著上升的背景下,干热河谷地区气温日较差存在显著增大的趋势,同时活动积温异常度加大。总结起来,前人的研究认为干热河谷内的环境因子在空间和时间上差异化分布明显,从而造成了自然环境资源的不均等分配。干热河谷内植物对差异化生境则相应产生了不同的对策,尤其在不同海拔高度环境因子变化较大的方向上,体现出来的差异更明显。沈蕊等[4]对元江流域干热河谷草地植物群落结构特征与相似性进行分析,认为干热河谷内种群的扩散和定居受海拔高度的影响,随着海拔高度的变化,植物群落的组成也发生变化。杨锐等[5]对元谋干热河谷植物性状对海拔梯度的响应进行研究,认为干热河谷地区植物对水分环境的海拔梯度变化产生响应,低海拔和高海拔物种对所处环境的适应策略不同。金沙江干热河谷的研究结果同样也反映了类似的适应策略[6]。在干热河谷区域深入开展大尺度植被时空格局的监测和动态服务功能分析,关注气候环境变化对干热河谷生态环境的影响以及植被的响应策略研究,将对生态环境保护和防灾减灾工作具有重要意义[7]。
元江干热河谷是我国西南地区重要的热带水果产地,加强其生态环境的研究,了解其主要气候环境因子的分布特征和变化规律,及其与干旱环境形成的关系,对于农业生产以及生态环境的防灾减灾具有深远意义。蕨类植物是维管植物中的低等类群,对生活环境有着严苛的要求,很多类群都是对环境中的单一或少数生态因子具有强依赖性的,可以指示特定的环境。如水龙骨科(Polypodiaceae)中95%的种类为附生类型,对环境湿度要求较高,而海金沙科(Lygodiaceae)则被看作为先锋植物甚至入侵物种,强烈指示开放性生境及偏酸性土壤[8]。相比于被子植物,蕨类植物世代更替明显,生命周期短,易于作为环境因子监测的媒介,同时多数的蕨类物种植株个体相对较大容易观察,在环境变化的研究中容易被接受[9]。为了研究干热河谷的水热条件分布规律,本研究以蕨类植物作为研究对象,并提出科学假设如下:干热河谷内随着空间位置的变化,气温和降水等主要气候环境因子也将随着改变,而这种改变可以由蕨类植物的空间差异化分布来指示。
1 研究区概况元江干热河谷是我国乃至世界上著名的干热河谷,位于中国西南部元江-红河干流的中上游地区,海拔在900 m以下,年均温23.7℃,年均降水量约800 mm,而蒸发量在2 000 mm以上,蒸发量远大于降水量[4]。元江(红河)是中国和越南共有的一条国际性河流,干流全长约1 140 km,中国境内干流长680 km[10]。通常所说的元江干热河谷指的是嘎洒-蛮耗河段,河谷地势自西北向东南倾斜,形成南北纵列高山深谷地形,大部分属山区或半山区, 平地面积不足5%[10]。
2 方法 2.1 样带和样方设计在元江干热河谷的核心地带元江水文站到蛮耗水文站约100 km长的河段,选取6个地点设置长条形样带,结合样带内的样方进行野外调查。样带样方的设置参考Hernández-Rojas等[11]的方法, 其中沿山坡上升方向设置倾斜样带3条(B、C、E),每条样带垂直高差(即样带内最高点和最低点的海拔高度之差)为200 m,样带内设置10个等距样方,小样方的海拔间距为20 m,根据地形情况因地制宜,大小为5 m×5 m。沿河岸上游到下游的河流方向设置水平样带3条(A、D、F),每条样带长度为1 000 m,样带内设置10个等距样方,小样方的水平间距为100 m,大小为5 m×5 m。各样带的位置见图 1,环境特征描述见表 1。每个样方内的蕨类植物均鉴定物种、拍照,统计植株数量, 并采集标本。

|
图 1 元江-红河流域概况和样方位置 Fig. 1 Yuanjiang-Red River watershed and the plots position |
| 表 1 样带环境特征 Table 1 Environment character of transects |
研究区域内的气温和降水数据主要来源于元江干热河谷内不同海拔高度的11个长期气象站点, 数据区间为1962-2018,取均值。以海拔为自变量, 气温和降水为因变量,将气温、降水与海拔之间的对应关系建立起来,研究和分析不同海拔高度上主要环境因子的变化规律。
2.3 数据的统计分析多样性指标包括香农-威纳指数(均值, H; 最大值, Hmax);物种分布均匀度指数(J)和显著性指数(dominant_index)。
物种数量和种群大小的指标[12-13]包括,在t个样方内的物种数量期待值(Sest);在t个样方内只有1株的物种数量(累计值, Singletons),可以理解为单个体种;仅出现在1个样方中的物种数量(累计值, Uniques),可以理解为稀有种或孤立种;基于物种丰度的覆盖度指数(均值, ACE);基于物种发生率的覆盖度指数(均值, ICE)和物种丰富度指数(Chao2)。
物种丰富度和稀有性指标采用简单线性分析模型GLMMs,基于样带和样方进行适配[14-15]。所有的模型均由卡方检验,显著性水平为0.05。模型的残差采用Shapiro-Wilk方法[16]进行正态性评估(P≥0.5)。为检验各条样带之间的生境差异,采用Tukey方法,在0.05的显著性水平进行运算,将计算结果输入R程序,使用lme4程序包生成简单线性模型GLMM[14-15],使用Vegan程序包进行多级模式分析(mutiple pattern analysis)[17],其中变量为样带和样方,不变量为物种。最后使用labdsv程序包开展指示种分析[18],同时亦采用多级模式分析计算物种在样带中的个体数和出现频率,根据计算结果再返回样带中,将指示种与海拔和主要气候因子进行匹配。
3 结果和分析 3.1 气温、降水的空间分布规律和植被环境根据元江干热河谷内11个气象观测台站多年气象观测数据,元江干热河谷内的降水和温度数据随着海拔的升高而呈现出不同的变化趋势(表 2)。具体表现为,降水量随海拔的升高而增加(正增长), 降水最大出现在高海拔站点(那诺,海拔1 752 m,年均降水1 312 mm),降水量最小出现在靠近主河道的低海拔站点(元江,海拔401 m,年均降水738 mm); 而气温则随着海拔的升高而降低(负增长),年均温最低值出现在高海拔的站点(甲寅,海拔1 712 m,年均温16.7℃),最高值出现在低海拔站点(元江,海拔401 m, 年均温24.5℃)。
| 表 2 元江干热河谷内气温和降水量随海拔高度的变化 Table 2 Changes in temperature and precipitation at different altitudes in Yuanjiang dry-hot valley |
在3条沿海拔高度变化的倾斜样带中,样带C的最高海拔640 m,样带E的最高海拔560 m,此两条样带均位于降水量稀少的地带,年均降水量为738~894 mm,年均温为22.3℃~23.5℃,相对比较炎热。且由于样带郁闭条件差,土壤水分不容易保持,因此不利于蕨类植物的生长。样带B位于海拔490~ 690 m,跟另2条样带一样,也属于降水偏少的海拔带,年均降水量为738~894 mm,但最高处海拔为1 750 m,属于降水相对密集的地区,年均降水量为1 246~1 312 mm。由于地形的因素,样带B尽管降水少,但容易接收来自高海拔降水形成的地表径流和地下渗流,富集土壤水分。在绝对海拔490 m的调查起始点,样点的相对湿度约为70%, 在绝对海拔690 m的调查终点(相对高差200 m), 相对湿度90%以上。沿海拔方向,相对高差200 m的梯度上,相对湿度提高了20%。沟谷里面生长的小乔木余甘子(Phyllanthus emblica)、山黄麻(Trema tomentosa)、小花扁担杆(Grewia biloba var. parviflora)、构树(Broussonetia papyrifera),以及灌木坡柳(Salix myrti- llacea)、枸骨(Ilex cornuta)、密蒙花(Buddleja offici- nalis)和假烟叶树(Solanum erianthum)等共同形成了郁闭条件,防止了空气水分扩散。
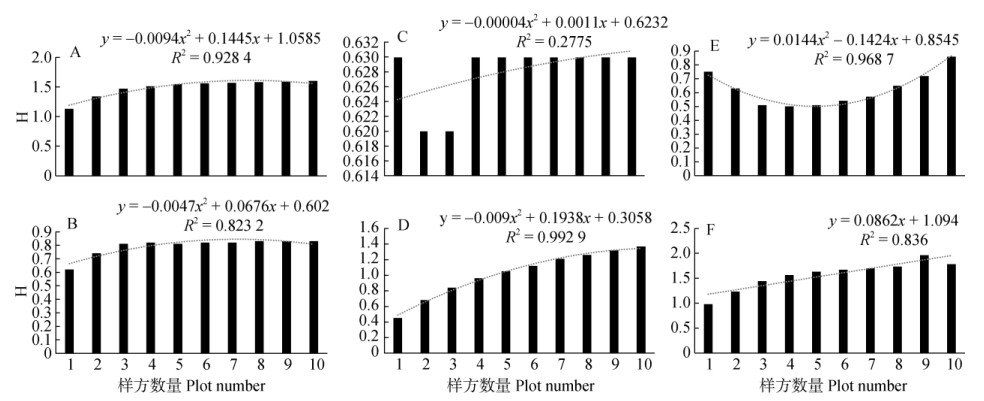
3.2 物种数量、种群大小指数的变化在调查的6个样带中,共发现蕨类植物2 020株,隶属于13科19属38种。由图 2可见,样带A和C的物种累积曲线在快速上升之后很快接近平缓,说明随着调查样方的增加,物种增加的趋势过早地接近于零。在调查中,样带A仅有3种蕨类植物,毛叶粉背蕨(Aleuritopteris squamousa)、旱生卷柏(Selaginella stauntoniana)和毛枝攀援卷柏(S. pseudopaleifera),除旱生卷柏仅在小样方3和4中分布外,另外2种在所有10个样方内均有分布。样带C仅有蜈蚣草(Pteris vittata)和毛叶粉背蕨2种, 且同时出现在2个样方中,而其余样方中没有发现,实际调查的结果与计算结果相吻合。其他4个样带的物种累积曲线比较陡峭,说明物种随着调查路线的延长,样方中还将出现更多的蕨类物种, 这也证明了这4条样带的空间异质性较高,为不同生境需求的蕨类植物提供了生存空间。
|
图 2 样带的多样性变化。A, C, E:倾斜样带; B, D, F:水平样带 Fig. 2 Changes in of diversity indexes among transects and plots. A, C, E: Inclined transect; B, D, F: Horizontal transect |
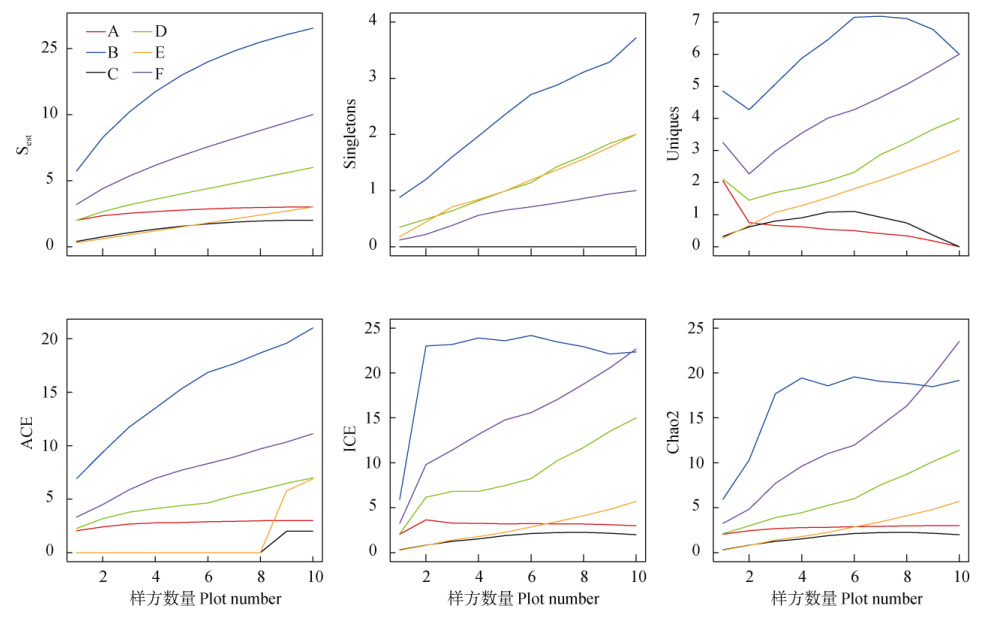
单个体种/孤独种Singletons指征的是样方中只有1个个体存在的物种,通常为个体较大的种。在样带A和C中,Singletons指数为零,不存在单个个体的物种。样带F的曲线快速上升之后亦很快趋于平缓,逼近值为1,在实际样方调查中,也仅发现唯一一个单个体种栗蕨(Histiopteris incisa),单个体种最多且增长趋势较快的是样带B。在实际调查中,多达9种物种以单个个体的形式存在于该样带内的小样方中,分别为蜈蚣草、剑叶凤尾蕨(Pteris ensiformis)、溪边凤尾蕨(P. terminalis)、傅氏凤尾蕨(P. fauriei)、海金沙(Lygodium japonicum)、薄叶卷柏(Selaginella delicatula)、半月形铁线蕨(Adiantum philippense)、热带鳞盖蕨(Microlepia speluncae)和瘤蕨(Phymatosorus scolopendria)。样带D亦有单个体种存在,分别为翠云草(Selaginella uncinata)、线羽凤尾蕨(Pteris arisanensis)、铁线蕨(Adiantum capillus- veneris)、假鞭叶铁线蕨(Adiantum malesianum)、姬蕨(Hypolepis punctata)、华南毛蕨(Cyclosorus para- siticus)和粉叶蕨(Pityrogramme calomelanos)。显而易见,以单个个体的形式存在于小样方中的都是一些常见、分布广泛、适应能力强的蕨类物种。
单样方种/稀有指数Uniques主要是通过区分对生境需求差异较大的物种,借以指征同一个样带内存在的多种不同生境。结果表明,样带A和C的Uniques指数极低,实际调查结果是这两条样带中物种数极低(分别为3和2种),且个体分布较为均匀。样带B、D、E和F的Uniques指数均随着样方数的增加呈上升趋势,说明随着调查的深入,样带出现不同蕨类物种的可能性在增加,且仅在其中1个样方内出现,亦暗示着生境的多样化在增加。
物种丰富度指数ACE、ICE和Chao2都是用于评估样带/样方内的物种丰富度,ACE是基于物种的丰度(个体数),ICE则是基于物种的发生率来计算;Chao2为经过修正的指数,是通过观测到的单个体种/孤独种Singletons结果推算出的理论丰富度,这个丰富度更接近真实的丰富度[19-20]。从图 3可见,ACE、ICE和Chao2曲线的趋势基本一致, 三者结果可以相互验证。结果表明,样带B、D和F的物种丰富度较高,其中样带D、F的蕨类物种数为10种,样带B则多达22种;样带A、C和E的物种丰富度较低,每条样带仅有2~3种蕨类植物。
|
图 3 样带及样方中的物种数量和丰富度变化 Fig. 3 Changes in species number and abundance in transects and plots |
对每个样带内的样方分别进行了多样性分析, 再对分析结果进行回归,评估样带内的多样性变化趋势。3个倾斜样带(图 2: A, C, E)沿坡度(海拔)上升设置小样方1~10个,样带B的多样性指数较高, 且变化趋势稳定,从较低海拔样方到较高海拔样方没有出现物种的突然增加或减少,说明该条样带内生境是呈均匀变化的。而在另两条样带C和E,多样性变化整体值偏低,且在样方之间有较大的差异,说明这两条样带中不同样方之间的生境是不连续的,变化较大,这种生境变化不仅不能维持原有蕨类物种的连续生存空间,也不支持新来的蕨类物种定居和繁衍。在实际调查中,样带B中的蕨类物种多达22种,在样方中逐渐增加,样带C和E分别只有2和3种,且仅分布于少数几个样方中,多数样方的蕨类植物为零记录。
水平样带(图 2: B, D, F)中,样带D和F的多样性指数较高,其中样带D的多样性在样方间呈现出明显的增长趋势,沿河流方向,不同的蕨类物种伴随着新的生境出现。这与图 3中的物种丰富度指数ACE、ICE和Chao2的变化趋势相吻合。样带F虽然也有较高的多样性指数,但是样方间的差异较大且变化不规律,显示为不连续的生境。样带A则相反,由于紧靠河岸,水分补给与河流泥沙基质在各样方间均匀分布,因此,尽管其多样性整体偏低, 但是蕨类物种在样方内是均匀分布。
3.4 环境温度和水分分布与蕨类植物分布的关系在元江干热河谷中,温度随着海拔升高而降低,年均20℃以上的高温通常只发生在海拔1 051 m以下、年均降水量在1 219 mm以下的区域。本次调查中,蕨类植物多样性均值H=1.74,发生于倾斜样带B,海拔为490~690 m。然而在较低海拔的样带D和F,蕨类植物多样性均值H分别为1.50和1.78,海拔分别为260和230 m。可见,在元江干热河谷内,海拔对于蕨类植物的分布没有产生明显的影响。
在水分影响方面,元江干热河谷内部的水分循环机制比较特殊,除了没有山体对水汽的抬升作用外,地形作用还在两方面对降水产生影响。一是暖湿气流移动到河谷时会产生下沉增压、升温趋势, 从而减弱了降水天气系统内部水汽抬升机制,一定程度减少了水汽的凝结效果;二是元江干热河谷日照充足、常年温度高、蒸发量大,河谷内容易形成岭谷风,岭谷风将河面蒸发的水汽被带到海拔较高的坡地,冷凝形成降水。因此,在元江干热河谷内,高海拔地区降水丰富,空气湿度较大,中低海拔地区高温少雨,空气干燥,从不同气象观测台站获得的降水数据亦能证明。通常认为,由于蕨类植物繁殖阶段对水分存在极度依赖,因此其分布状态与环境中水分条件密切相关。Pouteau等[21]认为影响蕨类植物自然分布的主要因子为基质、郁闭度和人为干扰;张伶俐等[22]则认为蕨类植物分布在一定程度上取决于生物地理性质,同时也受到生境异质性和气候因子的强烈影响。附生型蕨类已被证明对空气中水分以及环境的郁闭度有着强烈的依赖性[23-24], 而土生蕨类植物是否也有着相同的依赖性呢?在本研究中,土生型蕨类和附生型蕨类并没有表现出对水分需求的明显分化,但是却都普遍表现出正相关的关系。沿河道的3条水平样带中有2条样带实际调查到的蕨类物种均为10种(土生、附生蕨类均有),另1条样带调查到3种(土生、附生蕨类均有);沿山坡倾斜样带中,1条样带有蕨类植物22种(土生、附生蕨类均有),其余2条样带仅有2~3种(土生、附生蕨类均有)。从水分获取条件来说,3条水平样带紧靠河流,水源补给充分;3条倾斜样带中的样带B有山顶降水补给,土壤潮湿、环境郁闭、空气相对湿度较大。我们的调查研究首次用数据证明了水分条件(土壤基质含水量和空气中含水量)对蕨类植物自然分布有决定性的作用。我们在海南岛针对珍稀濒危蕨类植物的调查分析,也揭示出水分和郁闭度是决定蕨类植物自然分布的首要原因[25-26]。
3.5 指示种分析元江-红河干热河谷是生态环境脆弱的地区,为表征该地区的生境,在所调查的蕨类植物种类中筛选部分对环境因子波动比较敏感的物种,以便及时观测该地区的植被种群动态及环境变化。为此,进行了多级模式分析,并将显著性水平控制在P=0.05,共筛选到8指示种(表 3, 图 4),分别为毛枝攀援卷柏、毛叶粉背蕨、假鞭叶铁线蕨、蜈蚣草、骨碎补、水鳖蕨(Asplenium delavayi)、睫毛卷柏(Selaginella ciliaris)和海金沙。对各种的分布海拔进行重叠计算,表明绝大多数指示种分布于490~690 m海拔高度。
| 表 3 指示种 Table 3 Indicator species |

|
图 4 部分指示种。A:毛枝攀援卷柏; B:水鳖蕨; C:毛叶粉背蕨 Fig. 4 Partial indicator species. A: Selaginella pseudopaleifera; B: Asplenium delavayi; C: Aleuritopteris squamosa |
王晖等[27]的研究表明,梵净山自然保护区内共有蕨类植物106属329种,物种数量随海拔升高而迅速下降,两者呈强的负相关关系。然而本研究的调查结果却相反,在6条样带中,共有蕨类植物13科19属34种,其中,沿海拔高度上升的样带B中蕨类植物种类随海拔的升高而增加,二者呈显著正相关关系。低海拔样方中,广适性的蜈蚣草和假鞭叶铁线蕨较为常见。随海拔升高,蕨类物种为只能在湿度较大的环境中生长的水鳖蕨和光亮瘤蕨(Phymatosorus cuspidatus),环境相对湿度由70%增加到90%以上;样方内的蕨类植物数量由54株增加到了384株,增长近8倍。这可能是随着海拔高度的上升,降水量逐渐上升,但是温度却逐渐降低,蕨类植物适宜生长在温暖、潮湿的地带,由于蕨类植物对水分的强烈依赖,导致蕨类植物种类随湿度变化而增加。除蕨类植物外,更多的维管植物类群同样亦会出现沿海拔变化而产生的种类和种群大小变化,但有研究认为相同海拔高度,大面积的生境能支持更多的种类[28]。较高海拔虽然能得到更多降水以保持相应的湿度,但是随着海拔的继续升高,蕨类物种的适应性开始降低,亦即存在一个分布的海拔高度极限,这个分布极限在不同类群之间存在差异,如铁角蕨属(Asplenium)、耳蕨属(Polystichum)和冷蕨属(Cystopteris)的许多种都能分布到4 000 m以上的区域[29]。玉龙耳蕨(Polystichum glaciale)作为中国产蕨类植物中最耐寒的种类之一,分布于玉龙雪山的雪线附近[30]。
4.2 干热河谷的多样化生境与蕨类植物物种丰富度的关系根据生境异质性对物种多样性的贡献[31],不同物种需要不同的生境,生境复杂的区域往往拥有更为丰富、多样的生物类群;反之,在生境相对较为单一的区域,其物种的丰富度也相对较低。张伶俐等[22]对云南地区蕨类植物多样性分布格局的研究表明,生境异质性对多样性格局的影响有重要作用,且这种作用可能与生物地理分布区性质有关。本研究结果表明,倾斜样带B、C与水平样带D、F的Singletons指标和Uniques指数均较高,指示元江干热河谷内异质化生境较多,可维持较多的蕨类物种及其种群,而在生境单一的地区,如样带A和E,仅见少量蕨类植物。这表明生境异质性与蕨类植物种类的数量呈正相关的关系,即在生境越复杂的地方,蕨类植物的种类也越多,物种的丰富度也越高。元江干热河谷生境破碎化严重,绝大多数地方不利于蕨类植物生长繁殖和种群的发展壮大,因此条块化存在的阴湿小生境成为蕨类植物的避难所。有的样带(如样带F)内,由于水热条件良好, 甚至发育了较高大的木本植物,如聚果榕(Ficus race- mosa)、构树(Broussonetia papyrifera)形成强烈郁闭条件,更有利于保持空气湿度,从而形成有利于蕨类植物生长繁殖的特殊环境。哥斯达黎加的林冠学分析认为荫蔽条件帮助蕨类植物抵挡住了大部分的直射阳光,从而促进了附生及半附生蕨类植物的种群发展[32]。但是另一方面,林下有限的光照和水资源也促进了蕨类物种之间的竞争,在竞争过程中实现了生态空间的再次分配[33]。
4.3 指示种的差异指示种是一类客观可见的物种,用以表征特定的生存环境,同时指示种的出现与缺失、种群密度变化、传播和繁殖成功率变化均能反映生存环境的改变[34]。由于绝大多数蕨类植物对外界自然环境的要求十分严格,对生态环境具有高度的敏感性,不同物种对环境具有严格的选择性,只有满足其生长生存的条件才能够生存下去,因此,这些蕨类植物可以作为指示植物指示当地的气候、土壤和地质类型[25-26, 31]。Pouteau等的研究表明蕨类还可以作为热带高海拔地区环境变化的生物指示媒介[21]。本研究中筛选的指示种中有些是生态幅较广、适应性强、自然分布广泛的种,如蜈蚣草、海金沙、假鞭叶铁线蕨等;此外,还有生态幅较窄、分布区较小的种,如毛枝攀援卷柏、水鳖蕨、睫毛卷柏、骨碎补和毛叶粉背蕨,这些种基本上集中分布于海拔490~ 690 m, 这也是元江干热河谷内降水量开始显著增加、温度显著降低的海拔高度。
元江干热河谷地区蕨类植物种类较少,且大多生长在阴蔽、潮湿、热量差异大的地带,大部分种类为土生,少数为附生。由于谷地气流局部环流和焚风影响结合而形成了特殊的干热气候; 同时由于现代季风环流和山谷地形环境的共同作用使区域干旱化趋势一直在增长,造成了区域生态环境的脆弱,导致蕨类植物的数量较少。由于蕨类植物繁殖过程中对水因子的强烈依赖性,因此水分因素在蕨类自然分布中扮演着重要的角色。此外,地形的变化容易形成小范围的适宜生境,成为蕨类植物的避难所。海拔的因素虽然有一定的影响,但可能是由于海拔上升引起温度的变化而间接产生影响。在流域内的某些地点,地形相对较平缓,生境相对较为单一,蕨类植物的物种多样性较低。如果从生态学角度理解地区蕨类植物多样性的空间格局,生境异质性和水分差异可能是重要的影响因素。
| [1] |
GARNIER A, LESPEZ L. Fluvial system dynamics of Sudano-Sahelian zone during the Late Holocene:The Yamé River (Dogon Country, Mali)[J]. Geomorphology, 2019, 340: 32-52. DOI:10.1016/j.geomorph.2019.04.018 |
| [2] |
JINA J, WANG Q, WANGA J L, et al. Tracing water and energy fluxes and reflectance in an arid ecosystem using the integrated model SCOPE[J]. J Environ Manage, 2019, 231: 1082-1090. DOI:10.1016/j.jenvman.2018.10.090 |
| [3] |
WANG X F, JI W J, ZHANG M S, et al. Comparative characteristics of heat resources in the dry-hot valleys in Yunnan Province in recent 53 years[J]. Resour Environ Yangtze Basin, 2015, 24(S1): 92-97. 王学锋, 吉文娟, 张茂松, 等. 近53年来云南干热河谷热量资源变化的比较性特征[J]. 长江流域资源与环境, 2015, 24(S1): 92-97. DOI:10.11870/cjlyzyyhj2015Z10013 |
| [4] |
SHEN R, ZHANG J L, HE B, et al. The structure characteristic and analysis on similarity of grassland community in dry-hot valley of Yuanjiang River[J]. Ecol Environ, 2010, 19(12): 2821-2825. 沈蕊, 张建利, 何彪, 等. 元江流域干热河谷草地植物群落结构特征与相似性分析[J]. 生态环境学报, 2010, 19(12): 2821-2825. DOI:10.3969/j.issn.1674-5906.2010.12.009 |
| [5] |
YANG R, ZHANG B R, WANG L L, et al. The response of plant functional traits' group to gradients of altitude in dry-hot valley of Yuan-Mou[J]. Ecol Environ, 2015, 24(1): 49-56. 杨锐, 张博睿, 王玲玲, 等. 元谋干热河谷植物功能性状组合的海拔梯度响应[J]. 生态环境学报, 2015, 24(1): 49-56. DOI:10.16258/j.cnki.1674-5906.2015.01.008 |
| [6] |
LIU F Y, ZHANG Z X, WANG X Q, et al. Seed dispersion and seed bank characteristics of Terminalia franchetii in dry-hot valley of Jinsha River[J]. J Trop Subtrop Bot, 2012, 20(4): 333-340. 刘方炎, 张志翔, 王小庆, 等. 金沙江干热河谷滇榄仁种子扩散与种子库特征研究[J]. 热带亚热带植物学报, 2012, 20(4): 333-340. DOI:10.3969/j.issn.1005-3395.2012.04.003 |
| [7] |
YANG J D, ZHANG Z M, SHEN Z H, et al. Review of research on the vegetation and environment of dry-hot valleys in Yunnan[J]. Biodiv Sci, 2016, 24(4): 462-474. 杨济达, 张志明, 沈泽昊, 等. 云南干热河谷植被与环境研究进展[J]. 生物多样性, 2016, 24(4): 462-474. DOI:10.17520/biods.2015251 |
| [8] |
GU Z J, DUAN X W, SHI Y D, et al. Spatiotemporal variation in vegetation coverage and its response to climatic factors in the Red River Basin, China[J]. Ecol Indic, 2018, 93: 54-64. DOI:10.1016/j.ecolind.2018.04.033 |
| [9] |
ABOTSI K E, BOSE R, ADJOSSOU K, et al. Ecological drivers of pteridophyte diversity and distribution in Togo (West Africa)[J]. Ecol Indic, 2020, 108: 105741. DOI:10.1016/j.ecolind.2019.105741 |
| [10] |
DUAN X W, ZHANG G L, RONG L, et al. Spatial distribution and environmental factors of catchment-scale soil heavy metal conta-mination in the dry-hot valley of Upper Red River in southwestern China[J]. Catena, 2015, 135: 59-69. DOI:10.1016/j.catena.2015.07.006 |
| [11] |
HERNÁNDEZ-ROJAS A, KESSLER M, KRÖMER T, et al. Richness patterns of ferns along an elevational gradient in the Sierra de Juárez, Oaxaca, Mexico:A comparison with Central and South America[J]. Am Fern J, 2018, 108(3): 76-94. DOI:10.1640/0002-8444-108.3.76 |
| [12] |
CHAO A, CHIU C H. Bridging the variance and diversity decom-position approaches to beta diversity via similarity and differentiation measures[J]. Methods Ecol Evol, 2016, 7(8): 919-928. DOI:10.1111/2041-210X.12551 |
| [13] |
RICOTTA C, PODANI J. On some properties of the Bray-Curtis dissimilarity and their ecological meaning[J]. Ecol Complex, 2017, 31: 201-205. DOI:10.1016/j.ecocom.2017.07.003 |
| [14] |
BOLKER B M, BROOKS M E, CLARK C J, et al. Generalized linear mixed models:A practical guide for ecology and evolution[J]. Trends Ecol Evol, 2009, 24(3): 127-135. DOI:10.1016/j.tree.2008.10.008 |
| [15] |
PINHEIRO J, BATES D, DEBROY S, et al. Nlme: Linear and non-linear mixed effects models[CP/OL]//R Package, Version 31-101. R Package, 2011.
|
| [16] |
SHAPIRO S S, WILK M B. An analysis of variance test for normality (complete samples)[J]. Biometrika, 1965, 52(3/4): 591-611. DOI:10.1093/biomet/52.3-4.591 |
| [17] |
OKSANEN J, KINDT R, LEGENDRE P, et al. The vegan package[J]. Community Ecol Package, 2007, 10: 631-637. |
| [18] |
HAQ F, AHMAD H, IQBAL Z, et al. Multivariate approach to the classification and ordination of the forest ecosystem of Nandiar valley western Himalayas[J]. Ecol Ind, 2017, 80: 232-241. DOI:10.1016/j.ecolind.2017.05.047 |
| [19] |
CHAO A. Nonparametric estimation of the number of classes in a population[J]. Scand J Statist, 1984, 11(4): 265-270. DOI:10.2307/4615964 |
| [20] |
CHAO A. Estimating the population size for capture-recapture data with unequal catchability[J]. Biometrics, 1987, 43(4): 783-791. DOI:10.2307/2531532 |
| [21] |
POUTEAU R, MEYER J Y, BLANCHARD P, et al. Fern species richness and abundance are indicators of climate change on high-elevation islands:Evidence from an elevational gradient on Tahiti (French Polynesia)[J]. Climat Change, 2016, 138(1/2): 143-156. DOI:10.1007/s10584-016-1734-x |
| [22] |
ZHANG L L, XU C D, FENG J M. Biogeographical explanation of distribution pattern of fern diversity in Yunnan Province[J]. J Chu-xiong Norm Univ, 2017, 32(3): 45-50. 张伶俐, 徐成东, 冯建孟. 云南地区蕨类植物多样性分布格局的生物地理学解释[J]. 楚雄师范学院学报, 2017, 32(3): 45-50. DOI:10.3969/j.issn.1671-7406.2017.03.011 |
| [23] |
ANDRADE J L, NOBEL P S. Microhabitats and water relations of epiphytic cacti and ferns in a lowland neotropical forest[J]. Biotropica, 1997, 29(3): 261-270. DOI:10.1111/j.1744-7429.1997.tb00427.x |
| [24] |
HIETZ P, BRIONES O. Correlation between water relations and within-canopy distribution of epiphytic ferns in a Mexican cloud forest[J]. Oecologia, 1998, 114(3): 305-316. DOI:10.1007/s004420050452 |
| [25] |
YANG F C, HU X W, YOU L L. Geographical distribution and floristic composition of pteridophytes in Hainan island[J]. Acta Bot Yunnan, 2007, 29(2): 155-160. 杨逢春, 胡新文, 尤丽莉. 海南蕨类植物自然分布及区系组成[J]. 云南植物研究, 2007, 29(2): 155-160. DOI:10.3969/j.issn.2095-0845.2007.02.004 |
| [26] |
YANG F C, ZHANG C L, WU G, et al. Endangered pteridophytes and their distribution in Hainan island, China[J]. Amer Fern J, 2011, 101(2): 105-116. DOI:10.1640/0002-8444-101.2.105 |
| [27] |
WANG H, WEI Q, WU F F, et al. The characteristics of pteridophytes flora in Mt. Fanjingshan nature reserve[J]. J Guizhou Norm Univ (Nat Sci), 2014, 32(4): 22-28. 王晖, 魏奇, 吴菲菲, 等. 梵净山自然保护区蕨类植物的区系特征[J]. 贵州师范大学学报(自然科学版), 2014, 32(4): 22-28. DOI:10.3969/j.issn.1004-5570.2014.04.004 |
| [28] |
XU X, ZHANG H, LUO J, et al. Area-corrected species richness patterns of vascular plants along a tropical elevational gradient[J]. J MT Sci-ENGL, 2017, 14(4): 694-704. DOI:10.1007/s11629-016-3894-6 |
| [29] |
ALEJANDRO R, HERNANDEZ-CARDENAS, MENDOZA-RUIZ A, et al. The alpine ferns of the trans-Mexican volcanic belt[J]. Amer Fern J, 2019, 109(1): 11-25. DOI:10.1640/0002-8444-109.1.11 |
| [30] |
YU X, ZHANG B, OU Z, et al. Investigation of natural population and niche analysis for Sorolepidium glaciale, a plant species with extremely small populations[J]. J Hubei Univ National (Nat Sci), 2018, 36(1): 1-5. 余潇, 张宝, 区智, 等. 极小种群植物玉龙蕨的群落调查及生态位分析[J]. 湖北民族学院学报(自然科学版), 2018, 36(1): 1-5. DOI:10.13501/j.cnki.42-1569/n.2018.03.001 |
| [31] |
HOLTMANN L, KERLER K, WOLFGART L, et al. Habitat hetero-geneity determines plant species richness in urban stormwater ponds[J]. Ecol Eng, 2019, 138: 434-443. DOI:10.1016/j.ecoleng.2019.07.035 |
| [32] |
JAMES E W JrCATHERINE C.. Habitat differentiation of ferns in a lowland tropical rain forest[J]. Amer Fern J, 2009, 99(3): 162-175. DOI:10.1640/0002-8444-99.3.162 |
| [33] |
ZHANG, H, ZHU S D, JOHN R, et al. Habitat filtering and exclusion of weak competitors jointly explain fern species assemblage along a light and water gradient[J]. Sci Rep, 2017, 7: 298. DOI:10.1038/s41598-017-00429-9 |
| [34] |
ZHOU S X, PENG Y S, GAO P X, et al. Spatial pattern and association of main species in endangered plant Sinojackia rehderiana community[J]. J Trop Subtrop Bot, 2019, 27(4): 349-358. 周赛霞, 彭焱松, 高浦新, 等. 濒危植物狭果秤锤树群落内主要树种的空间分布格局和关联性[J]. 热带亚热带植物学报, 2019, 27(4): 349-358. DOI:10.11926/jtsb.3992 |
 2020, Vol. 28
2020, Vol. 28



