2. 中国科学院大学, 北京 100049;
3. 广东万山土壤修复技术有限公司, 广州 510060
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Guangdong Wanshan Soil Remediation Technology Co. Ltd., Guangzhou 510060, China
我国农田土壤重金属污染问题非常突出,2014年发布的《全国土壤污染状况调查公报》显示,我国耕地重金属超标率达19.7%,其中Cd点位超标率达7.0%,污染农田总面积约为2.00×107 hm2[1]。土壤重金属污染对粮食安全、公众健康和生态环境都造成了巨大的危害[2-3],成为我国面临的重要社会问题。农田重金属污染治理难度极大,可用的技术不多,目前提出的植物修复、重金属钝化、淋洗清除、电动修复等方法,多数效果不理想[4-5]。相对而言,重金属钝化技术较具实用性与可推广性,当前已在实践中得到应用。
农田重金属原位钝化具有成本低、见效快、技术简单、边生产边修复等优点[6-7]。但目前钝化技术还不成熟,效果不稳定,仍面临大量需要解决的问题。由于重金属钝化没有选择性,在降低重金属有效性的同时,也会抑制其他微量元素的供应[8],过高浓度的钝化剂则会造成农作物减产。目前报道的钝化剂种类很多,其修复效果跟土壤性状有关,尤其是不同土壤类型上,适用的钝化剂也不同。在南方弱酸性土上, 硅灰石有出色表现,能有效抑制作物对重金属Cd的吸收,而对作物产量没有负面影响[9]。分子筛具有很强的离子交换能力和吸附能力[10],分子筛的NH4+交换速率是土壤的34倍[11],能有效吸附水中的重金属, 降低其移动性[12],因此分子筛有钝化土壤Cd的应用潜力[13]。然而,2种钝化剂的实际应用仍需要大量的评估,包括在不同土壤性状上的表现,对作物吸收养分的影响,以及对土壤耕作性状的影响。
因此,本文利用4A分子筛和硅灰石为钝化剂,以生菜(Lactuca sativa)进行盆栽试验,研究不同剂量的2种钝化剂对广东省韶关市曲江区马坝镇污染土壤的修复效果和对植物元素吸收的影响,为钝化剂在粤北地区的推广应用提供科学依据。
1 材料和方法 1.1 试验材料试验土壤取自广东省韶关市曲江区马坝镇Cd污染农田,采用5点取样法,对表层20 cm土壤进行采样。土壤pH为5.83,土壤阳离子交换量(cation exchange capacity, CEC)为3.9 cmol/kg,全氮、速效磷、速效钾、有机质含量分别为1.03、0.5、0.13和36.17 g/kg,总Cd、有效Cd、有效Pb、有效Zn、有效Cu、有效Mn含量分别为2.97、1.87、80.44、36.35、9.90和9.06 mg/kg。钝化剂有4A分子筛和硅灰石, 4A分子筛(简称分子筛)是一种合成的硅铝酸盐,具有孔径0.4 nm的微孔立方晶格,可以吸附临界直径小于4A (0.4 nm)的分子,分子筛由36.98% SiO2、28.84% Al2O3和15.84% Na2O构成,颗粒直径19 μm,pH为11.8 (1%水溶液)。硅灰石是一种天然的单链硅酸盐矿物,由45.18% SiO2、42.76% CaO和3.04% MgO构成,硅灰石颗粒直径约14 μm,pH为8.43 (1%水溶液)。分子筛和硅灰石分别购自上海有新分子筛有限公司和江西盛泰化工有限公司。供试生菜(Lactuca sativa)种子购自高华种子有限公司。
1.2 试验设计在中国科学院华南植物园进行盆栽试验。每个塑料盆(290 mm×230 mm×115 mm)装3.0 kg Cd污染土壤。设置9个处理:按220、440、660、880 mg Si/kg浓度分别添加硅灰石和分子筛,即硅灰石0.95、1.9、2.85和3.8 g/kg,分子筛1.04、2.08、3.12和4.16 g/kg,以不加钝化剂为对照,每处理设置4个重复。钝化剂与土壤充分混合,保持土壤含水量约为70%,平衡30 d。以尿素、磷酸二氢铵、硫酸钾为基肥, 养分含量分别为N 0.2 g/kg、P2O5 0.15 g/kg和K2O 0.2 g/kg。施肥后平衡3 d。穴盘育苗15 d后,每盆分别移栽3株生菜幼苗,生长31 d后收获。
1.3 样品分析生菜收获后用去离子水彻底冲洗,分为地上部和地下部,在70℃的烘箱中烘至恒定并称量,然后粉碎并过0.5 mm筛,用于后续测定。生菜收获后采集土壤样品,风干,分别过2和0.15 mm筛。为了测定Cd总量,土壤和植物样品分别用HNO3-HF- HCl (体积比6:2:3)和5 mL浓HNO3微波炉消解,用电感耦合等离子体发射光谱法(ICP-OES, Optima 2000 DV, PE, USA)测定土壤和植物样品中Cd含量。土壤pH采用pH计(Mettler Toledo FE-20K)测定(土:水=1:2.5)。采用三氯化六铵合钴浸提-分光光度法测定土壤阳离子交换量(HJ 889-2017)。土壤Cd、Pb、Cu、Zn、Mn有效性采用DTPA浸提法(48 h内测定),土壤有效K、Ca、Mg和Na含量采用Mehlich-3溶液浸提[14],用原子吸收光谱法(AAS, contrAA800, 德国耶拿)进行测定,样品均测试试剂空白。每批样品的消化和提取均采用标准品大米样品GBW(E)100357或土壤样品GBW07437,样品回收率控制在90%~ 110%。采用ICP多元素标准溶液(GNM-M27195- 2013)作为质量控制(QC)标准校准测定的金属元素浓度,回收率控制在90%~110%。
1.4 钝化剂Cd吸附能力等温实验称取硅灰石0.05 g于50 mL离心管中,加入浓度分别为0、2、5、10、20、40、150 mg/L的Cd溶液50 mL。称取分子筛0.02 g于50 mL离心管中, 加入浓度分别为110、125、150、175、250、300 mg/L的Cd溶液50 mL。每处理设4个重复。于室温下300 r/min震荡4 h,恒温平衡16 h,3 374×g离心5 min,收集上清液用原子吸收光谱法(AAS, contr- AA800, 德国耶拿)测定。用Langmuir等温方程描述钝化剂的Cd吸附能力,Q=(a×b×x1-c)/(1+b×x1-c), 式中,Q为达到平衡时钝化剂吸附Cd2+的含量(mg/g), x为溶液中Cd2+的初始浓度(mg/L), a、b和c分别是与吸附性能相关的常数。
1.5 数据分析所有数据均为4次重复的平均值±标准差。采用单因素方差分析确定处理间的差异显著性(P < 0.05),采用Tukey honestly显著性差异检验法进行多重比较。以皮尔逊相关系数来表示土壤化学性质、土壤有效Cd含量和植物Cd含量之间的相关性(双尾检验,置信区间为95%)。采用SPSS 19.0软件对数据进行统计分析,使用Origin Pro软件制图。
2 结果和分析 2.1 钝化剂对生菜生物量的影响由图 1可知,2种钝化剂在≤440 mg Si/kg时对生菜地上部生物量没有显著影响,但当超过这一阀值时,不同钝化剂产生了不同作用,硅灰石使生物量上升,660 mg Si/kg钝化剂使生菜地上部生物量从3.98 g上升至4.47 g,比对照增加12%,进一步增大施用量对生物量不产生显著的影响。而分子筛超过660 mg Si/kg后,生菜地上部生物量持续下降,达到880 mg Si/kg时,比对照下降29%。2种钝化剂处理的生菜地下部生物量接近并且变化趋势一致,随着钝化剂用量的提高生物量有所下降, 但与对照的差异不显著,仅880 mg Si/kg的分子筛处理使生菜地下部生物量显著低于对照。
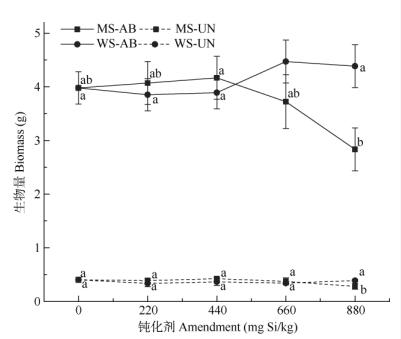
|
图 1 钝化剂对生菜生物量的影响。 MS: 4A分子筛; WS:硅灰石; AB:地上部分; UN:地下部分; n=4;线上的不同字母表示差异显著(P < 0.05)。以下图同。 Fig. 1 Effect of amendment on biomass of lettuce. MS: 4A molecular sieve; WS: Wollastonite; AB: Aboveground; UN: Underground; n=4. Different letters above the same line indicate significant difference at 0.05 level. The same is following Figures. |
钝化处理均提高了土壤pH,且随着钝化剂添加量的增加而线性上升,最大用量时,pH上升了1个单位以上,接近中性(表 1)。2种钝化剂均显著增大了土壤阳离子交换量(CEC),但不同添加量的分子筛处理间,土壤CEC无显著差异。而随着硅灰石施加量的增加,土壤CEC持续增大,添加880 mg Si/kg时CEC达13.34 cmol+/kg,上升了34.8%。
| 表 1 钝化剂对土壤pH、CEC、有效K、Na、Ca、Mg、Mn含量的影响 Table 1 Effects of amendment on soil pH, CEC, contents of available K, Na, Ca, Mg and Mn |
分子筛明显增加了土壤有效K含量,最大用量时提高了33.3%,硅灰石对土壤K的有效性无显著影响。含Na材料分子筛使土壤有效Na含量显著增大,并与添加量呈显著线性相关,最大用量时土壤有效Na含量上升10倍以上,但硅灰石略微降低了土壤有效Na含量。除了添加660 mg Si/kg分子筛使土壤有效Ca含量略有增加外,其他分子筛处理均显著降低了土壤有效Ca含量。含Ca材料硅灰石使土壤有效Ca含量显著增加,并与添加量呈线性相关。分子筛和硅灰石使土壤有效Mg含量分别增大了3%~19%和17%~28%,但均显著降低了土壤有效Mn含量,尤其是添加660 mg Si/kg钝化剂时,降幅达50%。
图 2表明钝化处理不一定意味着土壤重金属有效性的下降。添加硅灰石使土壤有效Cd含量增大了6%~11%,即使是最大施用量,也没有使有效Cd含量下降,仍高于对照。添加220 mg Si/kg分子筛也使土壤有效Cd含量增加了6%,而添加440 mg Si/kg分子筛时,有效Cd含量与对照相当,只有当添加660 mg Si/kg分子筛后有效Cd含量才明显下降,添加880 mg Si/kg分子筛时土壤有效Cd含量降低了8%。添加220 mg Si/kg硅灰石增加了土壤有效Pb含量,且随添加量增大略有下降;分子筛则对土壤Pb有效性无显著影响。2种钝化剂对土壤有效Cu含量的作用相反,硅灰石显著增加了土壤有效Cu含量,增幅达37%~55%;分子筛则显著降低,降幅达59%~65%。钝化处理显著抑制了土壤Zn的有效性,硅灰石和分子筛均使土壤有效Zn含量降低90%以上。
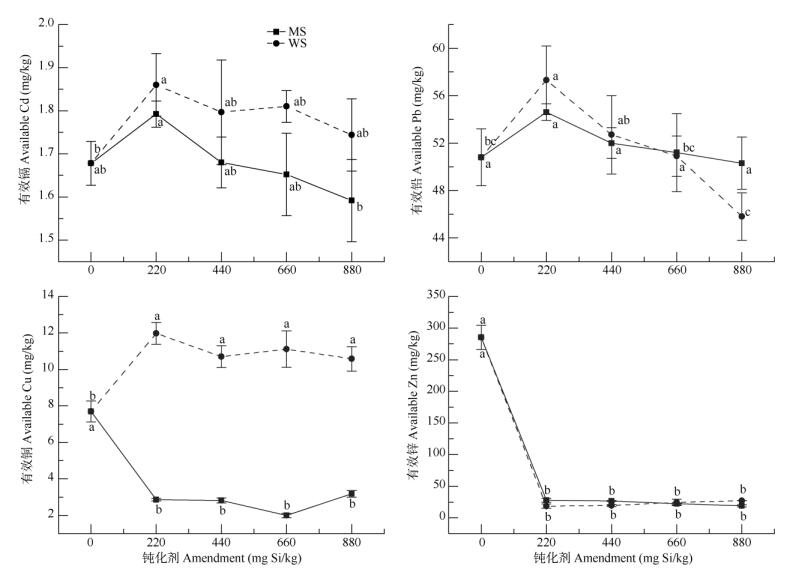
|
图 2 钝化剂对土壤有效态Cd、Pb、Cu、Zn含量的影响 Fig. 2 Effect of amendment on concentrations of available Cd, Pb, Cu and Zn |
分子筛对生菜地上部和地下部不同元素的影响不同(表 2)。施用分子筛对生菜地上部K含量无显著影响,但显著降低地下部K含量。分子筛降低生菜地上部Ca、Mg、Mn含量,Mn含量的降幅尤其明显,最大降幅达57%;也降低了生菜地下部Mg、Mn含量,其中Mn含量最大降幅达45%,但提高了生菜地下部Ca含量。
| 表 2 钝化剂对生菜元素含量的影响 Table 2 Effects of amendment on element contents of lettuce |
硅灰石对生菜地上部K、Ca、Mg含量无显著影响,而且不同添加剂量间也无显著差异,但显著降低了Mn含量,最大降幅达60%。施加硅灰石对生菜地下部元素含量的影响与地上部略有不同,在较低添加剂量时对K含量有提升作用。硅灰石明显提升生菜地下部Ca含量,并随着使用量的上升而升高。硅灰石对地下部Mg含量无显著影响,但显著降低了地下部的Mn含量,Mn含量与添加剂量呈线性负相关,最大降幅达46%。
从图 3可见,生菜地上和地下部分的Cd含量随着钝化剂施加量的提高呈线性下降,但在低剂量时(220 mg Si/kg)没有显示钝化效果,甚至提高了地下部的Cd含量,分子筛与硅灰石分别提高了9%和16%。从地上部看,添加剂量为660 mg Si/kg时, 分子筛钝化效果未进一步提高,生菜地上部的Cd含量下降了33%;但增加硅灰石用量使生菜地上部Cd含量进一步下降,添加880 mg Si/kg时降幅达61%。
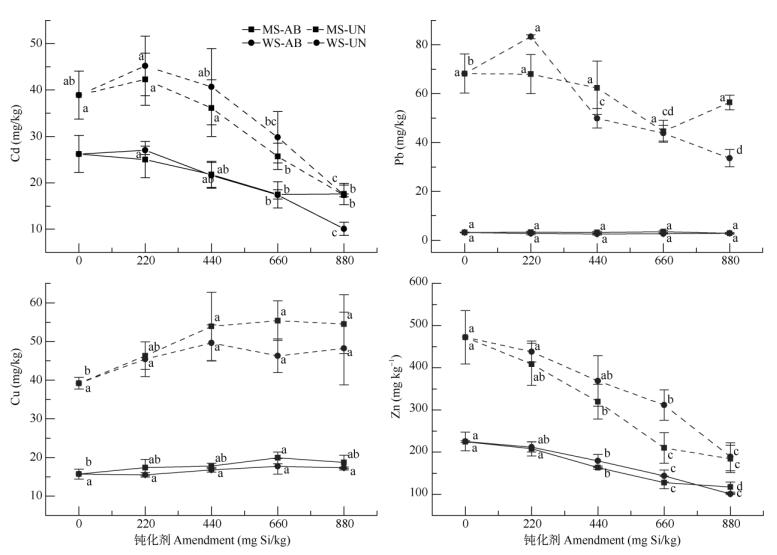
|
图 3 钝化剂对生菜Cd、Pb、Cu、Zn含量的影响 Fig. 3 Effect of amendment on the concentrations of Cd, Pb, Cu, Zn of lettuce |
2种钝化剂对生菜地上部的Pb含量无显著影响, 也没有剂量效应,Pb含量约稳定在3 mg/kg水平。生菜地下部的Pb含量随钝化剂添加量的增加而下降,660 mg Si/kg分子筛使Pb含量降低了35%;880 mg Si/kg硅灰石则显著下降了51%。例外的是,220 mg Si/kg硅灰石处理反而增加生菜地下的Pb含量。
钝化剂对生菜地上部Cu含量无明显影响,也不呈现剂量效应,分子筛使生菜地上部Cu含量略有上升。但2种钝化剂均提高了生菜地下部分的Cu含量,分子筛使地下部Cu含量显著升高了18%~ 41%;硅灰石提高地下部分Cu含量的效应未达显著差异。生菜地上和地下部的Zn含量随着钝化剂施加量的增大而显著降低,分子筛和硅灰石分别降低了地上部分Zn含量7%~48%和6%~55%;降低了地下部分13%~61%和7%~60%。
2.4 相关分析从表 3可见,土壤pH与生菜地上部Cd含量(r= -0.759)、地下部Cd含量(r=-0.825)和土壤有效Cd含量(r=-0.423)表现出极显著负相关关系;土壤有效Pb含量与生菜地上部Cd含量(r=0.395)、地下部Cd含量(r=0.419)和土壤有效Cd含量(r=0.568)存在显著正相关关系;土壤有效Cu含量与土壤有效Cd含量(r=0.675)、有效Ca含量(r=0.649)表现出极显著正相关关系;土壤有效Zn含量与生菜地上部Cd含量(r=0.467)存在显著正相关关系,土壤有效Ca则与生菜地上部Cd含量(r=-0.541)极显著负相关。
| 表 3 生菜Cd含量与土壤化学性质的相关性 Table 3 Pearson's correlation coefficients among soil chemistries and Cd contents in lettuce |
Langmuir方程很好地拟合了分子筛和硅灰石的等温吸附曲线,拟合优度R2分别为0.946 (n=6)和0.972 (n=8),分子筛对Cd的饱和吸附量为263.5 mg/g, 硅灰石对Cd的饱和吸附量为0.43 mg/g (图 4),分子筛的Cd吸附能力远远大于硅灰石。
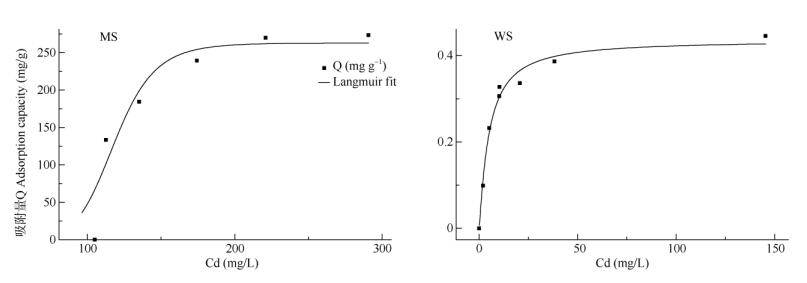
|
图 4 4A分子筛(MS)和硅灰石(WS)的吸附等温曲线 Fig. 4 Adsorption isotherm of 4A molecular sieve (MS) and wollastonite (WS) |
2种钝化剂对作物产量的影响不同,在较低剂量时,二者对生菜地上部生物量影响不大,只有小幅变化。但当硅灰石用量达到660 mg Si/kg时,生菜显著增产,升幅达12%,这与Lu等[15]的研究结果一致;而同等添加量的分子筛则导致大幅减产, 降幅达29%,这种变化足以影响农民对钝化治理技术的意愿和选择,硅灰石在降低重金属的同时,还具有增产效应,为其实际应用提供了极其重要的性状优势。
pH被认为是影响土壤重金属有效性的关键因素[16-17],添加钝化剂明显提升了土壤pH,且随添加量呈线性上升。但从土壤有效态Cd、Pb、Cu和Zn含量的变化趋势看,pH与重金属有效性间无显著相关性。硅灰石处理的土壤有效Cd含量均高于对照,即使是pH上升1个单位的最大使用量,有效Cd含量仍高于对照。施加分子筛提高了土壤pH,减少了有效Cd含量,有效Cd含量与pH呈负相关。有效态Pb、Cu、Zn含量的变化与pH也没有显著相关性,尤其是Cu元素,2种钝化剂均使土壤pH上升,但分子筛使有效Cu含量显著下降,而硅灰石使有效Cu含量显著上升,这说明,小幅度的pH变化与重金属有效性间无显著相关关系,此时,pH不是重金属有效性变化的主导因素。预期土壤pH大幅度变化时,与重金属有效性的负相关关系成立,即在土壤pH较低,酸性较强时,重金属有效性高,而pH上升至土壤为碱性时,重金属有效性会大幅下降[18]。本研究中,土壤pH与营养元素K、Na、Ca、Mg的有效性间也没有显著相关性,唯有Zn、Mn元素与pH呈显著负相关,2种钝化剂均有相同的效果。
钝化剂对植物吸收营养元素有显著影响[19]。本试验结果表明,2种钝化剂对生菜K含量无显著影响,高剂量的分子筛使土壤有效K含量大幅上升, 但显著降低了地下部K含量,生菜对K的吸收与土壤有效K含量无显著相关性。分子筛使生菜对Ca吸收有抑制作用,主要表现在地上部Ca含量上,而硅灰石有一定的促进作用,这与2种钝化材料对土壤有效Ca的作用效果有关,分子筛降低了土壤Ca有效性,而硅灰石大幅提高了土壤Ca有效性, 最大剂量时提高3倍多。分子筛显著提高了土壤有效Mg含量,但却降低了生菜的Mg含量;硅灰石使土壤Mg有效性上升,同时使生菜Mg含量升高。Mn元素的变化最为确定,2种钝化剂均导致土壤有效Mn含量的下降,生菜的Mn含量也同步下降, 二者存在极显著的相关性,这与我们之前的研究结果一致[20]。因而,钝化材料对土壤与作物体内不同元素的影响表现不同,显示出作物吸收营养元素的复杂性,元素的土壤有效性不一定能反映元素的供应水平,如提高土壤有效K、Mg含量,作物体内K、Mg含量反而下降。因而,钝化材料的使用会影响作物对养分元素的吸收,这种影响不能以土壤中相应元素的有效态水平来评估。在K、Ca、Mg和Mn这4种元素中,Mn必然会因钝化而影响供应,是钝化处置过程确定需要进行补充的元素。
以往的研究中,钝化意味着土壤有效态重金属含量的减少和重金属移动性的降低[21-22]。本试验中,2种钝化剂均降低了土壤Zn的有效性,分子筛降低了土壤Cd和Cu的有效性也支持这一结论。与此相反,本研究中硅灰石增大了土壤有效态Cd和Cu含量,添加220 mg Si/kg的2种钝化剂均增大土壤有效Pb含量。这可能是由于施加分子筛和硅灰石引入了交换性阳离子Na+和Ca2+,与Cd和Pb竞争土壤中的吸附位点[23-24],增大了土壤有效态Cd、Pb含量,提高了Cd和Pb的移动性[25-26]。同样地,来自硅灰石的大量Ca2+与土壤中的Cu发生了竞争吸附和离子交换[27],增大了土壤溶液中的Cu含量,提高了其有效性。土壤有效Ca含量与土壤有效Cu含量呈极显著正相关关系(P < 0.01)也支持了这一结论。
2种钝化剂未显著降低,甚至增加了土壤中Cd的有效性,但抑制了生菜对Cd的吸收,这说明除了降低土壤有效Cd含量,分子筛和硅灰石还存在其他减少植物Cd吸收的机制。根据等温吸附试验的结果,分子筛具有极强的吸附能力,饱和Cd吸附量达到263 mg/kg,远远高于硅灰石的0.43 mg/kg, 但两者对生菜Cd吸收的抑制作用相差不大。因而,2种钝化剂抑制作物吸收重金属的机理可能是不同的。施加硅灰石引入大量交换性强的Ca2+,与Cd竞争植物根表面的吸附位点和吸收通道[28],从而抑制了植物对Cd的吸收[29-30]。生菜地上部Cd含量与土壤有效Ca含量存在极显著负相关关系(P < 0.01)也支持这一结论。而分子筛则因其强大的吸附能力,通过有效吸附土壤Cd,降低其移动性,从而降低作物对Cd的吸收。此外,由于分子筛特殊的微孔结构,在自然条件下,通过离子交换进入到分子筛微孔中的Cd比因吸附或沉淀等作用而钝化的Cd更稳定。钝化对生菜地上部Pb含量无显著作用, 本研究中,生菜地上部Cd、Pb含量分别为0.37~1.1和0.07~0.14 mg/kg FW,而Pb含量≤0.3 mg/kg, 满足安全食用标准(GB 2762-2017),但Cd含量均高于安全食用标准规定的0.2 mg/kg,说明钝化剂抑制生菜Cd积累的作用有限。在实际生产中,该地区应避免种植叶菜类等Cd富集能力较强的作物。
钝化材料降低了土壤Zn的供应而使生菜Zn含量明显下降[20],但生菜Zn含量下降与土壤Zn有效性变化特征不对等,钝化剂抑制Zn吸收可能一定程度上通过Ca-Zn竞争而实现[31],生菜Zn含量与土壤有效Ca含量成极显著负相关关系(r=-0.398, P < 0.0.1)也支持这一结论。作物Cu含量因钝化剂的施用而上升,这种变化与土壤有效Cu含量的变化无显著相关性,说明作物对一些微量养分元素的吸收有着极其复杂机理,还有待深入研究。
分子筛会导致作物减产,而硅灰石可使作物增产,这主要是由于钝化剂改变土壤养分供应并影响作物对养分的吸收水平[32]。2种钝化剂使土壤pH逐步上升,有限幅度的pH变化(5.4~6.66)对土壤重金属与养分元素有效性不产生确定性影响。分子筛降低土壤Mn、Zn、Cu和Ca供应,增加K和Mg供应,降低生菜Ca、Mg、Mn和Zn含量,小幅增加了Cu含量;硅灰石降低土壤Mn、Zn供应,增加Ca、Mg和Cu供应,降低生菜Mn、Zn含量, 小幅增加Ca、Cu含量,Mg含量不随硅灰石的使用而变化。因而,钝化剂导致土壤养分元素的有效性变化,与作物吸收相应的养分元素并不直接相关。
在低用量时(220 mg Si/kg),钝化剂使土壤Cd、Pb的有效性上升,硅灰石没有降低土壤中Cd的有效性,反而明显上升,而分子筛在高剂量时(> 660 mg Si/kg)明显降低Cd、Pb有效性。因而, 在低用量时,2种钝化剂没有表现出抑制作物吸收重金属的效应,在达到660 mg Si/kg后,显著抑制作物对Cd、Pb吸收。硅灰石抑制作物对Cd的吸收是通过Ca-Cd竞争,而非通过降低土壤的Cd有效性而起作用。综合来看,作为一种低成本材料,硅灰石在大面积Cd污染土壤的修复中有巨大的应用前景。
| [1] |
State Environmental Protection Administration of China (EPA), State Land And Resources Administration of China (LRA). National bulletin of soil pollution survey[Z]. Beijing, 2014. 环境保护部, 国土资源部.全国土壤污染状况调查公报[Z].北京, 2014. http://www.cqvip.com/Main/Detail.aspx?id=49703733 |
| [2] |
GU J G, ZHOU Q X, WANG X. Reused path of heavy metal pollution in soil and its research advance[J]. J Basic Sci Eng, 2003, 11(2): 143-151. 顾继光, 周启星, 王新. 土壤重金属污染的治理途径及其研究进展[J]. 应用基础与工程科学学报, 2003, 11(2): 143-151. DOI:10.3969/j.issn.1005-0930.2003.02.005 |
| [3] |
CHEN C X, LU Z Q, ZHANG G Y, et al. Effects of cadmium and naphthalene on germination and growth of seedlings of mangrove plant Avicennia marina[J]. J Trop Subtrop Bot, 2016, 24(1): 80-86. 陈昌徐, 陆志强, 章耕耘, 等. 镉与萘复合胁迫对红树植物白骨壤幼苗萌芽及生长的影响[J]. 热带亚热带植物学报, 2016, 24(1): 80-86. DOI:10.11926/j.issn.1005-3395.2016.01.011 |
| [4] |
FAN T, YE W L, CHEN H Y, et al. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecol Environ Sci, 2013, 22(10): 1727-1736. 樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22(10): 1727-1736. DOI:10.3969/j.issn.1674-5906.2013.10.015 |
| [5] |
HUANG Y Z, HAO X W, LEI M, et al. The remediation technology and remediation practice of heavy metals-contaminated soil[J]. J Agro Environ Sci, 2013, 32(3): 409-417. 黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 32(3): 409-417. DOI:10.11654/jaes.2013.03.001 |
| [6] |
WANG L Q, LUO L, MA Y B, et al. In situ immobilization remediation of heavy metals-contaminated soils:A review[J]. Chin J Appl Ecol, 2009, 20(5): 1214-1222. 王立群, 罗磊, 马义兵, 等. 重金属污染土壤原位钝化修复研究进展[J]. 应用生态学报, 2009, 20(5): 1214-1222. |
| [7] |
XU L L, MA Y H, MA T Z, et al. Passivating agents on remediation of heavy metal pollution in soils[J]. J Agric Resour Environ, 2013, 30(6): 25-29. 徐露露, 马友华, 马铁铮, 等. 钝化剂对土壤重金属污染修复研究进展[J]. 农业资源与环境学报, 2013, 30(6): 25-29. DOI:10.3969/j.issn.1005-4944.2013.06.005 |
| [8] |
ARMELIN M J A, TREVIZAM A R, MURAOKA T, et al. Phosphate effect on the content of selected elements in a lettuce variety grown at a contaminated soil[J]. J Radioanal Nucl Chem, 2014, 301(1): 17-21. DOI:10.1007/s10967-014-3153-7 |
| [9] |
LU H P, ZHUANG P, LI Z A, et al. Contrasting effects of silicates on cadmium uptake by three dicotyledonous crops grown in contaminated soil[J]. Environ Sci Pollut Res, 2014, 21(16): 9921-9930. DOI:10.1007/s11356-014-2947-z |
| [10] |
LIU H, XU J Y, YIN M, et al. Adsorption of Zn2+ by 13X molecular sieve/attapulgite granular composite[J]. J Wuhan Univ Sci Technol, 2019, 42(6): 442-448. 刘红, 徐积昀, 殷萌, 等. 13X分子筛/凹凸棒土颗粒型复合材料吸附Zn2+的研究[J]. 武汉科技大学学报, 2019, 42(6): 442-448. |
| [11] |
HU J, XU H S, XIA S Q, et al. Application of zeolite in lead contaminated soil remediation[J]. Environ Sci Manag, 2016, 41(3): 93-97. 胡杰, 徐华胜, 夏思奇, 等. 分子筛在铅污染土壤修复中的应用研究[J]. 环境科学与管理, 2016, 41(3): 93-97. DOI:10.3969/j.issn.1673-1212.2016.03.021 |
| [12] |
SHI Y, SUN K, HUO L X, et al. Modification of 13X molecular sieve by chitosan for adsorptive removal of cadmium from simulated wastewater[J]. Materials, 2017, 10(9): 1101. DOI:10.3390/ma10091101 |
| [13] |
LIN D S, ZHOU Q X. Effects of soil amendments on the extractability and speciation of cadmium, lead, and copper in a contaminated soil[J]. Bull Environ Contam Toxicol, 2009, 83(1): 136-140. DOI:10.1007/s00128-009-9727-3 |
| [14] |
MAO P, ZHUANG P, LI F, et al. Phosphate addition diminishes the efficacy of wollastonite in decreasing Cd uptake by rice (Oryza sativa L.) in paddy soil[J]. Sci Total Environ, 2019, 687: 441-450. DOI:10.1016/j.scitotenv.2019.05.471 |
| [15] |
LU H P, LI Z, WU J T, et al. Influences of calcium silicate on chemical forms and subcellular distribution of cadmium in Amaranthus hypo-chondriacus L[J]. Sci Rep, 2017, 7: 40583. DOI:10.1038/srep40583 |
| [16] |
BOLTON K A, EVANS L J. Cadmium adsorption capacity of selected Ontario soils[J]. Can J Soil Sci, 1996, 76(2): 183-189. DOI:10.4141/cjss96-025 |
| [17] |
HE Y B, HUANG D Y, ZHU Q H, et al. A three-season field study on the in-situ remediation of Cd-contaminated paddy soil using lime, two industrial by-products, and a low-Cd-accumulation rice cultivar[J]. Ecotoxicol Environ Saf, 2017, 136: 135-141. DOI:10.1016/j.ecoenv.2016.11.005 |
| [18] |
SPARKS D L. Environmental Soil Chemistry[M]. New York: Academic Press, 1995: 32.
|
| [19] |
TAN W N, LI Z A, QIU J, et al. Lime and phosphate could reduce cadmium uptake by five vegetables commonly grown in south China[J]. Pedosphere, 2011, 21(2): 223-229. DOI:10.1016/S1002-0160(11)60121-5 |
| [20] |
WU J T, DUMAT C, LU H P, et al. Synergistic improvement of crop physiological status by combination of cadmium immobilization and micronutrient fertilization[J]. Environ Sci Pollut Res, 2016, 23(7): 6661-6670. DOI:10.1007/s11356-015-5888-2 |
| [21] |
BASTA N T, GRADWOHL R, SNETHEN K L, et al. Chemical immo- bilization of lead, zinc, and cadmium in smelter-contaminated soils using biosolids and rock phosphate[J]. J Environ Qual, 2001, 30(4): 1222-1230. DOI:10.2134/jeq2001.3041222x |
| [22] |
LI L F, AI S Y, WANG Y H, et al. In situ field-scale remediation of low Cd-contaminated paddy soil using soil amendments[J]. Water Air Soil Pollut, 2016, 227(9): 342. DOI:10.1007/s11270-016-3041-6 |
| [23] |
SMIČIKLAS I, ONJIA A, RAIČEVIĆ S, et al. Factors influencing the removal of divalent cations by hydroxyapatite[J]. J Hazard Mat, 2008, 152(2): 876-884. DOI:10.1016/j.jhazmat.2007.07.056 |
| [24] |
HUANG X R, ZHAO H H, ZHANG G B, et al. Potential of removing Cd(Ⅱ) and Pb(Ⅱ) from contaminated water using a newly modified fly ash[J]. Chemosphere, 2020, 242: 125148. DOI:10.1016/j.chemosphere.2019.125148 |
| [25] |
CORAMI A, MIGNARDI S, FERRINI V. Cadmium removal from single- and multi-metal (Cd+Pb+Zn+Cu) solutions by sorption on hydroxyapatite[J]. J Colloid Interface Sci, 2008, 317(2): 402-408. DOI:10.1016/j.jcis.2007.09.075 |
| [26] |
KHATTAK R A, JARRELL W M, PAGE A L. Mechanism of native manganese release in salt-treated soils[J]. Soil Sci Soc Amer J, 1989, 53(3): 701-705. DOI:10.2136/sssaj1989.03615995005300030009x |
| [27] |
WANG Q M, LI J S, POON C S. Recycling of incinerated sewage sludge ash as an adsorbent for heavy metals removal from aqueous solutions[J]. J Environ Manage, 2019, 247: 509-517. DOI:10.1016/j.jenvman.2019.06.115 |
| [28] |
TIAN S K, XIE R H, WANG H X, et al. Calcium deficiency triggers phloem remobilization of cadmium in a hyperaccumulating species[J]. Plant Physiol, 2016, 172(4): 2300-2313. DOI:10.1104/pp.16.01348 |
| [29] |
WAN G L, NAJEEB U, JILANI G, et al. Calcium invigorates the cadmium-stressed Brassica napus L. plants by strengthening their photosynthetic system[J]. Environ Sci Pollut Res, 2011, 18(9): 1478-1486. DOI:10.1007/s11356-011-0509-1 |
| [30] |
NOUAIRI I, JALALI K, ESSID S, et al. Alleviation of cadmium-induced genotoxicity and cytotoxicity by calcium chloride in faba bean (Vicia faba L. var. minor) roots[J]. Physiol Mol Biol Plants, 2019, 25(4): 921-931. DOI:10.1007/s12298-019-00681-5 |
| [31] |
KUMPIENE J, LAGERKVIST A, MAURICE C. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments:A review[J]. Waste Manage, 2008, 28(1): 215-225. DOI:10.1016/j.wasman.2006.12.012 |
| [32] |
THEODORATOS P, PAPASSIOPI N, XENIDIS A. Evaluation of monobasic calcium phosphate for the immobilization of heavy metals in contaminated soils from Lavrion[J]. J Hazard Mat, 2002, 94(2): 135-146. DOI:10.1016/S0304-3894(02)00061-4 |
 2020, Vol. 28
2020, Vol. 28


