2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
石斛属(Dendrobium)隶属兰科(Orchidaceae)树兰亚科(Epidendroideae),是兰科最大的属之一,具有极高的观赏价值,因其花香奇特、花朵秀丽、花形迷人与色泽鲜艳享誉世界,被称为世界“四大观赏洋兰”之一[1-2]。铁皮石斛(D. officinale)是珍稀的药食同源传统贵细中药材,主要以干燥茎入药,具有滋阴清热、益胃生津、抗氧化、抗衰老、增强免疫力等功效[3],是石斛属中最为珍稀名贵的品种。对石斛属植物的化学研究主要集中在茎、叶的多糖、石斛碱、黄酮等成分上[4-5],而对于石斛花的研究较少。
铁皮石斛花为可食用部分,产量丰富,具有很大的资源开发空间,在民间被广泛加工成花茶饮用。花香是观赏植物重要的审美和商品性状之一,作为信号物质,具有招引昆虫授粉等重要生态功能[6]。石斛属植物花香的研究报道较少,铁皮石斛的花香物质以萜类、脂肪族、芳香族化合物为主, 尤其是蒎烯、柠檬烯、桉油素、芳樟醇、α-松油醇等单萜化合物[7]。鼓槌石斛的主要花香物质是α-蒎烯、β-罗勒烯、苯乙醛和乙酸辛酯[8]。铁皮石斛花中富含多糖、挥发油、多酚类、花色素和黄酮类物质[7, 9-11],与茎、叶相比,花中总黄酮、总酚类物质含量更高,具有较高的抗氧化活性,而且还富含精氨酸等人体必需的氨基酸[10, 12]。然而,关于石斛属植物花中化合物合成的分子机理还不清楚,参与其合成的相关基因也鲜有报道[13-14]。因此,亟需开展花中化合物成分分析、生物合成途径及关键物质合成的分子机制研究,以便更好地开发利用石斛花资源。
高质量、高纯度RNA提取是植物分子生物学研究的基础,如Real-Time PCR分析、Northern杂交分析、目的基因克隆、cDNA文库构建等都需要高质量的RNA。常用的植物总RNA提取方法有TRIZOL法[15]、CTAB法[16]、SDS法[17]、异硫氰酸胍法[18]和试剂盒法[19]等。目前,以上方法均已应用于铁皮石斛茎的总RNA提取[10-11],但是不同植物或同种植物不同组织所含的成分存在较大差异,铁皮石斛花的总RNA提取方法必须通过实验才能确定。
因此,本研究针对铁皮石斛花中黄酮、多糖、多酚等次生代谢物质含量高的特点,通过比较改良CTAB-LiCl法、改良CTAB-异丙醇法、改良SDS-LiCl法、改良SDS-异丙醇法以及试剂盒法等8种方法提取的总RNA质量,筛选并确定铁皮石斛花的总RNA提取方法,为铁皮石斛花香物质合成酶基因的表达、调控及其相关的分子生物学研究提供技术手段。
1 材料和方法 1.1 试验材料本研究使用的5种石斛属植物花朵均采自广东省广州市中国科学院华南植物园石斛育种基地(25.14° N,113.35° E),包括气味略轻颜色淡黄的铁皮石斛(Dendrobium officinale,图 1)、香气浓郁色彩明黄的鼓槌石斛(D. chrysotoxum)、花呈淡黄绿色的霍山石斛(D. huoshanense)、气味芬芳颜色明艳的金钗石斛(D. nobile)和美花石斛(D. loddigesii),于盛花期(2019年4-5月)的晴天上午11:00每个品种随机采摘10朵以上,设3次生物学重复,置于-80℃冰箱保存备用。

|
图 1 铁皮石斛花 Fig. 1 Flowers of Dendrobium officinale |
十二烷基磺酸钠(sodium dodecyl sulfate, SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、三羟甲基氨基甲烷[tris(hydroxymethyl) aminomethane, THAM]、焦碳酸二乙酯(diethyl pyro- carbonate, DEPC)、十六烷基三乙基溴化铵(cetyltri- methyl ammonium bromide, CTAB)购自天津市科密欧化学试剂有限公司,多糖多酚植物RNA提取试剂盒(货号:0416-50)购自北京华越洋生物科技有限公司,柱式植物RNAout 2.0试剂盒(货号: 90404-50)购自北京天恩泽基因科技有限公司, RNAprep Pure多糖多酚植物总RNA提取试剂盒(货号:DP441)购自天根生化科技有限公司,Biospin多糖多酚植物总RNA提取试剂盒(货号:BSC65S1)购自杭州博日科技有限公司,RNA提取酚试剂(货号:W0250)购自北京索莱宝科技有限公司,M-MLV反转录试剂盒(货号:M1701)购自美国Promega公司,铁皮石斛Actin基因引物由北京擎科生物科技公司合成, 聚乙烯吡咯烷酮(polyvinyl pyrrolidone 40, PVP-40)、无水乙醇、三氯甲烷、β-巯基乙醇、异丙醇、氯化钠等化学试剂均为分析纯,购自广州化学试剂厂。
试验所用试剂瓶、研钵、镊子、药匙等非塑料制品在180℃下烘烤8 h后使用,塑料制品及试剂经0.1% (W/V) DEPC水处理12 h,121℃高压灭菌30 min后,烘干备用。
1.3 花的总RNA提取方法研究共采用了8种提取方法:改良CTAB-LiCl法(M1)、改良CTAB-异丙醇法(M2)、改良SDS-LiCl法(M3)、改良SDS-异丙醇法(M4)、多糖多酚植物RNA提取试剂盒法(M5)、柱式植物RNAout 2.0试剂盒法(M6)、RNAprep Pure多糖多酚植物总RNA提取试剂盒法(M7)、Biospin多糖多酚植物总RNA提取试剂盒法(M8)。
改良CTAB-LiCl法(M1) 参照Zeng等[20]的方法并适当修改。称取500 mg新鲜花朵,在液氮中快速研磨成粉末,转移至2 mL离心管中,加入1 mL 65℃预热的CTAB裂解液[2% CTAB (W/V), 2 mol/L NaCl, 25 mmol/L EDTA (pH=8.0), 100 mmol/L Tris-HCl (pH=8.0), 2% β-巯基乙醇(使用前加入)],65℃水浴15 min,期间上下颠倒3~5次。加入900 μL酚/氯仿/异戊醇(25:24:1, V/V), 剧烈振荡30 s, 于4℃下12 000×g离心10 min,将上清液转移到新的离心管中,加入800 μL氯仿/异戊醇(24:1, V/V), 剧烈振荡30 s,于4℃下12 000×g离心10 min,将上清液转移到新的离心管中。加入1/4体积的10 mol/L LiCl,于4℃冰箱中静置过夜,于4℃下12 000×g离心30 min沉淀RNA,弃上清,沉淀用75%乙醇漂洗2次,于4℃下12 000×g离心5 min,弃上清,风干后,加入40 μL DEPC水溶解RNA,于-80℃冰箱保存。
改良CTAB-异丙醇法(M2) 参照张力鹏等[21]的方法并适当修改。称取500 mg新鲜的铁皮石斛花朵,液氮中研磨成粉末后迅速转入含有500 μL CTAB提取液[2% CTAB (W/V), 2% PVP-40 (W/V), 0.045%亚精胺(W/V), 2.5 mol/L NaCl, 25 mmol/L EDTA (pH=8.0), 100 mmol/L Tris-HCl (pH=8.0), 2% β-巯基乙醇(使用前加入)]中,65℃水浴5 min,加入250 μL氯仿,剧烈震荡,于4℃下13 000×g离心5 min, 取上清液加入等体积的氯仿/异戊醇(24:1, V/V),剧烈振荡,于4℃下13 000×g离心5 min, 取上清液加入等体积的异丙醇,温和混匀后,-40℃冰箱放置30 min,于4℃下13 000×g离心10 min, RNA沉淀漂洗方法与M1相同。
改良SDS-LiCl法(M3) 参照Liu等[22]的方法并适当修改。称取100 mg新鲜的铁皮石斛花朵,加液氮充分研磨,加入RNA提取缓冲液[1% SDS (W/V), 4% PVP-40 (W/V), 250 mmol/L NaCl, 20 mmol/L EDTA (pH=8.0), 50 mmol/L Tris-HCl (pH=8.0)],迅速混匀后室温放置5 min,于4℃下12 000×g离心5 min。将上清液转移到新的离心管中,加入700 μL酚/氯仿/异戊醇(25:24:1, V/V),温和混匀后, 于4℃下12 000×g离心5 min,将上清液转移到新的离心管中,加入600 μL氯仿/异戊醇(24:1, V/V), 剧烈振荡30 s,于4℃下12 000×g离心5 min,将上清液转移到新的离心管中。加入500 μL 10 mol/L LiCl,冰上放置60 min,于4℃下12 000×g离心10 min,RNA沉淀漂洗方法与M1相同。
改良SDS-异丙醇法(M4) 参照Cheng等[17]的方法并适当修改。称取100 mg新鲜的铁皮石斛花朵,液氮中研磨成粉末后迅速转入含有1 mL 65℃预热的SDS提取液[10% SDS (W/V), 1 mol/L NaCl, 2.5 mol/L Tris-HCl (pH=7.4), 100 mmol/L EDTA (pH=8.0), 4% β-巯基乙醇(使用前加入)]中, 充分涡旋混匀,65℃水浴20 min,期间上下颠倒3~5次, 于4℃下13 000×g离心10 min。将上清液转移到新的离心管中,加入1/2体积的RNA提取酚试剂,充分颠倒混匀,-20℃冰箱放置10 min,于4℃下13 000×g离心10 min。将上清液转移到新的离心管中,加入等体积的氯仿/异戊醇(24:1, V/V), 颠倒混匀,于4℃下13 000×g离心10 min。将上清液转移到新的离心管中,加入等体积预冷的异丙醇, -20℃放置30 min,于4℃下13 000×g离心30 min,RNA沉淀漂洗方法与M1相同。
多糖多酚植物RNA提取试剂盒法(M5)、柱式植物RNAout 2.0试剂盒法(M6)、RNAprep Pure多糖多酚植物总RNA提取试剂盒法(M7)、Biospin多糖多酚植物总RNA提取试剂盒法(M8)均按照说明书要求进行。
1.4 RNA质量浓度检测提取的RNA采用Nano DropTM 2000c核酸蛋白分析仪(Thermo Scientific公司)进行测定,样品检测量为1 μL,记录样品的A260 nm/A280 nm和A260 nm/A230 nm值和浓度,并计算RNA产率(μg/g)=RNA浓度(μg/μL)×稀释倍数×RNA样品体积(μL)/样品质量(mg)。RNA条带完整性使用1%琼脂糖凝胶电泳检测, 4.5 μL样品与0.5 μL 10×Loading Buffer (TaKaRa公司)混匀后点样,180 V电压电泳10 min,用凝胶成像系统观察电泳条带并拍照。
1.5 RT-PCR检测将M4和M5方法提取的RNA,按照反转录酶M-MLV试剂盒说明书进行反转录合成cDNA,以该cDNA为模板,以铁皮石斛Actin (NCBI登录号:JX294908)[23]为内参基因进行扩增。正向引物:5ʹ-A- TATGCTAGTGGCCGCACAA-3ʹ;反向引物:5ʹ-GC- GGCTTCCATTCCAATCAG-3ʹ。25 μL PCR反应体系为:Yeasen PCR Master Mix 12.5 μL,正向引物1 μL, 反向引物1 μL,cDNA 1 μL,ddH2O 9.5 μL。扩增程序为:94℃预变性3 min,98℃变性10 s,55℃退火30 s,72℃延伸1 min,30个循环,最后72℃延伸10 min。取4.5 μL PCR产物,加入与0.5 μL 10× Loading Buffer混匀后上样, 于1%琼脂糖凝胶仪上150 V电压电泳15 min, 用凝胶成像系统观察电泳结果并拍照。
1.6 其他石斛属植物总RNA提取采用M4和M5方法分别提取霍山石斛、金钗石斛、鼓槌石斛、美花石斛花朵的总RNA,检测完整性、纯度和浓度。
2 结果和分析 2.1 总RNA完整性检测凝胶电泳是一种简便、适用的鉴定评估RNA完整性的方法,通过凝胶图像可判断RNA有无降解以及降解程度。从图 2可见,采用1%琼脂糖凝胶电泳,M8未见明显条带,效果不佳;M3、M6和M7提取的RNA条带较弱,浓度低,可能在提取或者电泳过程中RNA发生了部分降解;其余提取方法均显示出较为明显的条带,其中M1提取的RNA条带亮度较高,但条带较为弥散不清晰且具有拖带现象,存在蛋白和多糖污染情况,可能由于样品中多糖多酚含量较高,提取液中CTAB未能将其全部聚合形成复合物沉淀从而未与核酸更好地分离;M2和M4方法条带较为清晰,尽管M2提取的RNA中28S和18S条带明暗差距更为明显,但是M4提取的RNA中28S条带亮度明显高于18S;M5方法条带清楚且无拖带,重复性也较好。因此,比较8种提取方法,M4、M5提取的RNA完整性较好。
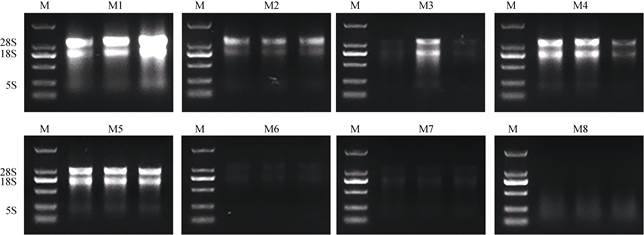
|
图 2 8种方法提取铁皮石斛花朵总RNA的电泳图。 M: DNA marker; M1:改良CTAB-LiCl法; M2:改良CTAB-异丙醇法; M3:改良SDS-LiCl法; M4:改良SDS-异丙醇法; M5:多糖多酚植物RNA提取试剂盒法; M6:柱式植物RNAout 2.0试剂盒法; M7: RNAprep Pure多糖多酚植物总RNA提取试剂盒法; M8: Biospin多糖多酚植物总RNA提取试剂盒法。 Fig. 2 Agarose gel electrophoresis of total RNA extracted by eight different protocols from Dendrobium officinale flowers. M: DL2000 marker; M1: Improved CTAB-LiCl method; M2: Improved CTAB-isopropanol method; M3: Improved SDS-LiCl method; M4: Improved SDS-isopropanol method; M5: Quick RNA Isolation Kit; M6: Column Plant RNAout 2.0; M7: RNAprep Pure Plant Plus Kit; M8: Plant Total RNA Extraction Kit. |
高质量RNA的A260 nm/A280 nm应介于1.8~2.0之间,A260 nm/A230 nm应大于2.0。通过Nano Drop 2000核酸蛋白检测仪对8种方法提取铁皮石斛花的总RNA进行浓度和纯度检测(表 1), M4方法所得的总RNA浓度最高,为(199.31±5.68) ng/μL;M5的次之[(142.30±4.66) ng/μL];M2、M3、M6、M7的为(46.42±4.84)~(66.37±2.47) ng/μL,效果一般;M8的仅为(16.20±1.23) ng/μL,无法满足后续试验要求。除M2、M6、M8提取的总RNA的A260 nm/A280 nm不符合要求外,其余方法均在1.8~2.0之间,M1、M6提取的总RNA的A260 nm/A230 nm低于2.0,其余方法的均高于2.0,说明样品中来自蛋白、酚类、糖类等的污染较少,提取的RNA质量较为可靠。因此,M4和M5是最优的2种方法。
| 表 1 8种方法提取的铁皮石斛花RNA的浓度、纯度和产率 Table 1 Yield, purity and concentration of total RNA extracted by using eight different protocols from Dendrobium officinale flowers |
为进一步验证所提取RNA的完整性,使用Promega公司的M-MLV反转录试剂盒, 将M4、M5方法提取的RNA进行反转录,以cDNA第一条链为模板设计铁皮石斛内参基因Actin (NCBI登录号: JX294908)的特异性引物进行扩增,经1%琼脂糖凝胶电泳检测(图 3), 可见,两种方法提取的RNA, 经反转录后PCR扩增产物片段均为250~500 bp,与预期目的片段390 bp相符,且条带清晰、单一,亮度较高,说明SDS-异丙醇法(M4)和华越洋试剂盒法(M5)均能用于RT-PCR反应等以RNA为基础的分子生物学研究分析。
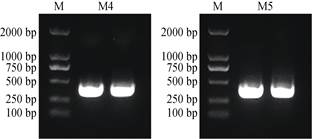
|
图 3 铁皮石斛Actin基因的RT-PCR电泳图。 M: DNA marker; M4:改良SDS-异丙醇法; M5:多糖多酚植物RNA提取试剂盒法。 Fig. 3 Agarose gel electrophoresis of Actin gene from Dendrobium officinale. M: DL2000 marker; M4: Improved SDS-isopropanol method; M5: Quick RNA Isolation Kit. |
采用M4和M5对4种常见的石斛属植物(霍山石斛、金钗石斛、鼓槌石斛、美花石斛)进行总RNA提取(图 4)。两种方法提取的RNA,经1%琼脂糖凝胶电泳均得到清晰无弥散的条带,说明蛋白质、酚类、糖类等杂质去除效果较好,所得RNA的A260 nm/A280 nm介于1.8~2.0之间,A260 nm/A230 nm大于2.0,且RNA浓度均高于100 ng/μL。因此, M4和M5方法能够提取出高质量、符合要求的霍山石斛、金钗石斛、鼓槌石斛、美花石斛花中的总RNA,也可为兰科石斛属其他植物花的RNA提取提供参考。
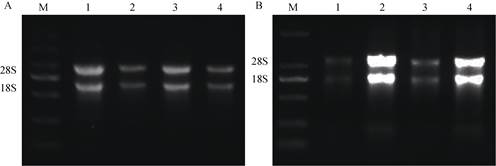
|
图 4 4种石斛属植物花的总RNA电泳图。 A: M4; B: M5; M: DNA marker; 1:鼓槌石斛; 2:霍山石斛; 3:金钗石斛; 4:美花石斛。 Fig. 4 Gel electrophoresis of flower total RNA from four Dendrobium plants. 4 A: M4; B: M5; 1: D. chrysotoxum; 2: D. huoshanense; 3: D. nobile; 4: D. loddigesii. |
无论是关键基因克隆、Real-Time PCR分析, 还是高通量测序等分子生物学研究,获取纯度高、完整性好、浓度高的RNA是研究开展的前提。石斛属植物花朵在生长过程中会大量富集挥发油、多酚类、花色素和黄酮类等多种次生代谢产物以及蛋白质和多糖等有机大分子[7-12, 14]。其中,多酚类物质易氧化成醌,与RNA发生不可逆结合,在有机溶剂抽提过程中会与部分RNA结合而流失[20, 22],影响RNA提取产率。多糖与RNA的理化性质相似, 在沉淀RNA过程中易形成黏胶状沉淀,导致所得RNA难溶于水,或溶解后溶液粘稠[17, 20-22],RNA产率降低,此外,多糖可以抑制下游酶的反应活性[17-18],被污染的RNA难以进行后续的分子生物学研究。因此,在石斛属植物(铁皮石斛)花朵的总RNA提取过程中,有效去除DNA、蛋白质和多糖、多酚等次生代谢产物干扰,抑制RNA酶活性是提取纯度高、完整性好、浓度大RNA的关键所在。
本研究采用改良SDS-异丙醇法(M4)以SDS、高浓度NaCl和β-巯基乙醇作为RNA抽提液的主要成分,经过水饱和酚、氯仿/异戊醇抽提,将绝大多数多糖、酚类物质留在有机相,再经异丙醇低温孵育,从而获得完整性好、纯度高的RNA。其中,SDS是一种阴离子表面活性剂,使蛋白质变性,细胞膜裂解,让核酸溶解于裂解液中,与β-巯基乙醇共同作用抑制RNA酶和DNA酶活性[17, 24]。水饱和酚使蛋白质变性,也抑制了RNA酶的降解作用。氯仿抽提加速水相与有机相分层,去除核酸溶液中的迹量酚[15, 22]。相比较M3,M4提取铁皮石斛花朵的RNA浓度、纯度都较高,主要原因可能是LiCl在与RNA反应的同时,也可能与多糖、多酚类物质结合沉淀,导致RNA部分流失。
前人研究表明,试剂盒具操作简便、提取时间短的优势,可用于多糖多酚含量高的植物总RNA提取。M5对菊花根尖[25]和花瓣[26]、M6对铁皮石斛茎和叶[23]的总RNA提取效果较好。本研究比较了4种试剂盒(M5、M6、M7、M8)提取铁皮石斛花总RNA的效果,仅M5可获得完整性好、纯度高的RNA。M6、M7、M8提取的效果较差,这可能是因为铁皮石斛花富含多糖、黄酮、多酚等物质, 在RNA提取过程中通过滤膜难于将杂质与核酸分离,易使小分子RNA丢失,导致总RNA浓度降低。此外,M5提取铁皮石斛花RNA的过程中,适当延长孵育时间可以增加RNA裂解液与植物细胞接触, 促进细胞充分裂解、释放RNA。
综上所述,改良SDS-异丙醇法(M4)、多糖多酚植物RNA提取试剂盒(M5)能有效从石斛属植物(铁皮石斛、鼓槌石斛、霍山石斛、金钗石斛、美花石斛)花朵中提取纯度较高、完整性较好的RNA, 所提取的总RNA的A260 nm/A280 nm为1.8~2.0,A260 nm/ A230 nm大于2.0,电泳的28S、18S条带清晰。Real- time PCR结果表明,M4和M5提取的总RNA纯化后可用于铁皮石斛花香合成的关键酶基因克隆等后续的分子生物学试验。本研究结果可为富含多糖、黄酮、花色素、多酚类物质的其他植物材料的RNA提取提供参考。
| [1] |
ZHU G F, GUO Z F. Progress on molecular biology of main ornamental Orchidaceae[J]. Chin Bull Bot, 2004, 21(4): 471-477. 朱根发, 郭振飞. 重要观赏兰科植物的分子生物学研究进展[J]. 植物学通报, 2004, 21(4): 471-477. DOI:10.3969/j.issn.1674-3466.2004.04.012 |
| [2] |
JING X J, HU F R. Research progress of Orchidaceae[J]. Mol Plant Breed, 2018, 16(15): 5080-5092. 景袭俊, 胡凤荣. 兰科植物研究进展[J]. 分子植物育种, 2018, 16(15): 5080-5092. DOI:10.13271/j.mpb.016.005080 |
| [3] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China, Volume Ⅱ[M]. Beijing: China Medical Science Press, 2015: 282-283. 国家药典委员会.中华人民共和国药典, 第二部[M].北京: 中国医药科技出版社, 2015: 282-283. |
| [4] |
ZHANG M Z, HE C M, WANG H B, et al. Advances in active polysaccharides in medicinal plants of Orchidaceae[J]. J Trop Subtrop Bot, 2019, 27(5): 611-622. 张明泽, 何春梅, 王浩斌, 等. 兰科药用植物活性多糖研究进展[J]. 热带亚热带植物学报, 2019, 27(5): 611-622. DOI:10.11926/jtsb.4073 |
| [5] |
DONG W, HE C M, YU Z M, et al. Dynamic changes in alcohol soluble components and six kinds of substances from Dendrobium officinale[J]. J Trop Subtrop Bot, 2017, 25(4): 370-378. 董伟, 何春梅, 俞振明, 等. 铁皮石斛醇溶性浸出物和六类物质的动态变化研究[J]. 热带亚热带植物学报, 2017, 25(4): 370-378. DOI:10.11926/jtsb.3703 |
| [6] |
BYERS K J R P, VELA J P, PENG F, et al. Floral volatile alleles can contribute to pollinator-mediated reproductive isolation in monkey-flowers (Mimulus)[J]. Plant J, 2014, 80(6): 1031-1042. DOI:10.1111/tpj.12702 |
| [7] |
LÜ S H, XU M, ZHANG X F, et al. Studies on volatile constituents of 11 families of Dendrobium officinale flowers[J]. China J Exp Trad Med For, 2016, 22(6): 52-57. 吕素华, 徐萌, 张新凤, 等. 11个铁皮石斛杂交家系鲜花的挥发性成分分析[J]. 中国实验方剂学杂志, 2016, 22(6): 52-57. DOI:10.13422/j.cnki.syfjx.2016060052 |
| [8] |
HUANG X L, ZHENG B Q, WANG Y. Study of aroma compounds in flowers of Dendrobium chrysotoxum in different florescence stages and diurnal variation of full blooming stage[J]. For Res, 2018, 31(4): 142-149. 黄昕蕾, 郑宝强, 王雁. 鼓槌石斛不同花期香气成分及盛花期香气日变化规律研究[J]. 林业科学研究, 2018, 31(4): 142-149. DOI:10.13275/j.cnki.lykxyj.2018.04.020 |
| [9] |
HUANG X H, WANG Z H, LI J, et al. Comparative analysis of quality properties and main nutrients in Dendrobium flowers during different flowering phases[J]. Chin J Trop Crops, 2017, 38(1): 45-52. 黄秀红, 王再花, 李杰, 等. 不同花期石斛花主要营养成分分析与品质比较[J]. 热带作物学报, 2017, 38(1): 45-52. DOI:10.3969/j.issn.1000-2561.2017.01.009 |
| [10] |
LI F, WEI Y, CHEN Y J. Study on the content of flavonoids in stems, leaves and flowers of Dendrobium officinale Kimura & Migo and its antioxidant activity in vitro[J]. Act Chin Med, 2019, 34(5): 1020-1023. 李芳, 魏云, 陈艳杰. 铁皮石斛茎、叶、花中黄酮含量及其体外抗氧化活性研究[J]. 中医学报, 2019, 34(5): 1020-1023. DOI:10.16368/j.issn.1674-8999.2019.05.242 |
| [11] |
XIN X X, WANG X X, LI M Y, et al. Active components of flowers in different flowering stages and floral structures of Dendrobium officinale[J]. J Zhejiang Agric For Univ, 2019, 36(1): 200-205. 辛小雪, 王雪香, 李明宇, 等. 铁皮石斛不同花期及花朵不同部位活性组分分析[J]. 浙江农林大学学报, 2019, 36(1): 200-205. DOI:10.11833/j.issn.2095-0756.2019.01.025 |
| [12] |
QU J X, HE Y X, SUN Z R, et al. Comparison of amino acids and volatile constituents in four kinds of Dendrobium flowers[J]. Mod Chin Med, 2018, 20(4): 387-394. 曲继旭, 贺雨馨, 孙志蓉, 等. 四种石斛花氨基酸和挥发性成分比较[J]. 中国现代中药, 2018, 20(4): 387-394. DOI:10.13313/j.issn.1673-4890.20170904003 |
| [13] |
ZHENG S G, HU Y D, ZHAO R X, et al. Genome-wide researches and applications on Dendrobium[J]. Planta, 2018, 248(4): 769-784. DOI:10.1007/s00425-018-2960-4 |
| [14] |
HUANG X L, WANG Y. Advances in Dendrobium molecular biology[J]. For Res, 2018, 31(3): 151-157. 黄昕蕾, 王雁. 石斛属分子生物学研究进展[J]. 林业科学研究, 2018, 31(3): 151-157. DOI:10.13275/j.cnki.lykxyj.2018.03.020 |
| [15] |
BILGIN D D, DELUCIA E H, CLOUGH S J. A robust plant RNA isolation method suitable for Affymetrix GeneChip analysis and quantitative real-time RT-PCR[J]. Nat Prot, 2009, 4(3): 333-340. DOI:10.1038/nprot.2008.249 |
| [16] |
POREBSKI S, BAILEY L G, BAUM B R. Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J]. Plant Mol Biol Rep, 1997, 15(1): 8-15. DOI:10.1007/BF02772108 |
| [17] |
CHENG Y J, GUO W W, YI H L, et al. An efficient protocol for genomic DNA extraction from Citrus species[J]. Plant Mol Biol Rep, 2003, 21(2): 177-178. DOI:10.1007/BF02774246 |
| [18] |
RONG T J, WEN G S, QIAN X, et al. Comparison on two modified total RNA isolating methods from Dendrobium officinale[J]. J Yunnan Agric Univ, 2012, 27(5): 703-707. 容天聚, 文国松, 钱雄, 等. 两种铁皮石斛总RNA提取方法的比较研究[J]. 云南农业大学学报, 2012, 27(5): 703-707. DOI:10.3969/j.issn.1004-390X(n).2012.05.015 |
| [19] |
SHAN T T, CHEN X M, GUO S X. Studies on total RNA extraction methods from the stems of Dendrobium species[J]. Biotechnol Bull, 2018, 34(6): 54-58. 单婷婷, 陈晓梅, 郭顺星, 等. 石斛属植物茎部总RNA提取方法的研究[J]. 生物技术通报, 2018, 34(6): 54-58. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0920 |
| [20] |
ZENG Y, YANG T. RNA isolation from highly viscous samples rich in polyphenols and polysaccharides[J]. Plant Mol Biol Rep, 2002, 20(4): 417. DOI:10.1007/BF02772130 |
| [21] |
ZHANG L P, ZHANG Y X, SONG W Q, et al. A highly efficient method of RNA extraction from Rhodiola plant[J]. Acta Sci Nat Univ Nankai, 2017, 50(6): 48-53. 张力鹏, 张银兴, 宋文芹, 等. 红景天属植物叶片RNA高效提取的方法[J]. 南开大学学报(自然科学版), 2017, 50(6): 48-53. |
| [22] |
LIU L L, HAN R C, YU N J, et al. A method for extracting high-quality total RNA from plant rich in polysaccharides and polyphenols using Dendrobium huoshanense[J]. PLoS One, 2018, 13(5): e0196592. DOI:10.1371/journal.pone.0196592 |
| [23] |
YU Z M, HE C M, DA SILVA J A T, et al. Molecular cloning and functional analysis of DoUGE related to water-soluble polysaccharides from Dendrobium officinale with enhanced abiotic stress tolerance[J]. Plant Cell Tiss Org Cult, 2017, 131(3): 579-599. DOI:10.1007/s11240-017-1308-2 |
| [24] |
LIU F, GUAN C Y. Research progress on RNA extracting from plants rich in polyphenols[J]. Crop Res, 2015, 29(1): 91-95, 100. 刘芳, 官春云. 富含多酚类植物RNA提取的研究进展[J]. 作物研究, 2015, 29(1): 91-95, 100. DOI:10.3969/j.issn.1001-5280.2015.01.22 |
| [25] |
GAO Y H, GAO Y K, WU Z P, et al. Characterization of TEMINAL FLOWER1 homologs CmTFL1c gene from Chrysanthemum morifolium[J]. Plant Mol Biol, 2019, 99(6): 587-601. DOI:10.1007/s11103-019-00838-6 |
| [26] |
HONG Y, TANG X J, HUANG H, et al. Transcriptomic analyses reveal species-specific light-induced anthocyanin biosynthesis in Chrysanthemum[J]. BMC Genom, 2015, 16(1): 202. DOI:10.1186/s12864-015-1428-1 |
 2020, Vol. 28
2020, Vol. 28



