2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
水分对植物的生长、死亡和分布至关重要[1]。植物水力性状(plant hydraulic trait)是指植物在长期演化过程中形成的适应生境水分条件的形态结构和生理功能,表征植物水分吸收、转运和丧失等过程的重要特征[2]。水力性状主要指与植物利用水分相关的性状,包括水力效率(hydraulic efficiency)和水力安全(hydraulic safety)两个方面[3]。水力效率是指植物吸收、转运、散失水分的速率和效率,如水力加权导管直径、理论导水率等。由于导管的导水率与其直径的四次方成正比,因此水力加权导管直径(Dh)能够突出直径较大的导管对水分传导的贡献[4];湿润地区植物的Dh显著大于干旱地区的植物[5-6]。理论导水率(Kth)是通过导管的解剖特征根据Hagen-Poiseuille法则进行估算,可以表征理论状态下植物的水分传导速率,与植物光合能力和抗旱性密切相关[7]。
而水力安全是指植物面对干旱胁迫时保持正常水分生理的能力,与植物抗旱相关的性状有叶片膨压丧失点、导管脆弱性指数等[8-9]。叶片膨压丧失点(TLP)是指植物在发生质壁分离时的水势,是表征植物抗旱能力的重要指标,TLP值越低表明植物在水分胁迫时维持自身膨压的能力越强[10-11]。脆弱性指数(VI)是由Carlquist提出的,通常用来表示物种对生境水分条件的适应能力,即植物水分运输的安全性;VI值越大说明植物在面对干旱胁迫时导管更易发生栓塞,反之导管发生栓塞风险越小[12]。因此, TLP、VI值越大说明植物水力安全越低。此外,叶脉密度(VD)和比叶面积(SLA)也与植物抗旱能力密切相关,叶脉是叶片内水分运输的通道,VD是指单位叶片面积中叶脉的长度,VD值越大的植物,一般具有越高的耐旱性[13-14]。而比叶面积是指单位叶片干质量的鲜叶面积,较低的SLA可以有效的减少蒸腾防止叶片过度失水,还可以将更多的物质用于构建保卫结构,以增加植物的抗旱能力[15]。
棕榈科(Palmae/Arecaceae)植物分布广泛,是分化较早的植物类群之一,起源于距今1亿年前白垩纪中期[16]。棕榈科植物能够适应广泛的水分生态位,其分布地年均降水量跨度较大(500~4 000 mm)。Eiserhardt等[17]报道约90%的棕榈科植物分布于热带雨林和沼泽森林等湿润生境(moist habitat),约10%分布于萨王纳草原、地中海森林和半荒漠草原等季节性干旱生境(seasonally dry habitat)。Cassia等[18]认为棕榈科植物的生态位保守性使其在湿润和季节性干旱生境中物种丰富度呈现巨大差异。有研究表明,分布于季节性干旱生境的耐旱棕榈具有较高的抗氧化酶活性和水分利用效率,能适应干旱胁迫[19-21]。然而有关两种原生境棕榈科植物叶片水力性状在同质园的差异研究未见报道。以同质园的植物为研究对象,可以排除环境的影响,更能反映植物遗传物质上的差异[22-23]。因此,本研究以中国科学院华南植物园中常见的6种棕榈科植物为材料,根据其原分布水分条件分为湿润生境物种(所罗门皱籽棕、槟榔、澳洲轴榈)和季节性干旱生境物种(大丝葵、澳洲蒲葵、大蒲葵),测定与水力效率和水力安全相关的结构和功能性状,探讨这些功能性状在原分布于不同生境的棕榈科植物间的变化趋势,以及水力效率和水力安全性状间是否存在权衡,为研究原分布于不同生境的棕榈对水分条件的适应性及其水力策略提供科学依据。
1 材料和方法 1.1 研究地概况本研究试验地位于广东省广州市中国科学院华南植物园(23°11′ N,113°21′ E)内,属于亚热带季风气候;光照充足,年均温约为22℃,年均降水量约为1 700 mm,但降水分布不均,存在明显的干湿季,4-9月为雨季,10月-次年3月为旱季,雨季降水量占全年的80%以上;海拔约为100 m,土壤以赤红壤为主,土层深厚,土壤质地以黏质和沙质土壤为主,pH为4.5~6.6,呈弱酸性。棕榈园始建于1956年,收集、种植了国内外棕榈科植物300多种,是国内棕榈科植物重要的种质资源保存基地。
1.2 材料本研究选取6种棕榈科植物为材料,参考Palmpedia棕榈科网站http://www.palmpedia.net和全球生物多样性数据库http://www.gbif.org的描述, 大丝葵(Washingtonia robusta),又名华盛顿棕榈,是贝叶棕亚科(Coryphoideae)乔木状植物,原产于墨西哥西北部巴贾半岛和索诺拉州,生长于沙漠山谷、荒漠或半荒漠等生境中,原生地年均降雨量约533 mm, 具有较强的耐旱性,现胸径为30.45 cm, 高达7.93 m。澳洲蒲葵(Livistona australis)是贝叶棕亚科乔木状植物,原产于澳大利亚昆士兰州、新南威尔士州和维多利亚州等地区,生长于稀树草原灌丛、落叶林以及沼泽森林等生境中,原生地年均降雨量约1 291 mm, 具有较强的耐旱性, 现胸径为19.33 cm, 高达3.00 m。大蒲葵(L. saribus, 大叶蒲葵)是贝叶棕亚科乔木状植物,分布于中国东南部海拔600~800 m阔叶林中,原生地年均降雨量约1 313 mm,具有一定的耐旱性, 现胸径为36.00 cm, 高达2.50 m。澳洲轴榈(Licuala ramsayi)是贝叶棕亚科乔木状植物, 原分布于澳大利亚海拔0~450 m的热带雨林、沼泽森林、红树林等生境中,原生地年均降雨量约2 300 mm,喜欢湿润生境,不耐干旱, 现胸径为13.00 cm, 高达0.60 m。槟榔(Areca catechu)是槟榔亚科(Arecoideae)乔木状植物,原产于马来西亚的热带雨林中,原生地年均降雨量约2 937 mm, 不耐干旱, 现胸径为8.33 cm, 高达5.17 m。索罗门皱籽棕(Ptychosperma salomonense)是槟榔亚科乔木状植物,原产于新几内亚所罗门地区的热带雨林中,原生地年均降雨量约3 147 mm,不耐干旱, 现胸径为4.88 cm, 高达5.73 m。
1.3 方法Cassia等[18]将棕榈科植物生境划分为季节性干旱生境、湿润生境和中间生境。年均降雨量小于1 800 m且具有显著较长时间季节性干旱的地区定义为季节性干旱地区[24],主要包括沙漠、荒漠或半荒漠、地中海森林和热带稀树草原等;而年均降雨量大于2 000 mm,且没有季节性干旱的地区定义为湿润地区[25],主要是热带雨林、沼泽森林、红树林等;中间生境的年均降雨量为1 800~2 000 mm。
本研究的6种棕榈科植物原生境可划分为两类:季节性干旱生境(大丝葵、澳洲蒲葵、大蒲葵)和湿润生境(澳洲轴榈、槟榔、所罗门皱籽棕)。植物性状测定于2019年5月完成,每种植物选择3~5株生长良好且胸径、株高尽可能一致的个体,每株植物采集至少1片叶子(因棕榈科植物叶片巨大且数量较少,过多采集对植物生长影响巨大),于清晨(5:30)采集完全展开、长势良好的成熟叶片,插入装有水的桶中,并在水中剪掉约2 cm的叶柄,盖上黑色遮光布,迅速带回实验室进行测定,充分复水24 h。
1.4 比叶面积取充分复水后叶片,选取分别位于同侧近轴端、中部和远轴端各3~4片小叶片(掌状叶,则选取0°、45°、90°附近的小叶片),用叶面积仪(Li-3000A, Li-Cor, Lincoln, NE, USA)测定小叶片叶面积(A),将小叶片放入60℃的烘箱中烘72 h至恒重,用天平称量小叶片干质量(Dw),计算比叶面积(specific leaf area, SLA, cm2/g),SLA=A/Dw。
1.5 叶片膨压丧失点选取位于另一侧近轴端、中部和远轴端各3~4片的小叶片(掌状叶,则选取0°、45°、90°附近的小叶片)测定叶片膨压丧失点。去除小叶片主脉,用剪刀将叶片剪成小段后混合,用铝箔纸包裹,将样品放入液氮中冷冻脆化2 h。取出脆化后的样品放入研钵中,加入液氮快速研磨至细颗粒粉末状。将研磨后的样品,转移至10 mL的一次性针筒中,快速按压针筒至出现液滴,用1 mL离心管盛接直至无液滴出现;将样品在1 006.2×g离心5 min,取上清液约200 μL用渗透压测定仪(Vogel, OM 801, Giessen, Germany)测量叶片的饱和渗透势ψs。计算膨压丧失点(leaf turgor loss point, TLP, MPa)[26], TLP=0.832ψs- 0.631。
1.6 叶脉密度选取测定膨压丧失点小叶临近处的2~3片小叶片测定叶脉密度(vein density, VD, mm/mm2)。叶脉密度是指叶脉长度与所对应叶片面积的比值。取中间约1 cm2的叶片,放入含5% NaOH的乙醇溶液中浸泡,去除叶肉组织使叶脉清晰可见。取出叶片用清水浸泡,去除残留的NaOH溶液,然后用1%次氯酸钠溶液漂白。漂白后再用清水浸泡,然后用1%的番红溶液染色2~3 min,用50%的乙醇溶液洗去样品表面浮色,制成临时装片,用显微镜(Lecia, DM2500, Lecia Microsystems, Wetzlar, Germany)在10倍镜头下拍摄若干视野,然后用ImageJ (NIH, Bethesda, MD, USA)计算叶脉长度。
1.7 理论导水率和脆弱性指数取离近轴端小叶片5 cm处的叶柄,切取1 cm3的样品放入FAA固定液中固定4 h。用乙二胺溶液软化24 h,将软化后的样品冲洗干净,经过梯度(5%、10%、20%、40%、60%、80%和100%)聚乙二醇(PEG 2000)溶液浸泡各24 h,制作成包埋样品后, 使用滑动切片机(Lecia, SM2010R, Lecia Microsystems, Wetzlar, Germany)制作叶柄横截面切片,然后使用1%番红和1%固绿溶液进行对染,经乙醇脱色,用二甲苯溶液进行透明,最后用中性树脂封片制作永久切片。用光学显微镜(Leica DM2500; Leica Microsystems, Wetzlar, Germany)观测,物镜放大10倍,每个切面拍摄若干视野,并拼接出整个叶柄横切面或1个扇形的区域。用ImageJ (NIH, Bethesda, MD, USA)测量叶柄导管密度(DV)、导管直径(D), 共计算了18张整合照片的约4 000根导管。
植物理论导水率[theoretical hydraulic conduc-tivity, Kth, kg/(m·MPa·s)]是根据Hagen-Poiseuille法则通过导管的解剖特征进行估算。首先计算出导管直径的权重值,Dh=(∑D4/N)1/4,式中,N为导管数量,Dh为导管的权重值,D为实测导管直径。再计算理论导水率,Kth=(Dh4πρ)/128η×DV, 式中, η是水在20℃下的粘度(1.002×10‒9 MPa·s),ρ是水在20℃时的密度(998.2 kg/m3),DV是导管密度。
Carlquist脆弱性指数(vulnerability index, VI, mm/m2),通常表示物种对水分环境的适应能力,表示植物水分运输的安全性,VI越小表示水分运输越安全,反之,VI越大表示水分运输危险[12],VI= (Dh/103)/(DV/106)。
1.8 数据分析对各性状间数据的差异显著性采用t检验。性状间的相关性用线性回归方程(linear regression)进行拟合。所有数据分析和作图均采用R软件(R Development Core Team, 2013)处理。
2 结果和分析 2.1 叶片水力性状原分布于湿润生境(originally distributed in moist habitat, SOMH)的棕榈科植物的SLA显著大于原分布于季节性干旱生境(originally distributed in seasonally dry habitat, SODH) (P < 0.05),分别为109.05和72.31 cm2/g。SOMH棕榈科植物的VD显著小于SODH的(P < 0.05),分别为3.33和5.05 mm/mm2。SOMH的棕榈科植物与水力效率相关性状Dh和Kth显著大于SODH的(P < 0.05),并且SOMH的棕榈科植物与水力安全相关的性状TLP和VI也显著大于SODH的(P < 0.05)(表 1)。
| 表 1 棕榈科6种植物的水力性状 Table 1 Hydraulic traits of six palm species |
相关分析表明,作为植物水力效率的相关指标Kth与水力安全的相关指标VI间呈显著正相关(R2= 0.92, P < 0.01, 图 1: A),并且与水力安全的相关指标TLP呈显著正相关(R2=0.71, P < 0.05, 图 1: B)。
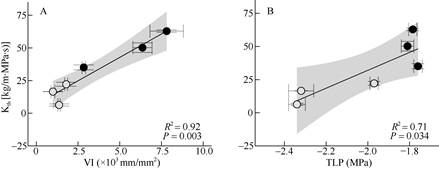
|
图 1 棕榈科6种植物的理论导水率(Kth)与脆弱性指数(VI)和膨压丧失点(TLP)间的相关关系。 ○: SODH; ●:SOMH。n=3~5。 Fig. 1 Relationships between theoretical hydraulic conductivity (Kth) and vulnerability index (VI), turgor loss point (TLP) of six Arecaceae species. ○: SODH; ●:SOMH. n=3-5. |
水力加权导管直径(Dh)和理论导水率(Kth)反映植物输导组织的水分传导能力。本研究表明,SOMH棕榈科植物的Dh和Kth均显著大于SODH棕榈科植物,即湿润生境的物种比季节性干旱生境的物种具有更高的水力效率,这与前人[27-28]的研究结果一致。Pfautsch等[28]对28种桉树导管性状进行了研究, 认为植物的导管直径和理论导水率随其分布地干旱的程度的增加而减小,而这种变化在很大程度上是源于基因型上的差异,而不是性状的可塑性。本研究在同质园中开展,避免了环境差异对性状的影响,因而从基因型上更准确地反映植物水力效率对生境水分可用性的长期适应。
在干旱生境中,植物将经常遭受干旱胁迫, 因此保障水力安全对植物来说至关重要。本研究表明,SODH棕榈科植物的TLP和VI均显著小于SOMH棕榈科植物,这与Zhu等[10]和Bartlett等[11]的研究结果一致,干旱生境的物种比湿润生境的物种具有更强的抗旱能力,而水力安全也更高。研究表明,分布于干旱地区的植物比湿润地区的植物具有更低的TLP和VI[10, 12]。更负的TLP有利于植物形成较低的叶片水势,产生土壤-植物水势梯度,使得植物根系能够更好的从土壤中吸收水分并转运到叶片中。而TLP是叶片发生萎蔫前所能达到的水势极值,因此TLP与植物的水力安全相关[10-11]。而且具有较小导管直径和较低VI的植物,其导管的抗栓塞能力较强,在干旱胁迫下植物不易发生水力失败[12]。因此,本研究表明长于季节性干旱生境的棕榈科植物具有更高的水力安全。
Sack等对全球不同生态系统中796种植物的叶脉功能性状进行了比较,认为植物叶脉密度(VD)与年降雨量之间呈负相关[13]。本研究表明,SODH物种的VD显著大于SOMH物种,这与前人[29-30]的研究结果相同。龚容等[30]认为当植物面对干旱胁迫时,蒸腾拉力大的叶片中导管容易发生栓塞,叶脉密度较大的叶脉冗余度也较大,可以在部分叶脉发生栓塞时提供更多的替代途径,保证叶片的水分正常供应,是一种水力安全策略。比叶面积是一个综合性状,与植物抗旱性和光合作用紧密相关。比叶面积(SLA)较低的植物在叶片保卫结构和叶片密度上投资较大,以增加叶片的导水阻力减小叶片蒸腾,提高叶片的抗旱性[31]。宋娟等[32]的研究表明, 6种蕨类植物的SLA随生境水分可利用性的减小而降低,叶片通过降低SLA来减小蒸腾。本研究中的3种SODH物种的SLA要显著小于SOMH物种, 说明生长于季节性干旱生境的棕榈将更多的物质和能量用于叶片的构建,降低SLA减少蒸腾适应干旱环境。
3.2 棕榈科植物叶片水力效率和水力安全间的权衡水力效率和水力安全是植物水分策略重要组成部分,本研究表明棕榈科植物叶片水力效率和水力安全之间存在权衡关系(trade-offs),这与前人[4, 6, 9]在相似研究中的结果相一致。苏田[33]和谭凤森[34]在研究木本植物枝条水力性状时,认为植物在构建水力系统时既要传输充足的水分满足植物蒸腾需水,又要在面对干旱胁迫时最大限度的降低水力失败的风险,因此水力效率和水力安全之间存在权衡关系,且和物种分布生境的水分条件密切相关[35]。在本研究中,分布生境不同的物种采用了不同水分策略,3种SOMH棕榈植物具有较高的水力效率但水力安全则较低,而3种SODH棕榈植物具有较低的水力效率但水力安全较高。
本研究发现在同质园中来自不同水分生境的棕榈科植物的水力性状和水分策略存在显著差异, 而这种差异可能是棕榈科植物在长期演化过程中形成的适应其生境水分条件的水力性状和水分策略,是趋异分化的结果,而且移栽至同质园后这种差异仍然存在;这与之前对同质园中来自不同分布中心的木兰科植物水力性状趋异分化的研究结果[23]一致。因此,同质园中SOMH和SODH棕榈植物水力性状和水分策略上的差异,在一定程度上反映了棕榈植物对不同水分生境的生理生态适应性。此外,随着全球气候变化,由降水格局变化所导致的干旱事件频发,严重影响了湿润生境棕榈科植物的生存和分布范围[36]。因此在棕榈科种质资源的保护中,应该加大对湿润生境物种的保护工作,特别是分布地范围小且降水高的岛屿物种,建立棕榈科植物园是一种十分有效的保护措施。
本研究中的6种棕榈科植物原分布地生境的水分条件迥异,在同质园中其水力性状也表现出很大的差异,以及水力效率和水力安全之间存在权衡关系,表明了水力性状对原生境的适应性是基因型的差异。本研究选取的物种偏少,还需要通过对更多物种和更精细、直接的水力性状数据,以深入研究物种对不同生境的适应性。
| [1] |
KRAMER P J, BOYER J S. Water Relations of Plants and Soils[M]. San Diego: Academic Press, 1995: 7-26.
|
| [2] |
HE P C, YE Q. Plant functional traits:From individual plant to global scale[J]. J Trop Subtrop Bot, 2019, 27(5): 523-533. 贺鹏程, 叶清. 基于植物功能性状的生态学研究进展:从个体水平到全球尺度[J]. 热带亚热带植物学报, 2019, 27(5): 523-533. DOI:10.11926/jtsb.4108 |
| [3] |
HE P C. Using functional traits to reveal the response of forest plants to environmental variation: From individual plant to global scale[D]. Beijing: University of Chinese Academy of Sciences, 2019: 1-8. 贺鹏程.基于功能性状探讨森林植物对环境变化的响应: 从个体水平到全球尺度[D].北京: 中国科学院大学, 2019: 1-8. http://www.cnki.com.cn/Article/CJFDTOTAL-RYZB201905005.htm |
| [4] |
TYREE M T, DAVIS S D, COCHARD H. Biophysical perspectives of xylem evolution:is there a tradeoff of hydraulic efficiency for vulnerability to dysfunction?[J]. IAWA J, 1994, 15(4): 335-360. DOI:10.1163/22941932-90001369 |
| [5] |
CAI J, TYREE M T. The impact of vessel size on vulnerability curves:Data and models for within-species variability in saplings of aspen, Populus tremuloides Michx[J]. Plant Cell Environ, 2010, 33(7): 1059-1069. DOI:10.1111/j.1365-3040.2010.02127.x |
| [6] |
HAJEK P, LEUSCHNER C, HERTEL D, et al. Trade-offs between xylem hydraulic properties, wood anatomy and yield in Populus[J]. Tree Physiol, 2014, 34(7): 744-756. DOI:10.1093/treephys/tpu048 |
| [7] |
SCOFFONI C, MCKOWN A D, RAWLS M, et al. Dynamics of leaf hydraulic conductance with water status:Quantification and analysis of species differences under steady state[J]. J Exp Bot, 2012, 63(2): 643-658. DOI:10.1093/jxb/err270 |
| [8] |
ANDEREGG L D L, HILLERISLAMBERS J. Drought stress limits the geographic ranges of two tree species via different physiological mechanisms[J]. Glob Change Biol, 2016, 22(3): 1029-1045. DOI:10.1111/gcb.13148 |
| [9] |
GLEASON S M, WESTOBY M, JANSEN S, et al. Weak tradeoff between xylem safety and xylem-specific hydraulic efficiency across the world's woody plant species[J]. New Phytol, 2016, 209(1): 123-136. DOI:10.1111/nph.13646 |
| [10] |
ZHU S D, CHEN Y J, YE Q, et al. Leaf turgor loss point is correlated with drought tolerance and leaf carbon economics traits[J]. Tree Physiol, 2018, 38(5): 658-663. DOI:10.1093/treephys/tpy013 |
| [11] |
BARTLETT M K, SCOFFONI C, SACK L. The determinants of leaf turgor loss point and prediction of drought tolerance of species and biomes:A global meta-analysis[J]. Ecol Lett, 2012, 15(5): 393-405. DOI:10.1111/j.1461-0248.2012.01751.x |
| [12] |
SCHULDT B, KNUTZEN F, DELZON S, et al. How adaptable is the hydraulic system of European beech in the face of climate change-related precipitation reduction?[J]. New Phytol, 2016, 210(2): 443-458. DOI:10.1111/nph.13798 |
| [13] |
SACK L, SCOFFONI C. Leaf venation:Structure, function, development, evolution, ecology and applications in the past, present and future[J]. New Phytol, 2013, 198(4): 983-1000. DOI:10.1111/nph.12253 |
| [14] |
QIN X, ZHU J J, GUAN X Y, et al. The correlations of leaf anatomical characteristics with photosynthetic capacity and drought tolerance in seven sugarcane cultivars[J]. Plant Physiol J, 2017, 53(4): 705-712. 秦茜, 朱俊杰, 关心怡, 等. 七个甘蔗品种叶片解剖结构特征与光合能力和耐旱性的关联[J]. 植物生理学报, 2017, 53(4): 705-712. DOI:10.13592/j.cnki.ppj.2017.0038 |
| [15] |
BUCCI S J, GOLDSTEIN G, MEINZER F C, et al. Functional convergence in hydraulic architecture and water relations of tropical savanna trees:From leaf to whole plant[J]. Tree Physiol, 2004, 24(8): 891-899. DOI:10.1093/treephys/24.8.891 |
| [16] |
COUVREUR T L P, BAKER W J. Tropical rain forest evolution:Palms as a model group[J]. BMC Biol, 2013, 11: 48. DOI:10.1186/1741-7007-11-48 |
| [17] |
EISERHARDT W L, SVENNING J C, KISSLING W D, et al. Geographical ecology of the palms (Arecaceae):Determinants of diversity and distributions across spatial scales[J]. Ann Bot, 2011, 108(8): 1391-1416. DOI:10.1093/aob/mcr146 |
| [18] |
CÁ SSIA-SILVA C, FREITAS C G, ALVES D M C C, et al. Niche conservatism drives a global discrepancy in palm species richness between seasonally dry and moist habitats[J]. Glob Ecol Biogeogr, 2019, 28(6): 814-825. DOI:10.1111/geb.12895 |
| [19] |
RENNINGER H J, PHILLIPS N, HODEL D R. Comparative hydraulic and anatomic properties in palm trees (Washingtonia robusta) of varying heights:Implications for hydraulic limitation to increased height growth[J]. Trees, 2009, 23(5): 911-921. DOI:10.1007/s00468-009-0333-0 |
| [20] |
ARAB L, KREUZWIESER J, KRUSE J, et al. Acclimation to heat and drought:Lessons to learn from the date palm (Phoenix dactylifera)[J]. Environ Exp Bot, 2016, 125: 20-30. DOI:10.1016/j.envexpbot.2016.01.003 |
| [21] |
RUAN Z P, TANG Y J, ZENG M J. Influence of drought stress on photosynthetic characteristics and activity of antioxidant enzymes of four species of palm seedlings[J]. Chin J Trop Crop, 2016, 37(10): 1914-1919. 阮志平, 唐源江, 曾美涓. 干旱胁迫对4种棕榈植物幼苗光合特性及抗氧化酶活性的影响[J]. 热带作物学报, 2016, 37(10): 1914-1919. DOI:10.3969/j.issn.1000-2561.2016.10.011 |
| [22] |
MA R Y. Study on the carbon metabolism, stoichiometry and regulation of water consumption of palms (Arecaceae)[D]. Beijing: University of Chinese Academy of Sciences, 2015: 10-18. 马仁义.棕榈科植物的碳代谢、养分计量和水分消耗调控的研究[D].北京: 中国科学院研究生院, 2015: 10-18. http://ir.xtbg.org.cn/handle/353005/9341 |
| [23] |
LIU H, XU Q Y, HE P C, et al. Strong phylogenetic signals and phylogenetic niche conservatism in ecophysiological traits across divergent lineages of Magnoliaceae[J]. Sci Rep, 2015, 5: 12246. DOI:10.1038/srep12246 |
| [24] |
BASTIN J F, BERRAHMOUNI N, GRAINGER A, et al. The extent of forest in dryland biomes[J]. Science, 2017, 356(6338): 635-638. DOI:10.1126/science.aam6527 |
| [25] |
MORLEY R J. Origin and Evolution of Tropical Rain Forests[M]. Chichester: Wiley, 2000: 15-60.
|
| [26] |
BARTLETT M K, SCOFFONI C, ARDY R, et al. Rapid determination of comparative drought tolerance traits:using an osmometer to predict turgor loss point[J]. Methods Ecol Evol, 2012, 3(5): 880-888. DOI:10.1111/j.2041-210X.2012.00230.x |
| [27] |
LENS F, SPERRY J S, CHRISTMAN M A, et al. Testing hypotheses that link wood anatomy to cavitation resistance and hydraulic conductivity in the genus Acer[J]. New Phytol, 2011, 190(3): 709-723. DOI:10.1111/j.1469-8137.2010.03518.x |
| [28] |
PFAUTSCH S, HARBUSCH M, WESOLOWSKI A, et al. Climate determines vascular traits in the ecologically diverse genus Eucalyptus[J]. Ecol Lett, 2016, 19(3): 240-248. DOI:10.1111/ele.12559 |
| [29] |
YAO G Q, WEI Y, BI M H, et al. Relationship between leaf vein density and the lowest water potential under drought stress in four Caragana species[J]. J Dis Res, 2018, 38(6): 1252-1258. 姚广前, 魏阳, 毕敏慧, 等. 干旱胁迫下4种锦鸡儿属植物叶脉密度与最低水势关系[J]. 中国沙漠, 2018, 38(6): 1252-1258. DOI:10.7522/j.issn.1000-694X.2017.00089 |
| [30] |
GONG R, XU X, JIANG H L, et al. Architectural traits of stem-leaf hydraulic system in typical shrubs in arid and semi-arid regions[J]. J Beijing Norm Univ (Nat Sci), 2018, 54(4): 534-542. 龚容, 徐霞, 江红蕾, 等. 干旱半干旱区几种典型灌木半灌木茎叶水分传导系统的结构特征[J]. 北京师范大学学报(自然科学版), 2018, 54(4): 534-542. DOI:10.16360/j.cnki.jbnuns.2018.04.017 |
| [31] |
REICH P B, WALTERS M B, ELLSWORTH D S, et al. Relationships of leaf dark respiration to leaf nitrogen, specific leaf area and leaf life-span:A test across biomes and functional groups[J]. Oecologia, 1998, 114(4): 471-482. DOI:10.1007/s004420050471 |
| [32] |
SONG J, LI R H, ZHU S D, et al. Leaf functional traits of ferns from different habitats in monsoon evergreen broad-leaved forest in Dinghushan Mountain[J]. J Trop Subtrop Bot, 2013, 21(6): 489-495. 宋娟, 李荣华, 朱师丹, 等. 鼎湖山季风常绿阔叶林不同生境蕨类植物的叶片功能性状研究[J]. 热带亚热带植物学报, 2013, 21(6): 489-495. DOI:10.3969/j.issn.1005-3395.2013.06.001 |
| [33] |
SU T. Vessel variation of woody plants and their coupling with leaf-wood traits across islands in eastern China[D]. Shanghai: East China Normal University, 2019: 2-6. 苏田.中国东部岛屿木本植物导管变异及其与叶片-木质性状耦合[D].上海: 华东师范大学, 2019: 2-6. http://d.wanfangdata.com.cn/thesis/Y2498470 |
| [34] |
TAN F S. Hydraulic characteristics of woody plants in a northern tropical seasonal rain forest in Guangxi's southwest karst landscape[D]. Nanning: Guangxi University, 2019: 1-15. 谭凤森.桂西南北热带喀斯特季雨林木本植物的水力学特征研究[D].南宁: 广西大学, 2019: 1-15. http://cdmd.cnki.com.cn/Article/CDMD-10593-1019210159.htm |
| [35] |
LIU H, GLEASON S M, HAO G Y, et al. Hydraulic traits are coordinated with maximum plant height at the global scale[J]. Sci Adv, 2019, 5(2): eaav1332. DOI:10.1126/sciadv.aav1332 |
| [36] |
WALTHER G R, GRITTI E S, BERGER S, et al. Palms tracking climate change[J]. Glob Ecol Biogeogr, 2007, 16(6): 801-809. DOI:10.1111/j.1466-8238.2007.00328.x |
 2020, Vol. 28
2020, Vol. 28


