核桃黑斑病,又名核桃黑腐病,几乎是世界上所有核桃主要产区最严重的地上部分病害[1-3], 导致落果严重,严重时落果率达60%以上,开花前后发生的感染可以使产量损失达到80%[4-6]。核桃细菌性黑斑病病原菌是专化寄生胡桃属(Juglans)病原细菌[7-8]。我国有关核桃黑斑病菌大都命名为Xanthomonas camperstris pv. juglandis,后来又被命名为X. arboricola pv. juglandis,也有部分报道为X. juglandis[6, 9-10]。陈善义等[11]对北京地区核桃黑斑病病原菌16S rDNA序列进行分析,认为其病原菌为X. campestris。美国加州核桃细菌性黑斑病菌株的dnaK和rpoD基因分析表明,致病菌的基因序列与X. arboricola非常接近,rDNA基因分析结果表明与X. arboricola、X. gardneri和X. vesicatoriajie均接近[12]。Stefania等[13]采用AFLP分子标记技术,对法国、英国和意大利等8个国家的66个核桃黑斑病致病菌鉴定为X. arboricola pv. pruni、X. arboricola pv. corylina、X. campestris pv. campestris、X. fraga- riae、X. hortorum和X. axonopodis pv. vesicatoria。
目前,任何核桃品种(无性系)对黑斑病都不具有完全免疫[14]。采用化学防治,存在无法掌握杀菌剂最佳使用时间及其对环境和自然生态系统的影响等问题,因此,使用抗病育种方法获得抗性栽培品种仍是最为有效和可靠的核桃黑斑病防治方法[1, 15-16]。Soltani等[17]对16个核桃基因型接种病原菌X. arboricola pv. juglandis进行抗病性试验,筛选出最抗病基因型94和最感病基因型69。Botu等通过对550个英国核桃无性系进行田间测试和形态学特征,筛选出3个(Valcor、Valmit和Valrex)抗黑斑病的无性系[18]。我国西南地区核桃产区高湿高热环境为病原菌的侵染提供了良好的先决条件,加之引进的北方品种展叶较早,黑斑病十分普遍并持续发生,已成为影响该地区核桃产业发展的主要限制因素[19]。本研究对引起四川盆地地区核桃黑斑病的病原体进行分离和致病性测定,依据病原菌形态学, 并结合16S rDNA基因序列构建系统发育树,确定病原菌的种类;同时,通过田间人工接种分离的病原物,对收集的四川18个核桃栽培品种(无性系)进行抗病性鉴定,以期为核桃黑斑病的准确识别、抗病机理研究和抗病新品种选育提供科学依据。
1 材料和方法 1.1 材料用于抗性评价的18个核桃(Juglans regia)栽培品种(无性系)信息见表 1, 均保存于四川农业大学崇州现代农业研发基地(103°67' E,30°63' N),基地位于四川省崇州市, 属典型亚热带季风性湿润气候,年均温15.9℃, 年均日照时数1 161.5 h,年均降雨量1 000 mm以上,且主要集中在夏季,试验地能充分代表四川盆地的气候特点。
| 表 1 用于抗病评价的核桃品种(无性系) Table 1 Cultivars (clones) used for resistance evaluation |
用于病原菌分离的寄主材料取自四川盆地地区核桃林,采集表现出黑斑病症状的当年生幼嫩叶片、幼果共计36份,用湿纱布擦洗干净放入自封袋中,做好标记并装入冰袋带回实验室保存于-20℃冰箱中备用。2 a生健康核桃苗用于回接试验,进行致病性测定。
1.2 病原菌的分离纯化与回接试验对采集的试验材料进行拍照、整理和编号,然后对疑似黑斑病的叶片、幼果进行病原菌的分离和纯化。用平板划线法分离病原菌[20]:将具有典型症状的核桃病叶用无菌水清洗干净,自然晾干后剪成10个5 mm×5 mm的小块病组织;75%酒精浸泡5 s, 立即用无菌水清洗3次;放入0.1%的升汞溶液中浸泡1 min,无菌水清洗3次;将病叶组织置于灭菌的载玻片上,滴加无菌水,并用灭菌的玻璃棒充分研碎;用灭菌移植环蘸取研碎的组织液于NA平板上划线培养,每份材料重复3次;最后将平板翻转并做好标记,将其置于28℃、12 h/12 h光暗交替的恒温培养箱中培养。将分离得到的病原菌放到LB平板上进行纯化培养,纯化后的菌落转移到LB液体培养基中扩大培养,-80℃保存备用[21]。
采用针刺涂抹法和柯赫氏法则进行回接试验。将保存的菌株划线转移至LB平板,28℃活化培养3~4 d,然后挑取单菌落进行扩大培养,配制成108 CFU/mL的菌体悬浮液。选取健康的2 a生核桃苗,采取针刺涂抹法于叶背面接种(先用灭菌束针轻刺叶片,再用毛笔刷蘸取少量菌液,涂抹于叶背面进行接种),接种后覆上一层保鲜膜,保湿培养24 h后去掉保鲜膜,并设置空白LB液体接种叶片作为对照。每处理接种6片叶,重复3次。7~10 d后记录发病情况,根据柯赫氏法则,待病原菌接种部位表现典型的黑斑病症状时,对发病的组织重新进行病原菌的分离与鉴定,并观察分离出的病原菌形态特性是否与之前的相同,初步确定核桃黑斑病的病原菌,再根据其发病率和严重度确定病原细菌的致病力大小。
1.3 病原菌形态学鉴定将黑斑病病原菌活化培养于LB平板培养基上, 28℃培养3 d后在OLYMPUS光学显微镜下观察菌落的形态特征,包括菌落表面(颜色、形状、大小、质地和光泽度)、是否隆起、边缘和透明度等重要的鉴别特征。
1.4 病原菌分子鉴定利用天根细菌总DNA提取试剂盒提取代表菌株28-2基因组DNA,稀释10倍备用。以DNA为模板,采用细菌通用引物27F/1492R (正向: 5'-AG- AGTTTGATCCTGGCTCAG-3';反向: 5'-GGTTAC- CTTGTTACGACTT-3')进行PCR扩增。PCR扩增体系为25 μL:DNA模板1 μL,Taq聚合酶(2×) 12.5 μL, 正反向引物各1 μL,去离子水补足至25 μL。反应程序为:95℃预变性5 min,94℃变性45 s,55℃退火45 s,72℃延伸45 s,35个循环,最后72℃延伸10 min,4℃保存。扩增产物用1%琼脂糖凝胶进行电泳检测,然后将菌株28-2的PCR产物送上海擎科生物技术公司进行16S rDNA测序。
将测序获得的序列在NCBI基因数据库中进行比对,并于GenBank已登录的相似序列进行同源性比对,利用MEGA X软件采用邻接法(neighbor- joining method)构建系统发育树,分析其亲缘关系。将病原菌的亲缘关系分析结果与其形态特征、培养性状及致病性结合起来对其进行鉴定。
1.5 抗病性评价将菌株28-2活化后配置107 CFU/mL菌体悬浮液。选取健康且长势一致的核桃品种(无性系)各13株,10株用于接种,3株为对照,从外围枝的顶叶上选取从外往里数长势良好的第二对小叶(12片/株), 并做好标记,采用针刺涂抹法接种,接种植株均为1 a生嫁接苗。以接种无病原菌的LB液为对照。接种后覆层保鲜膜,保湿培养48 h后揭除,10 d之后统计每株叶片的发病情况。
调查品种(无性系)的发病率(%)=发病的点数/调查总点数×100%,采用十字交叉法测量黑斑病的病斑直径,并进行分级[22], I级病斑症状不明显甚至无症状;II级病斑直径≥2.0 mm;III级病斑直径2.1~4.0 mm;IV级病斑直径4.1~6.0 mm;V级病斑直径≥6.1 mm。参照盛宝龙等[23]的方法计算病情指数(%)=∑(病点数×病级)/(调查总点数×最高病级)×100%,并将核桃品种(无性系)对黑斑病的田间抗性分为4级:高抗(HR)的病情指数为0.00~24.00,抗病(R)的病情指数为24.01~31.00,感病(S)的病情指数为31.01~40.00,高感(HS)的病情指数≥40.01。
2 结果和分析 2.1 病原菌的分离、纯化和致病性测定对从四川各地采集的36份核桃病叶、病果进行病原菌分离纯化,获得单菌落的菌株18株,经形态学初步鉴定,主要分为4类:黄单胞杆菌属(Xan-thomonas)、短小杆菌属(Curtobacterium)、泛菌属(Pantoea)和金黄杆菌属(Chryseobacterium),分离率分别为黄单胞杆菌属(33.33%) > 短小杆菌属 (27.78%) > 泛菌属(22.22%) > 金黄杆菌属(16.67%)。从叶片分离的菌落较纯, 且分离率较高,而从果实上分离的菌落比较杂乱, 说明核桃果实更容易受到多种病菌的复合侵染。对分离的4类菌株进行回接试验,接种7 d后, 只观察到黄单胞菌属菌株能引起植株发病。分离回接试验感病组织病原菌,其菌落形态与原分离的病原菌菌落形态相一致,确定该病菌与病样分离获得的病原菌为同一病菌, 符合柯赫氏法则,说明黄单胞杆菌属(Xanthomonas)是四川盆地核桃黑斑病的病原菌。
2.2 病原菌的形态特征及分子鉴定筛选获得的6个黄单胞杆菌属菌株形态特征基本相同,均表现为圆形、光滑、隆起,前期颜色为乳白色,后期均发展为浅黄色,质地均较粘稠(图 1: A)。显微镜下观察,6个菌株的单个菌体均呈短杆状,菌体大小为(0.3~0.8) μm×(1.0~2.4) μm, 革兰氏染色反应为阴性(图 1: B)。将分离获得的菌株回接到健康2 a生核桃植株叶片上,均能产生典型的黑斑病病斑。再次分离并挑取单菌落纯化,经组织培养和菌体形态学观察比较,再分离的病原菌与最初用于接种分离的菌株无差异,说明致病菌与接种菌为同一种菌,符合柯赫氏法则。
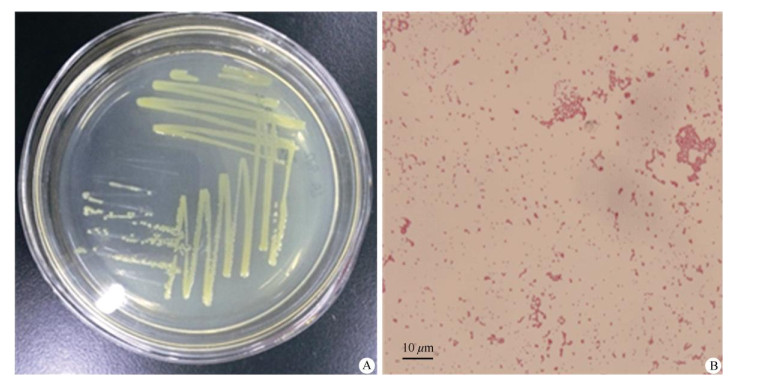
|
图 1 黑斑病病原菌落(A)和菌体(B)形态 Fig. 1 The morphology of colony (A) and thallus (B) of walnut blight pathogen |
从分离的菌株中选取代表病原菌株28-2进行基因组DNA提取,以提取的基因组DNA为模板,使用通用引物27F/1492R扩增得到长度约为1 446 bp的16S rDNA片段(图 2: A)。将获得的16S rDNA序列在GenBank中进行BLAST比对分析,结果表明,其与树生黄单胞杆菌(Xanthomonas arboricola) (登录号:KP340804.1)的相似性高达99%。系统发育树分析结果表明菌株28-2与黄单胞杆菌的亲缘关系最近,位于系统发育树的同一分支(图 2: B)。因此,结合致病性测定的结果、病原菌形态学特征和序列分析,将菌株28-2鉴定为树生黄单胞杆菌,初步确定四川盆地地区核桃细菌性黑斑病的病原菌为树生黄单胞杆菌。

|
图 2 菌株的16S rDNA PCR扩增电泳图和基于16S rDNA基因序列构建的系统发育树 Fig. 2 PCR amplification of 16S rDNA, and phylogenetic tree based on 16S rDNA gene sequences |
接种后,所有测试品种(无性系)的叶片均不同程度感病,接种后2~3 d开始出现小病斑,第7天病斑大量出现,但整体发病程度较轻(图 3: A)。因此,本次田间抗性调查在接种后的第10天进行。供试的18个核桃品种(无性系)中未发现对黑斑病免疫的品种,均不同程度发病,发病率为35.07% (Shujiang1)~78.57% (Yanyuanzao),变异系数为17.62%,其中14个品种(无性系)发病率在50.00%以上(图 3: B)。病情指数为0.18% (Shujiang1)~ 0.24% (Yanyuanzao),变异系数为0.29%,变化趋势与发病率基本一致(图 3: C)。根据抗病性评价标准, 筛选出抗病品种(无性系)共10个(5个HR品种、5个R品种),其中本地优良无性系6个,占抗病品种的60.00%;感病品种(无性系)中,栽培品种占5个(4个S品种,1个HS品种),占感病品种(无性系)的62.50%,说明本地优良无性系总体的抗性要强于栽培品种。
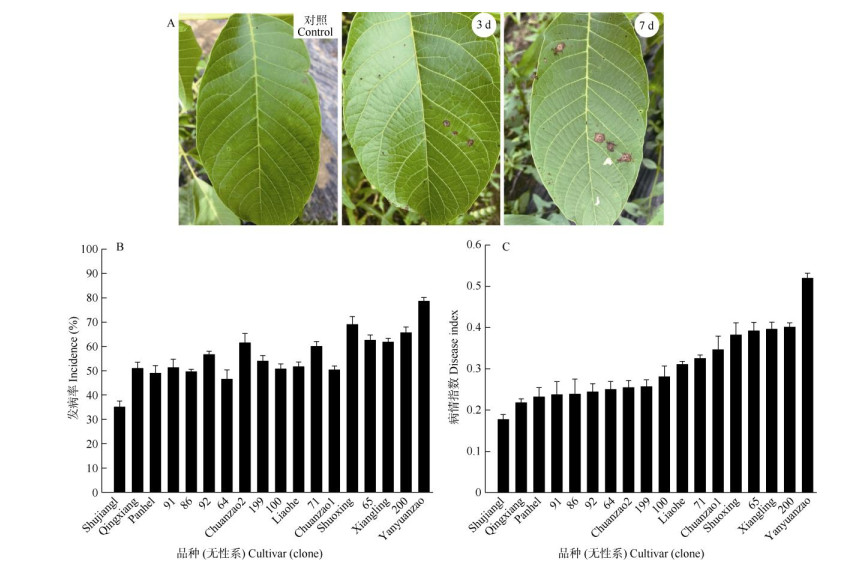
|
图 3 田间植株叶片侵染情况和品种抗病评价 Fig. 3 Leaf infections in field and resistance evaluation of walnut cultivars (clones) |
我国对核桃细菌性黑斑病的相关研究主要集中在病害诊断、预测与防治等方面[6]。为进一步明确我国核桃黑斑病病原菌分类地位,本文对引起四川盆地地区核桃黑斑病的病原菌进行分离和鉴定, 并通过柯赫氏法则验证分离病原菌的致病性,为从形态和分子上进行病原菌鉴定和分类提供了数据。同时采用田间接种评价方法,对四川省18个核桃栽培品种(无性系)进行抗病性评价。
本研究对黑斑病病原菌的形态进行观察,结果表明,此病原菌的菌落、菌体等形态和培养特征与已报道的核桃细菌性黑斑病病原菌黄单胞菌属细菌相似[11, 24-25]。本试验通过病原菌的形态学观察不能将其鉴定到黄单胞菌属中具体的种,因此,需要通过分子生物学手段进行进一步鉴定。而关于核桃黑斑病病原菌的命名存在争议,最早官方公认名称为X. campestris pv. juglandis (Pierce) Vauterin, 后命名为X. arboricola pv. juglandis (Pierce) Vauterin,最近有提议更名为X. juglandis (Pierce) Dowson[10, 26-27]。Adaskaveg等根据dnaK、rpoD和rDNA基因分析, 认为美国加州核桃细菌性黑斑病致病菌与X. Arbo- ricola、X. gardneri和X. vesicatoriajie接近。Daiva等[28]通过fyuA、gyrB和rpoD基因序列分析,认为立陶宛和波兰区核桃黑斑病病原菌为X. arboricola pv. juglandis。陈善义等[11]报道北京郊区核桃黑斑病病原菌的16S rDNA序列与X. campestris和X. arbo- ricola的某些变种相似性为99%, 但具体病原菌的鉴定还需进一步研究。王瀚等[25]采用形态学鉴定和16S rDNA序列分析,将甘肃陇南核桃黑斑病病原菌鉴定为X. campestris。曲文文[29]采用形态鉴定和ITS序列分析,将山东省核桃黑斑病病原菌鉴定为X. arboricola。因此,采用形态学与分子生物学相结合的方法能够对致病病原菌进行准确鉴定。为此, 本研究根据16S rDNA基因序列构建了系统发育树, 对病原菌进行鉴定,结果表明病原菌的16S rDNA基因序列与已登录的X. arboricola (登录号: KP340804.1)亲缘关系最近,相似性高达99%。结合病原菌形态学特征,本研究将四川盆地地区核桃黑斑病病原菌鉴定为变形菌门(Proteobacteria)假单胞菌科(Pseudo- monadaceae)树生黄单胞菌属细菌X. arboricola。四川省2000-2008年栽培核桃主要为北方引进品种, 这可能是四川盆地区与山东省核桃黑斑病为同一致病病原菌的原因之一。同时,与其他地区核桃黑斑病病原菌种存在差异,也表明我国不同生态环境下引起核桃黑斑病病原菌的多样性,对探索核桃细菌性黑斑病的发病规律、准确识别和有效防治技术研究具有重要的理论和指导意义。
四川省近年来实施退耕还林,为促进山区农村经济发展,大范围推广核桃栽培,并从其它核桃主产区调运苗木,但由于四川高湿热的环境条件,引进的北方早实核桃受到黑斑病害困扰造成大面积减产或死亡及品质的下降,已成为影响四川核桃产业发展的主要因素[19]。近年来,随着一大批本地选育优良核桃种质在生产中的使用,对四川核桃产业的健康发展起到一定的促进作用[30]。在调查中发现四川盆地区本地核桃种质材料发病率较低,说明本地优良的核桃种质材料可能对核桃黑斑病有一定的抗性。因此,本研究采用田间接种的方法对四川栽培品种和收集的本地优良无性系进行黑斑病抗性评价,其中Shujiang1、Qingxiang、Panhe1、91和86号被评价为高抗品种,病情指数为17.71%~ 23.88%;Yanyuanzao和200号为高感病品种,病情指数分别为51.96%和40.10%。这些被病原菌感染但表现出较强抗性的表型在育种中被认为可能获得持久和广泛的抗性,这些材料可作为进一步抗病品种选育的优良材料[31]。Jiang等[32]采用田间调查法、室内离体叶片接种法进行核桃黑斑病抗性调查,结果表明,Shujiang1属于易感病品种,与本研究结果不一致,可能原因一是试验材料的差异,本试验材料为1 a生嫁接苗,而Jiang等采用的8 a生结果树,叶片结构的差异可能导致抗病性结果出现偏差;二是病原菌接种方法不同可能导致病原菌侵染能力的差异;三是环境条件不同也可能导致病原菌致病性的不同。在病害最流行时期和植株最易感病时期进行感病情况调查,能够较真实地反映材料的抗性水平。因此,可采用田间调查和田间接种相结合的方法对核桃黑斑病抗病性进行准确评价,为抗病品种(无性系)的初步筛选和后续的抗病相关机制研究提供基础。
| [1] |
LAMICHHANE J R. Xanthomonas arboricola diseases of stone fruit, almond, and walnut trees:Progress toward understanding and management[J]. Plant Dis, 2014, 98(12): 1600-1610. DOI:10.1094/PDIS-08-14-0831-FE |
| [2] |
HIGUERA G, GONZÁLEZ-ESCALONA C, VÉLIZ C, et al. Draft genome sequences of four Xanthomonas arboricola pv. juglandis strains associated with walnut blight in Chile[J]. Genome Announc, 2015, 2(5): e01160-15. DOI:10.1128/genomeA.01160-15 |
| [3] |
SAWADA H, YOKOSAWA S, UEMATSU H, et al. First report of walnut blight caused by WB strains of Xanthomonas arboricola pv. juglandis in Japan[J]. Jpn J Phytopathol, 2017, 83(1): 10-21. DOI:10.3186/jjphytopath.83.10 |
| [4] |
RADIX P, SEIGLE-MURANDI F, CHARLOT G. Walnut blight:development of fruit infection in two orchards[J]. Crop Prot, 1994, 13(8): 629-631. DOI:10.1016/0261-2194(94)90010-8 |
| [5] |
SCORTICHINI M. Epidemiology and predisposing factors of some major bacterial diseases of stone and nut fruit trees species[J]. J Biol Chem, 2010, 285(17): 12935-129347. DOI:10.1074/jbc.M109.071696 |
| [6] |
GONG Y H. Advance in research on walnut blight[J]. N Fruit, 2012(6): 1-4. 宫永红. 核桃细菌性黑斑病研究进展[J]. 北方果树, 2012(6): 1-4. DOI:10.3969/j.issn.1001-5698.2012.06.001 |
| [7] |
RAMOS D E. Walnut Orchard Management[M]. Oakland: Agriculture and Natural Resources, 1985: 153-154.
|
| [8] |
RAMOS D. Walnut Production Manual[M]. Oakland: Agriculture and Natural Resources, 1998: 242-243.
|
| [9] |
SUN J. Sensitivity of Xanthomonas campestris to fungicides[J]. N Hort, 2017(9): 103-106. 孙俊. 核桃黑斑病菌杀菌剂敏感性测定[J]. 北方园艺, 2017(9): 103-106. DOI:10.11937/bfyy.201709022 |
| [10] |
SCHAAD N W, VIDAVER A K, LACY G H, et al. Evaluation of proposed amended names of several pseudomonads and xanthomonads and recommendations[J]. Phytopathology, 2000, 90(3): 208-213. DOI:10.1094/PHYTO.2000.90.3.208 |
| [11] |
CHEN S Y, TAO W Q, WANG H, et al. Identification and pathogennicity assay of the pathogen of walnut blight in Beijing[J]. J Fruit Sci, 2011, 28(3): 469-473. 陈善义, 陶万强, 王合, 等. 北京地区核桃黑斑病病原菌的分离、致病性测定和16S rDNA序列分析[J]. 果树学报, 2011, 28(3): 469-473. |
| [12] |
ADASKAVEG J E, FÖRSTER H, NGUYEN K, et al. Epidemiology and management of walnut blight[R]. Walnut Research Reports, 2008: 1-19.
|
| [13] |
LORETI S, GALLELLI A, BELISARIO A, et al. Investigation of genomic variability of Xanthomonas arboricola pv. juglandis by AFLP analysis[J]. Eur J Plant Pathol, 2001, 107(6): 583-591. DOI:10.1023/A:1017951406237 |
| [14] |
FRUTOS D, LÓPEZ G. Search for Juglans regia genotypes resistant/tolerant to Xanthomonas arboricola pv. juglandis in the framework of cost action 873[J]. J Plant Pathol, 2012, 94(S1): S1.37-S1.46. DOI:10.4454/jpp.v94i1sup.007 |
| [15] |
MALIK M T, AMMAR M, RANAN M, et al. Chemical and cultural management of die back disease of mango in Pakistan[J]. Acta Hort, 2016, 1111: 363-368. DOI:10.17660/ActaHortic.2016.1111.52 |
| [16] |
COSMULESCU S, BOTU M. Walnut biodiversity in south-western romania-resource for perspective cultivars[J]. Pak J Bot, 2012, 44(1): 307-311. |
| [17] |
SOLTANI J, ALIABADI A A. Genetic resistance to bacterial blight disease in Persian walnut[J]. Rur J Plant Pathol, 2010, 128: 65-70. DOI:10.1007/s10658-010-9629-6 |
| [18] |
BOTU M, BOTU I, ACHIM G, et al. Walnut cultivars in Romanian conditions[J]. Acta Hort, 2007, 760: 555-561. DOI:10.17660/ActaHortic.2007.760.79 |
| [19] |
JIANG S J, HAN S, HE D, et al. Evaluating walnut (Juglans spp.) for resistance to walnut blight and comparisons between artificial inoculation assays and field studies[J]. Austr Plant Pathol, 2019, 48(3): 221-231. DOI:10.1007/s13313-019-0621-0 |
| [20] |
FANG Z D. Research Methods of Plant Disease[M]. 3rd ed. Beijing: China Agriculture Press, 1998: 193-194. 方中达. 植病研究方法[M]. 第3版. 北京: 中国农业出版社, 1998: 193-194. |
| [21] |
ZHANG J N. Resistance evaluation and mechanism of different fall dormancy alfalfa (Medicago sativa L.) on Stemphyllium leaf spot disease[D]. Beijing: Beijing Forestry University, 2008. 张静妮.不同秋眠等级苜蓿匍柄霉叶斑病抗性评价及抗病机理研究[D].北京: 北京林业大学, 2008. |
| [22] |
LIU X M, LIU W B, PU J J, et al. Identification of resistance of mango cultivars against Xanthomonas campestris pv. mangiferae-indicae[J]. J Fruit Sci, 2009, 26(3): 349-352. 刘晓妹, 刘文波, 蒲金基, 等. 杧果对细菌性黑斑病抗病性测定[J]. 果树学报, 2009, 26(3): 349-352. |
| [23] |
SHENG B L, LI X G, LAN J, et al. Field investigation on resistance of different pear cultivars to black spot disease[J]. S China Fruit, 2004, 33(6): 76-77. 盛宝龙, 李晓刚, 蔺经, 等. 不同梨品种对黑斑病的田间抗性调查[J]. 中国南方果树, 2004, 33(6): 76-77. DOI:10.3969/j.issn.1007-1431.2004.06.037 |
| [24] |
ZAHGN Y Q, ZHU H Y, FENG Q, et al. Preliminary report on pathogen studies of Xanthomonas campestris and its control trial[J]. J Gansu For Sci Technol, 2004, 29(2): 41-42. 张永强, 朱惠英, 冯强, 等. 核桃黑斑病病原研究与防治试验初报[J]. 甘肃林业科技, 2004, 29(2): 41-42. DOI:10.3969/j.issn.1006-0960.2004.02.013 |
| [25] |
WANG H, ZHUO P Q, WANG R J, et al. Isolation, identification, and pathogenesis analysis of walnut blight in Longnan, Gansu[J]. China Fruits, 2018(4): 69-71. 王瀚, 卓平清, 王让军, 等. 甘肃陇南核桃黑斑病病原菌的分离鉴定及其致病性研究[J]. 中国果树, 2018(4): 69-71. DOI:10.16626/j.cnki.issn1000-8047.2018.04.019 |
| [26] |
DYE D W, BRADBURY J F, GOTO M, et al. International standards for naming pathovars of phytopathogenic bacteria and a list of pathovar names and pathotype strains[J]. Rev Plant Pathol, 1980, 59: 153-168. |
| [27] |
VAUTERIN L, HOSTE B, KERSTERS K, et al. Reclassification of Xanthomonas[J]. Int J Syst Bacteriol, 1995, 45(3): 472-489. DOI:10.1099/00207713-45-3-472 |
| [28] |
BUROKIENE D, PULAWSKA J. Characterization of Xanthomonas arboricola pv. juglandis isolated from walnuts in Lithuania[J]. J Plant Pathol, 2012, 94(S1): S1.23-S1.27. |
| [29] |
QU W W. Identification of pathogens on walnut (Juglans regia) in Shandong Province[D]. Tai'an: Shandong Agricultural University, 2011. 曲文文.山东省核桃(Juglans regia)主要病害病原鉴定[D].泰安: 山东农业大学, 2011. |
| [30] |
YAN S Y, ZHU P, GONG W, et al. Studies on genetic diversity of Juglans cultivar germplasms in Sichuan based on RAD-SNPs analysis[J]. J Trop Subtrop Bot, 2019, 27(1): 19-28. 闫思宇, 朱鹏, 龚伟, 等. 基于RAD-SNPs分析的四川核桃良种资源的遗传多样性研究[J]. 热带亚热带植物学报, 2019, 27(1): 19-28. DOI:10.11926/jtsb.3906 |
| [31] |
FORBES G A. Using host resistance to manage potato late blight with particular reference to developing countries[J]. Potato Res, 2012, 55(3/4): 205-216. |
| [32] |
WANG P, LI J, FU Y H, et al. QTL analysis of field resistance to brown leaf spot in F1 population of non-inbred parents in cassava[J]. J Trop Subtrop Bot, 2007, 15(3): 191-197. 王萍, 李杰, 付瑜华, 等. 利用非近交亲本间杂交F1群体对木薯褐斑病田间抗性的QTL分析[J]. 热带亚热带植物学报, 2007, 15(3): 191-197. DOI:10.3969/j.issn.1005-3395.2007.03.002 |
 2020, Vol. 28
2020, Vol. 28


