2. 园艺作物种质创新及生理生态安徽省重点实验室, 合肥 230000;
3. 安徽农业大学, 合肥 230000;
4. 安徽省农业科学院园艺研究所, 合肥 230000
2. Key Laboratory of Horticultural Crop Germplasm Innovation, Physiology and Ecology, Hefei 230000, China;
3. Anhui Agricultural University, Hefei 230000, China;
4. Institute of Horticulture, Anhui Academy of Agricultural Sciences, Hefei 230000, China
辣椒(Capsicum annuum)是茄科(Solanaceae)辣椒属一年或有限多年生草本植物,原产中南美洲, 明末传入我国[1]。辣椒种植面积仅次于大白菜,是我国第二大蔬菜作物,每年的种植面积超1.30× 106 hm2,经济效益居蔬菜之首[2]。
随着辣椒杂种优势的开发和不断推广,辣椒种质资源遗传背景日渐狭窄,可利用和挖掘的资源相对较少[3]。形态学分析可以快速展示品种特点,也是研究多样性及开展作物育种工作的基础[4‒5],但需要较长的种植周期去观察性状间的差异,既费时费力,影响因素也较多。不过,借助DNA分子标记技术可以有效提高育种效率和水平。SSR (simple sequence repeat)是一种通过电泳分析核心序列的长度多态性的分子标记[6],可以从分子层面评价种质间的亲缘关系,聚类分析较为清晰反映种质间特性差异,较为准确地揭示材料间遗传差异[7]。SSR分子标记具有操作简单、结果可靠等优点,在种质纯度鉴定[8‒9]、遗传多样性研究[10‒11]、全基因组多态性筛选[12]及遗传图谱构建[13‒14]等方面广泛应用。目前,已经利用表型与分子标记技术相结合,对杜鹃花(Rhododendron simsii)[15]、小麦(Triticum aestivum)[16]、豌豆(Pisum sativum)[17]、五节麦芒(Miscanthus flori- dulus)[18]、水稻(Oryza sativa)[19]等植物的遗传多样性进行研究,但用形态学和SSR分子标记同时分析辣椒多样性的研究报道较少[20]。
本研究以57份辣椒种质资源为材料,对34个表型性状进行遗传多样性分析,同时利用SSR分子标记进行多态性引物筛选和遗传多样性分析,基于表型性状和SSR标记分别进行聚类分析,旨在筛选出具有优良性状的种质资源,为亲本选配及资源评价提供参考。
1 材料和方法 1.1 材料试验选用的57份辣椒(Capsicum annuum)种质资源中有15份引自国外,42份来自国内地方品种(表 1)。试验材料于2019年1月播种,4月定植于安徽省农业科学院岗集示范基地,采用随机区组设计,每个小区种植14棵,株行距33 cm×40 cm,常规栽培管理。
| 表 1 57份辣椒种质材料的编号 Table 1 Accession of 57 capsicum resources |
辣椒种质资源表型性状的调查主要以辣椒种质资源描述规范[21]为主要依据。结合田间情况,对辣椒种质资源的株型、主茎色、分枝性、叶形、叶色、叶缘、叶面特征、叶面绒毛、花冠色、花药颜色、花柱颜色、花柱长度、花梗着生状态、果形、青熟果色、老熟果色、果面棱沟、果面特征、果顶形状、果肩形状、萼片形态及辣味22个质量性状进行调查统计;每个小区随机选取8~9株,对株高、冠幅、叶片长、叶片宽、果实纵径、果实横径等12个数量性状进行测量记录,取平均值。
按照李锡香农艺性状描述规范的赋值标准将数据记录在Excel表格中,利用SPSS 22.0计算各性状均值、标准差和变异系数,根据农艺性状相关系数,提取主成分并进行聚类分析。
香农多样性指数(Shannon’s diversity index)的计算公式为:
采用植物基因组DNA提取试剂盒(天根生物技术有限公司)分别提取57份辣椒种质资源的基因组DNA,用1%琼脂糖凝胶电泳和Spectrophotometer核酸检测仪检测提取的DNA质量和浓度,于-20℃冰箱保存备用。PCR扩增程序:94℃预变性5 min;94℃变性30 s,55℃~58℃退火30 s,72℃延伸1 min,32个循环;最后72℃延伸7 min;PCR扩增产物4℃保存。扩增产物用8%聚丙烯酰胺凝胶电泳检测,银染法染色。
根据电泳图谱,在相同迁移位置按条带有无分别赋值,有带的记为“1”,无带的记为“0”,建立1、0矩阵。利用NTsys 2.10e软件,计算遗传相似系数,按照非加权配对算数平均法(UPGMA)进行聚类分析[22]。
1.2.3 相关性分析利用NTsys 2.10e软件将57份辣椒资源表型性状数据进行标准化处理,构建欧式距离矩阵;根据SSR分子标记构建遗传距离矩阵,将两个矩阵进行Mantel test相关性分析[23]。
2 结果和分析 2.1 表型性状的多样性分析 2.1.1 变异系数对57份辣椒种质资源的34个表型性状,包含22个质量性状和12个数量性状进行统计分析。由表 2可知,不同辣椒资源的表型性状存在差异,34个表型性状的变异系数为9.12%~108.26%,平均为40.67%。22个质量性状中,果肩形状的变异系数最高,为108.26%,老熟果色变异系数最低,为9.12%。12个数量性状中,单果质量的变异系数最高,为105.73%,叶片长的变异系数最低,为20.84%。
| 表 2 辣椒种质资源表型性状的变异系数和香农多样性指数 Table 2 Coefficient variation and shannon's diversity index of phenotypic characters of Capsicum annuum germplasms |
香农多样性指数越大表示物种多样性越丰富。34个表型性状的香农多样性指数为0.29~2.32之间, 平均为1.20。22个质量性状中,果形的香农多样性指数最大,为2.32,株型和老熟果色的最小,为0.29。12个数量性状中,香农多样性指数最高的是冠幅, 为1.97,最低的是心室,为1.09。
2.1.2 主成分分析各性状间的相关性对区分辣椒种质材料有影响,可以通过主成分分析来消除不利因素的影响。对57份种质材料进行主成分分析表明,从34个性状中可提取10个主成分,贡献率为3.154%~22.317%,累计贡献率达75.972% (表 3)。第1主成分的贡献率为22.317%,其中果宽、单果质量、果肩形状、果顶形状、果形、肉厚等的绝对值排在前面,说明第1主成分是这些表型性状的综合反应,可总结为果实因子;第2主成分是叶长、叶宽和叶柄长等光合因子的综合反应;第3主成分为叶色组成;第4主成分由花柱颜色决定;第5主成分由叶面茸毛决定;第6主成分主要由冠幅决定;第7主成分主要表现在叶缘形状;第8主成分主要表现在叶面特征;第9主成分为花柱长度;第10主成分为叶形。
| 表 3 辣椒种质表型性状的主成分分析 Table 3 Principal components analysis of phenotypic characters of Capsicum annuum germplasms |
利用SPSS软件对34个表型性状数据进行处理,采用系统聚类中的Word法对57份辣椒资源进行聚类分析(图 1)。在欧式距离为5时将辣椒种质分为4大类,第Ⅰ类包含22份辣椒资源,其中6份种质资源引自国外,还有2份四川品种和3份陕西品种,均为直立株型,整体植株较高,首花节位高, 辣椒熟性较晚,果形大部分是线形辣椒,平均果形指数为4.95,平均单果达17.51 g,辣味适中;第Ⅱ类包含10份辣椒资源,其中3份种质资源引自国外,大部分为直立株型,熟性较早,果形属于短牛角形中等果辣椒,平均果形指数为4.45,平均单果达45.67 g;第Ⅲ类包含14份辣椒资源,只有1份资源引自美国,整体植株较低,株型开展度较大, 多数为短指形辣椒为主,平均果形指数为4.16,平均单果达13.67 g;第Ⅳ类包含11份辣椒资源, 其中4份引自美国,1份引自英国,均为直立株型且主茎色均为绿色,属于灯笼形和锥形等大果形辣椒种质资源,平均果形指数为1.13,平均单果达125.27 g。可见,来源地相同的材料并不全部聚为一类,如14、41和56号材料均来自甘肃,但41和56号聚为一类,14号为单独一支,可见聚类结果与品种来源关系较小,但聚类结果与单果质量和果形影响较大,果形相似的聚为同一类。
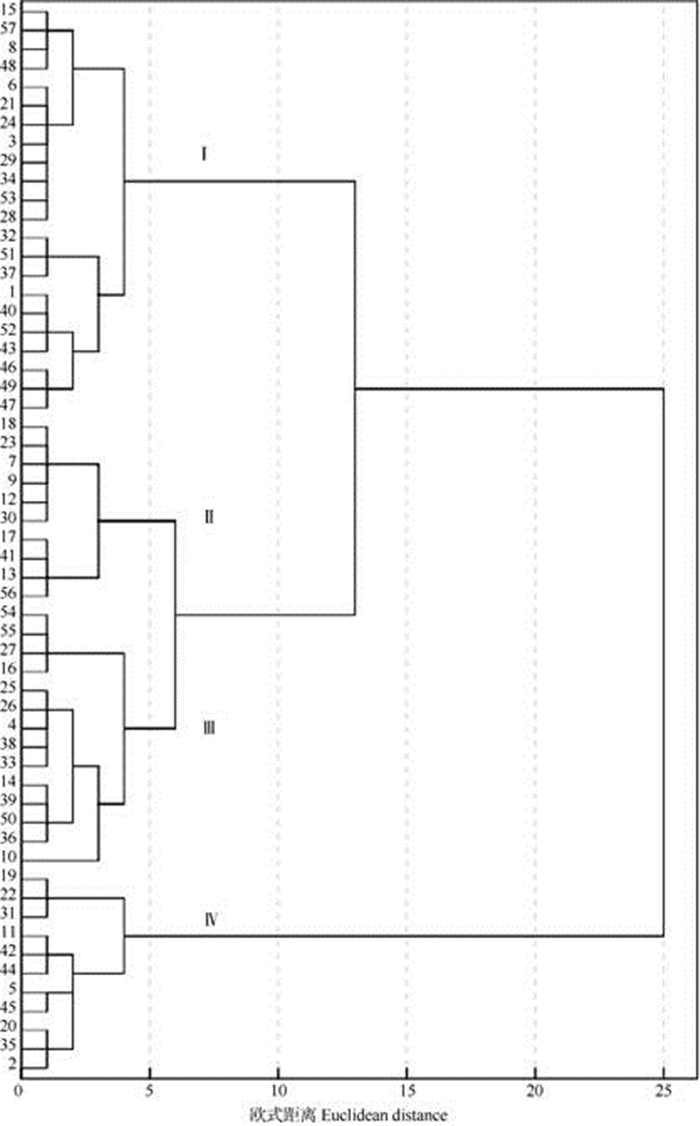
|
图 1 基于表型性状的辣椒种质资源聚类图。1~57见表 1。 Fig. 1 Clustering map of Capsicum annuum germplasms based on phenotypic characters. 1-57 see Table 1. |
采用19对SSR引物[24‒26]对57份辣椒种质材料进行遗传多样性分析(表 4),图 2为引物epms712对57份辣椒种质材料的扩增图谱。19对引物检测到的Nei’s基因多样性指数为0.21~0.67,平均为0.48,其中HpmsE014引物的Nei’s基因多样性指数最大,epms712引物的最小。19对引物的香农指数为0.40~1.10,平均为0.80,HpmsE149引物的香农指数最大,HpmsE014引物的最小。
| 表 4 SSR引物信息 Table 4 Information of SSR primers |

|
图 2 epms712引物对57份辣椒种质的扩增图谱。M: Marker; 1~57见表 1。 Fig. 2 Amplification map of 57 Capsicum annuum germplasms by epms712 primer. M: Marker; 1-57 see Table 1. |
应用NTsys2.10e软件对57份辣椒材料的SSR标记进行聚类分析,采用UPGMA法生成聚类树状图(图 3),在遗传相似系数为0.76处,将57份辣椒材料分成4类,其中材料28、33各为1类,材料45、42、43、27、和26等32份材料聚为1类,材料1、16、54、37、52等23份材料聚为一类。此外,57份辣椒种质材料中,材料40和14,以及材料52和37分别聚在一起,遗传相似系数达0.963,且田间性状调查两者相似性也较高,但这4份材料来源地各不相同,可能是由于品种间不断交流所导致的原因。
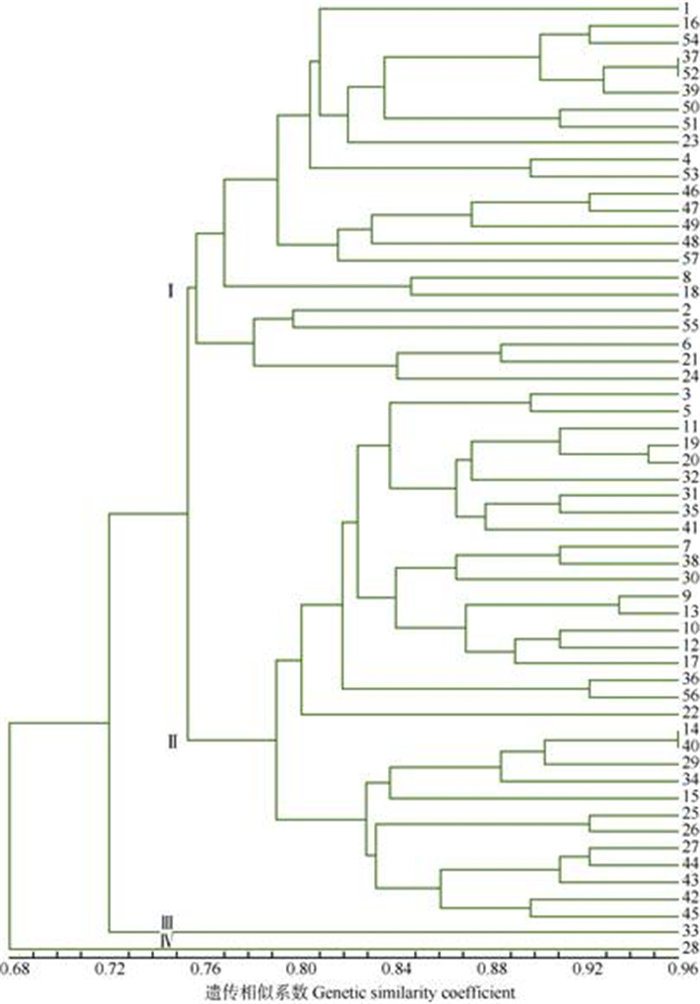
|
图 3 基于SSR标记的57份辣椒种质资源聚类图。1~57见表 1。 Fig. 3 Cluster dendrogram of 57 Capsicum annuum germplasms based on SSR markers. 1-57 see Table 1. |
为了解辣椒种质资源表型性状遗传多样性与分子标记遗传多样性之间的联系,将57份辣椒资源的表型性状欧式距离矩阵与SSR分子标记遗传距离矩阵进行Mantel test相关性分析。结果表明, 两种方法的聚类结果间不存在相关性(r=–0.175 9), 表型性状与SSR分子标记两种方法的聚类结果吻合性不高。
3 结论和讨论本研究通过表型性状和SSR分子标记分析57份辣椒种质材料遗传多样性,结果表明,34个表型性状的变异系数和香农多样性指数波动较大,说明种质材料间存在差异,但表型性状的平均变异系数和香农多样性指数以及19对SSR引物的平均Nei’s基因多样性指数和香农指数较低,说明了辣椒种质间遗传背景狭窄。主成分分析从34个表型性状中提取了10个主成分,累计贡献率为75.972%,主成分分析可以突出重要性状,排除重叠和消除意义不大的性状。依据表型性状和SSR分子标记均可将57份辣椒种质材料划分为4类,其中部分材料无论在表型层面还是分子层面均划为一类,如编号10、25、26和27等材料,但Mantel相关性分析表明2种聚类结果间相关性并不显著,这与沈梓力等[15]、傅鸿妃等[20]的研究结果一致。这为辣椒杂种优势利用时选择遗传关系较远亲本配对以及对种质资源评价提供参考的同时,也提示我们表型数据和分子数据提供的信息有所不同,育种实践中需要兼顾才能提高育种效率。
种质资源是作物遗传育种的基础,植物种质资源优良性状的发现与利用,会进一步推动育种工作开展。我国辣椒种质资源丰富,但遗传基础狭窄。本研究利用表型性状和SSR分子标记2种方法分析57份辣椒种质资源遗传多样性,但2种方法的结果吻合性不高。推测可能的原因是:首先,本研究用于分析的34个表型性状只是辣椒表型性状的一部分,可能会导致表型和分子聚类结果不一致[27];其次,表型性状易受人为和环境因素的影响,导致数据有误差,进而使聚类的结果产生误差,这与徐豪等[28]的研究结果一致;第三,表型性状是由多个基因决定,分子标记检测的基因位点可能只是其中的一部分,并不能代表某一性状的全部信息。本研究筛选出的19对SSR引物(表 2)数量较少,导致可检测的基因位点数量受到限制且不能覆盖到整个基因组,因此不能全部反映DNA遗传信息。同时, 分子标记检测到的基因位点并不一定能够在性状中有所表现。可见,表型性状和分子标记两者不能完全对应,导致不存在必然联系。詹永发等[29]指出农艺性状数据是植物分类不可缺少的重要依据之一, 是遗传多样性分析的基础,分子标记广泛应用到种质资源的分类研究中[30-31]是植物分类和种质创新的技术依据。所以,为进一步提高今后育种工作中亲本选配及辣椒种质评价的准确性,综合应用表型和分子标记两方面研究,在表型性状上严格按照表型性状描述规范,增加表型性状数量,在分子层面增加引物数量以获得更多的基因位点,进而更加全面、准确地区分种质资源及描述遗传多样性。
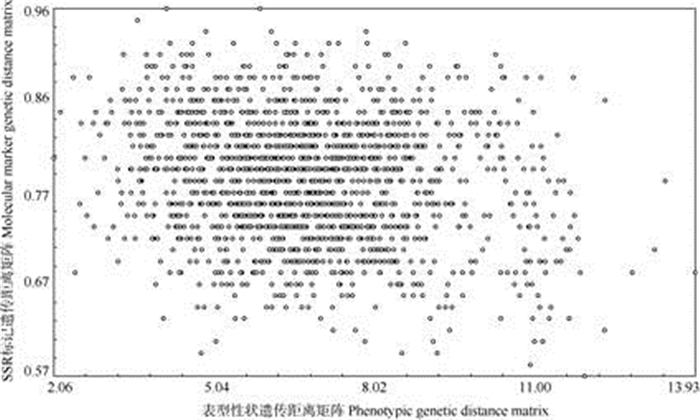
|
图 4 基于表型性状和SSR分子标记的聚类结果相关性 Fig. 4 Correlation of cluster results based on phenotypic traits and SSR markers |
| [1] |
GAO J X, WU X M, YANG A R, et al. Low temperature resistance evaluation of pepper germplasm at germination stage[J]. N Hort, 2018(9): 19-24. 高晶霞, 吴雪梅, 杨爱荣, 等. 辣椒不同种质资源种子萌发期耐低温性评价[J]. 北方园艺, 2018(9): 19-24. DOI:10.11937/bfyy.20174034 |
| [2] |
SHAO Y J, WU W W, SHEN X X, et al. Genetic study on genic male sterility of pepper and its application in hybrid breeding[J]. J Trop Subtrop Bot, 2013, 21(1): 93-99. 邵元健, 吴雯雯, 沈素香, 等. 辣椒雄性核不育基因的遗传研究及其在杂交育种中的应用[J]. 热带亚热带植物学报, 2013, 21(1): 93-99. DOI:10.3969/j.issn.1005-3395.2013.01.014 |
| [3] |
ZHANG B X, WANG L H, MAO S L, et al. Research progress on pepper genetic breeding during China's 'Eleventh Five-year Plan'[J]. China Veget, 2010(24): 1-9. 张宝玺, 王立浩, 毛胜利, 等. "十一五"我国辣椒遗传育种研究进展[J]. 中国蔬菜, 2010(24): 1-9. |
| [4] |
CHU P P, XIANG C P, ZHANG C X, et al. Genetic diversity of Cucurbita moschata genotypes revealed by RAPD markers and agro-nomic traits[J]. J Nucl Agric Sci, 2007, 21(5): 441-446. 褚盼盼, 向长萍, 张称心, 等. 中国南瓜种质资源农艺性状与RAPD标记分析[J]. 核农学报, 2007, 21(5): 441-446. DOI:10.3969/j.issn.1000-8551.2007.05.004 |
| [5] |
SHI J L, CHEN X Z, HUANG Z A, et al. Genetic diversity evaluation on main agronomic traits in south China ecotypic cucumber[J]. J Nucl Agric Sci, 2016, 30(10): 1914-1924. 史建磊, 陈先知, 黄宗安, 等. 华南型黄瓜主要农艺性状遗传多样性评价[J]. 核农学报, 2016, 30(10): 1914-1924. DOI:10.11869/j.issn.100-8551.2016.10.1914 |
| [6] |
WEBER J L, MAY P E. Abundant class of human DNA polymer-phisms which can be typed using the polymerase chain reaction[J]. Amer J Human Genet, 1989, 44(3): 388-396. |
| [7] |
YUAN W, ZHAO Y L, WANG L J. Development and application of SSR markers in peanut germplasm identification[J]. Mol Plant Breed, 2016, 14(12): 3462-3468. 苑旺, 赵永亮, 王丽洁. SSR分子标记在花生种质资源鉴定方面的应用研究[J]. 分子植物育种, 2016, 14(12): 3462-3468. DOI:10.13271/j.mpb.014.003462 |
| [8] |
YANG S J, YU W T, YUAN Y X, et al. Screening of SSR markers for purity identification of pepper variety 'Yujiao No. 101'[J]. Mol Plant Breed, 2019, 17(22): 7433-7437. 杨双娟, 于文涛, 原玉香, 等. 辣椒品种'豫椒101'纯度鉴定的SSR标记筛选[J]. 分子植物育种, 2019, 17(22): 7433-7437. DOI:10.13271/j.mpb.017.007433 |
| [9] |
LIU Z J, YANG Y, SUN J H, et al. Purity identification of Rela No. 2 pepper and genetic diversity analysis of excellent pepper inbred lines[J]. Chin J Trop Crops, 2014, 35(5): 847-853. 刘子记, 杨衍, 孙继华, 等. 热辣2号辣椒纯度鉴定及优良自交系遗传多样性分析[J]. 热带作物学报, 2014, 35(5): 847-853. DOI:10.3969/j.issn.1000-2561.2014.05.005 |
| [10] |
JIA H, WEI X C, YAO Q J, et al. Genetic diversity analysis of Capsicum genus germplasm resources using SSR markers[J]. Mol Plant Breed, 2017, 15(1): 353-363. 贾豪, 魏小春, 姚秋菊, 等. 辣椒SSR标记种质资源遗传多样性的分析[J]. 分子植物育种, 2017, 15(1): 353-363. DOI:10.13271/j.mpb.015.000353 |
| [11] |
GUAN J J, YU Z H, YANG X H, et al. Study on the application of SSR markers in pepper (Capsicum annuum L.) DUS testing[J]. J Plant Genet Resour, 2019, 20(2): 396-405. 管俊娇, 余志慧, 杨晓洪, 等. SSR标记在辣椒DUS测试中的应用研究[J]. 植物遗传资源学报, 2019, 20(2): 396-405. DOI:10.13430/j.cnki.jpgr.20180808001 |
| [12] |
LI Y, ZHAO H X, WANG Y, et al. Screening and application of SSR markers' polymorphism of capsicum whole genome[J]. Chin Agric Sci Bull, 2018, 34(17): 56-61. 李艳, 赵红星, 王勇, 等. 辣椒全基因组SSR标记多态性的筛选及应用[J]. 中国农学通报, 2018, 34(17): 56-61. DOI:10.11924/j.issn.1000-6850.casb17090062 |
| [13] |
CHEN Z H, SHAN R Y, YOU X M, et al. Constructing fingerprints and analyzing genetic diversity of 43 tea cultivars in Fujian Province[J]. J Trop Subtrop Bot, 2017, 25(6): 579-586. 陈志辉, 单睿阳, 游小妹, 等. 43个福建省茶树品种指纹图谱构建及遗传多样性分析[J]. 热带亚热带植物学报, 2017, 25(6): 579-586. DOI:10.11926/jtsb.3743 |
| [14] |
LIANG Y S, YAN C, QIN X J, et al. Construction of three half-sib SSR linkage maps derived from overwintering cultivated rice and segre-gation distortion loci mapping[J]. Genome, 2020, 63(4): 239-251. DOI:10.1139/gen-2019-0160 |
| [15] |
SHEN Z L, LI M Q, QIU T, et al. Analysis of main phenotypic traits and SSR marker diversity of F1 generation of rhododendron[J]. Jiangsu Agric Sci, 2019, 47(18): 177-181. 沈梓力, 李美芹, 邱甜, 等. 杜鹃花F1代群体主要表型性状及SSR标记的多样性分析[J]. 江苏农业科学, 2019, 47(18): 177-181. |
| [16] |
ZHANG Y J, GOU Z W, WANG X R, et al. An analysis of genetic diversity and linked agronomic traits of Heshangtou wheat in northwest China[J]. Acta Pratac Sin, 2019, 28(2): 142-155. 张彦军, 苟作旺, 王兴荣, 等. 西北地区和尚头小麦遗传多样性及农艺性状的关联分析[J]. 草业学报, 2019, 28(2): 142-155. DOI:10.11686/cyxb2018124 |
| [17] |
GU J, LI L, ZONG X X, et al. Association analysis between morpho-logical traits of pea and its polymorphic SSR markers[J]. J Plant Genet Resour, 2011, 12(6): 833-839. 顾竟, 李玲, 宗绪晓, 等. 豌豆种质表型性状SSR标记关联分析[J]. 植物遗传资源学报, 2011, 12(6): 833-839. DOI:10.13430/j.cnki.jpgr.2011.06.025 |
| [18] |
XUE D, XIAO L, AI X, et al. Genetic diversity of Miscanthus flori-dulus revealed by morphological characters and SSR markers[J]. Acta Pratac Sin, 2012, 21(5): 96-106. 薛德, 肖亮, 艾辛, 等. 五节芒表型性状和SSR标记遗传多样性分析[J]. 草业学报, 2012, 21(5): 96-106. |
| [19] |
XU F R, DONG C, YANG W Y, et al. Genetic similarity based on SSR markers and phenotypies traits of major improved rice (Oryza sativa L.) varieties in Yunnan province[J]. J Plant Genet Resour, 2011, 12(5): 700-708. 徐福荣, 董超, 杨文毅, 等. 基于表型性状和SSR分子标记的云南省水稻主要育成品种(系)的遗传相似性分析[J]. 植物遗传资源学报, 2011, 12(5): 700-708. DOI:10.13430/j.cnki.jpgr.2011.05.012 |
| [20] |
FU H F, LYU X H, CEHN J Y, et al. Genetic diversity analysis of capsicum germplasm based on phenotypic traits with SSR markers[J]. J Nucl Agric Sci, 2018, 32(7): 1309-1319. 傅鸿妃, 吕晓菡, 陈建瑛, 等. 辣椒种质表型性状与SSR分子标记的遗传多样性分析[J]. 核农学报, 2018, 32(7): 1309-1319. DOI:10.11869/j.issn.100-8551.2018.07.1309 |
| [21] |
LI X X, ZAHNG B X. Descriptors and Data Standard for Capsicum[M]. Beijing: China Agricultural Press, 2006: 1-98. 李锡香, 张宝玺. 辣椒种质资源描述规范和数据标准[M]. 北京: 中国农业出版社, 2006: 1-98. |
| [22] |
SUN M. Genetic diversity in three colonizing orchids with contrasting mating systems[J]. Amer J Bot, 1997, 84(2): 224-232. DOI:10.2307/2446084 |
| [23] |
ZHANG J B, YAN J J, BAI S Q, et al. Genetic diversity of native Erianthus arundinaceus germplasm detected by SRAP markers[J]. J Agric Biotechnol, 2013, 21(10): 1193-1202. 张建波, 鄢家俊, 白史且, 等. 斑茅野生种质资源SRAP遗传多样性研究[J]. 农业生物技术学报, 2013, 21(10): 1193-1202. DOI:10.3969/j.issn.1674-7968.2013.10.008 |
| [24] |
LEE J M, NAHM S H, KIM Y M, et al. Characterization and molecular genetic mapping of microsatellite loci in pepper[J]. Theor Appl Genet, 2004, 108(4): 619-627. DOI:10.1007/s00122-003-1467-x |
| [25] |
INAMIYAMA Y, TSURO M, HIRAI M. An SSR-based linkage map of Capsicum annuum[J]. Mol Breed, 2006, 18(2): 157-169. DOI:10.1007/s11032-006-9024-3 |
| [26] |
PORTIS E, NAGY I, SASVÁRI Z, et al. The design of Capsicum spp. SSR assays via analysis of in silico DNA sequence, and their potential utility for genetic mapping[J]. Plant Sci, 2006, 172(3): 640-648. DOI:10.1016/j.plantsci.2006.11.016 |
| [27] |
ZHENG D J, YUN T H, ZHANG Z L, et al. Study on genetic diversity and relationship for the Hainan island landraces of Cucurbita moschata[J]. J Nucl Agric Sci, 2016, 30(5): 869-877. 郑道君, 云天海, 张治礼, 等. 中国南瓜海南农家品种资源遗传多样性和亲缘关系研究[J]. 核农学报, 2016, 30(5): 869-877. DOI:10.11869/j.issn.100-8551.2016.05.0869 |
| [28] |
XU H, LIU M G, DONG S J, et al. Diversity and geographical varia-tions of germplasm resources of Armeniaca mandshurica[J]. Chin J Plant Ecol, 2019, 43(7): 585-600. 徐豪, 刘明国, 董胜君, 等. 东北杏种质资源多样性及其地理变化[J]. 植物生态学报, 2019, 43(7): 585-600. DOI:10.17521/cjpe.2019.0060 |
| [29] |
ZHAN Y F, YANG H, TU X M, et al. Genetic diversity of hot pepper germplasm resources and its cluster analysis[J]. Guizhou Agric Sci, 2010, 38(11): 12-15. 詹永发, 杨红, 涂祥敏, 等. 辣椒品种资源的遗传多样性和聚类分析[J]. 贵州农业科学, 2010, 38(11): 12-15. DOI:10.3969/j.issn.1001-3601.2010.11.004 |
| [30] |
HE W, ZHANG H, WANG Y. Analysis of morphology and SRAP of pepper germplasm resources[J]. Heilongjiang Agric Sci, 2019(5): 7-12. 赫卫, 张慧, 王莹. 辣椒种质资源的形态学和SRAP分析[J]. 黑龙江农业科学, 2019(5): 7-12. DOI:10.11942/j.issn1002-2767.2019.05.007 |
| [31] |
LI N, YANG T, PATIGULI, et al. Genetic diversity analysis of Xinjiang Dried-Orientation type pepper by SRAP and SCoT[J]. Mol Plant Breed, 2017, 15(8): 3331-3340. 李宁, 杨涛, 帕提古丽, 等. 适于新疆制干类型辣椒种质资源遗传多样性的SRAP和SCoT分析[J]. 分子植物育种, 2017, 15(8): 3331-3340. DOI:10.13271/j.mpb.015.003331 |
 2020, Vol. 28
2020, Vol. 28


