2. 武夷学院生态与资源工程学院, 福建 南平 354300;
3. 福建省高校森林生态系统过程与经营重点实验室, 福州 350002
2. College of Ecology and Resource Engineering, Wuyi University, Nanping 354300, Fujian, China;
3. Fujian Provincial Key Laboratory of Forest Ecosystem Processing and Management, Fuzhou 350002, China
植物内生菌是指生活在健康植物体内一段或全部时间,对宿主植物不造成明显危害或者产生有益影响的真菌或细菌。在共生过程中,内生菌可以通过自身的次生代谢产物促进植物的生长发育等。研究表明,一些内生菌通过产生铁载体、溶磷作用、分泌生长素等作用促进植物的生长和产量增加。Rashid等[1]分离的一些植物内生细菌不仅具有ACC脱氨酶活性,还具有分泌IAA和铁载体、溶磷、耐盐、抑菌等作用,能够促进油菜(Brassica campestris)根系的生长。种子萌发和萌发期的生长状况直接影响到植物幼苗的生长,而内生菌的加入对种子的发芽特性和幼苗的生理生化会产生一定的影响。赵晓静等[2]用内生真菌感染野大麦(Hordeum brevisubu- latum)种子后,促进了种子的萌发,提高了幼苗的耐盐能力。目前关于内生菌促进植物生长作用的研究多集中于单一菌株,然而植物体内部是一个复杂的微生态系统,存在着互惠共利的、中性的或相互有害的多种共生微生物。如果将单一菌株分离出来进行培养,可能会由于缺乏与其他微生物的相互作用使其某些功能发生变化。一些研究表明菌株共接种对植物的有益作用具有协同效应,与单独接种相比,某些内生菌根真菌与根瘤细菌联合接种对提高豆科(Leguminosae)植物对磷的利用水平、促进根瘤形成和固氮功能的效果更加明显,具有更显著的促进植物生长的作用[3-5]。Meena等[6]的研究表明,相对于单独接种,内生真菌Piriformospora indica与溶磷细菌Pseudomonas striata联合接种对鹰嘴豆(Cicer arietinum)的种群建成和植物干质量具有协同效应。
雷公藤(Tripterygium wilfordii)又名黄藤、黄藤木、断肠草等,主要分布在长江中下游地区,是中国珍贵的传统药用植物。雷公藤含有多种生物活性物质,具有抗菌、抗炎、抗生育、抗肿瘤等多种药理作用[7],其中雷公藤甲素、雷公藤红素被公认为是最重要的2种药用成分,是目前国内外雷公藤药用成份研究的热点。但是,雷公藤甲素和雷公藤红素等药用成分在植株中的含量很低,加上野生雷公藤植物资源稀少,人工种植生长周期长,现有雷公藤资源已经无法满足其在医药和农业上的需求。内生菌对植物生长发育和次生代谢产物的积累具有重要作用[8],然而,内生菌如何影响雷公藤甲素、雷公藤红素积累的相关研究却鲜有报道。
本研究将从健康雷公藤中分离的2株内生真菌和2株内生细菌进行单独和两两混合培养,研究其促生特性,通过单独或联合接种,分析其对雷公藤生长以及雷公藤甲素、雷公藤红素合成的影响,探讨雷公藤内生细菌与内生真菌联合接种对植物生长和次生代谢产物积累的促进作用,为内生菌在医药和农业上的应用提供科学依据。
1 材料和方法 1.1 材料供试菌株分别为2株内生真菌Fusarium oxy- sporum NS33、Penicillium steckii NS6和2株内生细菌Enterobacter cloacae LG3、Serratia marcescens LY1, 均分离自健康雷公藤(Tripterygium wilfordii)植株,保存于实验室,在前期研究中均显示出一定的植物益生特征[7]。内生真菌与内生细菌进行两两组合形成4组菌株组合进行后续联合接种试验,即NS33-LG3、NS33-LY1、NS6-LG3和NS6-LY1。雷公藤组培苗为本实验室保存,种源地为福建泰宁。
1.2 方法促生指标的测定 将供试菌株NS33、NS6、LG3和LY1在PDA和LB固体培养基上活化培养后,分别单独及混合接种于有氮液体培养基中生长48 h,取培养液置于冷冻离心机中以8 000×g离心10 min,取上清液1 mL于试管中,加入2 mL Sac- kowski显色剂,将反应液在黑暗环境中放置45 min, 于530 nm处测光密度值。以空白培养基作对照, 绘制IAA标准曲线,计算IAA产出量[9]。参考Schwyn等[10]的方法,采用CAS比色法测定菌株合成铁载体的能力。将A/Ar比值作为定量指标,比值越小,说明产铁载体能力越高。参考标准为:A/Ar 0~0.2记为+++++;0.2~0.4记为++++;0.4~0.6记为+++;0.6~0.8记为++;0.8~1.0记为+。将活化的供试菌株分别单独、混合接种于无机磷液体培养基中培养, 离心,取上清液, 采用钼锑抗比色法测定菌株的溶磷能力。
种子萌发试验 由于雷公藤种子采集困难, 发芽率低,因此选取小麦(Triticum aestivum)种子进行种子萌发试验。将活化后的供试菌株分别单独或混合接种于PDB+LB (体积比1:1)液体培养基中, 28℃振荡培养4~5 d,过滤、离心,取上清液, 过滤除菌,制得无菌发酵液。取无菌发酵液5 mL加入铺有滤纸的培养皿中,用等量的无菌水作为对照。参照卫东等[11]的方法,随机挑选表面健康,颗粒饱满且成熟度较好的小麦种子,用5%的高锰酸钾溶液消毒10 min,用自来水冲洗数次,再用无菌水冲洗3次,置于用不同培养液原液处理过的铺有两层滤纸的培养皿中,每个培养皿均匀地放30粒种子,28℃黑暗培养。每个处理重复3次。萌发过程中,每隔1 d加1次等量的无菌水,观察记录种子的出芽情况,1周后,测量种子胚芽和胚根长度,统计最终发芽数,计算发芽率、发芽势和活力指数。发芽率=发芽种子数/供试种子数×100%, 发芽势=第2天发芽种子数/供试种子数×100%,活力指数= (平均胚芽长+平均胚根长)×发芽率,根系活力采用氯化三苯基四氮唑(TTC)法测定,以TTC还原强度表示根系活力[12]。
雷公藤组培苗接种处理 将活化后的内生细菌菌株接种于液体LB培养基,30℃摇床培养24 h, 离心、收集菌体,无菌水洗涤后稀释至107 CFU/mL, 备用。内生真菌在PDA固体培养基上活化5 d后, 转接到新的PDA固体培养基上继续培养7 d,然后刮取菌丝于无菌水中振荡均匀,经2层纱布过滤后配成菌悬液用于接种。以体积比1:1配制内生细菌与内生真菌的混合菌悬液用于联合接种。选取长势一致的雷公藤3代无菌组培苗,采用蘸根法进行单独及联合接种处理,然后移入1/2MS培养基,每个组培瓶分装30 mL培养基,每处理重复10次,以不接菌的幼苗作为空白对照。在光照强度40 μmol/(m2·s)、光照时间12 h/d、温度(25±2)℃下培养30 d。通过复筛接种菌株验证菌苗共生关系的建立,即取接种处理的组培苗,表面消毒后碾碎分别涂布于LB和PDA培养基,纯化长出的菌株,与相应的接种菌株进行比较,若相同则表明已建立共生关系。测定雷公藤组培苗的株高、叶片数、鲜质量、干质量和叶片叶绿素、雷公藤甲素及雷公藤红素含量。其中,叶绿素含量的测定采用乙醇-丙酮混合提取法,应用分光光度计测定吸光值。
雷公藤甲素和雷公藤红素含量的测定 将雷公藤组培苗60℃烘干至恒重,粉碎,取0.3 g粉末,甲醇溶解定容至3 mL,自然浸提24 h后,用0.22 μm微孔滤头过滤,得到待测液。采用超高效液相(U3000)法测定雷公藤甲素和雷公藤红素含量,色谱柱为C18 (4.6 mm×250 mm, 5 μm)。雷公藤甲素、雷公藤红素标样购自福建省医学科学研究所, 均为色谱纯。测定雷公藤甲素所用流动相为体积比60:40的甲醇-水,检测波长为218 nm;测定雷公藤红素的流动相为体积比87:13的甲醇-1%醋酸水,检测波长为425 nm。进样量均为20 μL,柱温25℃,流速1 mL/min,每个处理重复3次。
1.3 数据处理采用Microsoft Excel 2010软件对数据进行处理和绘图,采用SPSS 19.0统计分析软件进行差异显著性分析(LSD法),以P < 0.05为有显著性差异。
2 结果和分析 2.1 内生菌株及其组合的促生潜势由表 1可以看出,8个处理的菌株都可以合成铁载体,但是合成能力并不相同,其中产量较高的是内生真菌NS6、NS33和菌株组合NS33-LG3、NS33- LY1。与内生细菌LG3、LY1相比,内生真菌NS33、NS6合成铁载体的能力更高。与内生真菌NS6相比,菌株组合NS6-LG3、NS6-LY1合成铁载体的数量有所降低;与内生真菌NS33相比, 菌株组合NS33- LG3、NS33-LY1合成铁载体的数量则差异不显著。从溶磷能力来看,菌株LY1最高,其次是菌株NS33、NS33-LY1、NS6-LY1;而菌株NS6、LG3和组合NS6- LG3、NS33-LG3的溶磷水平比较低。混合培养的菌株与单独培养的菌株相比,其溶磷水平介于相应的两株单菌之间, 如菌株组合NS33-LY的溶磷水平高于菌株NS33而低于菌株LY1。分泌IAA能力最大的是菌株组合NS33-LG3, 其次是内生真菌NS33、NS6和菌株组合NS33-LY1。与内生细菌LG3和LY1相比, 内生真菌NS33、NS6分泌IAA的能力更高。与相应的单一菌株相比,菌株组合NS33- LG3的IAA合成能力有明显的提高, 菌株组合NS6- LG3有明显的降低,而菌株组合NS33-LY1和NS6- LY的IAA合成能力则介于两个相应的单菌株之间。
2.2 对种子萌发和幼苗生长的影响从表 2可见,除内生真菌NS6和菌株组合NS6- LY1处理的小麦种子发芽势略高于对照外, 其余处理的发芽势相近,均接近于对照。可见,在种子发芽前期内生菌发酵液的加入对种子萌发的影响并不大。除菌株LY1处理外,其他处理的发芽率都高于对照,其中,促进作用最大的是内生真菌NS33和菌株组合NS33-LG3 (P < 0.05),分别比对照提高了12.3%和13.4%。与相应的单一菌株相比, 混合培养的菌株发酵液对发芽率并无明显的提高或降低作用,菌株组合NS33-LG3处理的发芽率与菌株NS33和菌株LG3处理的接近。
内生菌单独或混合培养的发酵液对小麦胚芽伸长具有显著的影响(表 2),其中,促生长效果最明显的是内生真菌NS33,胚轴长度、胚根长度、活力指数分别比对照提高了71.86%、34.99%和76.76%;其次是内生真菌NS6和菌株组合NS6-LG3。与内生细菌LG3、LY1相比,内生真菌NS33、NS6对胚芽伸长具有更显著的促进作用。与单独培养相比,混合培养菌的发酵液对胚芽伸长的促进作用接近或介于相应的两株单菌之间。
| 表 1 内生真菌和内生细菌及其组合的促生指标 Table 1 Growth-promoting indices of endophytic bacteria and endophytic fungi and their combinations |
| 表 2 内生真菌和内生细菌及其组合的促生指标 Table 2 Effect of fermentation liquor of endophytic strains on seed germination and embryo elongation of wheat |
内生菌单独或混合培养发酵液对小麦根系活力的影响各不相同。由图 1可以看出,对根系活力影响最大的是内生真菌NS6,根系活力是对照的3.57倍,其次是菌株组合NS33-LG3、NS33-LY1, 根系活力是对照的2.5倍。与内生细菌LG3、LY1相比,内生真菌NS33、NS6对根系活力的提高作用更明显。与单独培养相比,混合培养NS33-LG3的发酵液对根系活力的促进作用有所提高;而其余菌株混合培养发酵液的促进作用则介于相应的两株单菌之间。
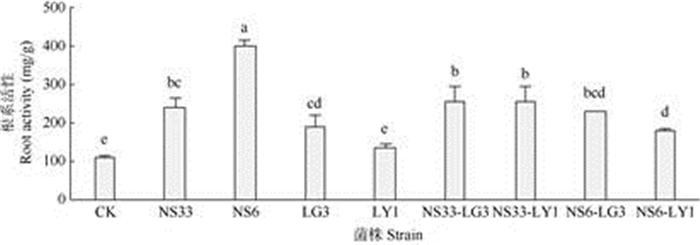
|
图 1 内生菌发酵液对小麦幼苗根系活力的影响。柱上不同字母表示差异显著(P < 0.05)。下同。 Fig. 1 Effect of fermentation liquor of endophytic strains on root activity of wheat seedlings. Different letters upon column indicate significant difference at 0.05 level. The same is following Figures. |
内生真菌和内生细菌或两者组合接种对宿主雷公藤组培苗的生长具有明显的影响(表 3)。与对照相比,大部分菌株处理显著提高了组培苗的高度(P < 0.05),其中内生细菌LG3的促进作用最明显, 其次是内生真菌NS33,分别比对照提高了32.4%和26.2%。与单一菌株NS6和LY1相比,菌株组合NS6-LY1进一步提高了组培苗高度;而联合接种NS33-LG3、NS33-LY1对组培苗高度的促进效应比相应的单一菌株接种则有所下降。与对照相比,单独或联合接种都提高了组培苗的叶片数,其中内生真菌NS33的促进作用最显著,是对照的2.125倍,其次是NS6的处理,是对照的1.7倍,内生真菌比内生细菌具有更大的促进作用。而菌株联合接种的促进作用介于相应的单一菌株之间。与对照相比, 接种内生菌不同程度地促进了雷公藤组培苗质量的增加,其中促进效果最好的是菌株组合NS6- LY1,联合接种的组培苗平均鲜质量和干质量分别是对照的2.05和1.68倍。除菌株组合NS6-LY1外,其他联合接种菌株组合的组培苗质量相对于接种相应的单一菌株的组培苗并没有显著变化。与内生细菌相比,内生真菌的促进作用更显著,接种菌株NS33、NS6的组培苗鲜质量和干质量均高于接种菌株LG3、LY1的组培苗。
| 表 3 内生菌接种对雷公藤组培苗生长的影响 Table 3 Effect of inoculation with endophytic strains on growth of Tripterygium wilfordii plantlets |
除菌株组合NS6-LY1外,单独接种各菌株及联合接种其它菌株组合的雷公藤组培苗叶片叶绿素的含量都高于对照(图 2)。叶绿素含量受内生真菌NS6的影响最大,是空白对照的1.92倍,其次是接种菌株NS33、NS33-LY1的组培苗(P < 0.05)。与内生细菌LG3、LY1相比,内生真菌NS33、NS6对雷公藤叶绿素含量的影响更大。与单独接种相比, 联合接种菌株组合NS6-LY1对雷公藤组培苗叶绿素含量的促进作用有所降低,显示出一定的拮抗效应;而联合接种其他菌株组合对雷公藤组培苗叶绿素含量的影响程度则介于相应的两种单菌之间。
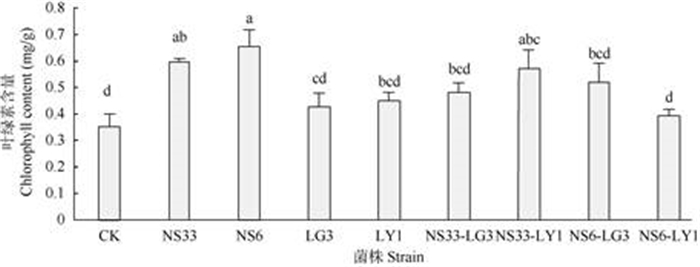
|
图 2 内生菌接种对雷公藤组培苗叶绿素含量的影响 Fig. 2 Effect of inoculation with endophytic strains on chlorophyll content of Tripterygium wilfordii plantlets |
组培苗植株中雷公藤甲素和雷公藤红素的含量因接种的内生菌种类和方式不同而呈现不同的变化,但接种内生菌均不同程度地提高了雷公藤甲素和雷公藤红素的含量(图 3)。与对照相比,菌株LG3、NS6、NS33和菌株组合NS33-LG3、NS33-LY1对雷公藤甲素合成的促进作用较为明显(P < 0.05), 雷公藤甲素含量是对照的5倍以上。而菌株LY1和菌株组合NS6-LG3、NS6-LY1对雷公藤甲素含量的影响则相对较小。与单独接种相比,联合接种内生真菌与内生细菌的雷公藤甲素含量并没有增加。单独及联合接种各菌株均显著提高了雷公藤红素的积累(P < 0.05),其中,菌株组合NS33-LG3、NS6-LY1和菌株LG3对雷公藤红素含量的促进作用相对较大,分别是对照的3.5、2.1和2.1倍。与单独接种相比,联合接种菌株组合NS33-LG3、NS6-LY1的雷公藤红素含量显著提高(P < 0.05)。
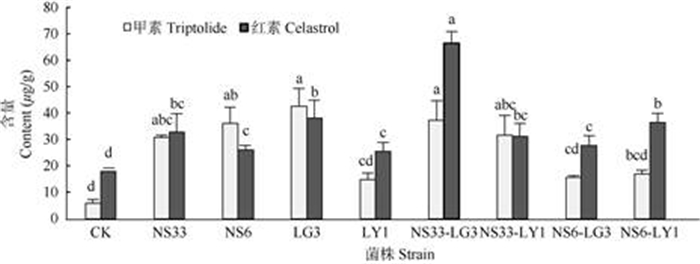
|
图 3 内生菌接种对雷公藤甲素和雷公藤红素含量的影响 Fig. 3 Effect of inoculation with endophytic strains on contents of triptolide and celastrol |
内生真菌和内生细菌可通过多种途径促进植物生长,如合成吲哚乙酸等生长调节剂、溶磷、分泌铁载体等。Amaresan等[12]从番茄(Lycopersicon escu- lentum)植株中筛选的内生细菌Bacillus sp. BETL9和B. pumilus BETL13具有相对较高的铁载体和IAA生产能力,接种后明显促进了番茄和红辣椒(Cap- sicum annuum)幼苗根、茎的伸长。本研究结果表明, 4种菌株及其组合均具有不同程度的植物促生性能。内生真菌NS33具有较高的铁载体合成、IAA分泌和溶磷能力,这可能是其能够明显提高种子萌发率、芽伸长和根系活力,显著促进雷公藤组培苗生长和提高叶绿素含量的重要原因。内生真菌NS33和内生细菌LG3混合培养的发酵液对种子萌发率、芽长、根系活力的促进作用可能也与该两株菌共存时能生产较多的铁载体和IAA有关。菌株NS6显示较强的铁载体和IAA分泌能力,菌株组合NS33- LY1则具有较高的铁载体合成和溶磷水平, 接种菌株NS6和联合接种菌株NS33、LY1不仅能显著提高小麦幼苗根系活力,而且能显著地促进雷公藤组培苗质量和叶绿素含量的增加。
内生细菌和内生真菌混合培养后,菌株合成铁载体、分泌IAA和溶磷能力会发生不同程度的变化。菌株NS33与LG3混合培养后的IAA分泌能力比单独培养有显著提高,表现出协同促进作用。植物共生真菌与细菌的协同作用已被较多研究证实[13],油棕榈树(Elaeis guineensis)内生细菌Pseudomonas aeru- ginosa UPMP3和Burkholderia cepacia UPMB3可以增加丛枝菌根真菌菌丝的长度和孢子的萌发[14]。然而,本研究中,菌株NS6与LG3混合培养后铁载体和IAA的合成能力则明显低于各自单独培养的, 反映出两者共存互作对铁载体和IAA的合成具有一定的抑制作用,其余菌株组合合成铁载体和IAA的能力基本介于相应的单一菌株之间,反映出这些菌株的混合培养对彼此间铁载体和IAA的合成能力影响不大,菌株组合产铁载体和IAA的能力更多与相应的单菌株的产生能力有关。具有不同溶磷能力的两种内生细菌菌株与内生真菌菌株混合培养以后,溶磷能力介于相应的两株单菌之间, 内生细菌菌株LY1具有很高的溶磷能力,而菌株组合NS33-LY1、NS6-LY1的溶磷能力则低于菌株LY1而高于菌株NS33和NS6,这在一定程度上反映出菌株间的溶磷能力亦没有明显的协同和拮抗效应。与单独接种相比,联合接种NS33与LG3显著提高了小麦幼苗的根系活力,这可能与两者共存能够协同促进菌株IAA的分泌能力有关。Nongkhlaw等[15]指出IAA能够促进植物根系的生长发育,从而增加根系表面积,提高植物对营养的吸收。与单独接种相比,联合接种NS6-LY1虽然降低了雷公藤组培苗的叶绿素含量,但提高了组培苗的高度和质量,这说明这两种菌株联合作用下,雷公藤组培苗生长的改善与叶绿素含量无明显的关系。水稻(Oryza sativa)种子内生泛菌Pantoea sp. REY-1与蛋白核小球藻共培养时,促进了小球藻生物量的增加,但藻细胞叶绿素a和类胡萝卜素总含量与对照差异不显著, 单细胞叶绿素a和类胡萝卜素含量则分别比对照下降42.58%和42.68%,差异显著[16]。微生物间的关系复杂,彼此的协同作用并不是广泛的,联合接种亦不总是具有正效应。多数雷公藤内生真菌和内生细菌的联合接种相对于单独接种对小麦种子萌发、幼苗生长和雷公藤组培苗生长的促进效应并无显著的变化。
内生菌长期生活在植物内部,不仅能够促进植物的生长发育,而且对植物的次生代谢也具有重要的影响。已有研究表明,内生菌可以促进长春花碱[17]、类倍伴萜烯[18]等多种生物活性物质在药用植物体内的积累。雷公藤甲素和雷公藤红素是雷公藤体内主要的药用成分,接种内生菌可以不同程度地提高雷公藤组培苗中雷公藤甲素和雷公藤红素的含量。菌株LG3、NS6、NS33和菌株组合NS33- LG3、NS33-LY1对雷公藤甲素含量的促进作用较大, 而有利于雷公藤红素合成的主要是菌株组合NS33- LG3、NS6-LY1和菌株LG3,这种菌株上的差异可能是因为内生菌通过不同的途径对植物次生代谢产物的积累产生影响。某些内生菌可以通过产生多种类型的酶或代谢前体物而将植物体内某些化学成分转化成活性物质或诱导植物次生代谢产物的合成[19],法国梧桐(Platanus orientalis)的某些内生菌能将白桦脂酸转化为桦木酮酸[20];内生菌通过调节长春花(Catharanthus roseus)萜类吲哚生物碱途径来提高根中阿吗碱和蛇根碱的形成和积累[21]。另有一些内生菌在与宿主植物长期协同进化中,可以获得产生与宿主相同或相似次生代谢产物的能力,从而可以增加该类物质在植物体内的积累[19, 22-23], 短叶红豆杉(Taxus brevifolia)、喜马拉雅红豆杉(T. wallichiana)、南方红豆杉(T. chinensis)、云南红豆杉(T. yunnanensis)和落羽杉(Taxodium distichum)等植物的多种内生真菌均能够产紫杉醇或其类似物[24-25]; 从桃儿七(Sinopodophyllum hexandrum)、南方山荷叶(Diphylleia sinensis)中都分离到产鬼臼毒素的内生真菌,这些内生真菌分布在不同属植物中[26]。与单独接种相比,联合接种NS33-LG3、NS6- LY1能够提高雷公藤组培苗中的雷公藤红素含量, 这反映出某些菌株的联合接种对植物次生代谢产物的积累具有一定的协同促进作用。
| [1] |
RASHID S, CHARLES T C, GLICK B R. Isolation and characteri-zation of new plant growth-promoting bacterial endophytes[J]. Appl Soil Ecol, 2012, 61: 217-224. DOI:10.1016/j.apsoil.2011.09.011 |
| [2] |
ZHAO X J, LI X Z, WANG P, et al. Effects of endophytic fungi on the seed physiology of Hordeum brevisubulatum under artificial ageing treatment[J]. Acta Agrest Sin, 2015, 23(6): 1272-1277. 赵晓静, 李秀璋, 王萍, 等. 内生真菌对野大麦种子人工老化处理下的生理影响[J]. 草地学报, 2015, 23(6): 1272-1277. DOI:10.11733/j.issn.1007-0435.2015.06.021 |
| [3] |
KHAN M K, SAKAMOTO K, YOSHIDA T. Dual inoculation of peanut with Glomus sp. and Bradyrhizobium sp. enhanced the sym-biotic nitrogen fixation as assessed by 15N-technique[J]. Soil Sci Plant Nutri, 1995, 41(4): 769-779. DOI:10.1080/00380768.1995.10417027 |
| [4] |
UNIYAL K, THAPAR H S. Growth responses in Prosopis juliflora inoculated with VA mycorrhizal fungi and Rhizobium in sodic soil[J]. Van-Vigyan, 1995, 33(3/4): 182-184. |
| [5] |
SINGH S. Interaction of arbuscular mycorrhizal fungi with nodule-forming nitrogen fixing organisms:Part 1. Effect of dual inoculation on plant, VAM and/or nitrogen fixers[J]. Mycorrhiza News, 1997, 9(3): 1-13. |
| [6] |
MEENA K K, MESAPOGU S, KUMAR M, et al. Co-inoculation of the endophytic fungus Piriformospora indica with the phosphate-solubilising bacterium Pseudomonas striata affects population dynamics and plant growth in chickpea[J]. Biol Fertil Soils, 2010, 46(2): 169-174. DOI:10.1007/s00374-009-0421-8 |
| [7] |
XU J J, SONG P, FENG L, et al. Growth-promoting effect and triptolide production regulation of endophytic bacteria from Triptery-gium wilfordii[J]. Chin J Appl Ecol, 2014, 25(6): 1681-1687. 许进娇, 宋萍, 封磊, 等. 雷公藤内生细菌的促生作用及其对雷公藤甲素生成的影响[J]. 应用生态学报, 2014, 25(6): 1681-1687. DOI:10.13287/j.1001-9332.20140409.016 |
| [8] |
LUDWIG-MÜLLER J. Plants and endophytes:Equal partners in secondary metabolite production?[J]. Biotechnol Lett, 2015, 37(7): 1325-1334. DOI:10.1007/s10529-015-1814-4 |
| [9] |
GLICKMANN E, DESSAUX Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Appl Environ Microbiol, 1995, 61(2): 793-796. DOI:10.1128/AEM.61.2.793-796.1995 |
| [10] |
SCHWYN B, NEILANDS J B. Universal chemical assay for the detection and determination of siderophores[J]. Anal Biochem, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9 |
| [11] |
WEI D, WANG Y R. Germination testing methods on Achnatherum splendens seeds[J]. Pratacult Sci, 1998, 15(4): 29-32. 卫东, 王彦荣. 芨芨草种子发芽检验方法的研究[J]. 草业科学, 1998, 15(4): 29-32. |
| [12] |
AMARESAN N, JAYAKUMAR V, KUMAR K, et al. Isolation and characterization of plant growth promoting endophytic bacteria and their effect on tomato (Lycopersicon esculentum) and chilli (Capsicum annuum) seedling growth[J]. Ann Microbiol, 2012, 62(2): 805-810. DOI:10.1007/s13213-011-0321-7 |
| [13] |
WANG X M, YAM T W, MENG Q W, et al. The dual inoculation of endophytic fungi and bacteria promotes seedlings growth in Dendro-bium catenatum (Orchidaceae) under in vitro culture conditions[J]. Plant Cell Tiss Organ Cult, 2016, 126(3): 523-531. DOI:10.1007/s11240-016-1021-6 |
| [14] |
SUNDRAM S, MEON S, SEMAN I A, et al. Symbiotic interaction of endophytic bacteria with arbuscular mycorrhizal fungi and its antago-nistic effect on Ganoderma boninense[J]. J Microbiol, 2011, 49(4): 551-557. DOI:10.1007/s12275-011-0489-3 |
| [15] |
NONGKHLA F M W, JOSHI S R. Epiphytic and endophytic bacteria that promote growth of ethnomedicinal plants in the subtropical forests of Meghalaya, India[J]. Rev Biol Trop, 2014, 62(4): 1295-1308. DOI:10.15517/RBT.V62I4.12138 |
| [16] |
SHI Y Q, ZHAO Y. Growth and lipid accumulation promotion of chlorella by endophytic Pantoea sp. from rice seeds[J]. Sci Agric Sin, 2016, 49(8): 1429-1442. 史玉倩, 赵艳. 水稻种子内生泛菌促进小球藻生长和油脂积累[J]. 中国农业科学, 2016, 49(8): 1429-1442. DOI:10.3864/j.issn.0578-1752.2016.08.001 |
| [17] |
PANDEY S S, SINGH S, BABU C S V, et al. Fungal endophytes of Catharanthus roseus enhance vindoline content by modulating structural and regulatory genes related to terpenoid indole alkaloid biosynthesis[J]. Sci Rep, 2016, 6: 26583. DOI:10.1038/srep26583 |
| [18] |
ZHOU J Y, YUAN J, LI X, et al. Endophytic bacterium-triggered reactive oxygen species directly increase oxygenous sesquiterpenoid content and diversity in Atractylodes lancea[J]. Appl Environ Microbiol, 2016, 82(5): 1577-1585. DOI:10.1128/AEM.03434-1510.1128/AEM.03434-15 |
| [19] |
STROBEL G, DAISY B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiol Mol Biol Rev, 2003, 67(4): 491-502. DOI:10.1128/MMBR.67.4.491-502.2003 |
| [20] |
BASTOS D Z L, PIMENTEL I C, de JESUS D A, et al. Biotrans-formation of betulinic and betulonic acids by fungi[J]. Phytochemistry, 2007, 68(6): 834-839. DOI:10.1016/j.phytochem.2006.12.007 |
| [21] |
SINGH S, PANDEY S S, SHANKER K, et al. Endophytes enhance the production of root alkaloids ajmalicine and serpentine by modulating the terpenoid indole alkaloid pathway in Catharanthus roseus roots[J]. J Appl Microbiol, 2020, 128(4): 1128-1142. DOI:10.1111/jam.14546 |
| [22] |
NICOLETTI R, FERRANTI P, CAIRA S, et al. Myrtucommulone production by a strain of Neofusicoccum australe endophytic in myrtle (Myrtus communis)[J]. World J Microbiol Biotechnol, 2014, 30(3): 1047-1052. DOI:10.1007/s11274-013-1523-x |
| [23] |
VENIERAKI A, DIMOU M, KATINAKIS P. Endophytic fungi residing in medicinal plants have the ability to produce the same or similar phar-macyologically active secondary metabolites as their hosts[J]. Hell Plant Prot J, 2017, 10(2): 51-66. DOI:10.1515/hppj-2017-0006 |
| [24] |
KUMAR A, PATIL D, RAJAMOHANAN P R, et al. Isolation, purify-cation and characterization of vinblastine and vincristine from endo-phytic fungus Fusarium oxysporum isolated from Catharanthus roseus[J]. PLoS One, 2013, 8(9): e71805. DOI:10.1371/journal.pone.0071805 |
| [25] |
DAI H Y, LIU M Z, DUAN Z G, et al. Screening and identification twenty-five strains of taxane-producing endophytic fungi from Taxus chinensis var. mairei[J]. J Trop Subtrop Bot, 2017, 25(3): 271-278. 戴黄益, 刘明志, 段中岗, 等. 从南方红豆杉中筛选和鉴定25株产紫杉烷的内生真菌[J]. 热带亚热带植物学报, 2017, 25(3): 271-278. DOI:10.11926/jtsb.3657 |
| [26] |
YANG X Z, GUO S P, ZHANG L Q, et al. Select of producing podo-phyllotoxin endophytic fungi from podophyllin plant[J]. Nat Prod Res Dev, 2003, 15(5): 419-422. 杨显志, 郭仕平, 张玲琪, 等. 鬼臼类植物产鬼臼毒素内生真菌的筛选[J]. 天然产物研究与开发, 2003, 15(5): 419-422. DOI:10.3969/j.issn.1001-6880.2003.05.012 |
 2020, Vol. 28
2020, Vol. 28


