毛竹(Phyllostachys edulis)作为一种重要的非木质资源,广泛分布于我国长江以南地区,其生长速度快,成材早,用途广,是我国重要的经济竹种[1]。然而毛竹在生长发育过程中面临着各种环境问题,如低温和干旱等,不仅制约着毛竹的生长和分布, 也给竹产业带来巨大的损失。当植物遭受环境胁迫时,一方面通过调节新陈代谢过程中的各种生理变化,如渗透调节物质(脯氨酸、可溶性糖等)的积累等减少胁迫造成的伤害[2-3]。另一方面,通过启动内部分子适应机制,如渗透调节物质合成基因:果聚糖合成基因、脯氨酸合成基因、甜菜碱合成基因等;具有解毒功能的抗氧化物质基因:超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)基因等;转录因子基因NAC、MYB、ERF等,通过调控这些基因的表达,增强植物对逆境的耐受能力[4]。迄今为止,已在毛竹中鉴定出多个基因家族,如MYB[5]、WRKY[6]、Hsf[7]等转录因子, 并对其在胁迫环境下发挥的功能进行了初步验证。
抗坏血酸过氧化物酶(ascorbate peroxidase, APX)作为一种重要的抗氧化物酶,在清除胁迫条件下积累的H2O2方面发挥着重要作用,尤其是叶绿体中的H2O2主要由APX清除[8-9]。抗坏血酸过氧化物酶最早在菠菜(Spinacia oleracea)叶绿体中发现, 属于植物型血红素过氧化物酶超家族[10-11]。根据亚细胞定位,植物中APX可分为4种类型:细胞质型、叶绿体型、线粒体型和过氧化物酶体型[12]。
迄今为止,已经在多种植物中克隆出了APX基因,如拟南芥(Arabidopsis thaliana)[13-14]、玉米(Zea mays)[15]、陆地棉(Gossypium hirsutum)[16]、水稻(Oryza sativa)[17]、细叶金丝桃(Hypericum gramineum)[18]和巴西橡胶树(Hevea brasiliensis)[19],并对其功能进行了验证。相关转录组数据分析表明,强光照下,毛竹中有6个APX基因表达量上调,可能与光胁迫响应有关[20]。低温[21]、干旱[22]处理后,毛竹APX活性提高,参与过氧化氢的清除,以减少植物受到的损伤。为了进一步研究毛竹中APX基因的结构、种类及在干旱、低温和盐胁迫应答中的作用,本研究对毛竹全基因组数据库进行筛选,鉴定毛竹中APX基因,通过生物信息学分析以及在干旱、低温和盐胁迫下表达模式分析,探讨APX基因在毛竹抗氧化胁迫中发挥的作用,以期为毛竹的抗性分子育种提供理论基础和候选基因。
1 材料和方法 1.1 材料毛竹(Phyllostachys edulis)种子产自广西桂林地区,种植于直径10 cm左右的塑料培养皿中,培养条件为24℃光照16 h/21℃黑暗8 h。用200 mmol/L NaCl、20% PEG 6000、4℃分别模拟高盐、干旱和低温胁迫,对3月龄的毛竹实生苗(地上部分高约20 cm)进行处理,分别于处理的0、3、6、12、24、48、72和120 h取幼嫩的主根和须根以及生长状态良好的叶片,液氮速冻后保存于-80℃冰箱中,用于RNA的提取。
1.2 毛竹APX基因家族成员鉴定和生物信息学分析从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中下载水稻APX氨基酸序列(OsAPX1, XP_015630498.1; OsAPX2, XP_015646556.1; OsAPX3, XP_015635863.1; OsAPX4, XP_015650808.1; OsAPX5, XP_015618477.1; OsAPX6, XP_015618175.1; OsAPX7, XP_015635863.1; OsAPX8, XP_015623105.1),并以此为探针,采用BLASTp为引擎对毛竹基因组数据库(http://www.bamboogdb.org/)进行检索,获得同源序列。使用NCBI的NCBI-CDD工具以及在线软件SMART (http://smart.embl-heidelberg.de)对候选毛竹APX蛋白序列保守结构域进行分析[23],最终获得具有完整保守结构域的APX家族基因序列。利用在线软件ExPASy (http://expasy.org/)对APX蛋白理化性质进行预测, 使用在线软件Plant-mPLoc (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)及Softberry (http://linux-1.softberry.com/)进行亚细胞定位预测。使用在线工具GSDS (http://gsds.cbi.pku.edu.cn/)对毛竹APX基因结构进行分析。使用在线工具MEME对毛竹APX氨基酸序列保守基序进行分析。使用Plant CARE软件对上游2 000 bp启动子序列顺式作用元件进行分析。
另外,从拟南芥数据库(http://www.arabidopsis.org/)、玉米数据库(https://www.maizegdb.org/)、JGI数据库(https://jgi.doe.gov/)以及PLAZA数据库(https://bioinformatics.psb.ugent.be/plaza/)[24]中下载拟南芥(AtAPX1, At1g07890; AtAPX2, At3g09640; AtAPX3, At4g35000; AtAPX4, At4g09010; AtAPX5, At4g35970; AtAPX6, At4g32320; AtSAPX, At4g08390; AtTAPX, At1g77490)、玉米(ZmAPX1, Zm00001d047757; Zm-APX2, Zm00001d007234; ZmAPX3, Zm00001d025047; ZmAPX4, Zm00001d053223; ZmAPX5, Zm00001d-023582; ZmAPX6, Zm00001d028709; ZmAPX7, Zm-00001d016802)、二穗短柄草(Brachypodium distachyon) (BdAPX1, Bradi3g45700; BdAPX2, Bradi4g41180; BdAPX3, Bradi5g10490)、番茄(Lycopersicon esculentum) (SlAPX1, Solyc01g 111510.2; SlAPX2, Solyc02g083620.2; SlAPX3, Soly c06g005150.2; SlAPX4, Solyc06g005160.2; SlAPX5, Solyc06g060260.2; SlAPX6, Solyc09g007270.2; SlAPX7, Solyc11g018550.2)和毛果杨(Populus trichocarpa) (PtAPX1, Potri.-006G132200; PtAPX2, Potri.009G134100; PtAPX3, Potri.016G084800)的APX氨基酸序列,采用Clustal X2软件进行比对,再利用MEGA 7.0软件对APX氨基酸序列进行聚类分析,采用邻接法(neighborjoining, NJ)构建系统进化树。
1.3 APX家族基因的组织表达模式从NCBI (登记号: SRX082501~SRX082512)的SRA数据库中下载毛竹7种组织(叶片、早花穗、晚花穗、茎、根、20 cm高竹笋、50 cm高竹笋)的转录组数据。为了便于统计,取表达量对数log2, 采用软件MeV绘制热图。
1.4 非生物胁迫下APX家族基因表达模式分析采用Trizol法提取毛竹总RNA,使用非酶DNA清除剂(天恩泽)去除基因组DNA,取1 μg RNA, 按照反转录试剂盒(Promega)说明书反转录为cDNA, 并保存于-20℃冰箱中备用。
使用Prime Primer 5.0软件设计定量引物,采用NCBI的Primer BLAST程序验证引物的特异性,内参引物为液泡膜内嵌蛋白41基因(TIP41)[25], 引物由上海生工生物有限公司合成(表 1)。qRT-PCR反应体系为2×SYBR PCR mix 5 μL,上、下游引物(10 mmol/L)各0.2 μL,cDNA模板0.8 μL,ddH2O 3.8 μL, 总体系为10 μL。qRT-PCR反应程序为: 94℃ 1 min;94℃ 10 s, 62℃ 10 s, 72℃ 10 s, 45个循环。3次重复,4个技术重复,在qTOWER 2.2 (Analytik Jena, Germany)实时定量PCR仪上进行定量分析, 并用2-△△CT对结果进行分析[26]。
| 表 1 qRT-PCR定量引物设计 Table 1 Primers for qRT-PCR |
利用生物信息学方法,对毛竹全基因组数据库进行筛选,共鉴定得到7个APX基因家族成员,分别命名为PeAPX1~PeAPX7。每个成员编码的蛋白质都含有血红素结合域(Heme-binding)、酶活性位点(Active-site),其中PeAPX6和PeAPX7分别存在2个叶绿体型APX特有结构域(Choroplastic-domain) (图 1),属于叶绿体型APX同工酶,与亚细胞预测结果相一致(表 2)。

|
图 1 PeAPXs的氨基酸序列比对 Fig. 1 Amino acid sequence alignments of PeAPXs |
| 表 2 PeAPXs蛋白理化性质分析和亚细胞定位预测 Table 2 Physical and chemical properties, and subcellular localization of PeAPXs |
采用GSDS在线工具对PeAPXs的内含子/外显子结构进行分析,结果表明,PeAPXs具有相似的基因结构,除PeAPX6和PeAPX7外,PeAPX1~ PeAPX5均含有9个外显子(图 2)。

|
图 2 PeAPXs基因的结构 Fig. 2 Gene structures of PeAPXs |
蛋白质理化性质分析结果表明,PeAPXs蛋白有250~479氨基酸,理论等电点为5.20~8.93, 相对分子质量为27.26~52.51 kDa。总平均亲水性GRAVY均为负值,说明7种PeAPXs均为疏水性蛋白。除PeAPX1和PeAPX4外,其他PeAPXs的蛋白不稳定系数均大于40,为不稳定蛋白。亚细胞定位预测结果表明,PeAPX1、PeAPX2和PeAPX5定位于胞质中,PeAPX3和PeAPX4定位于过氧化物酶体中, PeAPX6和PeAPX7定位于叶绿体/线粒体中(表 2)。
2.3 PeAPXs家族的聚类分析系统发育进化树显示PeAPXs可分为3个亚类,其中PeAPX1、PeAPX2、PeAPX5聚为亚类A, PeAPX3和PeAPX4聚为亚类B,PeAPX6和PeAPX7聚为亚类C。从亲缘关系来看,毛竹PeAPXs与单子叶植物水稻、二穗短柄草的亲缘关系较近,与双子叶植物拟南芥、马铃薯、杨树的亲缘关系较远(图 3)。

|
图 3 基于植物APXs氨基酸序列构建的系统进化树。Pe:毛竹; Os:水稻; At:拟南芥; Pt:毛果杨; Bd:二穗短柄草; Sl:番茄。 Fig. 3 Phylogenetic tree based on amino acid sequences of APXs in plants. Pe: Phyllostachys edulis; Os: Oryza sativa; At: Arabidopsis thaliana; Pt: Populus trichocarpa; Bd: Brachypodium distachyon; Sl: Lycopersicon esculentum. |
通过MEME软件构建PeAPXs保守区域基序分析图(图 4),结果表明,毛竹PeAPXs序列中含有7个基序,分别为Motif 1~Motif 7。Motif 1、Motif 2、Motif 3、Motif 4、Motif 5和Motif 7存在于所有PeAPXs中;Motif 6只存在于A与B类中,Motif 8只存在于C类中。氨基酸序列比对结果表明, PeAPX1~PeAPX6氨基酸序列相似,其基序种类、位置和长度也基本一致。同样的,PeAPX7和PeAPX8具有相似的保守基序。

|
图 4 PeAPXs的保守基序分布 Fig. 4 Distribution of conserved motifs in PeAPXs |
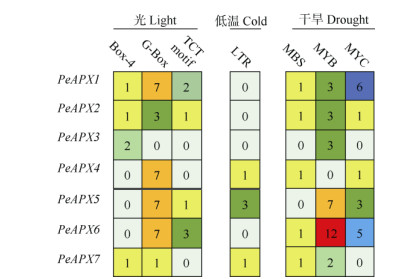
为预测PeAPXs功能,对各基因转录起始位点上游2 000 bp的启动子序列进行分析,结果表明,毛竹每个PeAPX的启动子均存在低温、干旱等非生物胁迫响应元件,同时有大量光响应元件如G-Box、Box-4和TCT-motif等(图 5),与转录组数据分析一致。
|
图 5 PeAPXs上游启动子序列中的响应元件数。格子中的数字代表顺式作用元件数量。 Fig. 5 Number of cis-acting elements in promoter regions of PeAPXs. The data in blocks represent the number of cis-elements. |
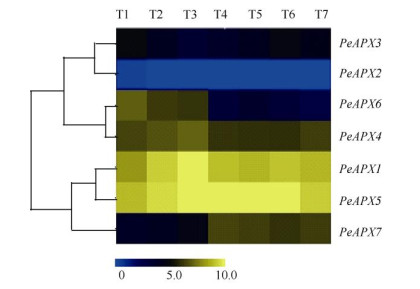
采用软件MeV绘制PeAPXs在7个组织中的表达量热图(图 6),结果表明,7个PeAPXs在不同组织的表达丰度存在差异,其中PeAPX1和PeAPX5在7个组织的表达丰度均较高;PeAPX6在叶片和花穗的表达量较高而在根和笋的表达量较低;PeAPX7在根和笋的表达量较高,在叶片和花穗的表达量较低;而PeAPX2在7个组织中的表达丰度均较低。
|
图 6 PeAPXs在毛竹不同组织中的表达。T1:叶; T2:早期花穗; T3:晚期花穗; T4:茎; T5:根; T6: 20 cm笋; T7: 50 cm笋。 Fig. 6 Expression of PeAPXs in different tissues. T1: Leaf; T2: Panicle at early stage; T3: Panicle at late stage; T4: Rhizome; T5: Root; T6: 20 cm shoot; T7: 50 cm shoot. |
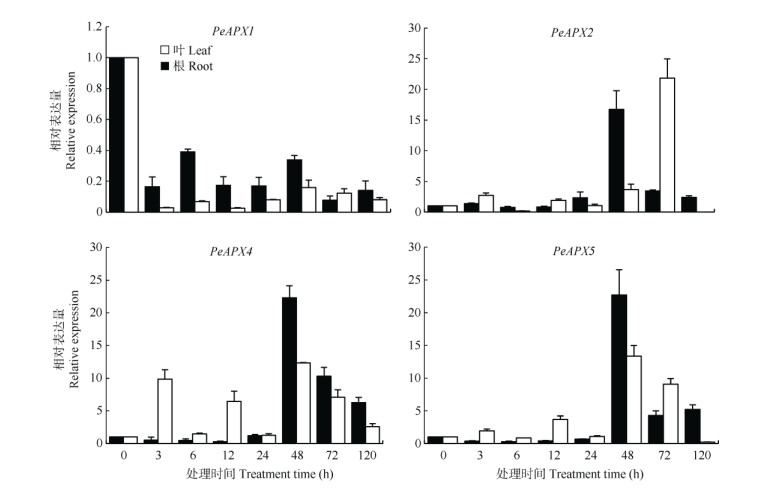
20% PEG 6000处理后,毛竹PeAPXs呈现两种表达模式,PeAPX2、PeAPX4和PeAPX5表达量大致呈先上升后下降趋势,而PeAPX1表达量呈现下调趋势,未检测到PeAPX3、PeAPX6和PeAPX7的表达。PeAPX2在叶片和根中的表达量分别在处理后的48和72 h达到最高,为对照的16.7和21.8倍,叶片和根中PeAPX4和PeAPX5表达量在处理后48 h达到峰值,叶片的PeAPX4和PeAPX5表达量分别为对照的22.3和22.7倍,根中PeAPX4和Pe APX5表达量分别为对照的12.3和13.4倍(图 7)。
|
图 7 干旱胁迫下毛竹根和叶中PeAPXs表达模式 Fig. 7 Expression pattern of PeAPXs in leaves and roots under drought stress |
200 mmol/L NaCl处理后,6个PeAPXs基因在叶片中的表达量均呈现上调趋势,未检测到PeAPX3的表达。其中,PeAPX1、PeAPX2、PeAPX5的表达量均在处理后的48 h达到最高,分别是对照的23.3、15.9和5.6倍。PeAPX4、PeAPX6和PeAPX7的表达量在处理后的72 h达到最高,分别为对照的9.3、2.9和4.0倍。毛竹根中,PeAPX5和PeAPX7表达量呈现下调趋势,PeAPX1、PeAPX4和PeAPX6的表达量均在处理后的48 h达到最高,PeAPX2的表达量在处理后的6 h达到最高(图 8)。

|
图 8 盐胁迫下毛竹叶和根中PeAPXs表达模式 Fig. 8 Expression pattern of PeAPXs in leaves and roots under salt stress |
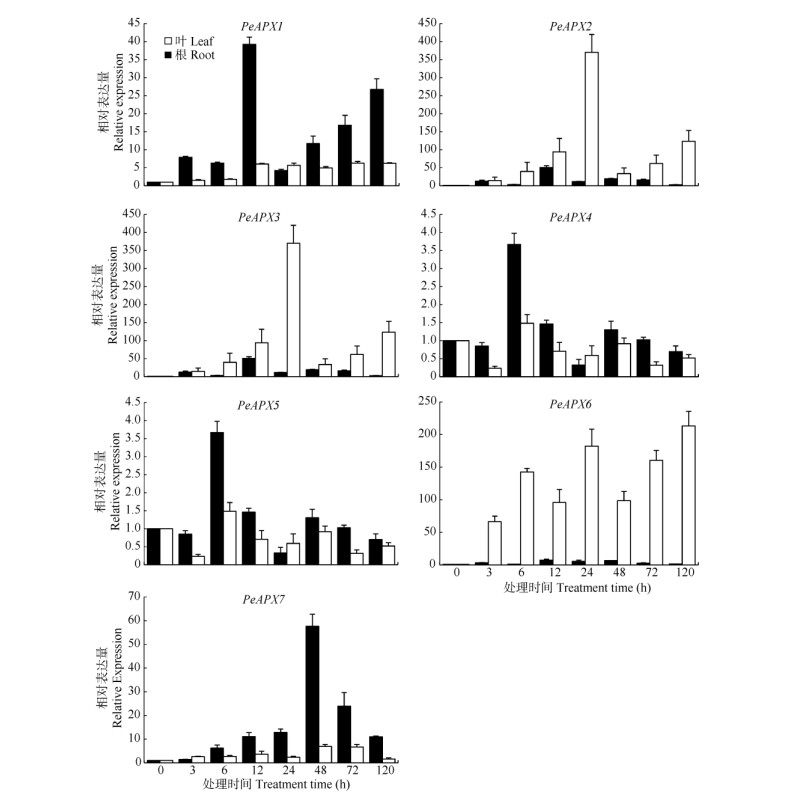
4℃低温处理后,根和叶片中均检测到7个PeAPXs的表达,且呈现上调趋势。叶片中PeAPX1、PeAPX2、PeAPX6的表达量在处理后的12 h达到最大,其中PeAPX1和PeAPX2表达量分别是对照的39.2和50.8倍。PeAPX3和PeAPX7表达量在处理后72 h达到最大,而PeAPX4和PeAPX5的表达量相比其余基因而言,虽整体呈现上调, 但变化不大。根中PeAPX1表达量在低温处理6 h后达到峰值并维持在稳定状态,而PeAPX2、PeAPX3、PeAPX5和PeAPX7表达量分别在处理后的24、3、12和48 h达到峰值,随后下调(图 9)。
|
图 9 低温胁迫下毛竹叶和根中PeAPXs表达模式 Fig. 9 Expression pattern of PeAPXs in leaves and roots under cold stress |
抗坏血酸过氧化物酶基因作为植物中一个重要的活性氧(reactive oxygen species, ROS)清除酶基因,在清除生物与非生物胁迫下积累的过量过氧化氢过程中发挥重要作用。因此,开展对毛竹中APX基因的鉴定及表达模式分析研究,对于揭示其在胁迫条件下发挥的作用和提高毛竹耐胁迫能力具有重要的参考价值。本研究中,我们对毛竹全基因组进行分析,共鉴定得到7个毛竹APX家族基因, 分别属于3个亚家族,各个亚家族成员基因结构、蛋白质理化性质存在差异。氨基酸序列分析表明,同一亚类PeAPXs具有相似的保守结构域,且保守基序的种类和位置基本一致。亚细胞定位预测表明, PeAPX6和PeAPX7定位在叶绿体或线粒体中,氨基酸序列分析表明,他们均具有叶绿体型APX特有的结构域,因此仍需进一步验证PeAPX6和PeAPX7的具体定位。
本研究采用qRT-PCR对毛竹根和叶中PeAPXs在干旱、低温和盐胁迫下的表达模式进行了研究。在3种非生物胁迫下,PeAPXs的表达模式存在差异, 大多数PeAPXs呈上调表达,尤其是PeAPX2维持着较高的表达水平,表明PeAPXs可能在毛竹的非生物胁迫反应中发挥重要作用,这与前人的研究结果一致[27-31]。然而,有些基因在胁迫下表达量呈现下调趋势,如盐胁迫下,毛竹根中PeAPX1、PeAPX2、PeAPX3、PeAPX5、PeAPX6和PeAPX7表达量变化不大,甚至出现下调,推测可能是这几个基因在胁迫后表达受到抑制,ROS由其他基因或者通过其他途径来清除。另外,个别基因在不同胁迫下的表达模式不同,PeAPX6在低温胁迫中表达量显著上调而在干旱胁迫中不表达或者下调,推测PeAPXs基因在不同的胁迫中发挥不同的功能。有研究也报道了类似的结果,菠菜(Spinacia oleracea)的cAPX在强光和紫外光下表达量上调,在干旱、盐胁迫下转录水平没有变化;而mAPX、sAPX和tAPX的转录水平在ABA、干旱、强光和盐处理下, 未发生变化[32]。此外,3种非生物胁迫下,PeAPX家族成员在不同组织中的表达模式也存在差异,盐胁迫下,毛竹根中PeAPX1、PeAPX2、PeAPX3、PeAPX5、PeAPX6和PeAPX7表达量变化不大,甚至出现下调,而叶片中6个PeAPX基因表达量呈现上调趋势。盐胁迫下PeAPX3不表达,干旱胁迫下,PeAPX3、PeAPX6和PeAPX7不表达,推测可能是胁迫抑制了这几个基因的表达。可见,4个毛竹PeAPX基因(PeAPX1、PeAPX2、PeAPX4和PeAPX5)均参与了3种非生物胁迫响应,但对胁迫的应激反应不同,植物体内ROS的清除是一个复杂的过程,需要通过多种途径实现。毛竹7种组织的转录组数据分析表明, PeAPX1、PeAPX2和PeAPX5在毛竹叶片和根中的表达丰度较高,同时定量分析结果表明他们均参与干旱、低温、盐胁迫响应,因此我们推测这3个基因能快速响应非生物胁迫。
| [1] |
JIANG Z H. Bamboo and Rattan in the World[M]. Beijing: China Forestry Publishing House, 2007: 71-77. 江泽慧. 世界竹藤[M]. 北京: 中国林业出版社, 2007: 71-77. |
| [2] |
YANG Y F, AL-BAIDHANI H H J, HARRIS J, et al. DREB/CBF expression in wheat and barley using the stress-inducible promoters of HD-Zip I genes:Impact on plant development, stress tolerance and yield[J]. Plant Biotechnol J, 2019. DOI:10.1111/pbi.13252 |
| [3] |
SHAO Y R, XU J X, XUE L, et al. Effects of low temperature stress on physiological-biochemical indexes and photosynthetic characteristics of seedlings of four plant species[J]. Acta Ecol Sin, 2013, 33(14): 4237-4247. 邵怡若, 许建新, 薛立, 等. 低温胁迫时间对4种幼苗生理生化及光合特性的影响[J]. 生态学报, 2013, 33(14): 4237-4247. DOI:10.5846/stxb201301150100 |
| [4] |
LI J. Progress on drought stress adaptation mechanisms of plant[J]. Guangdong Agric Sci, 2014, 41(19): 154-159. 李洁. 植物干旱胁迫适应机制研究进展[J]. 广东农业科学, 2014, 41(19): 154-159. DOI:10.3969/j.issn.1004-874X.2014.19.035 |
| [5] |
LI L, MU S H, CHENG Z C, et al. Characterization and expression analysis of the WRKY gene family in moso bamboo[J]. Sci Rep, 2017, 7: 6675. DOI:10.1038/s41598-017-06701-2 |
| [6] |
XIE L H, LI X Y, HOU D, et al. Genome-wide analysis and expression profiling of the heat shock factor gene family in Phyllostachys edulis during development and in response to abiotic stresses[J]. Forests, 2019, 10(2): 100. DOI:10.3390/f10020100 |
| [7] |
HOU D, CHENG Z C, XIE L H, et al. The R2R3MYB gene family in Phyllostachys edulis:Genome-wide analysis and identification of stress or development-related R2R3MYBs[J]. Front Plant Sci, 2018, 9: 738. DOI:10.3389/fpls.2018.00738 |
| [8] |
PANCHUK I I, ZENTGRAF U, VOLKOV R A. Expression of the APX gene family during leaf senescence of Arabidopsis thaliana[J]. Planta, 2005, 222(5): 926-932. DOI:10.1007/s00425-005-0028-8 |
| [9] |
CHEN H, WU J L, LI X J. Generation and scavenging of reactive oxygen species in chloroplasts[J]. Prog Mod Biomed, 2008, 8(10): 1979-1981, 1971. 陈花, 吴俊林, 李晓军. 叶绿体中活性氧的产生和清除机制[J]. 现代生物医学进展, 2008, 8(10): 1979-1981, 1971. |
| [10] |
NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1993, 22(5): 867-880. DOI:10.1093/oxfordjournals.pcp.a076232 |
| [11] |
LAZZAROTTO F, TEIXEIRA F K, ROSA S B, et al. Ascorbate per-oxidase-related (APx-R) is a new heme-containing protein functionally associated with ascorbate peroxidase but evolutionarily divergent[J]. New Phytol, 2011, 191(1): 234-250. DOI:10.1111/j.1469-8137.2011.03659.x |
| [12] |
SHIGEOKA S, ISHIKAWA T, TAMOI M, et al. Regulation and func-tion of ascorbate peroxidase isoenzymes[J]. J Exp Bot, 2002, 53(372): 1305-1319. DOI:10.1093/jexbot/53.372.1305 |
| [13] |
CHEW O, WHELAN J, MILLAR A H. Molecular definition of the ascorbate-glutathione cycle in Arabidopsis mitochondria reveals dual targeting of antioxidant defenses in plants[J]. J Biol Chem, 2003, 278(47): 46869-46877. DOI:10.1074/jbc.M307525200 |
| [14] |
MITTLER R, VANDERAUWERA S, GOLLERY M, et al. Reactive oxygen gene network of plants[J]. Trends Plant Sci, 2004, 9(10): 490-498. DOI:10.1016/j.tplants.2004.08.009 |
| [15] |
LIU Y J, YUAN Y, LIU Y Y, et al. Gene families of maize glutathione-ascorbate redox cycle respond differently to abiotic stresses[J]. J Plant Physiol, 2012, 169(2): 183-192. DOI:10.1016/j.jplph.2011.08.018 |
| [16] |
LIU N, WU J H, AN Y R, et al. Bioinformatics analysis of the ascor-bate peroxidase gene family in the Gossypium hirsutum L. genome[J]. Cott Sci, 2017, 29(1): 17-28. 刘娜, 吴金华, 安亚茹, 等. 陆地棉抗坏血酸过氧化物酶基因家族全基因组生物信息学分析[J]. 棉花学报, 2017, 29(1): 17-28. DOI:10.11963/issn.1002-7807.201701003 |
| [17] |
TEIXEIRA F K, MENEZES-BENAVENTE L, ROGÉRIO M, et al. Analysis of the molecular evolutionary history of the ascorbate peroxidase gene family:Inferences from the rice genome[J]. J Mol Evol, 2004, 59(6): 761-770. DOI:10.1007/s00239-004-2666-z |
| [18] |
GUAN Q J, WANG Z J, WANG X H, et al. A peroxisomal APX from Puccinellia tenuiflora improves the abiotic stress tolerance of trans-genic Arabidopsis thaliana through decreasing of H2O2 accumulation[J]. J Plant Physiol, 2015, 175: 183-191. DOI:10.1016/j.jplph.2014.10.020 |
| [19] |
CHAO J Q, ZHANG S X, CHEN Y Y, et al. Cloning, heterologous expression and characterization of ascorbate peroxidase (APX) gene in laticifer cells of rubber tree (Hevea brasiliensis Muell. Arg.)[J]. Plant Physiol Biochem, 2015, 97: 331-338. DOI:10.1016/j.plaphy.2015.10.023 |
| [20] |
ZHAO H S, LOU Y F, SUN H Y, et al. Transcriptome and comparative gene expression analysis of Phyllostachys edulis in response to high light[J]. BMC Plant Biol, 2016, 16: 34. DOI:10.1186/s12870-016-0720-9 |
| [21] |
FENG F M, SHI S J, CAO Y, et al. Effects of chilling and freezing stress on the physiological metabolism and the expression of cold-related transcription factors in seedlings of Phyllostachys heterocycla cv. pubescens[J]. J Bamboo Res, 2014, 33(2): 29-33, 45. 冯芳敏, 史世京, 曹颖, 等. 冷冻胁迫对毛竹幼苗生理代谢及抗寒相关转录因子表达的影响[J]. 竹子研究汇刊, 2014, 33(2): 29-33, 45. DOI:10.3969/j.issn.1000-6567.2014.02.006 |
| [22] |
LI L, SONG S J, FANG X M, et al. Protection enzymes and lipid peroxidation in Phyllostachys edulis seedlings with temperature and water stresses[J]. J Zhejiang Agric For Univ, 2017, 34(2): 268-275. 李黎, 宋帅杰, 方小梅, 等. 高温干旱及复水对毛竹实生苗保护酶和脂质过氧化的影响[J]. 浙江农林大学学报, 2017, 34(2): 268-275. DOI:10.11833/j.issn.2095-0756.2017.02.010 |
| [23] |
LETUNIC I, COPLEY R R, SCHMIDT S, et al. SMART 4.0:Towards genomic data integration[J]. Nucl Acids Res, 2004, 32(D1): D142-D144. DOI:10.1093/nar/gkh088 |
| [24] |
PROOST S, van BEL M, STERCK L, et al. PLAZA:A comparative genomics resource to study gene and genome evolution in plants[J]. Plant Cell, 2009, 21(12): 3718-3731. DOI:10.1105/tpc.109.071506 |
| [25] |
WU L J. The selection of endogenous reference genes in Phyllostachys edulis treated with abiotic stresses for qRT-PCR analysis[D]. Hang-zhou: Zhejiang Agricultural and Forestry University, 2018: 13-35. 吴林军.非生物胁迫下毛竹qRT-PCR分析中内参基因的选择[D].杭州: 浙江农林大学, 2018: 13-35. |
| [26] |
LIVAK K J, SCHMITTGEN T. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [27] |
CHEN X, ZHOU Z H, WANG R Q, et al. Effect of low temperature stress on antioxidant ability in Ilex verticillata leaves[J]. J Trop Subtrop Bot, 2016, 24(6): 689-695. 陈茜, 周之涵, 王瑞琪, 等. 低温处理对北美冬青叶片抗氧化能力的影响[J]. 热带亚热带植物学报, 2016, 24(6): 689-695. DOI:10.11926/j.issn.1005-3395.2016.06.013 |
| [28] |
SHAFI A, GILL T, ZAHOOR I, et al. Ectopic expression of SOD and APX genes in Arabidopsis alters metabolic pools and genes related to secondary cell wall cellulose biosynthesis and improve salt tolerance[J]. Mol Biol Rep, 2019, 46(2): 1985-2002. DOI:10.1007/s11033-019-04648-3 |
| [29] |
LONG Y L, ZHU B B, XU Z J, et al. Sequence analysis of APX gene in watermelon and its expression characteristic after treated with MeJA[J]. Genom Appl Biol, 2016, 35(8): 2125-2132. 龙娅丽, 朱白婢, 徐子健, 等. 西瓜APX基因的序列分析及其茉莉酸甲酯诱导表达特性[J]. 基因组学与应用生物学, 2016, 35(8): 2125-2132. DOI:10.13417/j.gab.035.002125 |
| [30] |
SHARMA P, DUBEY R S. Modulation of nitrate reductase activity in rice seedlings under aluminium toxicity and water stress:Role of osmolytes as enzyme protectant[J]. J Plant Physiol, 2005, 162(8): 854-864. DOI:10.1016/j.jplph.2004.09.011 |
| [31] |
KOUSSEVITZKY S, SUZUKI N, HUNTINGTON S, et al. Ascorbate peroxidase 1 plays a key role in the response of Arabidopsis thaliana to stress combination[J]. J Biol Chem, 2008, 283(49): 34197-34203. DOI:10.1074/jbc.M806337200 |
| [32] |
YOSHIMURA K, YABUTA Y, ISHIKAWA T, et al. Expression of spinach ascorbate peroxidase isoenzymes in response to oxidative stresses[J]. Plant Physiol, 2000, 123(1): 223-234. DOI:10.1104/pp.123.1.223 |
 2020, Vol. 28
2020, Vol. 28



