生物入侵及其后果越来越受到人们的关注,对生物入侵机制的研究已成为生物学研究的热点领域。对于植物入侵来说,研究入侵植物对土壤养分的吸收及作用机制是揭开其入侵机理的重要方向; 而植物的氮素营养与其生长繁殖和扩散密切相关, 因此研究入侵植物与土壤氮素间的作用机理可能是揭示植物成功入侵的重要途径[1]。土壤氮循环是陆地生态系统养分循环的重要组成部分,在维持全球生态系统健康与平衡等方面起着重要作用[1-2]。生物固氮是自然系统中氮的主要来源,而有机氮需要通过氨化作用才能转换成植物易吸收的无机氮, 然后通过硝化作用氧化成硝态氮,最后经反硝化作用还原成氮氧化物[2]。许多研究表明,外来植物入侵会影响生态系统的结构、功能及氮循环过程[3-6],而在此过程中起关键作用的则是土壤微生物。土壤氮循环过程与固氮细菌、氨化细菌、硝化细菌(氨氧化细菌)和反硝化细菌密切相关[2]。另一方面,多数研究认为,外来入侵植物由于有强烈的化感抑制作用从而造成脆弱生境物种多样性下降或丧失[7-8]。“新武器假说(novel weapon hypothesis)”认为,外来植物成功入侵的一个重要原因是他们能通过分泌化感物质(alleochemicals)抑制近邻植物生长[9]。入侵过程中的微生物变化,是研究生态系统地上-地下生物学联系的重要桥梁。有研究表明入侵植物的叶片水提液对土壤氮转化效率和氨氧化细菌丰度有显著影响,且与植物种类和水提液浓度有关[10-11],但截至目前,仍缺乏对入侵植物特定化感物质影响土壤氮循环功能菌的研究。
入侵植物的化感物质多种多样,这些化感物质的作用并不相同,因此研究入侵植物的化感作用, 应具体到入侵植物某一特定的化感物质。本研究以薇甘菊(Mikania micrantha)为例,开展其化感物质对土壤氮循环及其功能菌的影响研究,以期为入侵植物在入侵过程中的化感作用提供佐证。薇甘菊是菊科(Compositae)假泽兰属(Mikania)多年生草质藤本,原产热带美洲[12],现已成为我国华南地区危害最严重的外来入侵杂草。薇甘菊是国际自然保护联盟(IUCN)公布的全球100种最具威胁的入侵生物之一,也是3种菊科入侵植物[薇甘菊、南美蟛蜞菊(Sphagneticola trilobata)和飞机草(Chromolaena odorata)]之一[13]。薇甘菊的化感作用很强,极易形成单优种群[14-15]。孙盟等[16]采用同时蒸馏-萃取法(simultaneous distillation and solvent extraction, SDE)提取薇甘菊精油, 并用气相色谱-质谱联用仪(GCMS)检测出花序、茎、叶片和叶柄中β-石竹烯的含量均较高。β-石竹烯(C15H24)是一种双环倍半萜型的天然产物,对苘麻(Abutilon theophrasti)和稗草(Echinochloa crusgalli)均有生物毒性,存在很高的化感潜力[17]。此外,王建国等[18]采用生物活性跟踪法对薇甘菊地上部分化感活性成分进行分离,从其乙醇提取物正丁醇部分分离到绿原酸,并证实其对水稻(Oryza sativa)和稗草有显著的抑制作用。绿原酸(5-O-caffeoylquinic acid, 5-CQA)是由咖啡酸和奎宁酸缩合而成的一个酯类化合物,是植物在有氧呼吸过程中产生的一种苯丙素类化合物,具有多种生物活性[19]。
薇甘菊生长快速,有“一分钟一英里”之称[12], 因而需要大量的养分供给。薇甘菊入侵显著提高了土壤的硝化速率[10, 20-21],加速了土壤有机氮的矿化过程[7, 22-24]。但是,薇甘菊通过化感物质对氮循环过程及其氮循环功能菌的影响尚不清楚,这在很大程度上制约了我们对外来植物入侵机制的深刻理解[25-27]。因此,本研究通过外源添加已报道的薇甘菊2种化感物质绿原酸和β-石竹烯,测定土壤氮循环相关指标和菌群密度变化,试图阐明薇甘菊化感物质对养分循环的影响程度和方向,为薇甘菊的快速生长和对氮素的快速吸收提供理论依据。
1 材料和方法 1.1 土样采集试验所用土壤取自广东省广州市钟落潭镇(23º24ʹ28.53ʹʹ N,113º25ʹ11.03ʹʹ E),当地属亚热带海洋气候,年均降水量1 820 mm,年均温23.1℃,年均日照时数1 874 h。采样时,选取薇甘菊单优种群,在根部附近采集根际土壤样本;在薇甘菊单优种群临近位置,选取无薇甘菊生长的区域采集土壤,作为未入侵土壤样本或近邻土壤。在总共约8 000 m2的研究区内选取3块样地取样,每块样地面积为3 m× 3 m,且样地之间的距离 > 5 m。在取样前先去除土壤表面的植物和凋落物,在每块样地内采用对角线五点取样法取0~10 cm表层土组成1个混合土样。所有操作均使用无菌工具进行。
1.2 试验处理和培养方法取过2.0 mm土筛的薇甘菊未入侵土壤鲜土作为培养基质,分为5组,每组设置16个重复,共80份土样。将土样分别装入经高温、高压灭菌的干净透明的玻璃组培瓶(直径6 cm、高9 cm)中,每瓶分别装入100 g鲜土。5组的变量分别为外源添加无菌水、10和100 mg/L绿原酸溶液、25和100 mg/L β-石竹烯溶液。绿原酸和β-石竹烯浓度设置分别依据王建国等[18]和王瑞龙等[28]的试验结果。然后将组培瓶置于培养箱中,于黑暗条件(25℃、60%湿度)下培养44 d,并且每隔11 d补充1次相应的化感物质或无菌水。同时在每隔11 d补充添加液之前每组先随机选择4瓶取样,测定土壤全氮、铵态氮和硝态氮含量。最后在试验结束时也就是第44天时, 测定土壤微生物(细菌、真菌、自生固氮菌、氨化细菌、氨氧化细菌和硝酸化细菌和反硝化细菌)的菌群密度。
1.3 土壤氮素指标的测定含水率采用烘干法测定;pH值用pH计[T3100, 奥豪斯仪器仪器(常州)有限公司]测定[29]。有机质含量采用重铬酸钾外热氧化滴定法[5 mL浓硫酸, 5 mL 0.8 mol/L(1/6)重铬酸钾]测定(GB 7857-87)。全氮采用凯氏定氮法(3 mL浓硫酸+1.1 g催化剂酸解)测定(GB 7173-87)。铵态氮采用靛酚蓝比色法测定;硝态氮采用镉还原比色法测定[30]。
1.4 土壤微生物数量的测定取5 g鲜土加45 mL灭菌水制成土壤悬浊液。然后取适当稀释度的土样悬浊液涂布于培养基上, 采用平板计数法统计并计算土壤中各类菌群的密度。细菌培养采用牛肉膏蛋白胨培养基;真菌培养采用海博生物公司生产的改良马丁琼脂培养基,并加1%孟加拉红溶液和1%链霉素(抑制细菌和霉菌生长);自生固氮菌培养采用海博生物公司生产的无氮培养基;氨化细菌培养基、氨氧化细菌培养基和硝酸化细菌培养基根据林先贵等[31]的方法配制。
1.5 统计分析数据采用SPSS 19.0进行统计分析。对薇甘菊单优种群土壤及其近邻未入侵的土壤氮素指标进行两个独立样本t检验(P < 0.05)。对化感物质添加试验进行单因素方差分析,控制变量为外源添加物(无菌水、10和100 mg/L绿原酸溶液、25和100 mg/L β-石竹烯溶液),观察变量分别为全氮、铵态氮和硝态氮和各菌群密度(细菌、真菌、自生固氮菌、氨氧化细菌和硝酸化细菌)。然后采用Duncan-test进行多重比较和显著性检验(P < 0.05)。采用Origin 8.5软件作图。
2 结果和分析 2.1 土壤的氮素含量与未入侵的近邻土壤相比,薇甘菊单优种群土壤的pH值和铵态氮显著增加,其中铵态氮含量增加了约50%;全氮和硝态氮显著降低,其中硝态氮含量下降了约70% (表 1)。
| 表 1 薇甘菊种群土壤及其近邻未入侵土壤的氮素含量 Table 1 Soil nitrogen contents between Mikania micrantha monoculture and its neighboring area |
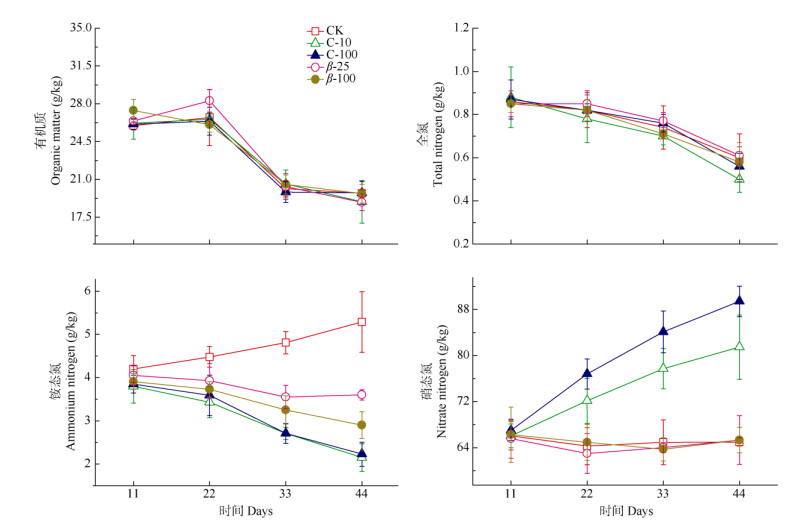
各处理的土壤有机质和全氮含量均呈逐渐下降的趋势(图 1),且处理间没有显著差异,说明外源绿原酸和β-石竹烯对土壤有机质和全氮含量没有明显的影响。对照土壤的铵态氮含量总体上呈逐渐上升的趋势。第11天各处理的铵态氮含量没有显著差异。但随培养时间的延长,与对照相比,各处理的铵态氮含量均逐渐降低。与添加β-石竹烯相比,添加绿原酸的土壤铵态氮含量降低幅度更大。对照土壤的硝态氮含量在培养期间保持稳定,添加绿原酸处理使土壤硝态氮含量显著上升,且高浓度绿原酸的促进作用更强。添加β-石竹烯对土壤硝态氮含量没有显著影响。
|
图 1 外源添加绿原酸和β-石竹烯对土壤化学指标的影响。CK:对照; C-10: 10 mg/L绿原酸; C-100: 100 mg/L绿原酸; β-25: 25 mg/L β-石竹烯; β-100: 100 mg/L β-石竹烯。下图同。 Fig. 1 Effects of chlorogenic acid and β-caryophyllene exogenous addition on soil chemical indexes. CK: Control; C-10: 10 mg/L chlorogenic acid; C-100: 100 mg/L chlorogenic acid; β-25: 25 mg/L β-caryophyllene; β-100: 100 mg/L β-caryophyllene. The same is following Figures. |
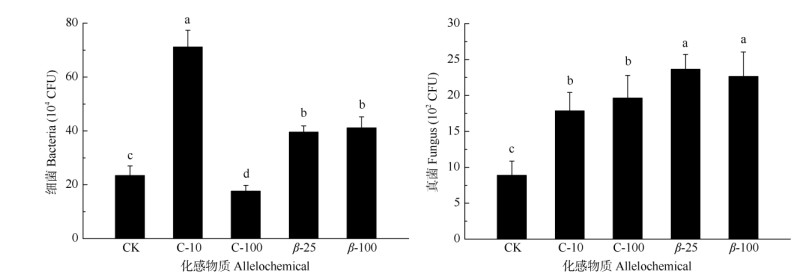
添加化感物质绿原酸和β-石竹烯后,土壤微生物菌群密度发生显著变化(图 2)。与对照相比,添加10 mg/L绿原酸后,土壤细菌菌群密度显著增加,但添加100 mg/L绿原酸的反而显著下降。添加β-石竹烯的土壤细菌菌群密度均显著增加,但增幅小于添加10 mg/L绿原酸的。添加绿原酸和β-石竹烯的土壤真菌菌群密度均显著增加,其中β-石竹烯对真菌的促进作用更大,但相同化感物质不同浓度间无显著差异。
|
图 2 外源添加绿原酸和β-石竹烯对土壤细菌和真菌菌群密度的影响。柱子上不同字母表示差异显著(Duncan-test, P < 0.05)。下图同。 Fig. 2 Effects of chlorogenic acid and β-caryophyllen addition on soil bacterial and fungus population density. Different letters above the bar indicate significant differences at 0.05 level by Duncan-test. The same is following Figure. |
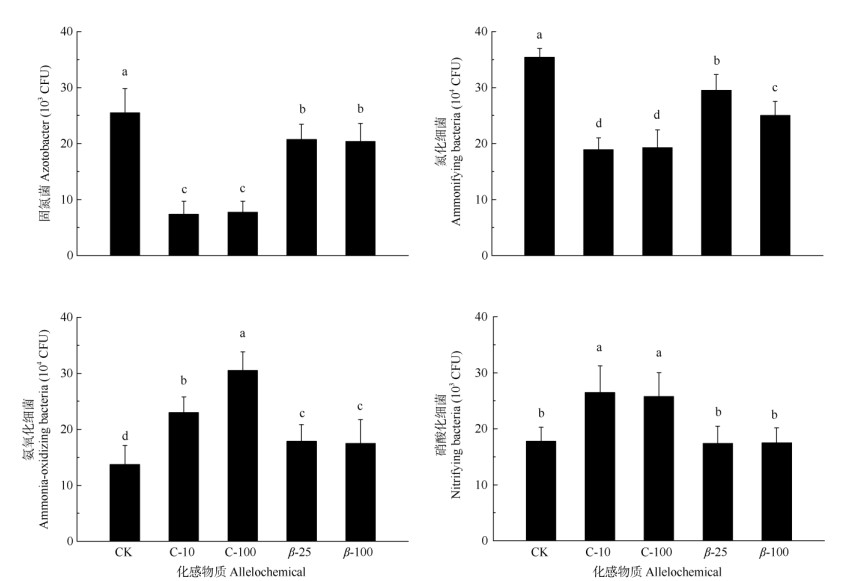
添加绿原酸和β-石竹烯均显著降低了土壤中自生固氮菌和氨化细菌的数量,且绿原酸的抑制作用较强(图 3);添加绿原酸和β-石竹烯均显著促进了土壤中氨氧化细菌的数量,且绿原酸的促进作用更强;添加绿原酸后土壤中硝酸化细菌数量显著增加,但β-石竹烯处理的硝酸化细菌数量与对照没有显著差异。
|
图 3 外源绿原酸和β-石竹烯对土壤氮循环功能菌菌群密度的影响 Fig. 3 Effects of chlorogenic acid and β-caryophyllene exogenous addition on soil nitrogen cycling functional bacteria population density |
野外试验表明,与未入侵的近邻土壤相比,薇甘菊单优种群土壤全氮和硝态氮含量显著下降,铵态氮含量显著增加,这与李钧敏等[24]对薇甘菊的研究结果类似。这说明薇甘菊入侵后加速了土壤有机氮的矿化过程,有较多的有机氮转化为铵态氮,可能是由于薇甘菊入侵地的氨化作用强度显著高于裸地[32]。硝态氮减少的原因较为复杂,可能是由于野外条件下土壤通气状况较差,硝化作用较弱。但其主要原因可能是薇甘菊对硝态氮的吸收高于铵态氮[33]。此外,有研究表明,薇甘菊入侵土壤的pH较高[24, 34-35],这与本研究结果相符。由于薇甘菊的生长提高了土壤pH值,这将对土壤微生物群落的种类和数量产生影响[36-41],pH值的提高会显著增加土壤中细菌和真菌数量[42]。但土壤微生物的丰富度与土壤pH值间的关系需要综合考虑很多其他的环境因素,如土壤水分、养分有效性以及植被类型等[43]。
单独添加薇甘菊2种化感物质后,土壤两种形态的有效氮含量表现出相反的变化趋势。其中,添加绿原酸后铵态氮含量显著降低,硝态氮含量显著增加。这进一步证明了薇甘菊分泌化感物质可促进铵态氮转化为硝态氮,以硝态氮作为薇甘菊的主要氮源。此外,土壤中铵态氮主要来源于固氮菌固定空气中的氮和氨化细菌对有机氮的矿化[2]。本研究中, 添加绿原酸后,固氮菌和氨化细菌菌群密度下降, 这可能是铵态氮减少的主要原因。许华等[44]对南美蟛蜞菊和薇甘菊复合群落土壤的研究也表明, 被入侵的土壤固氮菌数量显著减少。另一方面,由于硝态氮的主要来源是氨氧化细菌和硝酸化细菌分两个阶段将铵态氮氧化为硝态氮[2]。本研究中绿原酸(10 mg/L)显著促进了细菌的繁殖,特别是氨氧化细菌和硝酸化细菌的繁殖,从而加速了硝化作用过程,产生了较多的硝态氮。Hawkes等[41]研究指出,燕麦(Avena barbata)和雀麦(Bromus hordeaceous)入侵也使土壤中氨氧化细菌数量增加。β-石竹烯的添加效果与绿原酸有所不同,与对照相比,土壤铵态氮含量显著下降,但硝态氮含量无显著变化。这主要是由于添加β-石竹烯后氨氧化细菌显著增加, 促进了铵态氮氧化为亚硝态氮。但是硝酸化细菌数量没有显著变化,从而限制了将亚硝态氮进一步氧化成硝态氮。
薇甘菊的2种化感物质(绿原酸和β-石竹烯)均对自生固氮菌和氨化细菌的繁殖表现为抑制作用, 这与Rice[45]报道绿原酸能够抑制固氮菌的生长相似,也与近期的研究报道绿原酸和β-石竹烯具抑菌作用相同[46-48]。但是,McCarty等[49]还报道绿原酸对硝化作用没有显著影响,这与本研究中绿原酸对硝化作用中2种主要细菌(氨氧化细菌和硝酸化细菌)有促进作用的结果不同。此外,本研究中β-石竹烯对氨氧化细菌有促进作用,也与β-石竹烯具抑菌作用[48]的报道不同。通常不同的土壤具有不同的土壤微生物群落[50],本研究与前人的研究结果不同,土壤条件的不同可能是原因之一。而且不同的化感物质对不同的氮循环功能菌影响不一,从而影响了不同形态的有效氮的生成和氮循环过程。但是有关氮循环功能菌对化感物质的响应机制尚需进一步深入研究。
微生物是植物入侵改变土壤养分的桥梁[51],土壤微生物菌群密度对植物生长具有重要影响。李伟华等[35]研究了薇甘菊入侵对土壤基础呼吸的影响, 证明薇甘菊入侵提高了土壤的微生物活性。同样杨琼等[52]通过磷脂脂肪酸法(phospholipid fatty acid, PLFA)测定土壤微生物数量,与裸地相比,薇甘菊根际土壤中细菌和真菌数量显著增多。这与本研究中除了高浓度的绿原酸外的两种化感物质均增加了土壤细菌和真菌密度的结果相一致。由此可见, 绿原酸和β-石竹烯的添加可能促进了菌群密度的增加,这有利于释放更多的有效养分,从而为薇甘菊的快速生长提供了物质基础。但是微生物对化感物质的响应机制也还有待于进一步探索。
| [1] |
CHEN B M, WEI H J, CHEN W B, et al. Effects of plant invasion on soil nitrogen transformation processes and it's associated microbial[J]. Chin J Plant Ecol, 2019, 42(11): 1071-1081. 陈宝明, 韦慧杰, 陈伟彬, 等. 外来入侵植物对土壤氮转化主要过程及相关微生物的影响[J]. 植物生态学报, 2019, 42(11): 1071-1081. DOI:10.17521/cjpe.2018.0138 |
| [2] |
KUYPERS M M M, MARCHANT H K, KARTAL B. The microbial nitrogen-cycling network[J]. Nat Rev Microbiol, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [3] |
BOUDIAF I, BAUDOIN E, SANGUIN H, et al. The exotic legume tree species, Acacia mearnsii, alters microbial soil functionalities and the early development of a native tree species, Quercus suber, in North Africa[J]. Soil Biol Biochem, 2013, 65: 172-179. DOI:10.1016/j.soilbio.2013.05.003 |
| [4] |
SOUZA-ALONSO P, GUISANDE-COLLAZO A, GONZÁLEZ L. Gradualism in Acacia dealbata Link invasion:Impact on soil chemistry and microbial community over a chronological sequence[J]. Soil Biol Biochem, 2015, 80: 315-323. DOI:10.1016/j.soilbio.2014.10.022 |
| [5] |
JO I, FRIDLEY J D, FRANK D A, et al. Invasive plants accelerate nitrogen cycling:evidence from experimental woody monocultures[J]. J Ecol, 2017, 105(4): 1105-1110. DOI:10.1111/1365-2745.12732 |
| [6] |
ZHAO M X, LU X F, ZHAO H X, et al. Ageratina adenophora invasions are associated with microbially mediated differences in biogeochemical cycles[J]. Sci Total Environ, 2019, 677: 47-56. DOI:10.1016/j.scitotenv.2019.04.330 |
| [7] |
LIU X W, ZHOU Y L, QI C M, et al. Effects of Mikania micrantha invasion on soil nutrient contents and enzyme activities[J]. Ecol Environ Sci, 2013, 21(12): 1960-1965. 刘小文, 周益林, 齐成媚, 等. 入侵植物薇甘菊对土壤养分和酶活性的影响[J]. 生态环境学报, 2013, 21(12): 1960-1965. DOI:10.3969/j.issn.1674-5906.2012.12.009 |
| [8] |
CALLAWAY R M, CIPOLLINI D, BARTO K, et al. Novel weapons:Invasive plant suppresses fungal mutualists in America but not in its native Europe[J]. Ecology, 2008, 89(4): 1043-1055. DOI:10.1890/07-0370.1 |
| [9] |
CALLAWAY R M, RIDENOUR W M. Novel weapons:Invasive success and the evolution of increased competitive ability[J]. Front Ecol Environ, 2004, 2(8): 436-443. DOI:10.1890/1540-9295(2004)002[0436:NWISAT]2.0.CO;2 |
| [10] |
CHEN B M, PENG S L, NI G Y. Effects of the invasive plant Mikania micrantha H. B. K. on soil nitrogen availability through allelopathy in south China[J]. Biol Invasions, 2009, 11(6): 1291-1299. DOI:10.1007/s10530-008-9336-9 |
| [11] |
CHEN W B, CHEN B M, LIAO H X, et al. Leaf leachates have the potential to influence soil nitrification via changes in ammonia-oxidizing archaea and bacteria populations[J/OL]. Eur J Soil Sci, 2019.[2019-05-17] doi: 10.1111/ejss.12844.
|
| [12] |
DAY M D, CLEMENTS D R, GILE C, et al. Biology and impacts of Pacific islands invasive species:13. Mikania micrantha Kunth (Asteraceae)[J]. Pac Sci, 2016, 70(3): 257-285. DOI:10.2984/70.3.1 |
| [13] |
LOWE S, BROWNE M, BOUDJELAS S, et al. 100 of the World's Worst Invasive Alien Species, a Selection from the Global Invasive Species Database[M]. Auckland: Invasive Species Specialist Group, 2000.
|
| [14] |
HAN D D, WANG L Y, LUO Y P. Isolation, identification, and the growth promoting effects of two antagonistic actinomycete strains from the rhizosphere of Mikania micrantha Kunth[J]. Microbiol Res, 2018, 208: 1-11. DOI:10.1016/j.micres.2018.01.003 |
| [15] |
BANERJEE A K, MUKHERJEE A, DEWANJI A. Potential distri-bution of Mikania micrantha Kunth in India:Evidence of climatic niche and biome shifts[J]. Flora, 2017, 234: 215-223. DOI:10.1016/j.flora.2017.08.001 |
| [16] |
SUN M, ZE S Z, WU Y L, et al. GC-MS analysis of essential oil from different organs of Mikania micrantha[J]. Guangdong Agric Sci, 2013, 40(19): 111-115. 孙盟, 泽桑梓, 吴艳蕊, 等. GC-MS测定薇甘菊不同器官精油成分[J]. 广东农业科学, 2013, 40(19): 111-115. DOI:10.3969/j.issn.1004-874X.2013.19.039 |
| [17] |
ZHANG X F. Preliminary isolation and identification of potential allelochemicals from Trifolium repens L.[M]. Taian: Shandong Agri-cultural University, 2011: 45-48.
|
| [18] |
WANG J G, LI Y J, DAI Z D, et al. Isolation and identification of allelochemicals from Mikania micrantha[J]. J Henan Agric Sci, 2013, 42(11): 102-105. 王建国, 李拥军, 戴展都, 等. 薇甘菊化感物质的分离与鉴定[J]. 河南农业科学, 2013, 42(11): 102-105. DOI:10.3969/j.issn.1004-3268.2013.11.024 |
| [19] |
ZHU P, MIAO X L, CHEN Y. Degradation kinetics of chlorogenic acid, cryptochlorogenic acid, and neochlorogenic acid at neutral and alkaline pH values[J]. Acta Pharm Sin, 2016, 51(1): 122-126. 朱鹏, 苗潇磊, 陈勇. 绿原酸、隐绿原酸和新绿原酸在中性和碱性pH条件下的降解动力学[J]. 药学学报, 2016, 51(1): 122-126. |
| [20] |
CHEN B M, PENG S P. Effect of allelopathy of Mikania micrantha on N cycle of invasive system[C]//Academic Seminar of Guangdong Botanical Society. Guangzhou: Guangdong Society of Plant, 2010: 51-52. 陈宝明, 彭少麟.薇甘菊化感作用对入侵系统N循环的影响作用[C]//广东省植物学会学术研讨会.广州: 广东省植物学会, 2010: 51-52. |
| [21] |
HU W F, ZHANG L H, WAN S A, et al. Effects of Spartina alter-niflora invasion on sediment nitrification in a Cyperus malaccensis marsh of the Min River Estuary[J]. J Subtrop Resour Environ, 2017, 12(3): 19-26. 胡伟芳, 张林海, 万斯昂, 等. 互花米草入侵闽江河口短叶茳芏湿地对沉积物硝化速率的影响[J]. 亚热带资源与环境学报, 2017, 12(3): 19-26. DOI:10.3969/j.issn.1673-7105.2017.03.004 |
| [22] |
LI W H, ZHANG C B, JIANG H B, et al. Changes in soil microbial community associated with invasion of the exotic weed, Mikania micrantha H. B. K.[J]. Plant Soil, 2006, 281(1/2): 309-324. DOI:10.1007/s11104-005-9641-3 |
| [23] |
LI W H, ZHANG C B, GAO G J, et al. Relationship between Mikania micrantha invasion and soil microbial biomass, respiration and functional diversity[J]. Plant Soil, 2007, 296(1/2): 197-207. DOI:10.1007/s11104-007-9310-9 |
| [24] |
LI J M, ZHON Z C, DONG M. Change of soil microbial biomass and enzyme activities in the community invaded by Mikania micrantha, due to Cuscuta campestris parasitizing the invader[J]. Acta Ecol Sin, 2008, 28(2): 868-876. 李钧敏, 钟章成, 董鸣. 田野菟丝子(Cuscuta campestris)寄生对薇甘菊(Mikania micrantha)入侵群落土壤微生物生物量和酶活性的影响[J]. 生态学报, 2008, 28(2): 868-876. DOI:10.3321/j.issn:1000-0933.2008.02.052 |
| [25] |
ESKELINEN A, HARRISON S. Exotic plant invasions under enhanced rainfall are constrained by soil nutrients and competition[J]. Ecology, 2014, 95(3): 682-692. DOI:10.1890/13-0288.1 |
| [26] |
PORAZINSKA D L, FUJISAKI I, PURCELL M F, et al. Plant invasions from a belowground nematocentric perspective[J]. Soil Biol Biochem, 2014, 77: 213-220. DOI:10.1016/j.soilbio.2014.06.004 |
| [27] |
SARDANS J, BARTRONS M, MARGALEF O, et al. Plant invasion is associated with higher plant-soil nutrient concentrations in nutrient-poor environments[J]. Glob Change Biol, 2017, 23(3): 1282-1291. DOI:10.1111/gcb.13384 |
| [28] |
WANG R L, YANG X Y, SONG Y Y, et al. Allelopathic potential of Tephrosia vogelii Hook. f.:Laboratory and field evaluation[J]. Allelo-pathy J, 2011, 28(1): 53-62. |
| [29] |
LIU G S. Soil Physical and Chemical Analysis & Description of Soil Profiles[M]. Beijing: Standards Press of China, 1996: 24. 刘光崧. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996: 24. |
| [30] |
ZHANG Y. Tutorial for Physical and Chemical Analysis of Soil, Water and Plants[M]. Beijing: China Forestry Press, 2011: 61-64. 张韫. 土壤·水·植物理化分析教程[M]. 北京: 中国林业出版社, 2011: 61-64. |
| [31] |
LIN X G. Principles and Methods of Soil Microbiology Research[M]. Beijing: Higher Education Press, 2010: 369-370. 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010: 369-370. |
| [32] |
CHEN L. Invasion mechanism of three invasive plants of Compositae and preliminary study on biological control of Alternanthera philo-xeroides[D]. Fujian: Fujian Normal University, 2011: 19-21. 陈亮. 3种菊科入侵植物的入侵机制及空心莲子草生物防治的初步研究[D].福建: 福建师范大学, 2011: 19-21. |
| [33] |
CHEN W B, CHEN B M. Considering the preferences for nitrogen forms by invasive plants:A case study from a hydroponic culture experiment[J]. Weed Res, 2019, 59(1): 49-57. DOI:10.1111/wre.12344 |
| [34] |
WU S T. Effects of Mikania micrantha on plant community and physical-chemical properties of soil[J]. Hubei Agric Sci, 2011, 50(18): 3711-3713. 吴双桃. 薇甘菊对入侵地植物群落及土壤理化性质的影响[J]. 湖北农业科学, 2011, 50(18): 3711-3713. DOI:10.3969/j.issn.0439-8114.2011.18.012 |
| [35] |
LI W H, HAN R H, GAO G J. Effects of Mikania micrantha invasion on soil microbial biomass and soil respiration[J]. J S China Norm Univ (Nat Sci), 2008(3): 95-102. 李伟华, 韩瑞宏, 高桂娟. 薇甘菊入侵对土壤微生物生物量和土壤呼吸的影响[J]. 华南师范大学学报(自然科学版), 2008(3): 95-102. |
| [36] |
FIERER N, JACKSON R B. The diversity and biogeography of soil bacterial communities[J]. Proc Natl Acad Sci USA, 2006, 103(3): 626-631. DOI:10.1073/pnas.0507535103 |
| [37] |
HARTMAN W H, RICHARDSON C J, VIGALYS R, et al. Environ-mental and anthropogenic controls over bacterial communities in wet-land soils[J]. Proc Natl Acad Sci USA, 2008, 105(46): 17842-17847. DOI:10.1073/pnas.0808254105 |
| [38] |
LAUBER C L, HAMADY M, KNIGHT R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Appl Environ Microb, 2009, 75(15): 5111-5120. DOI:10.1128/AEM.00335-09 |
| [39] |
HAN C C, YANG Y, LIU B R, et al. Influencing factors of soil microbial diversity in grassland[J]. Pratacult Sci, 2014, 31(12): 2242-2250. 韩丛丛, 杨阳, 刘秉儒, 等. 草地土壤微生物多样性影响因子[J]. 草业科学, 2014, 31(12): 2242-2250. DOI:10.11829/j.issn.1001-0629.2013-0680 |
| [40] |
KOURTEV P S, EHRENFELD J G, HÄGGBLOM M. Experimental analysis of the effect of exotic and native plant species on the structure and function of soil microbial communities[J]. Soil Biol Biochem, 2003, 35(7): 895-905. DOI:10.1016/S0038-0717(03)00120-2 |
| [41] |
HAWKES C V, WREN I F, HERMAN D J, et al. Plant invasion alters nitrogen cycling by modifying the soil nitrifying community[J]. Ecol Lett, 2005, 8(9): 976-985. DOI:10.1111/j.1461-0248.2005.00802.x |
| [42] |
WANG Y K, HONG K. Effects of soil factors on microbe distributions in mangrove soil[J]. Chin J Trop Crop, 2005, 26(3): 109-114. 王岳坤, 洪葵. 红树林土壤因子对土壤微生物数量的影响[J]. 热带作物学报, 2005, 26(3): 109-114. DOI:10.3969/j.issn.1000-2561.2005.03.022 |
| [43] |
ROUSK J, BÅÅTH E, BROOKES P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. ISME J, 2010, 4(10): 1340-1351. DOI:10.1038/ismej.2010.58 |
| [44] |
XU H, DENG X Y, CHENG B J. Effect of Wedelia trilobata and Mikania micrantha compound community on soil chemical and biolo-gical characteristics[J]. Hubei Agric Sci, 2015, 54(16): 3932-3935. 许华, 邓晓勇, 程碧军. 三裂叶蟛蜞菊和薇甘菊复合群落对土壤化学和生物学特征的影响[J]. 湖北农业科学, 2015, 54(16): 3932-3935. DOI:10.14088/j.cnki.issn0439-8114.2015.16.025 |
| [45] |
RICE E L. Inhibition of nitrogen-fixing and nitrifying bacteria by seed plants:Ⅳ. The inhibitors produced by Ambrosia elatior and A. psilo-stachya[J]. SW Nat, 1965, 10(4): 248-255. DOI:10.2307/3669300 |
| [46] |
WANG S K, XU Y L, PAN M, et al. Research on the extraction of chlorogenic acid from sweet potato leaf and its antibacterial efficiency[J]. J Anhui Agric Sci, 2010, 38(11): 5862-5863, 5876. 王世宽, 许艳丽, 潘明, 等. 甘薯叶中绿原酸的提取及抑菌作用的研究[J]. 安徽农业科学, 2010, 38(11): 5862-5863, 5876. |
| [47] |
LI R G, CAO D. Extraction and bacteriostasis of chlorogenic acid from sweet potato[J]. Jiangsu Agric Sci, 2012, 40(4): 266-268. 李瑞国, 曹岱. 甘薯绿原酸的提取及抑菌作用[J]. 江苏农业科学, 2012, 40(4): 266-268. DOI:10.3969/j.issn.1002-1302.2012.04.099 |
| [48] |
HUANG M S, SANCHAZ-MOREIRAS A M, ABEL C, et al. The major volatile organic compound emitted from Arabidopsis thaliana flowers, the sesquiterpene (E)-β-caryophyllene, is a defense against a bacterial pathogen[J]. New Phytol, 2012, 193(4): 997-1008. DOI:10.1111/j.1469-8137.2011.04001.x |
| [49] |
McCARTY G W, BREMNER J M. Effects of phenolic compounds on nitrification in soil1[J]. Soil Sci Soc Amer J, 1986, 50(4): 920-923. DOI:10.2136/sssaj1986.03615995005000040018x |
| [50] |
ZHOU J, LEI T. Review and prospects on methodology and affecting factors of soil microbial diversity[J]. Biodiv Sci, 2007, 15(3): 306-311. 周桔, 雷霆. 土壤微生物多样性影响因素及研究方法的现状与展望[J]. 生物多样性, 2007, 15(3): 306-311. DOI:10.3321/j.issn:1005-0094.2007.03.012 |
| [51] |
YU X J, YU D, LU Z J, et al. A possible plant invasion mechanism:Invasive species affect the growth of native species by altering the soil microbial community in the invading site[J]. Chin Sci Bull, 2005, 50(9): 896-903. 于兴军, 于丹, 卢志军, 等. 一个可能的植物入侵机制:入侵种通过改变入侵地土壤微生物群落影响本地种的生长[J]. 科学通报, 2005, 50(9): 896-903. DOI:10.3321/j.issn:0023-074X.2005.09.011 |
| [52] |
YANG Q, LIANG Y, YANG J, et al. Soil microbial characteristics in the rhizosphere of exotic invasive Mikania micrantha[J]. Ecol Sci, 2015, 34(2): 148-155. 杨琼, 梁羽, 杨剑, 等. 入侵植物薇甘菊的根际土壤微生物特征[J]. 生态科学, 2015, 34(2): 148-155. DOI:10.3969/j.issn.1008-8873.2015.02.022 |
 2020, Vol. 28
2020, Vol. 28


