植物不同于动物,只能固着生长,常会暴露于各种各样的胁迫环境中,如高温等。面对高温胁迫, 植物进化出抵抗高温胁迫的复杂应答机制[1],其中植物获得耐热性是一种应对高温胁迫的重要机制, 即植物经历亚致死温度下的热适应,耐热性提高, 可以承受更严重的热胁迫[1-2]。获得耐热性使植物能够成功地应对更高温度胁迫[3]。
植物获得耐热性与热激蛋白(heat shock protein, HSPs)和热激转录因子(heat stress transcription factor, HSFs)的表达调控有关。HSPs根据分子量大小可分为5类:HSP100、HSP90、HSP70、HSP60和小分子热激蛋白(sHSPs)[4]。其中HSP101具有ATPase活性,属于HSP100家族的AAA+伴侣蛋白[5]。而HSP101基因的突变株hot1是利用正向遗传学方法发现的第一个热敏感突变体[3]。HSP70是细胞中最庞大的分子伴侣家族,在发生热胁迫时,HSP70具有防止蛋白变性并帮助已经变性的蛋白恢复活性的功能[6-7],并且参与热胁迫过程的反馈调节[8]。HSP70功能的有效性需要许多辅助分子伴侣协助, 其中HOP (HSP organizing protein)和Fes1就是典型的HSP70辅助分子伴侣,HOP作为真核生物中高度保守的单体蛋白,起到链接HSP70和HSP90的作用[9],并且是HSP90-受体蛋白复合物组装时所必需的辅助因子[10],拟南芥(Arabidopsis thaliana) hop1-2-3三突变体呈现热敏感表型[11]。Fes1A作为HSP70的另一辅助分子伴侣,是HSP70的核苷酸交换因子,敲除FES1A后的突变体获得耐热性明显下降[12]。HSFs作为热激转录抑制因子,调控热诱导基因的表达[13]。其中HSFA7A与热适应有关。此外,与自由基清除有关的apx2 (ascorbate peroxidase 2)突变体也具有明显的热敏感表型[1]。
虽然目前已经报道了许多拟南芥热敏感突变体,由于试验条件不一致,还缺少热敏感突变体的横向比较数据,不清楚各耐热相关基因对植物获得耐热性的具体贡献如何。因此,本研究对拟南芥6个热敏感突变体hsp70-15、apx2、hop1-2-3、hsfa7a、fes1a和hot1的获得耐热性进行系统的比较分析, 探讨这几种基因对植物耐热性的贡献,为植物的获得耐热性研究提供科学数据。
1 材料和方法 1.1 材料试验所用拟南芥(Arabidopsis thaliana)热敏感突变体分别为hsp70-15 (AT1G79920)、apx2 (AT3G09640)、hop1 (AT1G12270)、hop2 (AT1G62740)、hop3 (AT4G12400)、hsfa7a (AT3G51910)、fes1a (AT3G09350)、hot1 (AT1G74310),对应的T-DNA突变体分别是Cs_846012、Salk_067939、Cs_440234、Salk_ 001113C、Salk_023494、Salk_080138C、Cs_842189和Salk_066374。这些T-DNA插入突变体种子由美国俄亥俄州立大学拟南芥生物资源中心(Arabidopsis Biological Resource Center, ABRC)购得。
1.2 方法拟南芥植株的培育 拟南芥种子用70%乙醇和现配置的1% NaClO溶液进行灭菌消毒,用灭菌的去离子水清洗种子4~5次后,置于4℃春化3~ 5 d,置于培养皿在光照培养箱中培养,用Parafilm膜封口,光/暗时间为16 h/8 h,昼夜温度为22℃/ 18℃; 光照强度为30 μmol/(m2·s);相对湿度为70%~80%, 10 d左右将幼苗移至育苗基质中培养。
突变体鉴定 取拟南芥莲座叶,采用CTAB小量法[14]提取基因组DNA,并以基因组DNA为模板, 采用双引物法进行PCR鉴定, 所用PCR引物序列见表 1。
| 表 1 PCR扩增所用的引物 Table 1 Primers used for PCR |
拟南芥幼苗的耐热性分析 幼苗在光照下于38℃预处理2 h,然后在45℃下处理1~3 h。处理后的幼苗重新放入光照培养箱中继续培养7 d后, 观察表型并拍照。每种突变体均重复试验3次。
2 结果和分析 2.1 突变体纯合株系的获得首先,利用结合在T-DNA上的特异性引物LB3 (SAIL类型的突变体)或LBb1.3 (SALK类型的突变体)和热敏感突变体所对应基因的特异性引物RP为第一轮引物,对T-DNA进行扩增(图 1: 1, 3)。然后,利用位于T-DNA插入位点两侧的LP和RP为第二轮引物对目的基因进行扩增(图 1: 2, 4)。对扩增的T-DNA分别进行电泳验证,结果表明,T-DNA分别插在对应基因的外显子上(图 2)。
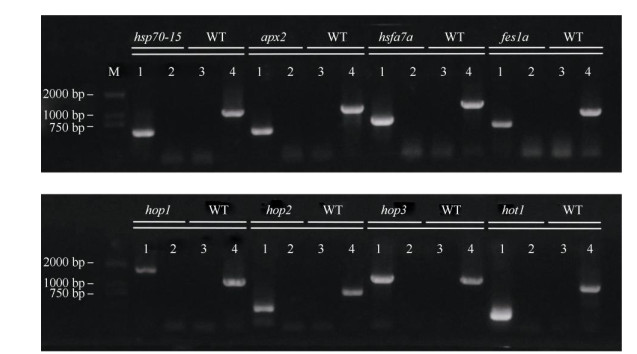
|
图 1 突变体的PCR鉴定。M: D2000 DNA标记; 1, 3: RP+LBb1.3/LB3引物; 2, 4: RP+LP引物。 Fig. 1 PCR identification of mutants. M: D2000 DNA Marker; 1, 3: RP+LBb1.3/LB3 primers; 2, 4: RP+LP primers. |
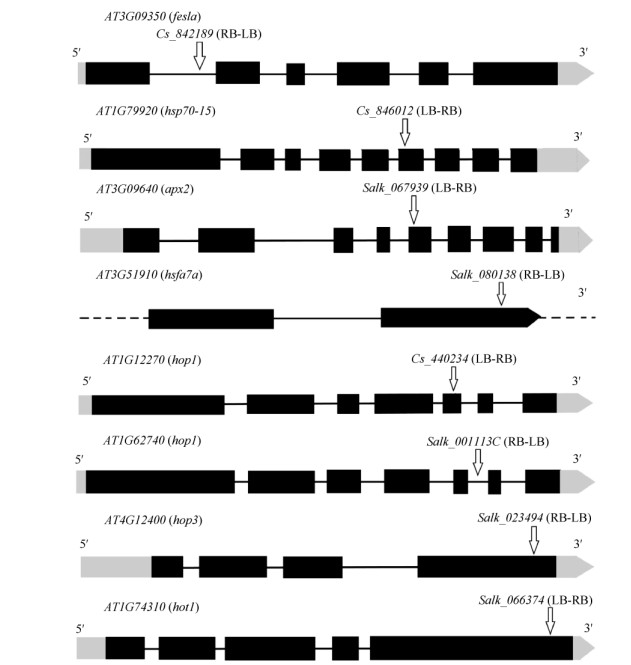
|
图 2 T-DNA在突变基因中的位置 Fig. 2 Locations of T-DNAs in mutated genes |
为了验证6个拟南芥突变体hsp70-15、apx2、hop1-2-3、hsfa7a、fes1a和hot1之间的热敏感差异, 对其进行获得耐热性表型分析。在热处理前,野生型WT和6个突变体株系均发育正常(图 3: A), 但经过38℃热适应2 h后在高温45℃处理90 min, 继续培养7 d,hot1株系逐渐白化死亡(图 3: B), 而其他株系仍正常生长,说明hot1热敏感性最高。45℃高温处理105 min后,不但hot1株系白化死亡,fes1a株系也出现大量白化死亡,表明fes1a的热敏感性低于hot1,但高于其他4个突变体(图 3: C)。

|
图 3 不同热敏感突变体的热敏感表型比较 Fig. 3 Phenotypic comparison of thermosensitive mutants |
对突变体hsp70-15、apx2、hsfa7a和fes1a继续进行高温胁迫,以WT为对照。当胁迫2 h后, fes1a幼苗全部白化死亡,apx2与hsfa7a出现轻度的损伤,两者的热损伤均比hsp70-15严重;hsp70-15与WT均没有出现明显的损伤现象(图 3: D)。当高温胁迫2.5 h后,apx2与hsfa7a株系均出现大量的白化死亡且损伤程度大致相同,他们的热损伤均比hsp70-15严重,但hsp70-15的热损伤程度大于WT (图 3: E)。由此可见,apx2与hsfa7a的热敏感性低于fes1a,但是高于hsp70-15。
对突变体hsp70-15、apx2、hsfa7a、hop1-2-3和WT进行高温胁迫处理135 min后,hop1-2-3的损伤程度与apx2和hsfa7a几乎相同,因此,apx2、hsfa7a和hop1-2-3的热敏感性基本相同。
2.3 6个热敏感突变体根的获得耐热性比较为了进一步证实突变体热敏感表型的准确性, 以hot1为参照,将6个热敏感突变体和野生型WT幼苗竖立放置于光照培养箱中,经过38℃获得耐热性处理和42.5℃高温处理2 h后,继续竖立培养7 d, 观察幼苗根系的生长情况(图 3: G, H)。结果表明, 经过高温处理之后,5个突变体hsp70-15、apx2、hop12-3、hsfa7a 和fes1a的根长均比hot1长,其中fes1a与hot1的差异显著(P < 0.05),而其余4个突变体与hot1的差异极显著(P < 0.01) (图 4)。这与地上部热敏感表型结果一致。
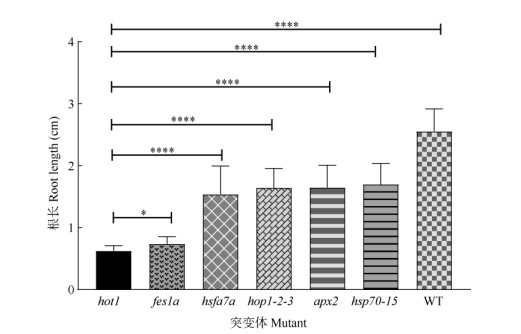
|
图 4 热胁迫后突变体的根系长度。n=3。 Fig. 4 Root length of mutants that was subjected to a heat stress. n=3. |
植物的热敏感相关基因及其分子机制是耐热植物生物学研究的热点,本文研究了6个拟南芥热敏感突变体的热敏感性,即fes1a、apx2、hsp70-15、hsp101、hsfa7a和hop1-2-3,其中hot1表现出最大的获得耐热性缺陷。有研究认为,热激会导致植物内蛋白质错误折叠和蛋白聚集体形成,从而影响细胞的存活[5]。而HSP101是蛋白质聚集体的解聚蛋白酶,它与sHSP和HSP70分子伴侣协同促进这些变性蛋白聚集体的解聚,有助于恢复细胞内蛋白质稳态[5]。HSP101是瓦解聚合蛋白的关键分子伴侣。拟南芥细胞质中HSP101为单基因编码[3],当该基因发生突变时,拟南芥瓦解聚合蛋白的功能基本丧失, hot1表现出明显的热敏感表型,说明瓦解高温导致的变性蛋白聚合体,是植物耐高温的关键机制。
本研究结果表明,fes1a的热敏感性仅次于hot1, 说明Fes1A相关途径与植物获得耐热性途径密切相关。Fes1A作为HSP70的核苷酸转换因子, 促进细胞溶质HSP70周转,Fes1A与HSP70结合,可以阻止HSP70的降解[12]。尽管Fes1A是HSP70的结合蛋白,但fes1a的热敏感性明显高于hsp70-15, 其原因可能是HSP70为家族蛋白,在拟南芥中编码HSP70的有18个基因[15],HSP70基因的功能各不相同,HSP70-1和植物的耐热性相关[16-17], HSP70-4参与维持细胞质中低水平的蛋白质前体和胚胎发生等过程[17-18],hsp70-6突变体在种子阶段经历热激处理后表现出热敏感表型[17, 19],本试验中HSP70-15在耐热性中扮演重要角色,但也只是HSP70基因家族的重要成员之一。FES1A是拟南芥中唯一表达的FES1基因[12],fes1a突变意味着钝化了HSP70家族的大多数成员,因此,fes1a突变体表现出比hsp70-15突变体更加热敏感。
HSFs作为热激转录因子,调控着热激蛋白的转录,在植物受到热胁迫时起重要作用,但本试验结果表明,hsfa7a突变体的热敏感性却低于hot1和fes1a。原因可能是,拟南芥中共有21个HSF,根据结构特征分为3类:A、B和C类[20]。功能研究表明,拟南芥中A类的HSF被认为是转录激活因子,并且A1类成员在激活热诱导基因的转录中起重要作用,当植物受到热胁迫时,通过诱导多种转录调节因子(包括其他类别的HSF、DREB2A、DREB2B、MBF1C和bZIP28)的表达来触发转录级联反应,这些转录调节因子中有几种参与热应激反应和耐热性[21]。可见,在热激响应机制中,HSFs的表达受到多个HSF的调控。当HSFA7A发生突变后,仅仅是热激调控部分环节被破坏,其他途径仍然独立发挥作用,这也解释了hsfa7a不是极度热敏感突变体。
hop1-2-3三突变体的热敏感性与hsfa7a基本相同。HOP作为一个辅助分子伴侣,衔接HSP70和HSP90,从而促进蛋白质的折叠与激活[9]。而HSP70和HSP90仅仅是热激响应机制的一部分,因此当HOP发生突变时,破坏了HSP70和HSP90衔接, 但对其他的HSPs功能影响不大,hop1-2-3也不归属于极度热敏感突变体,说明HSP70和HSP90是否衔接对植物耐热有一定影响。
APX2作为一种代表性的ROS (reactive oxygen species)清除酶,通常在热激条件下被激活[22]。植物经历高温后,ROS在组织中迅速积累,而ROS通常会对生物分子(如DNA和蛋白质)和细胞结构造成氧化损伤。因此,快速激活ROS清除系统对于热适应是必须的[23]。在众多抗氧化酶中,APX和过氧化氢酶(CAT)为植物热激下ROS的主要清除剂[24]。由于APX并不是ROS的唯一清除酶,因此,当APX2发生突变后,ROS响应通路仅仅可能部分受到损坏,热激产生的ROS仍然能够通过CAT等清除,apx2表现出与hsfa7a基本相同的热敏感表型,说明ROS途径对植物耐热性有重要作用。
| [1] |
LARKINDALE J, VIERLING E. Core genome responses involved in acclimation to high temperature[J]. Plant Physiol, 2008, 146(2): 748-761. DOI:10.1104/pp.107.112060 |
| [2] |
FU C, HOU Y F, GE J J, et al. Increased fes1a thermotolerance is induced by BAG6 knockout[J]. Plant Mol Biol, 2019, 100(1/2): 73-82. DOI:10.1007/s11103-019-00844-8 |
| [3] |
HONG S W, VIERLING E. Mutants of Arabidopsis thaliana defective in the acquisition of tolerance to high temperature stress[J]. Proc Natl Acad Sci USA, 2000, 97(8): 4392-4397. DOI:10.1073/pnas.97.8.4392 |
| [4] |
BANIWAL S K, BHARTI K, CHAN K Y, et al. Heat stress response in plants:A complex game with chaperones and more than twenty heat stress transcription factors[J]. J Biosci, 2004, 29(4): 471-487. DOI:10.1007/BF02712120 |
| [5] |
McLOUGHLIN F, KIM M, MARSHALL R S, et al. HSP101 interacts with the proteasome and promotes the clearance of ubiquitylated protein aggregates[J]. Plant Physiol, 2019, 180(4): 1829-1847. DOI:10.1104/pp.19.00263 |
| [6] |
GLOVER J R, LINDQUIST S. Hsp104, Hsp70, and Hsp40:A novel chaperone system that rescues previously aggregated proteins[J]. Cell, 1998, 94(1): 73-82. DOI:10.1016/S0092-8674(00)81223-4 |
| [7] |
SZABO A, LANGER T, SCHRÖDER H, et al. The ATP hydrolysis-dependent reaction cycle of the Escherichia coli Hsp70 system DnaK, DnaJ, and GrpE[J]. Proc Natl Acad Sci USA, 1994, 91(22): 10345-10349. DOI:10.1073/pnas.91.22.10345 |
| [8] |
MORIMOTO R I. Regulation of the heat shock transcriptional response:Cross talk between a family of heat shock factors, molecular chaperones, and negative regulators[J]. Genes Dev, 1998, 12(24): 3788-3796. DOI:10.1101/gad.12.24.3788 |
| [9] |
VANNINI A, CRAMER P. Conservation between the RNA polymerase Ⅰ, Ⅱ, and Ⅲ transcription initiation machineries[J]. Mol Cell, 2012, 45(4): 439-446. DOI:10.1016/j.molcel.2012.01.023 |
| [10] |
KOSANO H, STENSGARD B, CHARLESWORTH M C, et al. The assembly of progesterone receptor-hsp90 complexes using purified proteins[J]. J Biol Chem, 1998, 273(49): 32973-32979. DOI:10.1074/jbc.273.49.32973 |
| [11] |
FERNÁNDEZ-BAUTISTA N, FERNÁNDEZ-CALVINO L, MUÑOZ A, et al. HOP family plays a major role in long-term acquired thermo-tolerance in Arabidopsis[J]. Plant Cell Environ, 2018, 41(8): 1852-1869. DOI:10.1111/pce.13326 |
| [12] |
ZHANG J X, WANG C, YANG C Y, et al. The role of Arabidopsis AtFes1A in cytosolic Hsp70 stability and abiotic stress tolerance[J]. Plant J, 2010, 62(4): 539-548. DOI:10.1111/j.1365-313X.2010.04173.x |
| [13] |
KOTAK S, LARKINDALE J, LEE U, et al. Complexity of the heat stress response in plants[J]. Curr Opin Plant Biol, 2007, 10(3): 310-316. DOI:10.1016/j.pbi.2007.04.011 |
| [14] |
DOYLE J J, DOYLE J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochem Bull, 1987, 19: 11-15. |
| [15] |
LIN B L, WANG J S, LIU H C, et al. Genomic analysis of the Hsp70 superfamily in Arabidopsis thaliana[J]. Cell Stress Chaperones, 2001, 6(3): 201-208. DOI:10.1379/1466-1268(2001)006<0201:gaoths>2.0.co;2 |
| [16] |
CAZALÉ A C, CLÉMENT M, CHIARENZA S, et al. Altered expre-ssion of cytosolic/nuclear HSC70-1 molecular chaperone affects deve-lopment and abiotic stress tolerance in Arabidopsis thaliana[J]. J Exp Bot, 2009, 60(9): 2653-2664. DOI:10.1093/jxb/erp109 |
| [17] |
CHEN X, SHI L, ZHU L, et al. Molecular evolution characteristics and expression pattern analysis of the heat shock protein 70(HSP70) gene superfamily in plant[J]. Genom Appl Biol, 2017, 36(10): 4282-4294. 陈旭, 石垒, 朱璐, 等. 植物HSP70蛋白家族分子进化特征及其表达模式分析[J]. 基因组学与应用生物学, 2017, 36(10): 4282-4294. DOI:10.13417/j.gab.036.004282 |
| [18] |
LEE S, LEE D W, LEE Y, et al. Heat shock protein cognate 70-4 and an E3 ubiquitin ligase, CHIP, mediate plastid-destined precursor degradation through the ubiquitin-26S proteasome system in Arabidopsis[J]. Plant Cell, 2009, 21(12): 3984-4001. DOI:10.1105/tpc.109.071548 |
| [19] |
SU P H, LI H M. Arabidopsis Stromal 70-kD heat shock proteins are essential for plant development and important for thermotolerance of germinating seeds[J]. Plant Physiol, 2008, 146(3): 1231-1241. DOI:10.1104/pp.107.114496 |
| [20] |
NOVER L, BHARTI K, DÖRING P, et al. Arabidopsis and the heat stress transcription factor world:How many heat stress transcription factors do we need?[J]. Cell Stress Chaperones, 2001, 6(3): 177-189. DOI:10.1379/1466-1268(2001)006<0177:aathst>2.0.co;2 |
| [21] |
LIU H C, CHANG Y Y. Common and distinct functions of Arabidopsis class A1 and A2 heat shock factors in diverse abiotic stress responses and development[J]. Plant Physiol, 2013, 163(1): 276-290. DOI:10.1104/pp.113.221168 |
| [22] |
HAN S H, PARK Y J, PARK C M. Light primes the thermally induced detoxification of reactive oxygen species during development of thermotolerance in Arabidopsis[J]. Plant Cell Physiol, 2019, 60(1): 230-241. DOI:10.1093/pcp/pcy206 |
| [23] |
QU A L, DING Y F, JIANG Q, et al. Molecular mechanisms of the plant heat stress response[J]. Biochem Biophys Res Commun, 2013, 432(2): 203-207. DOI:10.1016/j.bbrc.2013.01.104 |
| [24] |
GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiol Biochem, 2010, 48(12): 909-930. DOI:10.1016/j.plaphy.2010.08.016 |
 2020, Vol. 28
2020, Vol. 28



