太阳光谱中的紫外辐射按照波长可以划分为UV-C (200~280 nm)、UV-B (280~315 nm)和UV-A (315~400 nm), 其中UV-C和大部分UV-B被地球的臭氧层所吸收并没有到达地表,只有小部分UV-B和全部的UV-A能够到达地表并对生物圈造成影响。人类活动产生的卤代烃、氮氧化合物可能导致臭氧层的损耗[1]。南极发现了臭氧层空洞[2], 伴随臭氧层空洞出现,日益增强的UV-B辐射对地球生物圈和人类健康的影响引起人们的广泛关注。
已有研究表明,UV-B辐射在一定程度上能够缓解干旱对植株的负效应[3-4], 相反,干旱也可以在一定程度上缓解UV-B对植株产生的负面影响[1], 植物中的这种交叉保护作用是存在的[5]。但是,在不同的物种或者在不同的干旱胁迫强度下,植物响应干旱和UV-B辐射的交叉抗性(cross tolerance)表现不尽相同。有研究指出干旱和UV-B胁迫都会对植物光合作用产生抑制作用,当植株同时暴露在UV-B和干旱胁迫下,对植物光合作用的负效应会加剧[6]。Wijewardana等[7]报道玉米(Zea mays)同时暴露在干旱和高剂量UV-B下可以通过打开气孔使叶片的水分蒸发加快。但也有研究表明干旱通过改变叶绿素含量和CO2固定的负调节作用以缓解高剂量UV-B对植物的影响[8]。当葡萄(Vitis vinifera)浆果同时受到UV-B和干旱胁迫时,果实成熟的时间推迟了28 d,相较于分别进行UV-B和干旱处理时推迟了11和13 d,果实成熟时间显著后移[9]。然而, 相似的双处理作用于葡萄树却能缓解UV-B和干旱单处理产生的光合相关的伤害和增加抗氧化酶的积累[9]。Kovács等[4]的研究表明UV-B缓解了干旱对小麦(Triticum aestivum)造成的叶片萎蔫。目前, 对于UV-B与干旱胁迫的互作研究存在不同的结果, 甚至相反,这可能与干旱的胁迫程度和UV-B处理的剂量有关。不同时进行2种处理时,第1个处理可能使植株中的抗性物质得到一定的积累,从而植株能更好地应对第2个处理;相反,同时进行2个处理可能导致的伤害超出了植株的防御能力从而加剧了伤害[10]。因此,UV-B剂量和干旱强度是影响试验结果的关键。此外,不同试验对象同样决定着UV-B与干旱互作试验的结果。UV-B可以缓解干旱引起烟草(Nicotiana tabacum)和大羊蹄(Rumex japonicas) CO2固定作用的减弱,但在其他物种中却加剧了这种减弱效应[11]。UV-B和干旱的相互作用也使渗透胁迫诱导的UVR8转录和蛋白水平提高[12]。干旱提高了草原生态系统的冠层温度,导致地上部分生物量减少,但UV-B辐射抵消了干旱引起的温度上升[13]。可见,不同试验对象对UV-B与干旱互作的响应不同。
STO蛋白属于BBX家族蛋白,又名BBX24, 该蛋白家族是一类具有锌指结构的转录因子,在酵母中与盐胁迫相关,在拟南芥(Arabidopsis thaliana)中对盐胁迫也有响应[14-15]。有报道指出,STO基因参与光信号转导途径,是光敏色素和蓝光色素的负调控因子,STO蛋白在黑暗中会被COP1识别降解[16]。本实验室前期研究结果证实STO基因是UV-B信号途径中的一个负调控因子,在UV-B途径中STO的表达受到UV-B的调控,能与COP1和HY5互作, 通过抑制HY5的表达负调控UV-B信号途径[17]。
随着植物UV-B信号通路研究的深入,低剂量UV-B可作为一个环境调控因子,调控植株的光形态建成。在臭氧层空洞和全球气候变暖的背景下, 自然环境中UV-B与其他环境因子的互作受到重视, 但UV-B与其他环境因子互作影响植物抗逆性及其机制的研究依旧匮乏。本研究主要比较了UV-B预处理对拟南芥野生型(WT)和sto突变体耐旱性的表型和生理指标的变化,为进一步从分子水平解析UV-B预处理提高拟南芥耐旱性奠定研究基础。
1 材料和方法 1.1 拟南芥培养条件拟南芥(Arabidopsis thaliana)材料包括野生型Columbia-0 (Heynh., Col-0)和以Col为背景的sto突变体。拟南芥种子加入700 μL超纯水并置于4℃黑暗春化3 d,用次氯酸钠(水和次氯酸钠溶液体积比为(3:7)消毒后播种在含GM培养基(pH=5.8)和BS培养液(pH=5.8)的水培装置中生长2周,培养条件为22℃,光暗周期为16 h/8 h。
1.2 UV-B和PEG模拟干旱处理采用PhilipsTL20W/01RS窄波段UV-B灯管(UV-B光度计测定约0.6 W/m2,International Light, USA),并附加10 µmol/(m2·s)光合辐射的白光(Philips TLD30W/865灯管, 采用可见光光度计测量,Inter- national Light, USA)。UV-B灯管的光经过Mylar film滤膜过滤,该滤膜为截止型长通滤光片,315 nm以下波段光被滤除,UV-B被过滤掉,为-UV-B处理;UV-B灯管的光经过Cellulose diacetate滤膜过滤,该滤膜为截止型长通滤光片,292 nm以下波段光被滤除,UV-B能透过,为+UV-B处理。2周龄的拟南芥水培幼苗分别在+/-UV-B下处理1周, 移出后分组,一部分正常生长(对照),另一部分采用添加30% PEG 6000模拟干旱处理。共设置4种处理:-UV-B、+UV-B、-UV-B+PEG和+UV-B+PEG。
1.3 含水量的测定参照李玲[18]的方法,先称取拟南芥幼苗(整株)的鲜质量(FW),然后在烘箱中烘干,称取干质量(DW)。含水量(%)=(FW-DW)/FW×100%。
1.4 类黄酮含量测定采用可见光分光光度计法制作类黄酮标准曲线,以芦丁为参照品作标准曲线,硝酸铝为显色液,在510 nm波长处测定类黄酮含量[19]。标准曲线: C= 0.1097X–0.0003 (X为吸光值)。样液制备:取样品0.02~0.1 g,记下每次重复的质量,用1 mL含1%盐酸乙醇溶液用样品快速制备系统研磨制备样液, 于30℃ 100 r/min恒温培养振荡器中浸取2 h, 13 523×g离心5 min。采用亚硝酸钠-硝酸铝比色法测定类黄酮含量,取0.9 mL样液或1%盐酸乙醇(空白对照)置于10 mL离心管中,加入5%亚硝酸钠溶液0.3 mL,摇匀后静置6 min;加入10%硝酸铝溶液0.3 mL,摇匀后静置6 min; 再加入4%氢氧化钠溶液,摇匀后静置15 min,510 nm处测定吸光值, 类黄酮含量(mg/g FW)=CV1/mV2,式中,C为类黄酮含量(mg/mL),从标准曲线中获得;V1为提取液定容体积(1 mL);V2为测定体积(0.9 mL);m为样品质量(mg)。
1.5 脯氨酸含量测定参照李玲[18]的方法。先制备脯氨酸标准曲线, 用磺基水杨酸法提取游离的脯氨酸。新鲜植物样品置于快速制备系统中研磨,加入1 mL 3%磺基水杨酸溶液,管口加盖玻璃球,于100℃金属浴浸取10 min。取出离心管,冷却到室温后,吸上清液1 mL,加1 mL冰乙酸和3 mL显色液,于水浴锅中沸水浴40 min。取出试管,冷却至室温后加入2.5 mL甲苯充分震荡,以萃取红色物质。静置分层后吸取甲苯层以0号管为对照在520 nm测吸光值。脯氨酸含量(μg/g FW)=CV/AW,C为脯氨酸含量(μg) (PS),由标准曲线y=(x+0.0067)/0.0457求得;V为提取液总体积(mL);A为吸取的体积(mL);W为样品质量(g)。0号管:从第二步起,加水1 mL,冰乙酸1 mL,显色液3 mL,甲苯2.5 mL,沸水浴40 min。
1.6 MDA含量测定参照李玲[18]的方法。称取新鲜植物样品20~ 100 mg (记下每个重复的质量),加入1 mL预冷10% TCA (三氯乙酸),样品快速制备系统(FastPrep-24, M.PB lomedicals, USA)制备研磨样液,4℃下1 664×g离心10 min,吸取0.9 mL上清液于10 mL玻璃试管中,对照加0.9 mL 10% TCA,加入0.9 mL 0.6% TBA溶液,混匀,盖上盖塞,沸水浴15 min, 迅速冷却,在紫外可见分光光度计上测定532和450 nm下的吸光值,MDA含量(C, μmol/L)=6.45OD532– 0.56OD450, 将MDA摩尔质量换算成质量比含量(μg/g FW)。
1.7 数据处理方法实验数据采用SigmaPlot 12.5软件计算各指标的平均值,标准差以及作图,数据显著性差异分析采用SPSS19.0,进行One-Way ANOVA分析,遵循LSD检验,Tukey’s分析比较不同处理间的差异显著性,不同小写字母,显著性符号表示差异显著, P < 0.05;差异极显著,P < 0.01。图片应用软件Photoshop CC 2018以及Illustrator CS6进行处理。
2 结果和分析 2.1 UV-B预处理对拟南芥耐旱性的影响UV-B处理后野生型(WT)拟南芥幼苗和sto突变体的含水量无显著变化,但改变了幼苗形态,均表现出矮壮的表型;UV-B预处理的WT在添加30% PEG模拟干旱胁迫时叶片坚挺,无萎蔫现象;无论有无UV-B预处理,添加30% PEG模拟干旱后,sto突变体的叶片都表现出萎蔫、叶片卷曲等典型缺水的表型(图 1: A),可见UV-B预处理并不能提高sto突变体的抗旱性。UV-B预处理能够提高拟南芥的耐旱性可能与STO蛋白相关。
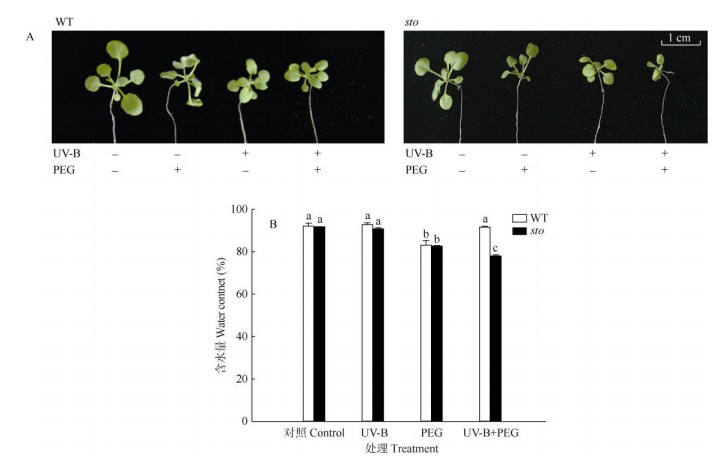
|
图 1 拟南芥幼苗的表型(A)和含水量(B)。柱上不同字母表示差异显著(P < 0.05)。下图同 Fig. 1 Phenotype (A) and water content (B) in WT and sto of Arabidopsis thaliana seedlings. Different letters upon bars indicate significant differences at 0.05 level |
应对干旱胁迫时,sto突变体植株的含水量变化趋势与WT型不同。PEG处理与对照相比,WT的含水量下降了7.97%,sto突变体下降了9.95%,均达显著差异; +UV-B+PEG处理与UV-B处理相比, WT的含水量无显著变化,sto突变体则显著下降了14.1% (图 1: B, P < 0.05),这表明UV-B可以提高野生型拟南芥(WT)的抗旱性, 但在sto突变体中由UV-B预处理产生的抗旱效应消失。+UV-B+PEG处理下,WT的含水量较sto突变体高17.1% (图 1: B, P < 0.05),达显著差异。表型性状与含水量均说明UV-B预处理在一定程度上提高野生型拟南芥的保水性与STO蛋白相关,STO蛋白在拟南芥耐旱性途径中可能是一个正调控因子。
2.2 UV-B预处理对拟南芥耐旱生理指标影响PEG处理的sto突变体植株的类黄酮含量显著高于不添加PEG处理;+UV-B+PEG处理的WT类黄酮含量比仅PEG处理的提高了38.2%,sto突变体提高了24.3% (图 2: A)。这表明植株在响应干旱胁迫时类黄酮含量会提高,且UV-B预处理有利于类黄酮的积累。在+UV-B+PEG处理时,WT比sto突变体的类黄酮含量高28.6% (图 2: A, P < 0.05)。在抵御干旱的进程中,WT植株的类黄酮积累高于sto突变体,表明STO蛋白可能与植株体内类黄酮的积累相关。

|
图 2 拟南芥幼苗的类黄酮、脯氨酸和丙二醛含量 Fig. 2 Contents of flavonoid, proline and MDA in Arabidopsis thaliana seedlings |
PEG处理的sto突变体植株的脯氨酸含量显著高于不添加PEG处理;+UV-B+PEG处理的WT脯氨酸含量比仅PEG处理的提高了55.6%,sto突变体提高了64.7% (图 2: B, P < 0.05), 表明植株在响应干旱胁迫时都提高了体内脯氨酸含量,UV-B预处理利于脯氨酸的积累。在+UV-B+PEG处理时, WT比sto突变体的的脯氨酸含量低53.6% (P < 0.05), 表明sto突变体植株体内脯氨酸含量较高,这可能与sto突变体在自然条件下原始脯氨酸含量较高有关。
PEG处理的sto突变体植株的MDA含量显著高于不添加PEG处理;+UV-B+PEG处理的WT丙二醛含量比仅PEG处理的降低了78.3% (P < 0.05), sto突变体提高了12.8% (图 2: C),表明在干旱胁迫时植株的细胞膜受到了一定程度的损伤, UV-B预处理一定程度上缓解了这种损伤,但加剧了干旱对sto突变体的这种损伤。这表明UV-B预处理对WT细胞膜有明显的保护作用。
3 结论和讨论Hui等的研究表明,UV-B (2.75、3.08、3.25和3.41 W/m2)和干旱同时作用于真藓植物, 其类胡萝卜素和总类黄酮含量比单处理时要高,而MDA含量则比单处理时要低[1]。Nogués等的研究表明,低剂量的UV-B (0.62 W/m2)处理豌豆(Pisum sativum), 植株通过减少失水率、气孔导度和叶片面积从而降低对干旱的敏感性[20]。拟南芥经UV-B和干旱胁迫的双处理,其相对生长率(RGR)、净同化率(NAR)、干质量和叶面积都比空白对照和单处理低,然而在恢复正常生长后,双处理植株的RGR和NAR比单处理的要高,此外经双处理的拟南芥开花时间延长[21]。UV-B处理后还能够缓解冬小麦由PEG诱导的干旱导致的叶片卷曲和萎蔫,这可能是UV-B处理后磷脂酰甘油和类黄酮含量上升[23]。Bandurska等的研究表明,UV-B处理后拟南芥的水杨酸(SA)水平上升从而增强了耐旱性[22]。
从表型和含水量来看,低剂量UV-B预处理后, 拟南芥幼苗在应对干旱时表现出较坚挺的表型和较强的保水性。有研究表明,植株在UV-B与干旱的交叉作用下,可能通过减少叶片面积,降低气孔导度,或者通过叶片和角质层加厚,同时积累抗氧化物质、类黄酮和其他代谢物质,如脯氨酸等来适应[24],这与本研究结果基本一致。有趣的是,UV-B预处理提高野生型拟南芥的耐旱性主要是通过改变植株的抗逆性物质类黄酮含量,降低细胞膜受损程度,提高保水性来实现。有趣的是,UV-B提高拟南芥耐旱性的效应在sto突变体中减弱,表明UV-B诱导的拟南芥耐旱性提高可能与STO蛋白相关, 这为UV-B提高拟南芥耐旱性的分子机制研究提供了新的研究方向。相比于其他环境胁迫因子, 低剂量UV-B作为一种环境调节因子未对植物造成损伤但能提高拟南芥的抗性,或许在农业的应用上能作为一个更优化的前处理增强植物对其他逆境的抗性。
| [1] |
HUI R, ZHAO R, LIU L, et al. Effects of UV-B, water deficit and their combination on Bryum argenteum plants[J]. Russ J Plant Physl, 2016, 63(2): 216-223. DOI:10.1134/S1021443716020084 |
| [2] |
McKENZIE R L, AUCAMP P J, BAIS A F, et al. Changes in biologically-active ultraviolet radiation reaching the Earth's surface[J]. Photochem Photobiol Sci, 2007, 6(3): 218-231. DOI:10.1039/B700017K |
| [3] |
KOVÁCS V, GONDOR O K, SZALAI G, et al. UV-B radiation modifies the acclimation processes to drought or cadmium in wheat[J]. Environ Exp Bot, 2014, 100: 122-131. DOI:10.1016/j.envexpbot.2013.12.019 |
| [4] |
ROBSON T M, HARTIKAINEN S M, APHALO P J. How does solar ultraviolet-B radiation improve drought tolerance of silver birch (Betula pendula Roth.) seedlings?[J]. Plant Cell Environ, 2015, 38(5): 953-967. DOI:10.1111/pce.12405 |
| [5] |
AROÚJO M, SANTOS C, COSTA M, et al. Plasticity of young Moringa oleifera L. plants to face water deficit and UVB radiation challenges[J]. J Photochem Photobiol B-Biol, 2016, 162: 278-285. DOI:10.1016/j.jphotobiol.2016.06.048 |
| [6] |
DOUPIS G, BOSABALIDIS A M, PATAKAS A. Comparative effects of water deficit and enhanced UV-B radiation on photosynthetic capacity and leaf anatomy traits of two grapevine (Vitis vinifera L.) cultivars[J]. Theor Exp Plant Phys, 2016, 28(1): 131-141. DOI:10.1007/s40626-016-0055-9 |
| [7] |
WIJEWARDANA C, HENRY W B, GAO W, et al. Interactive effects on CO2, drought, and ultraviolet-B radiation on maize growth and development[J]. J Photochem Photobiol B-Biol, 2016, 160: 198-209. DOI:10.1016/j.jphotobiol.2016.04.004 |
| [8] |
SHEN X F, DONG Z X, CHEN Y. Drought and UV-B radiation effect on photosynthesis and antioxidant parameters in soybean and maize[J]. Acta Physiol Plant, 2015, 37(2): 25. DOI:10.1007/s11738-015-1778-y |
| [9] |
MARTÍNEZ-LÜSCHER J, MORALES F, DELROT S, et al. Characterization of the adaptive response of grapevine (cv. Tempranillo) to UV-B radiation under water deficit conditions[J]. Plant Sci, 2015, 232: 12-22. DOI:10.1016/j.plantsci.2014.12.013 |
| [10] |
BANDURSKA H, NIEDZIELA J, CHADZINIKOLAU T. Separate and combined responses to water deficit and UV-B radiation[J]. Plant Sci, 2013, 213: 98-105. DOI:10.1016/j.plantsci.2013.09.003 |
| [11] |
RAPANTOVÁ B, KLEM K, HOLUB P, et al. Photosynthetic response of mountain grassland species to drought stress is affected by UV-induced accumulation of epidermal flavonols[J]. Beskydy, 2016, 9(1/2): 31-40. DOI:10.11118/beskyd201609010031 |
| [12] |
FASANO R, GONZALEZ N, TOSCO A, et al. Role of Arabidopsis UV RESISTANCE LOCUS 8 in plant growth reduction under osmotic stress and low levels of UV-B[J]. Mol Plant, 2014, 7(5): 773-791. DOI:10.1093/mp/ssu002 |
| [13] |
NOVOTNÁ K, KLEM K, HOLUB P, et al. Evaluation of drought and UV radiation impacts on above-ground biomass of mountain grassland by spectral reflectance and thermal imaging techniques[J]. Beskydy, 2016, 9(1/2): 21-30. DOI:10.11118/beskyd201609010021 |
| [14] |
LIPPUNER V, CYERT M S, GASSER C S. Two classes of plant cDNA clones differentially complement yeast calcineurin mutants and increase salt tolerance of wild-type yeast[J]. J Biol Chem, 1996, 271(22): 12859-12866. DOI:10.1074/jbc.271.22.12859 |
| [15] |
NAGAOKA S, TAKANO T. Salt tolerance-related protein STO binds to a Myb transcription factor homologue and confers salt tolerance in Arabidopsis[J]. J Exp Bot, 2003, 54(391): 2231-2237. DOI:10.1093/jxb/erg241 |
| [16] |
INDORF M, CORDERO J, NEUHAUS G, et al. Salt tolerance (STO), a stress-related protein, has a major role in light signalling[J]. Plant J, 2007, 51(4): 563-574. DOI:10.1111/j.1365-313X.2007.03162.x |
| [17] |
JIANG L, WANG Y, LI Q F, et al. Arabidopsis STO/BBX24 negatively regulates UV-B signaling by interacting with COP1 and repressing HY5 transcriptional activity[J]. Cell Res, 2012, 22(6): 1046-1057. DOI:10.1038/cr.2012.34 |
| [18] |
LI L. Plant Physiology Module Experiment Instruction[M]. Beijing: Science Press, 2009: 75-87. 李玲. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2009: 75-87. |
| [19] |
LI X C, CHEN D F, MAI Y, et al. Concordance between antioxidant activities in vitro and chemical components of Radix Astragali (Huangqi)[J]. Nat Prod Res, 2012, 26(11): 1050-1053. DOI:10.1080/14786419.2010.551771 |
| [20] |
NOGUÉS S, ALLEN D J, MORISON J I L, et al. Ultraviolet-B radiation effects on water relations, leaf development, and photo-synthesis in droughted pea plants[J]. Plant Physiol, 1998, 117(1): 173-181. DOI:10.1104/pp.117.1.173 |
| [21] |
COMUNT D, WINTERS A, GWYNN-JONES D. Acclimation and interaction between drought and elevated UV-B in A. thaliana:Differences in response over treatment, recovery and reproduction[J]. Ecol Evol, 2012, 2(11): 2695-2709. DOI:10.1002/ece3.387 |
| [22] |
BANDURSKA H, CIEŚLAK M. The interactive effect of water deficit and UV-B radiation on salicylic acid accumulation in barley roots and leaves[J]. Environ Exp Bot, 2013, 94: 9-18. DOI:10.1016/j.envexpbot.2012.03.001 |
| [23] |
GONDOR O K, SZALAI G, KOVÁCS V, et al. Impact of UV-B on droughtor cadmium-induced changes in the fatty acid composition of membrane lipid fractions in wheat[J]. Ecotoxicol Environ Saf, 2014, 108: 129-134. DOI:10.1016/j.ecoenv.2014.07.002 |
| [24] |
ALONSO R, BERLI F J, BOTTINI R, et al. Acclimation mechanisms elicited by sprayed abscisic acid, solar UV-B and water deficit in leaf tissues of field-grown grapevines[J]. Plant Physiol Biochem, 2015, 91: 56-60. DOI:10.1016/j.plaphy.2015.03.011 |
 2020, Vol. 28
2020, Vol. 28


