2. 四川省林业勘察设计研究院, 成都 610084
2. Sichuan Forestry Investigation and Design Institute, Chengdu 610084, China
土壤微生物是陆地生态系统最活跃的部分, 对维持生态系统物质循环和能量流动具有重要作用[1]。与土壤理化性质相比,土壤微生物对外源干扰的响应更为快速[2],常被认为是评价土壤生态系统变化的预警和敏感指标[3]。
桉树是世界三大速生树种之一,具有适应性强,速生丰产,用途广泛等优点[4]。目前,我国桉树人工林面积达4.5×106 hm2[5],仅用2%的林地生产出了全国25%的木材[6]。桉树人工林发展带来巨大经济效益的同时,也造成了耗水耗肥、生物多样性降低等一系列的生态问题[7]。如何保证桉树人工林的可持续发展已成为林业研究中亟待解决的问题。连栽是世界桉树人工林最典型的培育措施[8], 近年来,围绕桉树连栽对林地生产力[9]、生物多样性[10-11]和土壤理化性质[11-12]的影响等方面作了大量的研究;也有不同植被类型转变为巨桉人工林对土壤理化性质[13]和土壤微生物[13-15]等影响的报道。但桉树连栽对土壤微生物影响的研究较少[8],这不利于解析桉树连栽后土壤微生物的变化特征和调控机理。
本研究在四川省青神县白果乡,采用时空互换法,利用逐步回归分析和通径分析探讨马尾松(Pinus massoniana)林和不同代次巨桉(Eucalyptus grandis)人工林的土壤微生物生物量、数量与土壤理化性质的关系,了解巨桉连栽对土壤微生物的影响,探究巨桉连栽过程中导致微生物变化的土壤理化因子,为巨桉人工林地土壤质量的评价和改善及巨桉人工林可持续经营提供参考依据。
1 材料和方法 1.1 研究区概况研究区位于青神县西龙镇白果乡(103°41′~103° 59′ E、29°42′30′′~29°55′33′′ N),为川西平原与川西丘陵接壤的过渡带。年均气温17.1℃,年降雨量约1 130 mm。气候温和湿润,属亚热带山地季风型气候。主要土壤类型为紫色砂岩和页岩发育形成的紫色土, 厚度大于50 cm。地带性森林群落为亚热带常绿阔叶林,但从20世纪50年代末期开始,原生植被陆续被马尾松(Pinus massoniana)林替代(天然更新和人工更新),90年代开始大面积采伐马尾松林,推广巨桉(Eucalyptus grandis)人工林。通过查阅青神县森林资源规划设计调查,目前青神县巨桉人工林面积1.05×104 hm2,占全县林地面积的89.15%[16]。马尾松林残存较少,且主要为30~40 a生林。
1.2 样地设置2016年7月,在研究区选取立地条件基本一致的一、二和三代巨桉人工林作为研究对象。一代巨桉人工林(G1)于2010年在马尾松皆伐林地上营造;二代(G2)和三代(G3)巨桉人工林于2010年分别在8 a生巨桉一代林和二代林皆伐林地上营造。由于研究区巨桉人工林都是在马尾松皆伐林地上营造,为了比较巨桉连栽林地初始和连栽后土壤特征的变化情况,本研究选择巨桉人工林邻近的30 a生马尾松林(PM)作为对照。在各人工林中设置3块20 m×20 m的样地(表 1),共12块。巨桉人工林在栽植前每穴施底肥(2.00 kg农家肥和0.25 kg尿素),栽种方式为人工植苗。
| 表 1 样地基本情况 Table 1 the information of forestland |
2017年4月在每个样地中按品字型布设3个土壤剖面,采集0~10 cm土样, 混合均匀后分为两部分,一部分过2 mm筛后于4℃冷藏保存,用于测定土壤微生物生物量和数量;另一部分风干后,用以测定土壤化学性质。采集土壤样品的同时,用环刀取原状土测定土壤物理性质。
1.4 方法土壤容重、总孔隙度、含水率和田间持水量采用环刀法。土壤有机质采用重铬酸钾氧化-外加热法测定;全氮(TN)采用凯氏定氮法测定;全磷(TP)采用氢氧化钠碱熔-钼锑抗比色法测定;全钾采用氢氧化钠碱熔-火焰光度计法测定[17]。土壤微生物生物量碳和生物量氮采用改进的氯仿熏蒸-K2SO4浸提法[18]制取浸提液,提取液中的碳和氮采用有机碳自动分析仪(Total organic carbon analyzer-2500, Shimadzu Corporation, Japan)测定。土壤中的细菌、真菌和放线菌数量分别采用牛肉膏蛋白胨培养法、马丁氏培养基和高氏1号培养基法测定,细菌、真菌和放线菌均采用平板计数法计数[19]。微生物量生物量碳、生物量氮用每千克干土的碳、氮质量表示,微生物数量用每克干土的菌落数量表示。
1.5 数据的统计和分析使用Excel和SPSS 20.0对数据进行统计分析,采用Origin 8制图。用单因素方差分析法(One-Way ANOVA)和最小显著性差异法(LSD)进行显著性检验,若不满足方差齐性检验,则采用Tamhane’s T2进行非参数检验,比较土壤理化性质和微生物指标在不同连栽代数之间的差异性(P < 0.05)。以土壤理化性质为自变量,微生物指标为因变量进行多元逐步线性回归分析,并对土壤理化性质进行通径分析。
2 结果和分析 2.1 连栽对土壤理化性质的影响由表 2可知,马尾松林转为巨桉人工林(G1)后, 土壤容重、含水率、田间持水量、有机质和全磷含量均无显著变化,总孔隙度和全钾含量显著下降,但全氮含量显著增加。与马尾松林相比,G2和G3巨桉人工林的土壤容重、全氮含量无显著变化,其土壤总孔隙度、全磷和全钾含量显著降低,G3巨桉人工林的土壤含水率、田间持水量、有机质含量显著降低。随着巨桉连栽代数的增加,土壤总孔隙度、含水率、有机质、全氮、全磷和全钾含量均逐渐下降,G3与G1间差异显著;但土壤容重和田间持水量无显著变化。
| 表 2 土壤理化性质 Table 2 Soil physicochemical properties |
由图 1可知,马尾松林转为巨桉人工林(G1)后,土壤微生物生物量碳、生物量氮无显著变化。与马尾松林相比,G2和G3巨桉人工林的微生物生物量碳显著降低,G3巨桉人工林的微生物生物量氮显著降低。随巨桉连栽代次增加,微生物生物量碳、生物量氮递减,G3与G1间差异显著。与马尾松林相比,巨桉林微生物生物量碳氮比随连栽代次增加而增加,但差异不显著。
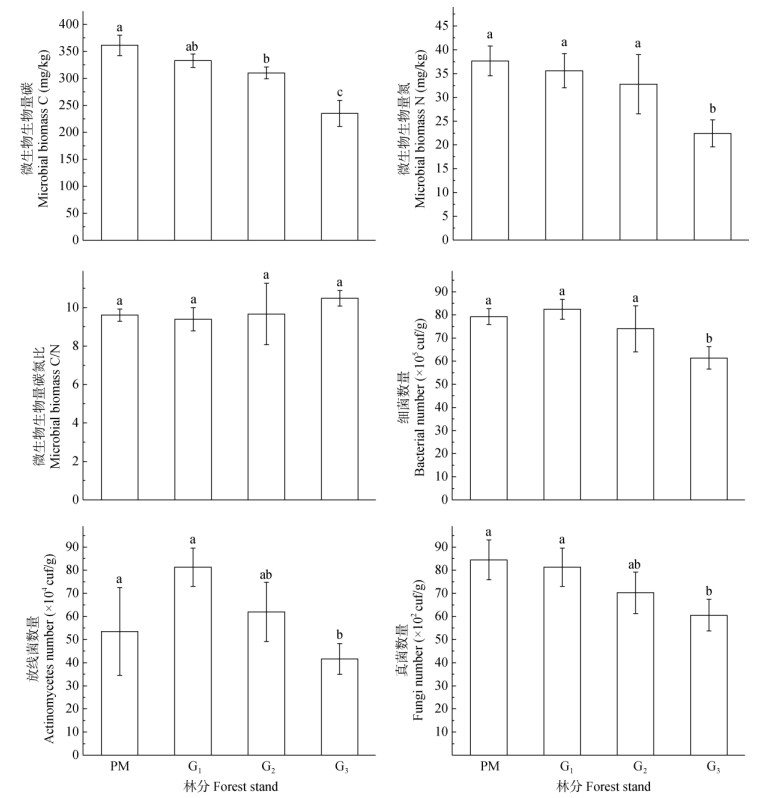
|
图 1 土壤微生物生物量碳、生物量氮、生物量碳氮比和细菌、放线菌、真菌数量。柱上不同字母表示差异显著(P < 0.05) Fig. 1 Soil microbial biomass C, biomass N, biomass C/ biomass N and number of bacteria, actinomycetes, fungi. Different letters upon bars indicate significant different at 0.05 level |
马尾松林转为巨桉人工林(G1)后,土壤细菌和真菌的数量无显著差异,放线菌数量显著增加。与马尾松林相比,G3巨桉人工林的细菌、真菌和放线菌数量显著降低。随巨桉连栽代次增加,细菌、真菌和放线菌数量递减,G3与G1间差异显著。从土壤微生物数量来看,细菌占绝对优势,占微生物总数的90.77%~93.47%;放线菌次之,占微生物总数的6.43%~9.14%;真菌最少,低于0.2%。
2.3 相关性分析逐步回归分析结果表明(表 3),土壤总孔隙度能独立解释土壤微生物生物量碳79.5%的变异,总孔隙度和全磷能共同解释微生物生物量碳87.9%的变异,这表明总孔隙度和全磷是巨桉人工林微生物生物量碳差异的主控因素。由图 2可知,总孔隙度和全磷作用于微生物生物量碳的直接通径系数分别为0.567和0.447,总孔隙度的直接通径系数最大,说明总孔隙度的直接作用最大。间接通径系数为相关系数与组成该间接通径的直接通径系数之积。总孔隙度和全磷作用于微生物生物量碳的间接通径系数分别为0.334和0.424,表明总孔隙度通过全磷所产生的间接作用和全磷通过总孔隙度产生的间接作用均为正效应。
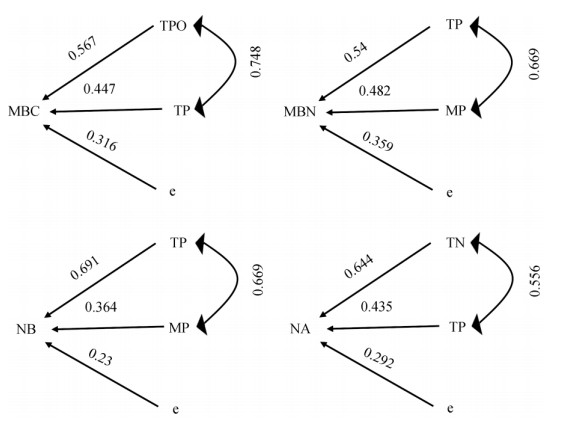
|
图 2 微生物指标与土壤理化性质的通径分析。NB:细菌数量; NA:放线菌数量; TN:全氮; e:误差。→:存在因果关系,其上的数字是直接通径系数;↔:存在相关关系,右侧数字是相关系数 Fig. 2 Path analysis of microbial indicators with soil physicochemical properties. NB: Number of bacteria; NA: Number of actinomycetes; TN: Total N; e: Errors. →: Causal relationship, the data upon line is direct path coefficient; ↔: Existing correlation, the data at right is correlation coefficients |
| 表 3 土壤理化性质与微生物生物量的逐步回归分析 Table 3 Stepwise regressions of microbial biomass and physicochemical properties of soil |
土壤全磷能独立解释土壤微生物生物量氮71.7%的变异,全磷和含水率能共同解释84.2%的变异(表 3),表明全磷和含水率是巨桉人工林微生物生物量氮差异的主控因素。由图 2可知,全磷和含水率作用于微生物生物量氮的直接通径系数分别为0.540和0.482,全磷的直接通径系数最大, 说明全磷对微生物生物量氮的直接作用最大。全磷和含水率作用于微生物生物量氮的间接通径系数分别为0.322和0.361,表明全磷通过含水率所产生的间接作用和含水率通过全磷产生的间接作用均为正效应。
土壤全磷能独立解释土壤细菌数量86.1%的变异,全磷和含水率能共同解释93.5%的变异(表 4), 表明全磷和含水率是巨桉人工林细菌数量差异的主控因素。由图 2可知,全磷和含水率作用于细菌的直接通径系数分别为0.691和0.364,全磷的直接通径系数最大,说明全磷对细菌的直接作用最大。全磷和含水率作用于细菌的间接通径系数分别为0.243和0.462,表明全磷通过含水率所产生的间接作用和含水率通过全磷产生的间接作用均为正效应。
| 表 4 马尾松林和巨桉人工林土壤理化性质与土壤微生物数量的逐步回归分析 Table 4 Stepwise regressions of soil microbes number with soil physicochemical properties of Pinus massoniana forests and Eucalyptus grandis plantations |
土壤全氮能独立解释土壤放线菌数量76.3%的变异,全氮和全磷能共同解释89.6%的变异(表 4),表明全氮和全磷是巨桉人工林放线菌数量差异的主控因素。由图 2可知,全氮和全磷作用于放线菌的直接通径系数分别为0.644和0.435,全氮的直接通径系数最大,说明全氮对放线菌的直接作用最大。全氮和全磷作用于微生物细菌的间接通径系数分别为0.242和0.358,这表明全氮通过全磷所产生的间接作用和全磷通过全氮产生的间接作用均为正效应。土壤全磷能独立解释土壤真菌数量63.0%的变异(表 4),表明全磷是巨桉人工林真菌数量差异的主控因素。
3 讨论逐步回归分析结果表明,总孔隙度和全磷是巨桉人工林微生物生物量碳差异的主控因素。随巨桉连栽代次增加,土壤微生物生物量碳递减,这一方面可能是因为巨桉生长迅速,耗肥较多[13],导致土壤全磷显著下降。生长速率假说指出,生长速率较快的土壤微生物富含磷含量较高的核糖体RNA,对磷的需求量较高[20-21]。因此,土壤微生物很容易受到P限制。土壤全磷的下降将不利于土壤微生物对磷素的固持和利用[22],进而抑制微生物活性, 降低微生物生物量碳。另一方面,连栽过程中,人为活动会直接压实表层土壤[4, 23],降低土壤总孔隙度。同时,土壤肥力的下降可能会造成根系活动减弱[24],间接影响土壤孔隙发育。这会限制土壤微生物的水分条件和通气条件[25],降低微生物生物量碳。但与对照马尾松林相比,巨桉一代林的土壤微生物生物量碳差异不显著,可能是因为巨桉取代马尾松后,土壤总孔隙度下降对微生物生物量碳的负面作用与全磷增加的正面作用相互抵消。Pulrolnik等[15]也得到了相似的结论。此外,总孔隙度通过全磷所产生的间接作用和全磷通过总孔隙度产生的间接作用均为正效应,表明总孔隙度与全磷之间存在着协同效应,共同影响微生物生物量碳,这可能是因为磷含量降低会造成巨桉根系活动减弱,从而影响土壤孔隙发育[26];同时,孔隙度降低,会抑制土壤动物和微生物的活动,不利于养分(磷素)释放[27]。与本研究的结果不同,王会利等[28]对马尾松林分的研究表明,土壤有机碳与孔隙度相互作用,是影响微生物生物量最重要的因素。这可能是本研究的巨桉人工林栽植前施加了农家肥,因此有机碳(有机质)不是土壤微生物生物量碳的限制因子。
逐步回归分析结果表明,全磷和含水率是巨桉人工林微生物生物量氮差异的主控因素,随巨桉连栽代次增加,土壤微生物生物量氮递减,这是因为土壤全磷含量的下降可能会导致微生物受到磷限制,致使微生物衰减。同时,巨桉的耗水能力较强[29]。连栽巨桉后,林地土壤含水率显著下降,一方面会直接导致微生物新陈代谢等生命过程被抑制,另一方面可能会改变微生物的环境温度和养分供应从而间接降低微生物生物量氮[30]。但与对照马尾松林相比,巨桉一代林的土壤微生物生物量氮差异不显著,这可能是因为巨桉取代马尾松后, 微生物生物量氮的主控因素土壤含水率和全磷的变化均不显著。此外,全磷和含水率相互促进,影响着土壤微生物生物量氮,可能是因为水肥之间会相互耦合,水分匮乏不利于磷素的释放和迁移,从而降低元素的移动性和有效性[31]。另外,有研究表明,磷素匮乏不利于植物的水分利用[32],土壤微生物也可能存在着这一现象,有待进一步研究。
通常认为,土壤微生物的群落结构受到土壤养分(如氮和磷)的调控[33]。本研究的逐步回归分析表明,土壤全氮和全磷是巨桉人工林放线菌数量差异的主控因素。王卫霞等[34]对南亚人工林的研究也得到了相似结论。与对照马尾松林相比,巨桉一代林的土壤放线菌数量显著增加,可能是因为马尾松林转为巨桉林后,凋落物特别是凋落叶的迅速分解, 加快了氮、磷淋失率[35],养分归还到土壤的速度较快。同时,桉树栽植前的施肥措施改善了土壤肥力,土壤氮磷含量增加,尤其是全氮显著增加,为土壤放线菌提供了更多的氮源和磷源,激发放线菌的生长繁殖。但是马尾松林转为巨桉林后,土壤真菌和细菌数量变化并不显著,可能是因为不同的微生物种类对森林类型变化的适应机制和对水肥气热等土壤肥力因子的利用机制可能存在差异[36]。回归分析也表明,土壤放线菌数量变异的主控因素是全氮和全磷,土壤细菌数量变异的主控因素是全磷和含水率,真菌数量变异的主控因素是全磷。这说明相比于真菌和放线菌,本研究区土壤细菌对水分更为敏感,而相比于细菌和真菌,放线菌对氮素更为敏感。有研究表明,相比于真菌和放线菌,细菌更喜好湿润环境[37-38]。但放线菌与氮素之间的相关性仍不清楚,有待于进一步研究。事实上,不同的生态系统类型,影响微生物变化的生态因子也不尽相同。本研究中,土壤真菌、细菌和放线菌数量随着连栽代次的增加而降低,这可能是因为随着连栽代次的增加,巨桉人工林土壤全磷、全氮和含水率都逐渐下降,导致微生物生长繁殖受到限制。通径分析还表明,全氮和全磷相互促进,影响着放线菌数量,可能是因为氮磷具有显著的协同效应[33, 39],微生物对氮(磷)的利用有利于其对另一种元素的固持。
本研究结果表明,土壤全磷能独立解释土壤微生物生物量氮、细菌和真菌71.7%、86.1%和63.0%的变异,其与总孔隙度共同解释微生物生物量碳87.9%的变异,与全氮共同解释放线菌89.6%的变异,说明土壤全磷可能是影响本区域巨桉人工林土壤微生物特征的重要因素。Cleveland等[40]也报道, 磷是限制微生物过程的重要元素。因此,为保证本区域巨桉人工林可持续经营,在连栽过程中应及时补充磷肥。
综上所述,巨桉连栽通过改变土壤理化性质使土壤微生物生物量和数量发生变化。土壤全磷能较大程度地解释微生物生物量和数量特征的变化。因此,在巨桉连栽过程中应增施磷肥,促进土壤微生物生物量和数量增长,进而改善土壤质量状况。本研究未能对不同连栽代次桉树人工林的土壤微生物群落结构和功能基因进行研究,未来可采用磷脂脂肪酸分析和高通量测序等技术,对连栽桉树人工林土壤微生物群落结构和功能基因的差异进行长期研究,以更深入地理解桉树人工林对微生物群落功能的影响,进而为桉树人工林可持续经营提供科学支撑。
| [1] |
ARTURSSON V, FINLAY R D, JANSSON J K. Interactions between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth[J]. Environ Microbiol, 2006, 8(1): 1-10. DOI:10.1111/j.1462-2920.2005.00942.x |
| [2] |
LEWIS D E, WHITE J R, WAFULA D, et al. Soil functional diversity analysis of a bauxite-mined restoration chronosequence[J]. Microb Ecol, 2010, 59(4): 710-723. DOI:10.1007/s00248-009-9621-x |
| [3] |
FAN S, YANG N. Comparsion of soil microbiology characteristics in five subtropical ecosystems[J]. J Trop Subtrop Bot, 2016, 24(6): 635-641. 范适, 杨宁. 亚热带5个生态系统土壤微生物学性质比较[J]. 热带亚热带植物学报, 2016, 24(6): 635-641. DOI:10.11926/j.issn.1005-3395.2016.06.006 |
| [4] |
LUO S M, HE D J, XIE Y L, et al. Effect of stand density on commu- nity structure and ecological effect of Eucalyptus urophylta×E. eamal- ducensis Plantation[J]. J Trop Subtrop Bot, 2010, 18(4): 357-363. 罗素梅, 何东进, 谢益林, 等. 林分密度对尾赤桉人工林群落结构与生态效应的影响研究[J]. 热带亚热带植物学报, 2010, 18(4): 357-363. DOI:10.3969/j.issn.1005-3395.2010.04.003 |
| [5] |
ZHU W K, CHEN S X, WANG Z C, et al. Ecological stoichiometric characteristrics of carbon, nitrogen and phosphorus in litter and soil of Eucalyptus urophylla×E. grandis Plantation at different forest ages[J]. J Trop Subtrop Bot, 2017, 25(2): 127-135. 竹万宽, 陈少雄, 王志超, 等. 不同林龄尾巨桉人工林凋落物和土壤C、N、P化学计量特征[J]. 热带亚热带植物学报, 2017, 25(2): 127-135. DOI:10.11926/jtsb.3665 |
| [6] |
ZHU L Y, WANG X H, CHEN F F, et al. Effects of the successive planting of Eucalyptus urophylla on soil bacterial and fungal commu- nity structure, diversity, microbial biomass, and enzyme activity[J]. Land Degrad Dev, 2019, 30(6): 636-646. DOI:10.1002/ldr.3249 |
| [7] |
LEMENIH M, OLSSON M, KARLTUN E. Comparison of soil attributes under Cupressus lusitanica and Eucalyptus saligna estab- lished on abandoned farmlands with continuously cropped farmlands and natural forest in Ethiopia[J]. For Ecol Manage, 2004, 195(1/2): 57-67. DOI:10.1016/j.foreco.2004.02.055 |
| [8] |
CHEN F L, ZHENG H, ZHANG K, et al. Soil microbial community structure and function responses to successive planting of Eucalyptus[J]. J Environ Sci, 2013, 25(10): 2102-2111. DOI:10.1016/S1001-0742(12)60319-2 |
| [9] |
HAN Y S, WEI Y C, OUYANG Z Y, et al. Effects of continuous planting rotation on forest structural characteristics and water holding capacity of Eucalyptus plantations[J]. Acta Ecol Sin, 2008, 28(9): 4609-4617. 韩艺师, 魏彦昌, 欧阳志云, 等. 连栽措施对桉树人工林结构及持水性能的影响[J]. 生态学报, 2008, 28(9): 4609-4617. DOI:10.3321/j.issn:1000-0933.2008.09.065 |
| [10] |
YE S M, WEN Y G, YANG M, et al. Correlation analysis on biodi- versity and soil physical & chemical properties of Eucalyptus spp. plantations under successive rotation[J]. J Soil Water Conserv, 2010, 24(4): 246-250, 256. 叶绍明, 温远光, 杨梅, 等. 连栽桉树人工林植物多样性与土壤理化性质的关联分析[J]. 水土保持学报, 2010, 24(4): 246-250. DOI:10.13870/j.cnki.stbcxb.2010.04.051 |
| [11] |
WEN Y G, YE D, CHEN F, et al. The changes of understory plant diversity in continuous cropping system of Eucalyptus plantations, south China[J]. J For Res, 2010, 15(4): 252-258. DOI:10.1007/s10310-010-0179-8 |
| [12] |
ZHANG K, ZHENG H, CHEN F L, et al. Changes in soil quality after converting Pinus to Eucalyptus plantations in southern China[J]. Solid Earth, 2015, 6(1): 115-123. DOI:10.5194/se-6-115-2015 |
| [13] |
CHEN F L, ZHANG K, WANG Y, et al. Impacts of converting natural secondary forests to exotic Eucalyptus plantations on structure and function of soil microbial communities[J]. Acta Ecol Sin, 2018, 38(22): 8070-8079. 陈法霖, 张凯, 王芸, 等. 引进种桉树人工林取代天然次生林对土壤微生物群落结构和功能的影响[J]. 生态学报, 2018, 38(22): 8070-8079. DOI:10.5846/stxb201801060036 |
| [14] |
ARA JO A S F, SILVA E F L, NUNES L A P L, et al. The effect of converting tropical native savanna to Eucalyptus grandis forest on soil microbial biomass[J]. Land Degrad Dev, 2010, 21(6): 540-545. DOI:10.1002/ldr.993 |
| [15] |
PULROLNIK K, de BARROS N F, SILVA I R, et al. Carbon and nitrogen pools in soil organic matter under eucalypt, pasture and savanna vegetation in Brazil[J]. Rev Bras Ciênc Solo, 2009, 33(5): 1125-1136. DOI:10.1590/S0100-06832009000500006 |
| [16] |
WEI S Z, LI L, LUO X, et al. Soil enzyme activities and their rela- tionships to soil physicochemical properties in different successive rotation plantations of Eucalyptus grandis[J]. Chin J Appl Environ Biol, 2019, 25(6): 1-10. 魏圣钊, 李林, 骆晓, 等. 不同连栽代次的巨桉(Eucalyptus grandis)人工林土壤酶活性及其与土壤理化性质的关系[J]. 应用与环境生物学报, 2019, 25(6): 1-10. DOI:10.19675/j.cnki.1006-687x.2019.02029 |
| [17] |
Institute of Soil Science, Chinese Academy of Sciences. Soil Physico- chemical Analysis[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1978: 62-132. 中国科学院南京土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978: 62-132. |
| [18] |
WU J, JOERGENSEN R G, POMMERENING B, et al. Measurement of soil microbial biomass C by fumigation-extraction: An automated procedure[J]. Soil Biol Biochem, 1990, 22(8): 1167-1169. DOI:10.1016/0038-0717(90)90046-3 |
| [19] |
Microbiology Laboratory, Institute of Soil Science, Chinese Academy of Sciences. Method of Soil Microorganism[M]. Beijing: Science Press, 1985: 42-81. 中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M]. 北京: 科学出版社, 1985: 42-81. |
| [20] |
ELSER J J, DOBBERFUHL D R, MACKAY N A, et al. Organism size, life history, and N:P stoichiometry: Toward a unified view of cellular and ecosystem processes[J]. BioScience, 1996, 46(9): 674-684. DOI:10.2307/1312897 |
| [21] |
ELSER J J, STERNER R W, GOROKHOVA E, et al. Biological stoichio- metry from genes to ecosystems[J]. Ecol Lett, 2000, 3(6): 540-550. DOI:10.1111/j.1461-0248.2000.00185.x |
| [22] |
REDEL Y D, ESCUDEY M, ALVEAR M, et al. Effects of tillage and crop rotation on chemical phosphorus forms and some related biological activities in a Chilean Ultisol[J]. Soil Use Manage, 2011, 27(2): 221-228. DOI:10.1111/j.1475-2743.2011.00334.x |
| [23] |
TEMESGEN D, GONZ LO J, TURRI N M B. Effects of short- rotation Eucalyptus plantations on soil quality attributes in highly acidic soils of the central highlands of Ethiopia[J]. Soil Use Manage, 2016, 32(2): 210-219. DOI:10.1111/sum.12257 |
| [24] |
LIAO L P, DENG S J, YU X J, et al. Growth, distribution and exudation of fine roots of Chinese fir trees grown in continuously cropped plantations[J]. Acta Ecol Sin, 2001, 21(4): 569-573. 廖利平, 邓仕坚, 于小军, 等. 不同连栽代数杉木人工林细根生长、分布与营养物质分泌特征[J]. 生态学报, 2001, 21(4): 569-573. DOI:10.3321/j.issn:1000-0933.2001.04.008 |
| [25] |
HE J N, SHI Y, YU Z W, et al. Subsoiling improves soil physical and microbial properties, and increases yield of winter wheat in the Huang- Huai-Hai Plain of China[J]. Soil Till Res, 2019, 187: 182-193. DOI:10.1016/j.still.2018.12.011 |
| [26] |
WENG C F, TANG J, WU L J, et al. Sparingly soluble phosphorus absorption and root response to phosphorus deficiency stress in Eucaly- ptus seedlings[J]. Acta Bot Boreali-Occid Sin, 2014, 34(5): 970-975. 翁彩凤, 唐健, 吴柳杰, 等. 桉树幼苗对难溶性磷的吸收及其根系对低磷胁迫的响应[J]. 西北植物学报, 2014, 34(5): 970-975. DOI:10.7606/j.issn.1000-4025.2014.05.0970 |
| [27] |
LUO M, LIU C H. Effect of mulching greenery waste on soil nutrients and soil microbial biomass of municipal forest land[J]. Ecol Environ Sci, 2016, 25(2): 223-232. 罗萌, 刘长海. 绿化植物废弃物对城市林地土壤微生物量和养分特性的影响[J]. 生态环境学报, 2016, 25(2): 223-232. DOI:10.16258/j.cnki.1674-5906.2016.02.007 |
| [28] |
WANG H L, BI L D, ZHANG B. Change in microbial biomass and its controlling factors in degraded soil after reforestration of Pinus massoniana[J]. Acta Pedol Sin, 2008, 45(2): 313-320. 王会利, 毕利东, 张斌. 退化红壤马尾松恢复林地土壤微生物生物量变化及其控制因素研究[J]. 土壤学报, 2008, 45(2): 313-320. DOI:10.3321/j.issn:0564-3929.2008.02.017 |
| [29] |
HUA L, HE Q, LI J Y, et al. Comparison of the water consumption characteristics of Eucalyptus and Corymbia clone seedlings and the local indigenous tree species Bischofia javanica[J]. Chin J Appl Ecol, 2014, 25(6): 1639-1644. 华雷, 何茜, 李吉跃, 等. 桉树无性系和华南乡土树种秋枫苗木耗水特性的比较[J]. 应用生态学报, 2014, 25(6): 1639-1644. DOI:10.13287/j.1001-9332.20140415.007 |
| [30] |
YI Z G, FU S L, YI W M, et al. Partitioning soil respiration of subtro- pical forests with different successional stages in south China[J]. For Ecol Manage, 2007, 243(2/3): 178-186. DOI:10.1016/j.foreco.2007.02.022 |
| [31] |
WANG J, YE Z, ZHU G X. Coupling effects of water and phosphate fertilizer supply on soil P availability and use efficiency[J]. Chin J Eco-Agric, 2015, 23(11): 1377-1383. 王静, 叶壮, 褚贵新. 水磷一体化对磷素有效性与磷肥利用率的影响[J]. 中国生态农业学报, 2015, 23(11): 1377-1383. DOI:10.13930/j.cnki.cjea.150449 |
| [32] |
ZRIBI O T, ABDELLY C, DEBEZ A, et al. Interactive effects of salinity and phosphorus availability on growth, water relations, nutria- tional status and photosynthetic activity of barley (Hordeum vulgare L.)[J]. Plant Biol, 2011, 13(6): 872-880. DOI:10.1111/j.1438-8677.2011.00450.x |
| [33] |
LIU L, GUNDERSEN P, ZHANG T, et al. Effects of phosphorus addition on soil microbial biomass and community composition in three forest types in tropical China[J]. Soil Biol Biochem, 2012, 44(1): 31-38. DOI:10.1016/j.soilbio.2011.08.017 |
| [34] |
WANG W X, SHI Z M, LUO D, et al. Characteristics of soil microbial biomass and community composition in three types of plantations in southern subtropical area of China[J]. Chin J Appl Ecol, 2013, 24(7): 1784-1792. 王卫霞, 史作民, 罗达, 等. 南亚热带3种人工林土壤微生物生物量和微生物群落结构特征[J]. 应用生态学报, 2013, 24(7): 1784-1792. DOI:10.13287/j.1001-9332.2013.0411 |
| [35] |
YANG G R, ZHANG X Q, CAI D S, et al. Litter decomposition of dominant plantations in Guangxi and its effects on leachate quality[J]. Chin J Appl Ecol, 2012, 23(1): 9-16. 杨钙仁, 张秀清, 蔡德所, 等. 广西主要人工林凋落物分解过程及其对淋溶水质的影响[J]. 应用生态学报, 2012, 23(1): 9-16. DOI:10.13287/j.1001-9332.2012.0002 |
| [36] |
WU Q S, LONG J, LIAO H K, et al. Soil bacterial community charac- teristics under different microhabitat types on Maolan karst forest, Guizhou, southwest China[J]. Chin J Appl Ecol, 2019, 30(1): 108-116. 吴求生, 龙健, 廖洪凯, 等. 贵州茂兰喀斯特森林不同小生境下土壤细菌群落特征[J]. 应用生态学报, 2019, 30(1): 108-116. DOI:10.13287/j.1001-9332.201901.014 |
| [37] |
BAO T L, ZHAO Y G, GAO L Q, et al. Dynamic of culturable micro- organisms in biological soil crusts under trampling disturbance[J]. J Desert Res, 2019, 39(1): 119-126. 包天莉, 赵允格, 高丽倩, 等. 踩踏干扰下生物结皮土壤可培养微生物数量[J]. 中国沙漠, 2019, 39(1): 119-126. DOI:10.7522/j.issn.1000-694X.2018.00013 |
| [38] |
COOK R J, PAPENDICK R I. Soil water potential as a factor in the ecology of Fusarium roseum f. sp. cerealis 'Culmorum'[J]. Plant Soil, 1970, 32(1/2/3): 131-145. DOI:10.1007/BF01372852 |
| [39] |
ELSER J J, BRACKEN M E S, CLELAND E E, et al. Global analysis of nitrogen and phosphorus limitation of primary producers in fresh- water, marine and terrestrial ecosystems[J]. Ecol Lett, 2007, 10(12): 1135-1142. DOI:10.1111/j.1461-0248.2007.01113.x |
| [40] |
CLEVELAND C C, TOWNSEND A R, SCHMIDT S K. Phosphorus limitation of microbial processes in moist tropical forests: Evidence from short-term laboratory incubations and field studies[J]. Ecosys- tems, 2002, 5(7): 680-691. DOI:10.1007/s10021-002-0202-9 |
 2020, Vol. 28
2020, Vol. 28



