太阳光的固有成分之一是紫外光(UV),通常分为3个区段:A区(UV-A,315~400 nm)、B区(UV-B,280~315 nm)和C区(UV-C,100~280 nm)。在地球演化过程中,平流层臭氧层的形成导致太阳光到达地面的光谱成分发生变化[1],由于UV-C和UV-B分别被臭氧层完全和部分吸收,致使生物圈受到UV-A和部分UV-B辐射的影响[2]。另外,人为污染物破坏了臭氧层而导致平流层臭氧层变薄,导致到达地面的太阳UV-B辐射增加[3],称其为“增强UV-B辐射(enhanced UV-B radiation)”。在污染物没有合理控制的情况下,平流层中的臭氧将继续下降,据估计,北半球的增强UV-B辐射年增加率将达到14%,南半球将达到40%[4],鉴于臭氧层被持续破坏,进而引发了人们对增强UV-B辐射潜在危害的担忧。
关于高强度增强UV-B辐射对生物体危害的研究报道较多[5–6],对植物的危害包括遗传物质、光合机制、活性氧(reactive oxygen species, ROS)的产生和细胞损害等诸多方面,其中增强UV-B辐射还会诱导保护性反应产生,包括光修复能力的增强、紫外线屏蔽色素的积累和总抗氧化能力的增加等[7–8]。目前, 对增强UV-B辐射的研究多集中于大面积栽培的草本农作物的苗期效应及其生理生化机制方面, 如小麦(Triticum aestivum)、玉米(Zea mays)、水稻(Oryza sativa)和大豆(Glycine max)等,而对多年生木本植物, 如果树的研究相对较少。
芒果(Mangifera indica)素有“热带果王”美誉, 为仅次于香蕉(Musa acuminata)的世界第二大热带水果,为中国四大热带水果之一,营养价值高,经济效益显著,深受人们喜爱。增强UV-B辐射对芒果栽培表现和叶片光合作用的影响已进行了初步研究,结果表明,人工模拟增强UV-B辐射强度达48 kJ/(m2·d) (大约相当于正常环境中UV-B辐射增强了8%)及以上时会引起芒果成年树减产、单果重下降和果实品质变劣,导致叶片生物膜出现活性氧损伤,促使叶绿素降解、抑制叶片光合作用, 并表现出增强UV-B辐射处理的剂量效应和积累效应[9–10]。本文在前期研究基础上,设置代表性的低、高剂量水平的增强UV-B辐射处理,检测叶片中重要的抗氧化和耗散UV-B辐射成分,如芒果苷等的积累变化,进一步探讨芒果成年树对增强UV-B辐射胁迫的抗氧化响应特点,为植物抗增强UV-B辐射逆境生理研究提供理论基础,也为未来制定芒果抗增强UV-B辐射逆境栽培技术的制定提供科学依据。
1 材料和方法 1.1 材料试验地点位于海南省陵水县英州镇军田村芒果园,该地区属热带季风海洋气候,年日照时数2 261.6 h,年均降水量1 717.9 mm,年均温25.4℃, 园土为砖红沙壤土。选择10 a生且生长健壮、长势均匀、无不良表现的‘台农1号’芒果(Mangifera indica ‘Tainong No. 1’)成年树9株为试验树, 11-12月为花芽分化期,12-翌年2月为开花坐果期,3-4月为果实迅速膨大期,5月上中旬为果实成熟期。
1.2 设计本试验共设置3个处理,即对照(自然光, CK)和2个增强UV-B辐射[强度分别为24和96 kJ/(m2·d)]处理,单株小区,3次重复。自2018年2月12日开始人工模拟增强UV-B辐射处理。增强UV-B辐射采用40 W的UV-B灯管[购于北京电光源研究所,灯管辐射范围为:280~320 nm,辐射剂量为24 kJ/(m2·d)]照射树冠,产生的UV辐射先通过0.08 mm的乙酸纤维素膜过滤UV-C,灯管离树顶保持30 cm,进入开花结果期后控制新梢生长,可维持此高度在整个试验处理期内保持不变。24 kJ/(m2·d)处理在树冠顶部正中悬挂1根灯管,96 kJ/(m2·d)处理在树冠顶部正中十字交叉状悬挂4根灯管。晴天自日出至日落进行人工模拟增强UV-B辐射处理,阴天、雨天、阵雨和短暂阴天时段则都停止处理(关闭光源灯电源)。
1.3 取样和样品处理从2018年2月12日开始坐果至2018年4月22日采果为止进行增强UV-B辐射处理,分别于2月12日、3月5、21日、4月8和22日在UV-B灯管下方随机选取第二蓬梢中部叶片作为样品。每次对各供试单株分别标记10片叶片,在田间于上午9:00- 10:00完成光合速率的测定,随即采摘叶片并放入液氮罐速冻,带回实验室贮存于-80℃超低温冰箱中备用。
1.4 方法采用Yaxin-1101便携式光合作用测定仪测定叶片净光合速率;采用硫代巴比妥酸比色法测定叶片丙二醛(MDA)含量[11];参照陈爱葵等[12]方法测定相对电导率;采用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性[13];采用愈创木酚法测定过氧化物酶(POD)活性[13];采用紫外吸收法测定过氧化氢酶(CAT)活性[13];采用2, 6-二氯酚靛酚染色滴定法测定Vc含量[11];采用巯基试剂DTNB测定还原型谷胱甘肽含量[14];参照周开兵等[15]的方法测定多酚和类黄酮的含量;采用高效液相色谱法测定芒果苷含量[16],流动相为0.2%乙酸-乙腈(88:12), 流速为1.0 mL/min,检测波长为258 nm,柱温为室温,进样体积10 μL。
1.5 数据统计和分析采用SAS 9.1.3进行数据统计分析,ANOVA过程作方差分析,LSD法作多重比较分析。
2 结果和分析 2.1 对叶片的损伤MDA含量 从图 1可见,UV-B处理和CK的MDA含量总体上均随处理时间延长呈上升的变化趋势, 96 kJ/(m2·d) UV-B处理的MDA含量均显著高于CK,24 kJ/(m2·d)处理的则与CK无显著差异,两处理间自3月21日至4月8日差异显著。可见,24 kJ/(m2·d)处理未导致叶片明显的细胞膜脂过氧化损伤,而96 kJ/(m2·d)处理则引起了叶片细胞膜脂过氧化损伤。
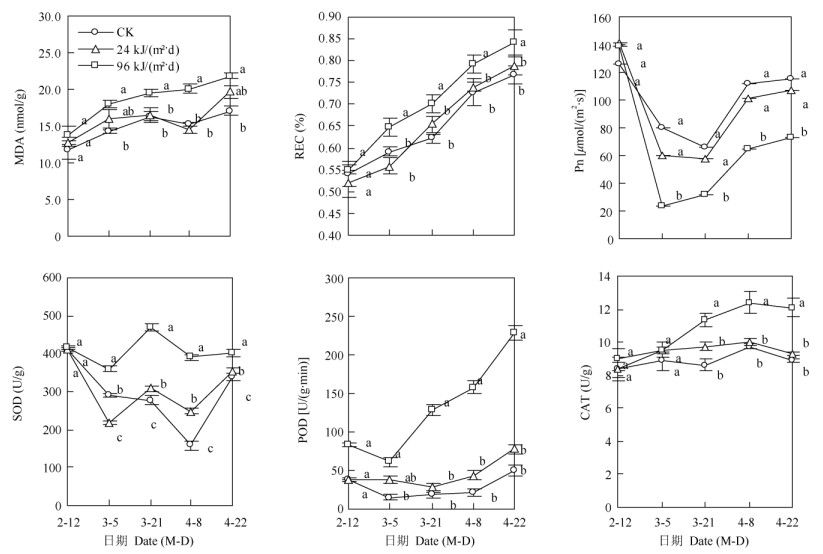
|
图 1 增强UV-B辐射对芒果叶片丙二醛含量(MDA)、相对电导率(REC)、净光合速率(Pn)、超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的影响。不同字母表示差异显著(P < 0.05)。下图同。 Fig. 1 Effects of enhanced UV-B radiation on MDA content, relative electric conductivity, net photosynthetic rate (Pn), activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) in Mangifera indica leaves. Different letters indicate significant differences at 0.05 level. The same is following Figures. |
叶片相对电导率 UV-B处理和CK的相对电导率均随处理时间的延长呈上升的变化趋势(图 1), 96 kJ/(m2·d) UV-B处理的相对电导率始终显著高于CK,24 kJ/(m2·d)处理的与CK无显著差异。可见, 96 kJ/(m2·d) UV-B处理引起了叶片膜通透性损伤, 而24 kJ/(m2·d)处理对叶片膜通透性没有显著影响, 并且96 kJ/(m2·d)处理的叶片膜通透性损伤可能是其膜脂过氧化损伤的结果。
叶片光合速率(Pn) UV-B处理和CK的Pn均随处理时间延长呈先下降后上升的变化趋势(图 1)。CK的Pn始终保持最高,96 kJ/(m2·d) UV-B处理的Pn均显著低于CK,24 kJ/(m2·d)处理的与CK无显著差异,两个UV-B处理间的差异显著。可见,24 kJ/(m2·d)处理对芒果叶片的Pn没有显著影响, 而96 kJ/(m2·d)处理会引起芒果叶片Pn显著降低, 说明96 kJ/(m2·d)处理抑制了叶片光合作用,从而抑制净光合产物积累。
2.2 对叶片抗氧化酶活性的影响SOD活性 UV-B处理和CK的SOD活性均随处理时间呈“W”形变化趋势,96 kJ/(m2·d) UV-B处理的SOD活性始终显著高于CK;24 kJ/(m2·d)处理的SOD活性除3月5日和4月8日分别显著低于和高于CK外,其余时间和CK差异不显著。96 kJ/(m2·d)处理的SOD活性除2月12日外均显著高于24 kJ/(m2·d)处理。可见,24 kJ/(m2·d)处理对叶片SOD活性基本上没有明显影响,而96 kJ/(m2·d)处理使叶片SOD活性明显增强,即其通过增强叶片清除活性氧自由基的能力而减轻损伤(图 1)。
POD活性 UV-B处理和CK的POD活性均随处理时间不断升高(图 1), 96 kJ/(m2·d) UV-B处理的POD活性始终显著高于CK,24 kJ/(m2·d)处理的则与CK均差异不显著;两个UV-B处理的POD活性除3月5日差异不显著外,其余时间均差异显著。可见,24 kJ/(m2·d)处理对芒果叶片POD活性没有显著影响,而96 kJ/(m2·d)处理使芒果叶片POD活性明显增强,即其通过增强清除叶片活性氧自由基的能力而减轻损伤。
CAT活性 UV-B处理和CK的CAT活性均随处理时间的延长呈上升的变化趋势(图 1),3月5日之前,UV-B处理和CK间均无显著差异;之后, 96 kJ/(m2·d) UV-B处理的CAT活性均显著高于CK和24 kJ/(m2·d)处理,后两者间无显著差异。可见, 24 kJ/(m2·d)处理对叶片CAT活性没有显著影响, 96 kJ/(m2·d)处理使叶片CAT活性明显增强,即其通过增强清除H2O2自由基的能力而减轻叶片损伤。
2.3 对保护性成分含量的影响多酚含量 从图 2可见,CK和96 kJ/(m2·d) UV-B处理的多酚含量随处理时间的延长总体上呈上升的变化趋势,24 kJ/(m2·d)处理的呈先上升后下降的变化趋势。3月5日之前,UV-B处理和CK间的多酚含量均无显著差异;之后,96 kJ/(m2·d)处理的多酚含量均显著高于CK和24 kJ/(m2·d)处理; 24 kJ/(m2·d)处理的仅在4月22日显著低于CK,其余时间与CK没有显著差异。可见,24 kJ/(m2·d)处理对叶片多酚的含量没有明显影响,96 kJ/(m2·d)处理能提高叶片中多酚的含量,说明其可能通过积累多酚类化合物来减轻活性氧损伤。
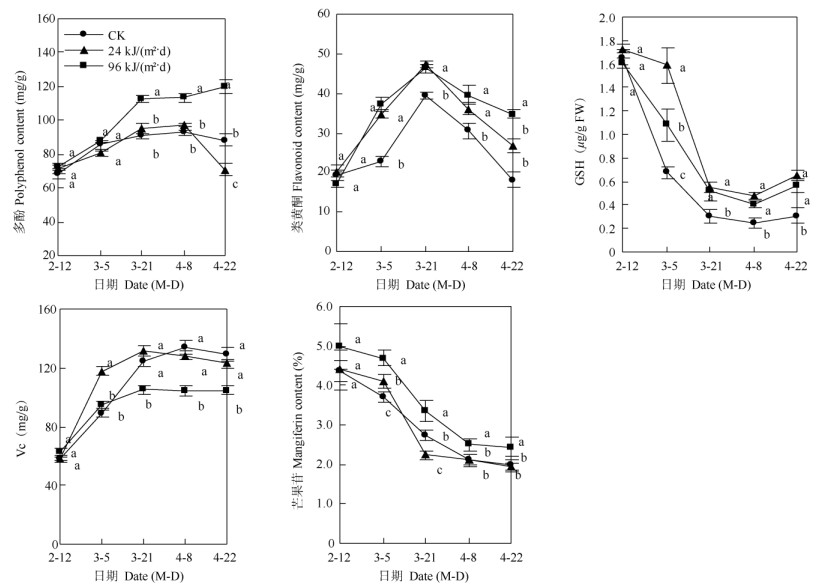
|
图 2 增强UV-B辐射对芒果叶片多酚、类黄酮、还原型GSH、Vc和芒果苷含量的影响 Fig. 2 Effects of the enhanced UV-B radiation on the content of polyphenol, flavonoid, reduced GSH, Vc and mangiferin in Mangifera indica leaves |
类黄酮含量 UV-B处理和CK的类黄酮含量变化趋势均为单峰曲线,高峰均出现在3月21日(图 2)。UV-B处理的类黄酮含量均显著高于CK;两个UV-B处理间的类黄酮含量除4月22日差异显著外,其余时间均无显著差异。可见,增强UV-B辐射处理均能通过诱导叶片积累类黄酮来抵御损伤。
还原型GSH含量 UV-B处理和CK的还原型GSH含量随处理时间的延长均呈下降的变化趋势(图 2),两个UV-B处理的还原型GSH含量均显著高于CK;UV-B处理间除3月5日差异显著外,其余时间均无显著差异。可见,两个增强UV-B辐射处理均能通过诱导叶片积累还原型GSH而抵御损伤。
叶片Vc含量 UV-B处理和CK的叶片Vc含量均随处理时间的延长呈上升的趋势(图 2),3月5日前,96 kJ/(m2·d) UV-B处理与CK的叶片Vc含量无显著差异,之后显著低于CK;24 kJ/(m2·d)处理的除3月5日显著高于CK外,其余时间均与CK无显著差异;96 kJ/(m2·d) UV-B处理的叶片Vc含量始终显著低于24 kJ/(m2·d)处理。可见,24 kJ/(m2·d)处理对叶片Vc的含量没有明显影响,96 kJ/(m2·d)处理使叶片Vc含量降低,即其可能通过消耗叶片Vc来减轻损伤。
芒果苷含量 UV-B处理和CK的叶片芒果苷含量均随处理时间的延长呈下降的变化趋势(图 2), 96 kJ/(m2·d) UV-B处理的叶片芒果苷含量始终显著高于CK;24 kJ/(m2·d)处理的仅在3月5和21日显著低于CK,其余时间均与CK无显著差异;96 kJ/(m2·d)处理的均显著高于24 kJ/(m2˖d)处理。可见,24 kJ/(m2˖d)处理对叶片的芒果苷含量没有明显影响,96 kJ/(m2˖d)处理能诱导叶片积累更多的芒果苷而尽可能减轻损伤。
3 结论和讨论我们前期研究表明,人工模拟增强UV-B辐射强度达48 kJ/(m2·d)及以上时会引起芒果果实产量下降和果实风味品质变劣[9–10]。本研究结果表明, 高强度增强UV-B辐射[96 kJ/(m2·d)]导致芒果叶片中MDA含量和相对电导率显著增加,这与前人研究结果[17–21]一致, 进一步印证了“细胞膜系统是UV-B辐射胁迫的靶位”的结论[22]。芒果叶片光合作用受到抑制也与玉米、花生(Arachis hypogaea)和葡萄(Vitis vinifera)在高强度增强UV-B辐射下的表现一致[23–25], 也与我们前期在芒果上的研究结果一致[9–10], 这说明高剂量增强UV-B辐射能引起芒果叶片细胞膜脂过氧化损伤和抑制芒果叶片光合作用。
高剂量的增强UV-B辐射使植物积累活性氧(ROS)而对细胞构成威胁[26],在增强UV-B辐射处理下植物的保护机制启动,包括增强抗氧化酶活性和提高非酶保护性成分含量,其中非酶保护成分利用其还原性清除活性氧自由基,同时其中的类黄酮、还原型GSH和Vc等兼具吸收UV-B辐射的能力而可以耗散增强UV-B辐射胁迫[17, 27],本研究结果与其一致,尤其我们在多年多点的芒果田间试验中取得了具重演性的结果,证实这两种机制在芒果树中确实存在。增强UV-B辐射诱导芒果叶片积累芒果苷来增强其抗增强UV-B辐射胁迫能力,还未见有研究报道。芒果苷具有吸收UV-B辐射的能力和强大的抗氧化活性[28–29],意味着芒果叶片藉此耗散增强UV-B辐射胁迫和清除增强UV-B诱导产生的活性氧自由基,这种双重保护功效是芒果叶片抗增强UV-B辐射胁迫的重要特殊机制,是一个创新点。
芒果苷具有强大的抗氧化活性[28–29],意味着其对生命体具有重要的保健和医疗价值。芒果苷对脑缺血再灌注血液的大鼠能降低脑组织中丙二醛的含量,提高超氧化物歧化酶和谷胱甘肽过氧化物酶活性来改善其神经功能缺陷,对脑组织起到保护作用[30]。芒果苷还具有抗病毒、抗肿瘤、抗菌、抗炎、免疫、镇痛等多种药理活性[31–34]。本研究结果也意味着高剂量的增强UV-B辐射处理下的芒果叶片具有更高的保健和医疗价值,为增强UV-B辐射胁迫下的芒果叶片用作新型的医药、兽药、化妆品、食品和饲料等深加工开发提供了理论上的可能性,围绕芒果苷的利用而制定的芒果叶片深加工有关的理论和技术均有待进一步研究。本研究结果表明在芒果开始坐果时叶片芒果苷含量最高,此时是芒果叶片实现保健和医疗用途的采叶合理时期。当然, 在不同栽培条件下,在芒果树生命周期和年周期中合理的采叶时机还需更深入的探究。
24 kJ/(m2·d) UV-B处理未对‘台农1号’芒果成年树造成损伤,可能是通过提高类黄酮和还原型GSH的含量来清除活性氧自由基而免遭损伤;96 kJ/(m2·d) UV-B处理则引起了叶片活性氧损伤和抑制光合作用, 一方面叶片通过提高SOD、POD、CAT等抗氧化酶活性和提高多酚、类黄酮、还原型GSH、Vc和芒果苷等还原性成分含量来尽可能清除活性氧自由基,另一方面利用类黄酮、还原型GSH和芒果苷等成分吸收UV-B辐射而耗散其胁迫。在实践应用上,可以通过制定合理的栽培技术来诱导提高树体抗氧化酶活性、还原性保护成分的含量和补充Vc,进而提高芒果成年树耐增强UV-B辐射的能力。另外,增强UV-B辐射处理诱导芒果叶片积累更丰富的芒果苷,这可能提升了叶片开发为医药、兽药、饲料、化妆品和保健品等加工价值,为芒果叶片的深加工利用开创了新途径。
| [1] |
JANSEN M A K, GABA V, GREENBERG B M. Higher plants and UV-B radiation:Balancing damage, repair and acclimation[J]. Trends Plant Sci, 1998, 3(4): 131-135. DOI:10.1016/S1360-1385(98)01215-1 |
| [2] |
ULM R, JENKINS G I. Q & A:How do plants sense and respond to UV-B radiation?[J]. BMC Biol, 2015, 3: 45. DOI:10.1186/s12915-015-0156-y |
| [3] |
SHINDELL D T, RIND D, LONERGAN P. Increased polar stratospheric ozone losses and delayed eventual recovery owing to increasing green-house-gas concentrations[J]. Nature, 1998, 392(6676): 589-592. DOI:10.1038/33385 |
| [4] |
HAAPALA J K, MORSKY S K, SAARNIO S, et al. Carbon dioxide balance of a fen ecosystem in northern Finland under elevated UV-B radiation[J]. Glob Change Biol, 2009, 15(4): 943-954. DOI:10.1111/j.1365-2486.2008.01785.x |
| [5] |
TERAMURA A H, SULLIVAN J H. Effects of UV-B radiation on photosynthesis and growth of terrestrial plants[J]. Photosynth Res, 1994, 39(3): 463-473. DOI:10.1007/bf00014599 |
| [6] |
ROZEMA J, van de STAAIJ J, BJÖRN L O, et al. UV-B as an environmental factor in plant life:stress and regulation[J]. Trends Ecol Evol, 1997, 12(1): 22-28. DOI:10.1016/S0169-5347(96)10062-8 |
| [7] |
STRID Å, CHOW W S, ANDERSON J M. UV-B damage and protect-tion at the molecular level in plants[J]. Photosynth Res, 1994, 39(3): 475-489. DOI:10.1007/BF00014600 |
| [8] |
MORALES L O, TEGELBERG R, BROSCHÉ M, et al. Effects of solar UV-A and UV-B radiation on gene expression and phenolic accu-mulation in Betula pendula leaves[J]. Tree Physiol, 2010, 30(7): 923-934. DOI:10.1093/treephys/tpq051 |
| [9] |
ZHOU K B, LI S J, YUAN M L. The influences of enhanced UV-B radiation on yield and fruits quality and photosynthesis of mango trees[J]. Chin J Trop Crops, 2018, 39(6): 1102-1107. 周开兵, 李世军, 袁孟玲. 增强UV-B辐射对芒果株产和果实品质及光合作用的影响[J]. 热带作物学报, 2018, 39(6): 1102-1107. DOI:10.3969/j.issn.1000-2561.2018.06.010 |
| [10] |
YUAN M L, YUE K, WANG H, et al. Effects of enhanced UV-B radiation treatment on photosynthesis, yield and conventional quality of adult mango tree[J]. J S Agric, 2018, 49(5): 930-937. 袁孟玲, 岳堃, 王红, 等. 增强UV-B辐射对芒果成年树光合作用及其产量与常规品质的影响[J]. 南方农业学报, 2018, 49(5): 930-937. DOI:10.3969/j.issn.2095-1191.2018.05.15 |
| [11] |
LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 134-138. 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 134-138. |
| [12] |
CHEN A K, HAN R H, LI D Y, et al. A comparison of two methods for electrical conductivity about plant leaves[J]. J Guangdong Educ Inst, 2010, 30(5): 88-91. 陈爱葵, 韩瑞宏, 李东洋, 等. 植物叶片相对电导率测定方法比较研究[J]. 广东教育学院学报, 2010, 30(5): 88-91. DOI:10.3969/j.issn.1007-8754.2010.05.016 |
| [13] |
ZHANG S Q. Experimental Techniques of Plant Physiology[M]. Beijing: Science Press, 2011: 191-194. 张蜀秋. 植物生理学实验技术教程[M]. 北京: 科学出版社, 2011: 191-194. |
| [14] |
CHEN J X, WANG X F. Experimental Guidance of Plant Physiology Experiment[M]. Guangzhou: South China University of Technology Press, 2006: 76-77. 陈建勋, 王晓峰. 植物生理实验学实验指导[M]. 广州: 华南理工大学出版社, 2006: 76-77. |
| [15] |
ZHOU K B, WANG H, MEI W L, et al. Antioxidant activity of papaya seed extracts[J]. Molecules, 2011, 16(6): 6179-6192. DOI:10.3390/molecules16086179 |
| [16] |
FENG X, WANG S B, DENG J G, et al. Simultaneous determination of mangiferin and high mangiferin in mango leaves by high performance liquid chromatography[J]. Chin Tradit Pat Med, 2008, 30(10): 1504-1506. 冯旭, 王胜波, 邓家刚, 等. 高效液相色谱法同时测定芒果叶中芒果苷与高芒果苷的含量[J]. 中成药, 2008, 30(10): 1504-1506. DOI:10.3969/j.issn.1001-1528.2008.10.030 |
| [17] |
YANG L, ZHAO T H. The effect of enhanced UV-B radiation on soybean root's activate oxygen metabolism and antioxidative system[J]. N China Agric J, 2018, 33(5): 174-180. 杨璐, 赵天宏. UV-B辐射增强对大豆根系活性氧代谢及抗氧化系统的影响[J]. 华北农学报, 2018, 33(5): 174-180. DOI:10.7668/hbnxb.2018.05.024 |
| [18] |
TEVINI M, BRAUN J, FIESER G. The protective function of the epidermal layer of rye seedlings against ultraviolet-B radiation[J]. Photochem Photobiol, 1991, 53(3): 329-333. DOI:10.1111/j.1751-1097.1991.tb03636.x |
| [19] |
YUAN M L, YUE K, WANG H, et al. Damages and responses on antioxidance of 'Tainong No. 1' Mango adult trees under treatment of enhanced UV-B radiation[J]. Chin J Trop Crops, 2018, 39(9): 1724-1731. 袁孟玲, 岳堃, 王红, 等. '台农一号'芒果成年树在增强UV-B辐射处理下的损伤及其抗氧化响应[J]. 热带作物学报, 2018, 39(9): 1724-1731. DOI:10.3969/j.issn.1000-2561.2018.09.007 |
| [20] |
ZHOU K B, LI S J, YUAN M L, et al. The injures and the responses on antioxidation of adult mango trees under the treatments of enhanced UV-B radiation[J]. Acta Hort Sin, 2019. 周开兵, 李世军, 袁梦玲, 等. 杧果成年树在增强UV-B辐射处理下的损伤与抗氧化响应[J]. 园艺学报, 2019. DOI:10.16420/j.issn.0513-353x.2018-0448 |
| [21] |
LIU P, ZHOU K B, WANG S, et al. Damages and protection responses of Mangifera indica L. leaves with different age under enhanced UV-B radiation[J]. J Trop Org, 2010, 1(4): 350-356. 刘鹏, 周开兵, 王爽, 等. 芒果不同叶龄叶片在增强UV-B辐射处理下的损伤和保护响应[J]. 热带生物学报, 2010, 1(4): 350-356. DOI:10.3969/j.issn.1674-7054.2010.04.011 |
| [22] |
MURPHY T F. Effect of broad-band ultraviolet and visible radiation on hydrogen peroxide formation by cultured rose cells[J]. Physiol Plant, 1990, 80(1): 63-68. DOI:10.1111/j.1399-3054.1990.tb04375.x |
| [23] |
LIU J C, ZHAO Y J, SONG H Y, et al. Antagonism or synergism? combined effects of enhanced UV-B radiation and acid rain on photo-synthesis in seedlings of two C4 plants[J/OL]. Acta Ecol Sin, (2019-01-02). doi: 10.1016/j.chnaes.2018.12.009.
|
| [24] |
DU Z K. The Physio-ecological effects and molecular mechanisms of enhanced UV-B radiation on peanut (Arachis hypogaea L.)[D]. Chong-qing: Southwest University, 2014: 1-121. 杜照奎. UV-B辐射增强对花生的生理生态影响及其分子机制[D].重庆: 西南大学, 2014: 1-121. |
| [25] |
ZHOU X M, ZHANG Z W, HUI Z M, et al. Effects of enhanced ultraviolet-B radiation on diurnal variations of photosynthesis in grape-vine[J]. Trans Chin Soc Agric Eng, 2009, 25(3): 209-212. 周新明, 张振文, 惠竹梅, 等. UV-B辐射增强对葡萄光合作用日变化的影响[J]. 农业工程学报, 2009, 25(3): 209-212. |
| [26] |
HIDEG É, JANSEN M A K, STRID Å. UV-B exposure, ROS, and stress:Inseparable companions or loosely linked associates?[J]. Trends Plant Sci, 2013, 18(2): 107-115. DOI:10.1016/j.tplants.2012.09.003 |
| [27] |
CZÉGÉNY G, LE MARTRET B, PÁVKOVICS D, et al. Elevated ROS-scavenging enzymes contribute to acclimation to UV-B exposure in transplastomic tobacco plants, reducing the role of plastid peroxi-dases[J]. J Plant Physiol, 2016, 201: 95-100. DOI:10.1016/j.jplph.2016.05.026 |
| [28] |
KULKARNI V M, RATHOD V K. Mapping of an ultrasonic bath for ultrasound assisted extraction of mangiferin from Mangifera indica leaves[J]. Ultrason Sonochem, 2014, 21(2): 606-611. DOI:10.1016/j.ultsonch.2013.08.021 |
| [29] |
DU S Y, LIU H R, LEI T T, et al. Mangiferin:An effective therapeutic agent against several disorders (Review)[J]. Mol Med Rep, 2018, 18(6): 4775-4786. DOI:10.3892/mmr.2018.9529 |
| [30] |
TAN A X, ZHU Y B, LI X Y. Effect of mangiferin on antioxidant system in rats with cerebral ischemia reperfusion[J]. Lishizhen Med Mat Med Res, 2012, 23(1): 161-162. 谭安雄, 朱耀斌, 李小云. 芒果苷对脑缺血再灌注大鼠抗氧化系统的影响[J]. 时珍国医国药, 2012, 23(1): 161-162. DOI:10.3969/j.issn.1008-0805.2012.01.071 |
| [31] |
LI L, JIANG X F, ZHANG Z B, et al. Study on antioxidant activity of crude extract of suede and mango skin[J]. J Univ Electr Sci Technol, 2003, 32(6): 755-759. 李琳, 姜新发, 张志斌, 等. 枇杷皮和芒果皮粗提液抗氧化活性研究[J]. 电子科技大学学报, 2003, 32(6): 755-759. DOI:10.3969/j.issn.1001-0548.2003.06.041 |
| [32] |
BERARDINI N, FEZER R, CONRAD J, et al. Screening of mango (Mangifera indica L.) cultivars for their contents of flavonol O- and xanthone C-glycosides, anthocyanins, and pectin[J]. J Agric Food Chem, 2005, 53(5): 1563-1570. DOI:10.1021/jf0484069 |
| [33] |
LIAO H L, SU C L, HU X L, et al. New advanced research on the pharmacology of mangiferin[J]. J Pharm Pract, 2008, 26(3): 161-162. 廖洪利, 苏春丽, 胡小兰, 等. 芒果苷药理研究新进展[J]. 药学实践杂志, 2008, 26(3): 161-162. DOI:10.3969/j.issn.1006-0111.2008.03.001 |
| [34] |
DORTA E, GONZÁLEZ M, LOBO M G, et al. Screening of phenolic compounds in by-product extracts from mangoes (Mangifera indica L.) by HPLC-ESI-QTOF-MS and multivariate analysis for use as a food ingredient[J]. Food Res Int, 2014, 57: 51-60. DOI:10.1016/j.foodres.2014.01.012 |
 2020, Vol. 28
2020, Vol. 28


