植物在自然环境中常遭受强光、极端温度、干旱等环境条件胁迫[1],为适应环境,植物会发生形态结构及生理生化功能的改变[2]。随着全球气候改变和气候异常事件发生频率增加,干旱胁迫越来越成为影响植物生长、生存的重要因素。干旱多指水分收支或供求不均衡所致的水分短缺[3],对植物的影响主要表现在抑制生长、降低光合、过氧化伤害和营养代谢失衡等[4]方面。植物在进化过程中已形成多种响应、适应干旱的方式,如形态结构[5-6]、生理功能[7]、代谢[8]和细胞水平[9]上的改变。
兰科(Orchidaceae)植物广泛分布于热带、亚热带地区,生物多样性极其丰富,形成了耐干旱或喜半阴等不同生态生理类型[10]。五唇兰(Phalaenopsis pulcherrima)为兰科蝴蝶兰属多年生常绿草本植物[11-12],为东亚特有种,在我国仅分布于海南岛海拔200~500 m的热带季雨林稀疏林下落叶层或花岗岩上[13-14]。五唇兰具有明显的气生根和附生(岩石)习性[15],原生境具有明显干湿季[16],附生在裸露岩石上的五唇兰在冬季极易遭受干旱胁迫,此时正是五唇兰的结荚期[12],水分极大地影响果实的发育和种子数量。因此研究干旱对五唇兰生长的影响,探讨其对水分的需求规律,对于兰花保育和引种栽培具有十分重要的意义。原生境条件下,五唇兰为附生,以树皮或岩石为基质,根系多暴露在空气中,因此采用土壤水分控制试验不适合于此类植物。聚乙二醇(polyethylene glycol, PEG)具有良好的水溶性,用不同浓度PEG溶液浇灌可以影响植物对水分的吸收,从而模拟干旱胁迫。前人已采用PEG模拟水分胁迫,对植物生长[17]、渗透调节物质[18-20]、抗氧化系统[8, 20]等的影响进行研究。因此,本试验采用PEG模拟干旱胁迫,对五唇兰叶片的光合色素、渗透调节物质和非结构碳水化合物含量进行测定,探讨干旱对五唇兰生长的影响,为五唇兰栽培、保育研究提供理论支撑。
1 材料和方法 1.1 供试材料于2018年5-6月,选取长势一致的3 a生五唇兰(Phalaenopsis pulcherrima)组培中苗(由东方迦南兰花产业有限公司提供),在海南大学开展试验。
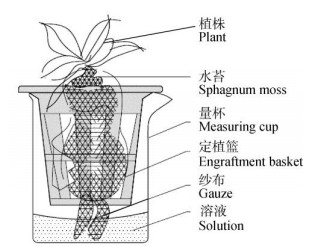
1.2 设计设置4个处理,分别配制5%、10%和20%的PEG 6000溶液(以下简称PEG)为胁迫处理,以清水为对照(CK),采用随机区组设计,每处理3次重复,每处理10盆。试验于LRH-250-Gb型光照培养箱中进行,光强63 μmol/(m2·s),光周期12 h/12 h (光/暗),昼夜温度为26℃/24℃。试验设计采用图 1方式,即由纱布(20 cm×20 cm)、量杯(100 mL)、定植篮(高55 mm, 外径60 mm, 内径43.5 mm)共3部分构成,量杯用于盛装处理溶液(液面低于定植篮底部);定植篮可维持根系的位置,保持通气;纱布用于裹覆少量水苔(用于保水)于五唇兰根部,其下端浸入处理溶液中起到引流作用,每5 d测定溶液浓度并补充水分,以保持其浓度。
|
图 1 PEG胁迫处理装置设计 Fig. 1 Design of PEG-stress treatment device |
处理后每5 d对五唇兰倒3叶进行生理生化指标测定。叶绿素(Chl)含量采用混合液(丙酮:乙醇=1:1)提取,紫外可见分光光度计测定吸光值;可溶性糖、淀粉含量采用蒽酮比色法[21];可溶性蛋白含量采用苏州科铭生物技术有限公司提供的BCA法蛋白含量试剂盒测定。植株含水量(%)=(植株鲜质量-干质量)/鲜质量×100%;非结构性碳水化合物(non- structural carbohydrate, NSC)=可溶性糖(soluble sugar, SS)+淀粉(starch, St) [22]。
1.4 数据统计和分析采用Excel 2016和SPSS 20.0对数据进行统计分析,采用单因素方差分析(One-Way ANOVA)和Duncan检验比较数据间的差异显著性。
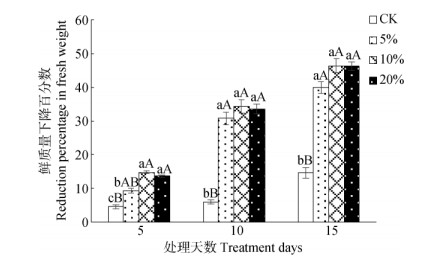
2 结果和分析 2.1 对植株鲜质量的影响PEG胁迫后,五唇兰植株鲜质量显著下降,且随PEG浓度升高和处理时间延长,植株鲜质量下降更加显著(图 2)。10%和20% PEG处理5 d的鲜质量与对照间达极显著差异(P < 0.01),植株已出现较明显失水症状,第10天后各处理与对照间均已达到极显著差异(P < 0.01)。
|
图 2 PEG胁迫对五唇兰植株鲜重的影响。柱上不同小写和大写字母分别表示差异显著(P < 0.05)和极显著(P < 0.01)。以下图同 Fig. 2 Effects of PEG stress on fresh weight of Phalaenopsis pulcherrima. Different small and capital letters upon column indicate significant differences at 0.05 and 0.01 levels, respectively. The same is following Figures |
相关性分析表明,植株鲜质量下降百分数(与0 d相比植株鲜质量下降量占0 d植株鲜质量的百分数)与PEG浓度间存在明显相关性,用二项式曲线(图 3)进行模拟,结果表明,影响效果最显著的PEG浓度范围为13.75%~14.72%。

|
图 3 鲜质量下降百分数与PEG浓度的相关性 Fig. 3 Correlation between reduction percentage in fresh weight and PEG concentration |
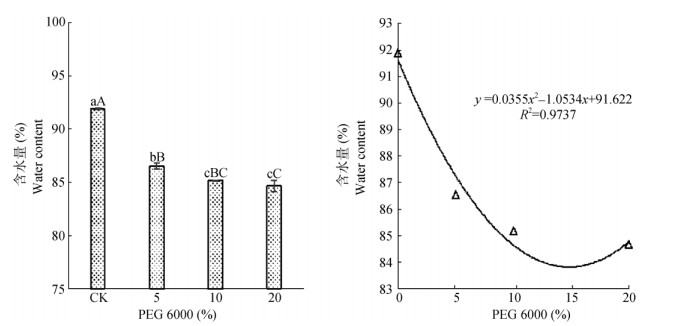
对处理15 d的五唇兰植株含水量进行测量,结果表明(图 4),PEG胁迫使五唇兰植株含水量极显著(P < 0.01)低于对照,且PEG浓度越高,植株含水量越低。5%与20%处理间的差异达极显著水平(P < 0.01),5%与10%处理间的差异显著(P < 0.05), 而10%与20%处理间的差异不显著。
|
图 4 PEG对植株含水量的影响及其相关性 Fig. 4 Effect of PEG on plant water content and their correlation |
植株含水量与PEG浓度间存在显著相关性(图 4),PEG浓度在0~14.84%时,随PEG浓度升高, 植株含水量呈递减趋势,PEG浓度为14.84%时降至最低点。
2.3 对叶片光合色素含量的影响PEG处理导致五唇兰叶片的Chl a、Chl b含量下降(表 1),PEG浓度越高下降得越显著,且PEG处理的Chl a、Chl b和Chl a+b含量与对照间均存在极显著差异(P < 0.01)。20%与5%、10% PEG处理的Chl a和Chl a+b含量均存在极显著差异(P < 0.01); Chl b含量存在显著差异(P < 0.05);而5%和10% PEG处理间无显著差异; Chl a/b随PEG浓度升高,呈现先上升后下降的趋势,但差异均不显著。
| 表 1 PEG胁迫对五唇兰叶片叶绿素含量的影响 Table 1 Effect of PEG stress on chlorophyll contents in Phalaenopsis pulcherrima leaves |
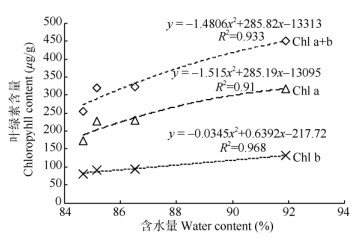
叶片Chl a、Chl b和Chl a+b含量与植株含水量的相关性分析表明(图 5),五唇兰叶片叶绿素含量与植株含水量间存在极显著正相关关系(P < 0.01), 植株含水量越低,五唇兰叶片的叶绿素含量越低。
|
图 5 叶绿素含量与植株含水量的相关性 Fig. 5 Correlation between chlorophyll contents and plant water content |
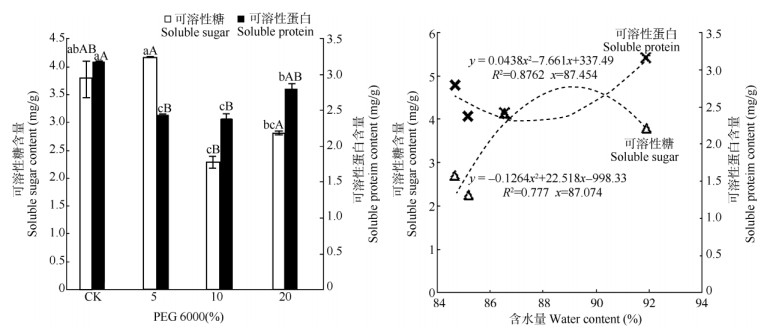
随着PEG处理浓度升高,五唇兰叶片可溶性蛋白含量呈先下降后上升的趋势(图 6),各处理与对照间均存在显著差异(P < 0.05),其中5%、10% PEG处理与对照间存在极显著差异(P < 0.01)。而叶片的可溶性糖(SS)含量呈先上升后下降的趋势。与对照相比,除5% PEG处理的可溶性糖含量提高外,10%、20% PEG处理的均下降,这表明低浓度的PEG处理使五唇兰叶片可溶性糖含量升高,而较高浓度则下降。
|
图 6 PEG对渗透调节物质含量的影响及其相关性 Fig. 6 Effect of PEG on osmotic material contents and their correlation |
叶片可溶性蛋白、可溶性糖含量与植株含水量的相关分析表明(图 6),植株含水量在87.45%~ 91.89%时,叶片可溶性蛋白含量会随植株含水量下降而下降,植株含水量低于87.45%时叶片可溶性蛋白含量有回升趋势。植株含水量在89.07%~91.89%时,随植株含水量的降低叶片可溶性糖含量呈升高趋势,若植株含水量低于89.07%时,叶片可溶性糖含量呈减少趋势。
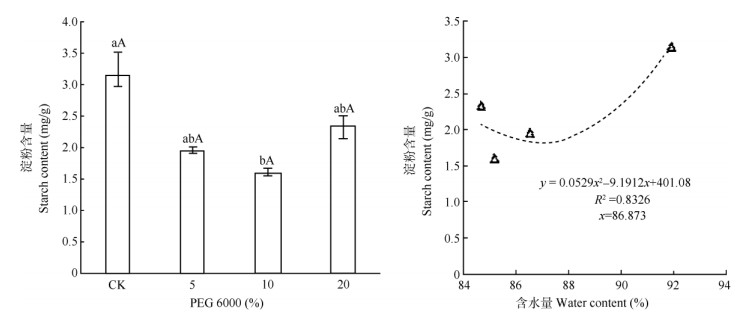
2.5 对叶片淀粉含量的影响随着PEG处理浓度升高,五唇兰叶片淀粉(St)含量呈先下降后上升的趋势(图 7)。除10% PEG处理与对照间存在显著差异外(P < 0.05),其余处理与对照间均无显著差异。与植株含水量的相关性分析表明,植株含水量在86.87%~91.89%时,随植株含水量的降低叶片淀粉含量呈降低趋势,而植株含水量小于86.87%时,叶片淀粉含量有回升趋势。
|
图 7 PEG对五唇兰叶片淀粉含量的影响及其相关性 Fig. 7 Effect of PEG on starch content in Phalaenopsis pulcherrima leaves and their correlation |
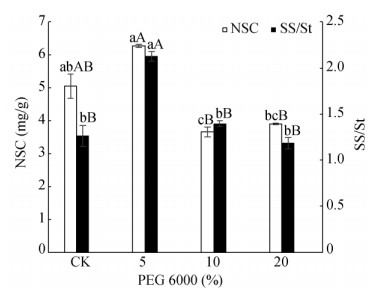
从图 8可见,随PEG浓度的升高非结构性碳水化合物(NSC)含量和SS/St均呈先上升后下降的趋势。5% PEG处理的SS/St极显著高于对照和10%、20% PEG处理(P < 0.01)。5% PEG处理的NSC含量极显著(P < 0.01)高于10%、20%处理(P < 0.01),但与对照间无显著差异。
|
图 8 PEG对五唇兰叶片NSC含量和SS/St的影响 Fig. 8 Effect of PEG on NSC and SS/St |
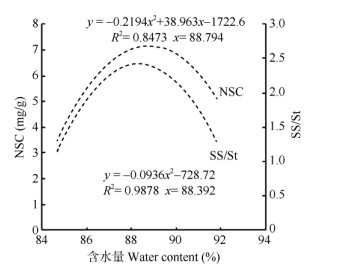
从图 9可见,植株含水量在88.79%~91.89%时,随植株含水量的降低叶片NSC含量呈上升趋势, 而植株含水量小于88.79%时,NSC含量则呈下降趋势; 植株含水量在88.39%~91.89%时,随植株含水量的降低叶片SS/St呈上升趋势,而植株含水量小于88.39%时,SS/St呈下降趋势。
|
图 9 NSC含量和SS/St与植株含水量的相关性 Fig. 9 Correlation between NSC content, SS/St and water content |
干旱胁迫影响植物正常生长发育和生殖[23-25], 导致叶片失水,气孔密度增大,而气孔开张度、气孔导度和开放率的降低,叶绿体内部构造发生改变[26-27], 叶片叶绿素合成下降而分解加快[28]。叶绿体色素在植物光能吸收、传递与转换中发挥重要作用[29]。Chl a和b能够捕获、传递光能,只有少数特殊状态的Chl a分子具有将光能转变为电能的作用[30]。本研究结果表明,PEG处理浓度越高, 五唇兰叶片的Chl a、Chl b和Chl a+b含量越低。Chl a/b可反映植物叶片内囊体垛叠程度和光合能力高低, 本研究中,高浓度PEG胁迫降低了五唇兰叶片的Chl a/b, 可能与光合系统完整性遭破坏有关[31]。
植物在受到水分胁迫后通常会通过改变可溶性蛋白、可溶性糖等渗透调节物质含量以维持膨压[32]。渗透调节物质含量与植物的渗透调节能力密切相关[33-34]。有研究表明,在植物胁迫响应中,可溶性蛋白含量的提高可促进下游物质合成,从而为机体缓冲环境改变所造成的生物合成、代谢改变提供物质和能量基础[35]。可溶性糖是植物光合产物,是植物生命活动利用碳水化合物的直接形式[36],在逆境胁迫下可溶性糖含量的增加会引起渗透势下降, 有利于细胞持水,减轻胁迫伤害[37]。本研究中,随着植株含水量的降低,叶片可溶性蛋白含量总体呈下降趋势,而可溶性糖含量呈先升后降趋势,可能与植物相对较低程度失水状况下抗胁迫响应及胁迫超过耐受极限其合成受阻有关。
淀粉是高等植物合成的碳水化合物之一,在光合组织叶绿体中合成存储的淀粉含量在一定程度上可以反映叶片的光合存储能力。淀粉含量的降低一方面可能是叶片的光合作用受抑制导致淀粉合成存储量降低,另一方面也可能是植物调动淀粉作为碳库来缓减碳失衡[38-39]。本研究结果表明,五唇兰叶片的淀粉含量随植株含水量的降低呈下降趋势,这可能一方面是干旱胁迫下五唇兰光合色素含量降低,导致光合能力下降,淀粉合成减少;另一方面是在植物可耐受干旱胁迫下,植物动用存储的淀粉转化为可溶性糖来维持细胞渗透压[40]。
非结构性碳水化合物(NSC, 主要包括可溶性糖和淀粉)作为植物光合产物参与植物重要生命过程[22], NSC含量反映植物碳摄入(光合作用)与碳消耗(生长与呼吸)的平衡关系[41],同时表征植物可用于抗逆的碳水化合物含量[42-43]。水分胁迫一般会使叶片的蔗糖合成增加,淀粉合成减少,致使蔗糖积累而淀粉含量减少[21]。相关分析表明,随着植株含水量的下降,NSC、SS/St均呈先升后降趋势。在轻度胁迫下,植株存储更多的NSC来缓冲胁迫伤害[44]。而SS/St的升高可能与植物在逆境条件下保持更高比例的可溶性糖以维持细胞渗透有关。严重失水状况下NSC与SS/St的下降则与植物叶片光合受阻有关。
干旱胁迫显著降低五唇兰叶绿素含量,影响叶片光合能力和光合产物积累[45]。轻度胁迫下,五唇兰叶片淀粉含量降低而可溶性糖含量上升,致使NSC与SS/St升高,以维持五唇兰正常生理活动。随着胁迫加剧,可溶性糖、NSC含量及SS/St均下降,说明干旱对五唇兰的正常生理代谢的破坏作用逐渐明显。
| [1] |
BIEHLER K, FOCK H. Evidence for the contribution of the mehler- peroxidase reaction in dissipating excess electrons in drought-stressed wheat[J]. Plant Physiol, 1996, 112: 265-272. DOI:10.1104/pp.112.1.265 |
| [2] |
LI Z L. The morphology and structure of xerophytes[J]. Bull Biol, 1981(4): 9-12. 李正理. 旱生植物的形态和结构[J]. 生物学通报, 1981(4): 9-12. |
| [3] |
WANG J S, LI Y H, WANG R Y, et al. Preliminary analysis on the demand and review of progress in the field of meteorological drought research[J]. J Arid Meteor, 2012, 30(4): 497-508. 王劲松, 李耀辉, 王润元, 等. 我国气象干旱研究进展评述[J]. 干旱气象, 2012, 30(4): 497-508. |
| [4] |
ZHANG J M, REN X X, QIN W, et al. Effects of drought stress on antioxidant enzyme activities, chlorophyll fluorescence parameters and root activity of watermelon leaves[J]. Tianjin Agric Sci, 2018, 24(11): 1-3. 张金民, 任晓雪, 秦伟, 等. 干旱胁迫对西瓜叶抗氧化酶活性、叶绿素荧光参数及根系活力的影响[J]. 天津农业科学, 2018, 24(11): 1-3. DOI:10.3969/j.issn.1006-6500.2018.11.001 |
| [5] |
GAO L. Effects of drought stress on plant[J]. Fujian Agric, 2014(8): 19. 高蕾. 干旱胁迫对植物的影响[J]. 福建农业, 2014(8): 19. |
| [6] |
SUN X Z, ZHENG C S, WANG X F. Advances of drought tolerant mechanism in woody plant[J]. Acta Bot Boreal-Occid Sin, 2007, 27(3): 629-634. 孙宪芝, 郑成淑, 王秀峰. 木本植物抗旱机理研究进展[J]. 西北植物学报, 2007, 27(3): 629-634. DOI:10.3321/j.issn:1000-4025.2007.03.037 |
| [7] |
DINU Q X, LIU J, GAO J. Physiological response of Brachypodium sylvaticum under simulated drought stress by polyethylene glycol (PEG-6000)[J]. Acta Agrest Sin, 2016, 24(5): 995-1000. 丁青霞, 刘佳, 高菊. 小颖短柄草对PEG-6000模拟干旱胁迫的生理响应[J]. 草地学报, 2016, 24(5): 995-1000. DOI:10.11733/j.issn.1007-0435.2016.05.010 |
| [8] |
ZHOU Q, CAO J C, CUI M K, et al. Roles of non-structural sugars in response and adaptation of plants to drought stress[J]. J Anhui Agric Sci, 2018, 46(30): 24-28. 周倩, 曹家畅, 崔明昆, 等. 非结构性糖在植物对干旱胁迫响应与适应中的作用[J]. 安徽农业科学, 2018, 46(30): 24-28. DOI:10.13989/j.cnki.0517-6611.2018.30.008 |
| [9] |
ZHANG L L, YU H X, MENG H T, et al. Physiological and bioche- mical response of Panax quinquefolius to drought stress[J]. Spec Wild Econ Anim Plant Res, 2018, 40(4): 16-20. 张淋淋, 于红霞, 孟洪涛, 等. 西洋参对干旱胁迫的生理生化反应[J]. 特产研究, 2018, 40(4): 16-20. DOI:10.16720/j.cnki.tcyj.2018.04.003 |
| [10] |
DENG H. The study of crassulacean acid metabolism (CAM) photo- synthesis in orchids[D]. Beijing: Chinese Academy of Forestry, 2015: 1–100. 邓华.兰科植物景天酸代谢(CAM)途径研究[D].北京: 中国林业科学研究院, 2015: 1–100. |
| [11] |
TSAI C C, CHIANG Y C, HUANG S C, et al. Molecular phylogeny of Phalaenopsis Blume (Orchidaceae) on the basis of plastid and nuclear DNA[J]. Plant Syst Evol, 2010, 288(1/2): 77-98. |
| [12] |
YANG Q. Population monitor and re-introduction of Phalaenopsis pulcherrima Lindl. (Orchidaceae) in the original habitat[D]. Haikou: Hainan University, 2013: 1–53. 杨琪.五唇兰野外种群监测和重引入研究[D].海口: 海南大学, 2013: 1–53. |
| [13] |
JI Z H, CHEN X Q, LUO Y B, et al. Florae Reipublicae Popularis Sinicae, Tomus 19[M]. Beijing: Science Press, 1999: 276-278. 吉占和, 陈心启, 罗毅波, 等. 中国植物志, 第19卷[M]. 北京: 科学出版社, 1999: 276-278. |
| [14] |
JIN X H, LI D Z, REN Z X, et al. A generalized deceptive pollination system of Doritis pulcherrima (Aeridinae: Orchidaceae) with non- reconfigured pollinaria[J]. BMC Plant Biol, 2012, 12: 67. DOI:10.1186/1471-2229-12-67 |
| [15] |
SONG X Q. Tropical Floriculture[M]. Beijing: China Forestry Publishing House, 2009: 263-273. 宋希强. 热带花卉学[M]. 北京: 中国林业出版社, 2009: 263-273. |
| [16] |
LONG W X, DING Y, ZANG R G, et al. Environmental characteristics of tropical cloud forests in the rainy season in Bawangling National Nature Reserve on Hainan Island, south China[J]. Chin J Plant Ecol, 2011, 35(2): 137-146. 龙文兴, 丁易, 臧润国, 等. 海南岛霸王岭热带云雾林雨季的环境特征[J]. 植物生态学报, 2011, 35(2): 137-146. DOI:10.3724/SP.J.1258.2011.00137 |
| [17] |
DONG X Y, MI C, LIU Z G, et al. Response of winter rapessed seeding growth and physiological characteristics under PEG drought tolerance[J]. J Henan Agric Univ, 2018, 52(3): 313-321. 董小云, 米超, 刘自刚, 等. PEG模拟水分胁迫对白菜型冬油菜幼苗生长及生长特性的影响[J]. 河南农业大学学报, 2018, 52(3): 313-321. DOI:10.16445/j.cnki.1000-2340.2018.03.002 |
| [18] |
DU H, MA T T, GUO S, et al. Response of root morphology and leaf osmoregulation substances of seedling in barley genotypes with different heights to PEG stress[J]. Sci Agric Sin, 2017, 50(13): 2423-2432. 杜欢, 马彤彤, 郭帅, 等. 大麦近等基因系苗期根系形态及叶片渗透调节物质对PEG胁迫的响应[J]. 中国农业科学, 2017, 50(13): 2423-2432. DOI:10.3864/j.issn.0578-1752.2017.13.002 |
| [19] |
GUO Y Y, YU H Y, KONG D S, et al. Response of seed germination of Lycium ruthenicum to PEG-simulated drought stress[J]. Bull Soil Water Cons, 2017, 37(5): 98-102. 郭有燕, 余宏远, 孔东升, 等. 黑果枸杞种子萌发对PEG模拟干旱胁迫的响应[J]. 水土保持通报, 2017, 37(5): 98-102. DOI:10.13961/j.cnki.stbctb.2017.05.017 |
| [20] |
CHEN X, YANG P J, ZHANG X Q, et al. Physiological response of transgenic tobacco to drought stress simulated by PEG 6000[J]. Guihaia, 2016, 36(12): 1498-1504. 陈霞, 杨鹏军, 张旭强, 等. 转基因烟草在PEG 6000模拟干旱胁迫条件下的生理响应[J]. 广西植物, 2016, 36(12): 1498-1504. DOI:10.11931/guihaia.gxzw201510024 |
| [21] |
LIU Z D. The study of transformation mechanism of morphology and physiology in the switch from C3-photosynthesis to Crassulacean acid metabolism of Dendrobium [D]. Wuhan: Huazhong Agricultural University, 2014: 14–15. 刘张栋.石斛属植物C3/CAM代谢转换中形态结构及生理生化转变研究[D].武汉: 华中农业大学, 2014: 14–15. |
| [22] |
DU Y, HAN Y, WANG C K. The influence of drought on non-structural carbohydrates in the needles and twigs of Larix gmelinii[J]. Acta Ecol Sin, 2014, 34(21): 6090-6100. 杜尧, 韩轶, 王传宽. 干旱对兴安落叶松枝叶非结构性碳水化合物的影响[J]. 生态学报, 2014, 34(21): 6090-6100. DOI:10.5846/stxb201401260198 |
| [23] |
MA Y P, SUN L L, MA X Q. Ecophysiological responses of summer maize to drought and waterlogging in Huang-Huai-Hai Plain[J]. Agric Res Arid Areas, 2016, 34(4): 85-93. 马玉平, 孙琳丽, 马晓群. 黄淮海地区夏玉米对干旱和涝渍的生理生态反应[J]. 干旱地区农业研究, 2016, 34(4): 85-93. DOI:10.7606/j.issn.1000-7601.2016.04.13 |
| [24] |
CHEN X, KANG Y, GONG L S, et al. Effect of water on cotton growth and yield in jujube-cotton intercropping system[J]. J Tarim Univ, 2018, 30(4): 44-50. 陈旭, 康郁, 龚莉莎, 等. 枣棉间作下水分对棉花生长发育的影响[J]. 塔里木大学学报, 2018, 30(4): 44-50. DOI:10.3969/j.issn.1009-0568.2018.04.007 |
| [25] |
WANG X L, XU Z H, WEI W C, et al. Effect of drought stress on growth and carbonic anhydrase activity of Pinus yunnanensis seedlings[J]. J Shandong Agric Univ (Nat Sci), 2019, 50(1): 6-11. 王晓丽, 徐志鸿, 韦文长, 等. 干旱胁迫对云南松苗木生长及碳酸酐酶的影响[J]. 山东农业大学学报(自然科学版), 2019, 50(1): 6-11. DOI:10.3969/j.issn.1000-2324.2019.01.002 |
| [26] |
CHEN W R, ZENG W W, LI Y X, et al. The physiological responds of highbush blueberry to drought stress and the comprehensive evaluation on their drought resistance capacity[J]. Acta Hort Sin, 2012, 39(4): 637-646. 陈文荣, 曾玮玮, 李云霞, 等. 高丛蓝莓对干旱胁迫的生理响应及其抗旱性综合评价[J]. 园艺学报, 2012, 39(4): 637-646. DOI:10.16420/j.issn.0513-353x.2012.04.006 |
| [27] |
WU J H, GUO Y, CUI Y T. Effects of water stress on ultrastructure and photosynthetic physiological factors of Potentilla sericea[J]. Pratac Sci, 2012, 29(3): 434-439. 吴建慧, 郭瑶, 崔艳桃. 水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响[J]. 草业科学, 2012, 29(3): 434-439. |
| [28] |
MOHANTY S, GRIMM B, TRIPATHY B C. Light and dark modu- lation of chlorophyll biosynthetic genes in response to temperature[J]. Planta, 2006, 224(3): 692-699. DOI:10.1007/s00425-006-0248-6 |
| [29] |
QIN Y M, HAN F Y, LIU S H, et al. Effects of silicon on growth, photosynthetic pigment and photosynthetic characteristics of sand culture potato[J]. Jiangsu Agric Sci, 2018, 46(20): 72-75. 秦永梅, 韩凤英, 刘素慧, 等. 硅对沙培马铃薯生长发育、光合色素与光合特性的影响[J]. 江苏农业科学, 2018, 46(20): 72-75. DOI:10.15889/j.issn.1002-1302.2018.20.018 |
| [30] |
HOU W, SUN A H, YANG F S, et al. Effects of low temperature stress on photosynthesis and chlorophyll fluorescence in watermelon seedlings[J]. Guangdong Agric Sci, 2014, 41(13): 35-39. 侯伟, 孙爱花, 杨福孙, 等. 低温胁迫对西瓜幼苗光合作用与叶绿素荧光特性的影响[J]. 广东农业科学, 2014, 41(13): 35-39. DOI:10.3969/j.issn.1004-874X.2014.13.008 |
| [31] |
YUAN G Q, LIU Y, WU J C, et al. Response of growth and photo- synthesis of mulberry and birch under three soil types to simulated flooding in the Three Gorges Reservoir Region[J]. J NW Agric For Univ (Nat Sci), 2018, 46(6): 1-10. 袁贵琼, 刘芸, 邬静淳, 等. 3种土壤类型下桑树和水桦生长及光合对模拟三峡库区消落带水淹的响应[J]. 西北农林科技大学学报(自然科学版), 2018, 46(6): 1-10. DOI:10.13207/j.cnki.jnwafu.2018.06.009 |
| [32] |
ZHANG Z H, GONG J R, YAN X, et al. Effects of grazing on photosynthetic characteristics of Leymus chinensis in meadow steppe of Inner Mongolia, China[J]. Acta Pratacult Sin, 2018, 27(11): 36-48. 张子荷, 龚吉蕊, 晏欣, 等. 放牧干扰对内蒙古草甸草原羊草光合特性的影响[J]. 草业学报, 2018, 27(11): 36-48. DOI:10.11686/cyxb2017516 |
| [33] |
VURUKONDA S S K P, VARDHARAJULA S, SHRIVASTAVA M, et al. Enhancement of drought stress tolerance in crops by plant growth promoting rhizobacteria[J]. Microbiol Res, 2016, 184: 13-24. DOI:10.1016/j.micres.2015.12.003 |
| [34] |
SONG J X, LÜ J, ZONG X F, et al. Effects of brassinolide and N, P, K fertiliser on growth of Leymus chinensis under drought stress[J]. Acta Pratacult Sin, 2018, 27(11): 171-178. 宋吉轩, 吕俊, 宗学凤, 等. 干旱胁迫下BR与N、P、K配合对羊草生长及抗旱性的影响[J]. 草业学报, 2018, 27(11): 171-178. DOI:10.11686/cyxb2017512 |
| [35] |
WANG D, XUAN J P, ZHU X C, et al. Relationships of freezing tolerance and the contents of carbohydrates, proline, protein in centipe- degrass[Eremochloa ophiuroides (Munro.) Hack.][J]. Acta Agrest Sin, 2010, 18(6): 816-822. 王丹, 宣继萍, 朱小晨, 等. 假俭草抗寒性与体内碳水化合物、脯氨酸、可溶性蛋白含量的关系[J]. 草地学报, 2010, 18(6): 816-822. DOI:10.11733/j.issn.1007-0435.2010.06.012 |
| [36] |
WU Y, SU H N, HUANG A J, et al. Effect of Candidatus liberibacter asiaticus infection on carbohydrate metabolism in Citrus sinensis[J]. Sci Agric Sin, 2015, 48(1): 63-72. 吴越, 苏华楠, 黄爱军, 等. 柑橘黄龙病菌侵染对甜橙叶片糖代谢的影响[J]. 中国农业科学, 2015, 48(1): 63-72. DOI:10.3864/j.issn.0578-1752.2015.01.07 |
| [37] |
GUO H J. Research progress on osmotic adjustment material under water stress[J]. J Anhui Agric Sci, 2010, 38(15): 7750-7753. 郭华军. 水分胁迫过程中的渗透调节物质及其研究进展[J]. 安徽农业科学, 2010, 38(15): 7750-7753. DOI:10.3969/j.issn.0517-6611.2010.15.013 |
| [38] |
ZHU Y R, LIU M M, LI Y H, et al. Research advance in regulation mechanism of starch synthesis in plants[J]. Plant Physiol J, 2013, 49(12): 1319-1325. 朱晔荣, 刘苗苗, 李亚辉, 等. 植物淀粉生物合成调节机制的研究进展[J]. 植物生理学报, 2013, 49(12): 1319-1325. DOI:10.13592/j.cnki.ppj.2013.12.024 |
| [39] |
GIBON Y, PYL E T, SULPICE R, et al. Adjustment of growth, starch turnover, protein content and central metabolism to a decrease of the carbon supply when Arabidopsis is grown in very short photoperiods[J]. Plant Cell Environ, 2009, 32(7): 859-874. DOI:10.1111/j.1365-3040.2009.01965.x |
| [40] |
KRASENSKY J, JONAK C. Drought, salt, and temperature stress- induced metabolic rearrangements and regulatory networks[J]. J Exp Bot, 2012, 63(4): 1593-1608. DOI:10.1093/jxb/err460 |
| [41] |
XIE H T, YU M K, CHENG X R. Leaf non-structural carbohydrate allocation and C:N:P stoichiometry in response to light acclimation in seedlings of two subtropical shade-tolerant tree species[J]. Plant Physiol Biochem, 2018, 124: 146-154. DOI:10.1016/j.plaphy.2018.01.013 |
| [42] |
RICHARDSON A D, CARBONE M S, HUGGETT B A, et al. Distri- bution and mixing of old and new nonstructural carbon in two tem- perate trees[J]. New Phytol, 2015, 206(2): 590-597. DOI:10.1111/nph.13273 |
| [43] |
HARTMANN H, TRUMBORE S. Understanding the roles of non- structural carbohydrates in forest trees: From what we can measure to what we want to know[J]. New Phytol, 2016, 211(2): 386-403. DOI:10.1111/nph.13955 |
| [44] |
WÜRTH M K R, PELÁEZ-RIEDL S, WRIGHT S J, et al. Non- structural carbohydrate pools in a tropical forest[J]. Oecologia, 2005, 143(1): 11-24. DOI:10.1007/s00442-004-1773-2 |
| [45] |
YANG F, WANG Z M, ZHU D H, et al. Dynamic characteristics of non-structural carbohydrates in leaves of six woody plants under evergreen broad-leaved forest[J]. Chin J Appl Environ Biol, 2019, 25(5): 1-13. 杨芳, 王振孟, 朱大海, 等. 常绿阔叶林林下6种木本植物叶片非结构性碳水化合物的动态特征[J]. 应用与环境生物学报, 2019, 25(5): 1-13. DOI:10.19675/j.cnki.1006-687x.2018.11018 |
 2020, Vol. 28
2020, Vol. 28


