青枯病是一种由青枯菌(Ralstonia solanacearum)引起的毁灭性土传病害,发病植物茎叶萎蔫下垂直至全部枯死,是世界上危害最大、分布最广、造成损失最严重的植物病害之一,至今尚没有有效的化学农药和防治办法, 因此青枯病被称为植物的“癌症”。植物青枯菌可侵染40多科200多种植物,仅次于农杆菌(Agrobacterium tumefaciens),包括番茄(Lycopersicon essculentum)、马铃薯(Solanum tuberosum)、花生(Arachis hypogaea)、甘薯(Dioscorea esculenta)、烟草(Nicotiana tabacum)、辣椒(Capsicum annuum)、茄子(Solanum melongena)、生姜(Zingiber officinale)、草莓(Fragaria ananassa)、香蕉(Musa nana)以及一些贵重药材和花卉植物,青枯病已成为许多农产品生产的重要限制因素,在世界各地均有分布。青枯病菌是一个复杂的群体,有明显的生理分化,不同地区和不同寄主来源的菌株,在寄主范围、致病力、生化型、血清型等细菌学特性上差异很大,因此增加了对此病害防治研究的难度[1]。
近几年来,人们从不同角度对青枯菌进行了多方面的研究,目前预防和治疗青枯病的方法和手段主要有农业防治、药剂防治和生物防治。农业防治包括实行轮作、改良土壤、优化栽培方式、培育壮苗、喷施微肥;化学防治是指在作物生长过程中或种植前喷洒特定药剂;生物防治包括无致病力青枯菌菌株的利用[2]、有益根际微生物的利用、有益真菌的利用、噬菌体的利用、生物农药的生产利用、抗性植株的构建等。但由于抗病品种抗性低且抗性容易丧失,以及一些农业防治的手段会受地域条件的限制而且农产品的农药残留和剧毒农药会直接对人类生存环境造成严重污染,危及人类和其他生物的安全,所以拥有可持续农业和可持续植保观念的生物防治越来越受到人们的重视,其研究和开发成为目前防治青枯病的重点和热点。
植物内生菌是指一定阶段或全部阶段生活于健康植物的组织和器官内部的真菌或细菌,普遍存在于高等植物中,木本、草本植物,单子叶植物和双子叶植物内均有内生菌,目前已成为生物防治中有潜力的微生物农药、增产菌或作为潜在的生防载体菌而加以利用。植物内生菌在国外广受关注,始于禾本科(Gramineae)植物内生真菌以及林木内生真菌的特殊作用。产紫杉醇的红豆杉(Taxus chinensis)内生真菌被报道后,植物内生菌研究在生理活性物质领域开始暴发式的增加[3]。
马齿苋(Portulaca oleracea)为马齿苋属一年生肉质草本植物,可做野生蔬菜食用,广布全世界温带和热带地区。马齿苋是常用的中草药之一,据《本草纲目》记载,马齿苋具有散血消肿、清热解毒、止痢消炎等功效,有“天然抗生素”的说法。现代研究指出,马齿苋还具有抑菌[4]、降血糖[5]、耐缺氧与防治病虫害等生物学活性,这些功效与其含有多糖、生物碱、黄酮类、萜类、有机酸、多酚和蒽醌苷等生物活性成分有关[6-8]。几乎每种植物都有内生菌,在自然选择下会产生与宿主植物相同或相似的天然生理活性物质,如抗菌、抗病毒、抗癌、抗虫、免疫抑制与抗氧化物质等次级代谢产物[9-13], 这些次级代谢产物大多具有重要的生物学作用,可广泛用于医药、生物、农业与工业等领域,并越来越受到国内外研究者的关注[14]。本研究以药食两用植物马齿苋为材料,发掘和筛选具有抑制青枯菌生长的内生菌,探明其作用的物质基础,为农业的生物防治、绿色防治提供科学依据。
1 材料和方法 1.1 材料试验材料 马齿苋(Portulaca oleracea)采集于广东省广州市,青枯菌(Ralstonia solanacearum)由华南农业大学生态系蔡昆争教授提供。
培养基 马铃薯葡萄糖琼脂(PDA)培养基购买于广东环凯微生物科技有限公司,每升含马铃薯300 g,葡萄糖20 g,琼脂15 g,氯霉素0.1 g。马铃薯葡萄糖水(PDB)购买于广东环凯微生物科技有限公司,每升含马铃薯300 g,葡萄糖20 g。青枯雷尔氏菌培养基(CPG), 每升含胰蛋白胨10 g,葡萄糖10 g,酪蛋白水解物1 g (固体培养基硬胶另加18 g琼脂粉,软胶另加9 g琼脂粉)。
设备 生化培养箱(上海一恒科学仪器有限公司),ZHWY-103D恒温培养箱(上海智城分析仪器制造有限公司),G6540B液相与四极杆飞行时间串联质谱仪(美国安捷伦科技有限公司),色谱柱(ACQUITY UPLC, BEH C18 2.1 mm×50 mm i.d., 1.7 μm,美国沃特世科技有限公司)。
试剂 真菌基因组DNA快速抽提试剂盒(生工生物工程股份有限公司),硫酸链霉素(生工生物工程股份有限公司),色谱甲醇、乙腈、甲酸等(美国Fisher公司),其他有机分析纯试剂(广州化学试剂厂)。
1.2 方法内生真菌的分离、纯化 茎、根、叶用自来水洗净,晾干,75%酒精浸泡2 min,无菌水冲洗,0.1%氯化汞浸泡1.5 min (叶浸泡30 s),无菌水冲洗。用最后的无菌水涂板(PDA),作为空白对照, 根、茎、叶切成小块接种于PDA培养基上,28℃培养箱培养[15]。无菌条件下用平板画线法把菌落不断挑纯,直到变成单一菌落。
内生菌粗提物获取及病原菌菌液获取 将已纯化的内生菌菌落挑入PDB培养基中, 在28℃,180 r min-1摇床上培养7 d,过滤取上清液,加入等体积的乙酸乙酯萃取,取有机相至250 mL圆底烧瓶中,置于旋转蒸发仪上45℃蒸发浓缩,过0.22 µm滤膜,用色谱甲醇配制成10 mg mL-1贮存液。取保种的青枯菌,倒入CPG液体培养基中,在30℃, 220 r min-1摇床上培养24 h,用紫外分光光度计测其OD值[16]。
活性筛选 内生真菌的抗病原菌活性筛选采用双层平板法,重复3次。在超净工作台上先于灭菌培养皿中倒一层CPG硬胶,软胶凉至45℃ (不烫手时)与青枯菌(终浓度为OD600=0.05)混合倒于凝固的硬胶上,待培养基全部凝固,用直径8 mm的打孔器在软胶上打孔,在孔中加入10 μL内生菌粗提物贮存液,以1 mg mL-1的链霉素为阳性对照, 所有平板置于恒温培养箱中28℃培养,观察抑菌圈大小并用十字交叉法对抑菌圈直径进行测量2次, 取平均值,3个菌落再次取平均,以抑菌圈大小表示抗菌活性,分为4个等级:无抑菌圈为“-”,直径小于1.0 cm为“+”,直径1.1~1.5 cm为“++”,直径大于1.5 cm为“+++”[15]。
培养菌液对青枯菌的抑制作用 在无菌环境下取PDA培养基上已纯化的内生菌菌落,挑入PDB培养基中于28℃,180 r min-1摇床上培养7 d, 用灭菌纱布过滤取上清液,取若干已灭菌的15 mL离心管, 分别吸取0、500、1 000、1 500、2 000 μL菌液与PDB培养基混合定容至总体积为8 000 μL后与青枯菌混合,使其终浓度为OD600=0.05,离心管置于30℃,220 r min-1摇床上培养24 h,用紫外分光光度计测其OD600值,记录数据并分析。
内生真菌测序鉴定 将已纯化的内生菌菌落挑入PDB培养基中, 在28℃,180 r min-1摇床上培养7 d,过滤取菌渣,加液氮研磨成粉末,按真菌基因组DNA快速抽提试剂盒上的方法提取内生真菌的DNA,然后进行PCR扩增。PCR反应体系总体积20 μL:包含2×Taq Plus Master Mix,10.0 μL;5p ITS4,0.8 μL;5p ITS5,0.8 μL;DNA模板,1.0 μL (0.1 μg);无菌水补足。PCR反应程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,72℃复性10 min,共35个循环。PCR产物采用凝胶电泳检测,切割目的条带进行纯化并测序[17]。
活性内生菌的活性化合物 内生菌粗提物用色谱甲醇配置成1 mg mL-1的样品溶液, 经0.22 μm滤膜过滤上质谱仪分析。分析条件为流动相0.1%甲酸水(A)和乙腈(B),洗脱梯度:0~1 min, 90%A,1~ 3 min, 90%A~80%A, 3~5.5 min, 80%A~40%A; 5.5~ 7 min,40%A~10%A;7~9 min,10%A~5%A;9~ 10 min,5%A~90%A,流速为0.4 mL min-1,柱温35℃,进样体积5 μL。采用电喷雾离子化(ESI);干燥气温度300℃;干燥气体流量8.0 L min-1, 鞘气温度350℃;碎片电压120 V, 检测范围为m/z 100~ 1 000的正负态模式,正负态的毛细管电压分别设定为3.0 kV和2.5 kV。
化合物含量测定 无菌条件下将已纯化的内生菌菌落挑入PDB培养基中,置于28℃,180 r min-1摇床上培养,每天取培养液1.5 mL存于-40℃冰箱, 共14 d,最后1 d将所有样品室温解冻后用0.22 μm滤膜过滤,用液质联用仪检测化合物含量。
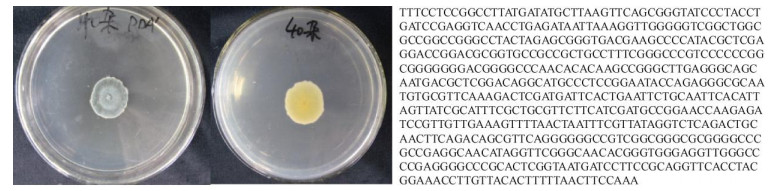
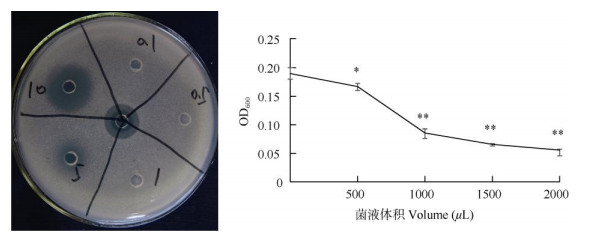
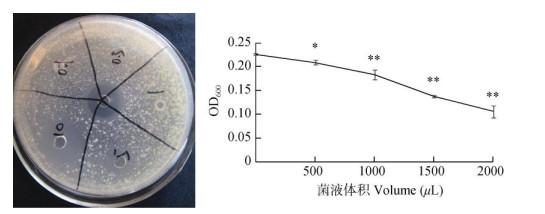
2 结果和分析 2.1 马齿苋内生菌的分离、鉴定和活性评价分离获得2株马齿苋内生菌,用双层平板法进行抗青枯菌试验,显示“+++”活性。利用No051 16S rDNA ITS (ITS4、ITS5)序列进行BLAST搜索, 选取与序列相近的种或菌株进行比对,确定菌株种名, 分别是橘青霉(Penicillium citrinum, 图 1)和波兰青霉(Penicillium polonicum, 图 2),都是青霉属菌。对青枯菌抑制作用试验结果表明,橘青霉和波兰青霉粗提物浓度越高或培养液体积越大,抑菌效果越明显(图 3, 4, 表 1)。
|
图 1 橘青霉和ITS序列 Fig. 1 Penicillium citrinum and ITS sequence |

|
图 2 波兰青霉、孢子和ITS序列 Fig. 2 Penicillium polonicum, spores and the ITS sequence |
|
图 3 橘青霉粗提物及培养菌液抑制青枯菌效果。*: P < 0.05; **: P < 0.01。 Fig. 3 Antibacterial activity of crude extract and liquid culture of Penicillium citrinum. *: P < 0.05; **: P < 0.01. |
|
图 4 波兰青霉粗提物及培养菌液抑制青枯菌效果。*: P < 0.05; **: P < 0.01。 Fig. 4 Antibacterial activity of crude extract and liquid culture of Penicillium polonicum. *: P < 0.05; **: P < 0.01. |
| 表 1 橘青霉粗提物对青枯菌的抑菌活性 Table 1 Antibacterial activity of crude extract of Penicillium citrinum |
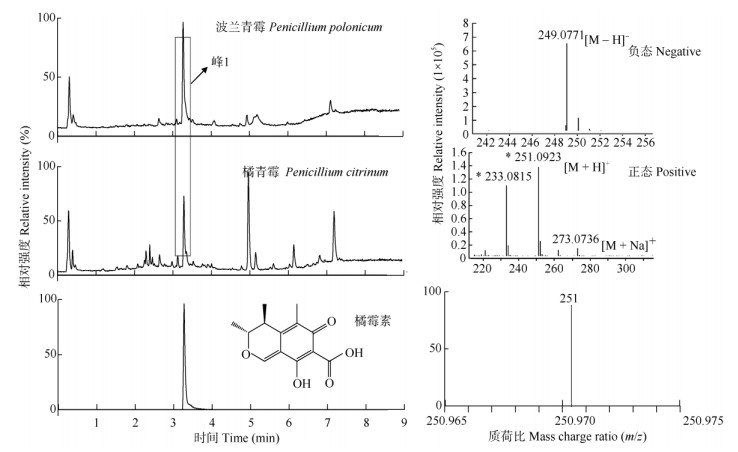
取10 mg mL-1的贮存液,用色谱甲醇配制成1 mg mL-1的样品溶液,经0.22 μm滤膜过滤,用液质联用仪分析粗提物,得到橘青霉和波兰青霉的液相质谱图。2种内生菌提取物中的共有峰1含量相对较高,尤其在波兰青霉中是主要成分,推测峰1可能为主要的活性成分。经高分辨质谱分析,正负态准分子离子峰m/z 251.092 3 [M + H]+和m/z 249.077 1 [M-H]-, 及正离子加钠离子m/z 273.073 6为[M + Na]+,确定峰1的分子式为C13H14O5。根据菌种鉴定结果,查阅Scifinder数据库和同属报道的化学成分,化合物橘霉素的分子式与峰1的分子式相同,进一步用液相质谱对比分析橘霉素标准品与峰1,具有相似的保留时间和离子碎片,因此,确定峰1为化合物橘霉素(图 5)。
|
图 5 UPLC-QTOF-MS分析内生菌的活性成分 Fig. 5 Bioactive compound of endophytics by UPLC-QTOF-MS |
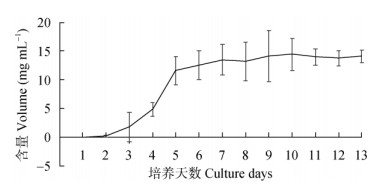
为探讨橘青霉和波兰青霉代谢产物橘霉素的抑菌活性,将橘霉素标准品配制成0、1、2.5、5和10 mg mL-1溶液,以1 mg mL-1链霉素为阳性对照,用双层平板法进行抑制青枯菌试验,结果表明, 1 mg mL-1的橘霉素抑菌圈直径为(3.01±0.102) cm, 比阳性对照[(0.89±0.167) cm]大(表 2),说明橘霉素具有比链霉素更强的抑制青枯菌活性。另外,橘青霉培养时间越长,化合物橘霉素含量越高,培养10 d达最大值(14.45±2.813) mg mL-1 (图 6),这对后期获得高浓度的化合物具有重要的参考价值。
| 表 2 橘霉素对青枯菌抑菌活性 Table 2 Antibacterial activity of citrinin |
|
图 6 橘霉素在橘青霉培养过程中的含量变化 Fig. 6 Change in content of citrinin in Penicillium citrinum with cultivation time |
从植物不同组织部位分离获得的内生菌种类不同,分离频率不同也可能得到不同的内生菌种类。目前从马齿苋分离的内生真菌有附球菌属(Epicoccum)、镰刀菌属(Fusarium)、青霉菌属(Penicillium)、毛壳菌属(Chaetomium)、彼得壳属(Petriella)[18];内生细菌有肠杆菌(Enterobacter sakazakil)、短小芽孢杆菌(Bacillus pumilus)、无色杆菌(Achromobacter spp.)、类芽孢杆菌属(Paenibacillus)、赖氏细菌属(Leifsonia)和Rhodanobacter[19], 这些菌可以抵抗金黄色葡萄球菌、变形杆菌、大肠杆菌、铜绿假单胞菌[15]。本研究首次从马齿苋中分离得到内生菌橘青霉和波兰青霉,丰富了马齿苋内生菌的种类。
橘青霉用途广泛,可以生产壳聚糖[20]、内葡聚糖酶[21]、角蛋白[22]、工业核苷酸[23]、纤维素酶[24]以及抗肿瘤的抗生素[25];另外,橘青霉可以刺激辣椒(Capsicum annuum)生长并诱导对炭疽病的抗性[26],以及用于废水处理等[27]。而对波兰青霉的研究则相对较少,波兰青霉的活性物质也具有多种生物活性,如抗肝癌、体外增加葡萄糖摄取的作用[28-29];还有抑制单胺氧化酶家族的作用,单胺氧化酶抑制剂是治疗抑郁症的处方药,使用历史悠久,也可治疗帕金森病等[30]。另外,高效可见光诱导波兰青霉合成的银纳米粒,对血清型伤寒沙门氏菌、鲍曼不动杆菌具有抑制作用[31-32]。这些表明橘青霉和波兰青霉具有广阔的应用前景,还有待于深入研究。
目前对橘霉素的活性功能研究相对较少,主要活性是对革兰氏阳性菌有抗菌作用,而对革兰氏阴性菌无抗菌作用,还具有抗梨形四膜虫[33]和结核杆菌的作用,其他方面未见报道。本研究首次报道橘霉素具有抗青枯菌活性。但有报道橘霉素具有一定毒性,大量注射或口服可以致死[34]。关于橘霉素是否能够应用于实际生产生活中,应从其是否能被植物吸收,通过食物进入人体后的影响等方面来考虑,还有待深入研究。
| [1] |
GAO H L. The research progress of Ralstonia solanacearum[J]. Legal Syst Soc, 2009(12): 354. 高欢乐. 论青枯菌病害的研究进展[J]. 法制与社会, 2009(12): 354. DOI:10.19387/j.cnki.1009-0592.2009.12.244 |
| [2] |
LI T W. Advances in biological control of Ralstonia solanacearum[J]. Plant Doct, 2009, 22(5): 4-6. 李土文. 青枯病的生物防治研究进展[J]. 植物医生, 2009, 22(5): 4-6. DOI:10.3969/j.issn.1007-1067.2009.05.001 |
| [3] |
WANG Z W, JI Y L, CHEN Y G. Studies and biological significances of plant endophytes[J]. Microbiol China, 2015, 42(2): 349-363. 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. DOI:10.13344/j.microbiol.China.130815 |
| [4] |
CHEN W P. Experimental study on the antibacterial effect of Portulaca oleracea extract liquid[J]. Lishizhen Med Mat Med Res, 2007, 18(9): 2205-2206. 陈万平. 马齿苋提取液体外抑菌作用的实验研究[J]. 时珍国医国药, 2007, 18(9): 2205-2206. DOI:10.3969/j.issn.1008-0805.2007.09.078 |
| [5] |
FAN Y S. Study on the hypoglycemic activity of polysaccharides isolated from Portulace oleracea L. [D]. Yangling: NW Agric For University, 2008: 1-66. 范玉生.马齿苋多糖降血糖作用研究[D].杨凌: 西北农林科技大学, 2008: 1-66. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008101577.htm |
| [6] |
HE G P. Pharmacological action and clinical application of Portulaca oleracea L.[J]. Chin J Drug Abuse Prev Treat, 2009, 15(4): 243-245. 何国萍. 马齿苋的药理作用与临床应用[J]. 中国药物滥用防治杂志, 2009, 15(4): 243-245. DOI:10.15900/j.cnki.zylf1995.2009.04.002 |
| [7] |
LIU H, LI Y P, ZHOU C L, et al. Study on extraction and bioactivity of Portulaca oleracea L. flavonoids[J]. Lishizhen Med Mat Med Res, 2010, 21(11): 2866-2867. 刘华, 李玉萍, 周春丽, 等. 马齿苋黄酮提取及生物活性研究[J]. 时珍国医国药, 2010, 21(11): 2866-2867. DOI:10.3969/j.issn.1008-0805.2010.11.069 |
| [8] |
QIN X Z, WANG D, ZHANG H Y, et al. Study on the anti-inflammation, analgesia effects and the toleration oxygen deficit of the porslane[J]. Chin J Hosp Pharm, 2010, 30(22): 1909-1911. 秦孝智, 王丹, 张红英, 等. 马齿苋不同提取物的抗炎镇痛耐缺氧作用[J]. 中国医院药学杂志, 2010, 30(22): 1909-1911. |
| [9] |
LI W K, HU Z B. Endophytes and natural medicines[J]. Chin Nat Med, 2005, 3(4): 193-199. 黎万奎, 胡之璧. 内生菌与天然药物[J]. 中国天然药物, 2005, 3(4): 193-199. |
| [10] |
JIA L, CHEN S Y, ZHAI Y G, et al. Recent advances in studies on endophytes and their associated bioactive products[J]. Chin Trad Herb Drugs, 2007, 38(11): 1750-1754. 贾栗, 陈疏影, 翟永功, 等. 近年国内外植物内生菌产生物活性物质的研究进展[J]. 中草药, 2007, 38(11): 1750-1754. DOI:10.3321/j.issn:0253-2670.2007.11.053 |
| [11] |
STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260(5105): 214-216. DOI:10.1126/science.8097061 |
| [12] |
REN A Z, GAO Y B. Endophytic fungi, a kind of resource microorganism with broad application prospect[J]. Microbiol China, 2001, 28(6): 90-93. 任安芝, 高玉葆. 植物内生真菌——一类应用前景广阔的资源微生物[J]. 微生物学通报, 2001, 28(6): 90-93. DOI:10.3969/j.issn.0253-2654.2001.06.022 |
| [13] |
LIU J H, YU B Y. Isolation of endophytic fungi from Camptotheca acuminata and the screening method of antitumor secondary metabolite produced by the fungi[J]. J Plant Resour Environ, 2004, 13(4): 6-10. 刘吉华, 余伯阳. 喜树内生真菌的分离及其抗肿瘤活性代谢产物的筛选方法[J]. 植物资源与环境学报, 2004, 13(4): 6-10. DOI:10.3969/j.issn.1674-7895.2004.04.002 |
| [14] |
ZHANG J C, WANG Z M, ZHANG H Y, et al. The summarize about recent research process on fern endophyte[J]. Chin Agric Sci Bull, 2010, 26(20): 70-72. 张君诚, 王铮敏, 张杭颖, 等. 蕨类植物内生菌研究进展[J]. 中国农学通报, 2010, 26(20): 70-72. |
| [15] |
GONG J. Isolation and anti-microbial activity of endophyte in Portulaca oleracea L.[J]. Food Ind, 2014, 35(7): 144-147. 巩健. 马齿苋内生菌分离及其抑菌效果研究[J]. 食品工业, 2014, 35(7): 144-147. |
| [16] |
ZHAO F F, HAN B J, LI P P, et al. Extracts from tendrils and leaves of Piper nigrum Linn.: Components analysis and activity to three types of agricultural pathogenic fungi[J]. Chin J Trop Crops, 2019, 40(1): 115-122. 赵方方, 韩丙军, 李萍萍, 等. 胡椒蔓和叶粗提物成分分析及对3种农业病原真菌活性研究[J]. 热带作物学报, 2019, 40(1): 115-122. DOI:10.3969/j.issn.1000-2561.2019.01.017 |
| [17] |
XIAO Y R, WANG Y S, LI N Z, et al. Isolation and identification of a blinin-producing endophytic fungus from Conyza blinii H. Lév [J/OL]. Genom Appl Biol, 2019: 1-8. [2019-04-04] http://kns.cnki.net/kcms/detail/45.1369.Q.20190403.1421.004.html. 肖义蓉, 王寅生, 李南臻, 等.金龙胆草产苦蒿素内生真菌的筛选鉴定[J/OL].基因组学与应用生物学, 2019: 1-8. [2019-04-04] http://kns.cnki.net/kcms/detail/45.1369.Q.20190403.1421.004.html. |
| [18] |
ZHANG Y. Isolation of endophytic fungi from Portulaca oteracea and study on their infulence on hosts growth [D]. Hohhot: Inner Mongolia Agricultural University, 2015: 1-39. 张瑜.马齿苋内生真菌的分离、鉴定及其对宿主生长的影响[D].呼和浩特: 内蒙古农业大学, 2015: 1-39. http://cdmd.cnki.com.cn/Article/CDMD-10129-1015427639.htm |
| [19] |
WU Y, SHANG S H, YANG Q, et al. Isolation and identification of endophytes from Portulaca oteracea[J]. J Shanxi Agric Univ (Nat Sci), 2014, 34(2): 117-120. 武燕, 尚世辉, 杨倩, 等. 马齿苋内生细菌的分离鉴定[J]. 山西农业大学学报(自然科学版), 2014, 34(2): 117-120. |
| [20] |
NAMBOODIRI M M T, PAKSHIRAJAN K. Sustainable and green approach of chitosan production from Penicillium citrinum biomass using industrial wastewater as a cheap substrate[J]. J Environ Manage, 2019, 240: 431-440. DOI:10.1016/j.jenvman.2019.03.085 |
| [21] |
OUEPHANIT C, BOONVITTHYA N, THEERACHAT M, et al. Efficient expression and secretion of endo-1, 4-β-xylanase from Penicillium citrinum in non-conventional yeast Yarrowia lipolytica directed by the native and the preproLIP2 signal peptides[J]. Protein Expr Purif, 2019, 160: 1-6. DOI:10.1016/j.pep.2019.03.012 |
| [22] |
NIKITINA Z K, GORDONOVA I K. Exogenous regulation of productivity of Penicillium citrinum-keratinase producer[J]. Probl Biol Med Pharm Chem, 2016, 19(9): 8-12. |
| [23] |
CHEN X Y, WANG B, PAN L. Heterologous expression and characterization of Penicillium citrinum nuclease P1 in Aspergillus niger and its application in the production of nucleotides[J]. Protein Expr Purif, 2019, 156: 36-43. DOI:10.1016/j.pep.2018.12.004 |
| [24] |
MUTHUKRISHNAN S. Optimization and production of industrial important cellulase enzyme from Penicillium citrinum in Western Ghats of Sathuragiri hills soil sample isolate[J]. Univ J Microbiol Res, 2017, 5(1): 7-16. DOI:10.13189/ujmr.2017.050102 |
| [25] |
QADER M M, KUMAR N S, JAYASINGHE L, et al. Production of antitumor antibiotic GKK1032B by Penicillium citrinum, an endophytic fungus isolated from Garcinia mangostana fruits[J]. Med Aromat Plants, 2016, 5(1): 1000225. DOI:10.4172/2167-0412.1000225 |
| [26] |
MANI P G, AUDIPUDI A V. Growth stimulation and induction of systemic resistance in chilli against anthracnose disease by Penicillium citrinum AVGE5[J]. Int J Adv Res, 2016, 4(5): 419-426. DOI:10.21474/IJAR01/389 |
| [27] |
ALVES A M, de MOURA R B, CARVALHO A K F, et al. Penicillium citrinum whole-cells catalyst for the treatment of lipid-rich wastewater[J]. Biomass Bioenergy, 2019, 120: 433-438. DOI:10.1016/j.biombioe.2018.12.004 |
| [28] |
WEN Y Z, LV Y B, HAO J, et al. Two new compounds of Penicillium polonicum, an endophytic fungus from Camptotheca acuminata Decne [J/OL]. Nat Prod Res, 2019, [2019-02-13] doi: 10.1080/14786419.2019.1569003.
|
| [29] |
FATIMA N, SRIPISUT T, YOUN U J, et al. Bioactive constituents from an endophytic fungus, Penicillium polonicum NFW9, associated with Taxus fauna[J]. Med Chem, 2017, 13(7): 689-697. DOI:10.2174/1573406413666170216145121 |
| [30] |
ELSUNNI M A, YANG Z D. Secondary metabolites of the endophytic fungi Penicillium polonicum and their monoamine oxidase inhibitory activity[J]. Chem Nat Compd, 2018, 54(5): 1018-1019. DOI:10.1007/s10600-018-2540-7 |
| [31] |
NEETHU S, MIDHUN S J, SUNIL M A, et al. Efficient visible light induced synthesis of silver nanoparticles by Penicillium polonicum ARA 10 isolated from Chetomorpha antennina and its antibacterial efficacy against Salmonella enterica serovar Typhimurium[J]. J Photochem Photobiol B, 2018, 180: 175-185. DOI:10.1016/j.jphotobiol.2018.02.005 |
| [32] |
NEETHU S, MIDHUN S J, RADHAKRISHNAN E K, et al. Green synthesized silver nanoparticles by marine endophytic fungus Penicillium polonicum and its antibacterial efficacy against biofilm forming, multidrug-resistant Acinetobacter baumanii[J]. Microb Pathog, 2018, 116: 263-272. DOI:10.1016/j.micpath.2018.01.033 |
| [33] |
HAYES A W, BIRKHEAD H E, HALL E A. Antiprotozoal activity in citrinin[J]. Bull Environ Contam Toxicol, 1976, 15(4): 429-436. DOI:10.1007/BF01685067 |
| [34] |
WANG Y. Citrinin[J]. Sci China, 1951, 2(4): 433-454. 汪猷. 橘霉素[J]. 中国科学, 1951, 2(4): 433-454. |
 2019, Vol. 27
2019, Vol. 27


