植物甾醇不仅是生物膜的重要组成成分,还是一类无色无味的甾体类活性成分,不溶于水,溶于有机溶剂,属于三萜类化合物,含有28~29个C原子,主要骨架是4个环的环戊烷多氢菲,C-3羟基是活性基团[1-2],与羧酸形成植物甾醇酯,具有更好的水溶性和生理活性。植物甾醇以游离或结合甾醇的方式广泛存在于植物体中,除常见的豆甾醇、β-谷甾醇、菜油甾醇和菜籽甾醇外,已经报道了超过250种的衍生物,如甾体皂苷、甾体糖苷生物碱、植物甾酮和油菜素内酯等[3]。植物甾醇不仅具有抗氧化和延缓衰老的功能[4-5],还对多种肿瘤的发生和发展具有预防和治疗作用[6-9]。
铁皮石斛(Dendrobium officinale)是兰科(Orchidaceae)石斛属多年生药食两用植物,具有增强免疫力、抗肿瘤、降血糖、抗氧化和抗疲劳等生理活性[10-11]。铁皮石斛有效成分种类多样,除了石斛类多糖和生物碱外,还有菲类、芪类、笏酮类、倍半萜类、甾体类及香豆素等[12]。杨柳等[13]利用正己烷蒸馏法提取的铁皮石斛干燥茎挥发性成分中含有22, 23-二氢豆甾醇、γ-谷甾醇、豆甾醇和油菜甾醇, 相对含量分别为11.093%、4.126%、3.138%和1.648%, 4种甾醇占挥发性成分的20.005%。陈晓梅等[14]从固体培养铁皮石斛原球茎甲醇提取物中分离鉴定到豆甾醇和β-谷甾醇。仝晶晶等[15]分析了6个产地铁皮石斛干燥茎的豆甾醇和β-谷甾醇含量,产于云南省普洱市景谷县的豆甾醇含量最高,为86.399 μg g-1, 产于浙江省乐清市双峰乡的β-谷甾醇含量最高,为344.683 μg g-1。
转录组(RNA-seq)测序能够获取植物特定组织或器官在特定时期的基因表达信息,有利于挖掘药用植物次生代谢产物合成调控关键酶基因。吴超等[16]对铁皮石斛叶片进行转录组测序,KEGG注释结果表明有1 006个Unigenes与次生代谢物的生物合成有关。Guo等[17]对铁皮石斛茎转录组数据分析表明,有69个Unigenes参与生物碱骨架的生物合成。Zhang等[18]对铁皮石斛生长期和成熟期进行转录组测序,KEGG注释结果表明有430个糖基转移酶,89个纤维素合酶,135个Unigenes参与果糖和甘露糖代谢。
本研究以2个生长阶段的铁皮石斛茎、叶为材料,利用Illumina HiSeq 4000高通量测序技术进行转录组测序,以期获得与植物甾醇合成相关的基因信息,分析铁皮石斛植物甾醇代谢途径, 为铁皮石斛植物甾醇的代谢调控研究提供科学依据。
1 材料和方法 1.1 材料铁皮石斛(Dendrobium officinale)原种采自福建省龙岩市连城县冠豸山崖壁,经过茎段扩繁后种植于福建省农业科学院亚热带农业研究所资源圃,分别于生长期(2016年8月15日)和成熟期(2016年12月15日)随机采集3株新鲜茎、叶,分别标记为T1 (生长期茎)、T2 (生长期叶)、T3 (成熟期茎)和T4 (成熟期叶),经液氮速冻后用干冰寄到广州基迪奥生物科技有限公司进行RNA提取、转录组测序和Unigene功能注释。
1.2 植物甾醇生物合成途径分析依据植物甾醇生物合成途径,结合转录组数据GO功能分类结果,分析植物甾醇生物合成途径的相关Unigenes。
1.3 植物甾醇生物合成关键酶基因表达分析用标准化后的Reads Per Kilobase per Million mapped reads (RPKM)值来表示样品的表达量,分析植物甾醇生物合成关键酶基因在铁皮石斛不同生育期的表达模式。
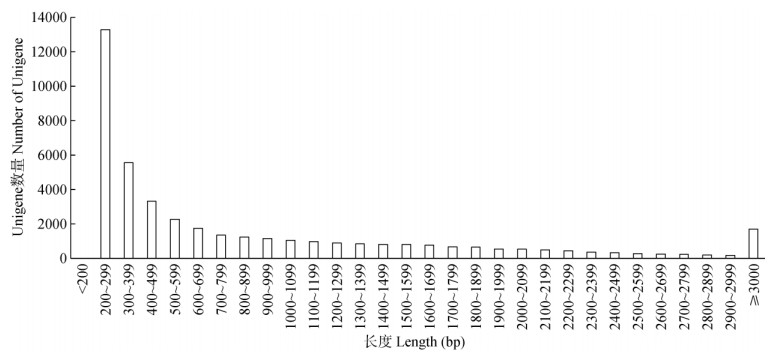
2 结果和分析 2.1 转录组测序和数据组装铁皮石斛4个样品的原始数据(NCBI SRA号: SRP181716)经过滤除杂处理后,分别获得22 809 182、19 492 544、21 587 660和21 058 784 reads,分别包含有3 388 594 751、2 884 066 418、3 171 710 203和3 132 109 020个核苷酸序列信息。将获得的高质量核苷酸序列进行de novo拼接,共获得长度大于200 bp的Unigenes片段43 085条,N50为1 628 bp,平均长度902 bp,最长Unigene片段为20 526 bp, 长度在200~299 bp的片段最多,有13 280条,其次是300~399 bp,有5 558条,≥3 000 bp的有1 701条(图 1)。
|
图 1 Unigene长度分布 Fig. 1 Length distribution of Unigenes |
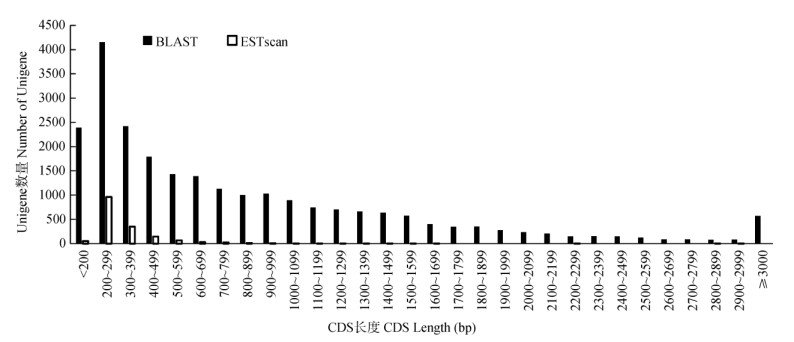
通过BLAST比对和ESTscan预测Unigene片段的编码区(CDS),结果表明, 有25 928条Unigenes片段含有CDS (分别获得24 266和1 662条),占Unigenes片段的60.18%,其中CDS长度大于1 000 bp的Unigenes片段有7 550条,占总数的17.52% (图 2)。
|
图 2 CDS长度分布 Fig. 2 CDS length distribution |
将43 085条Unigenes片段在Nr、Swiss-prot、KOG和KEGG数据库搜索比对序列相似性,共有24 459条获得注释,占总数56.77%:其中,在Nr数据库注释的有23 460条,占54.45%,Swiss-prot数据库有18 514条,占42.97%;KOG数据库有15 522条,占36.03%;KEGG数据库有8 972条, 占20.82%;在4个数据库都得到注释的有7 333条, 占17.02%。
通过GO功能数据库比对分析,共有13 710条Unigenes得到注释和功能分类,分为3大类49个功能(表 1),生物过程含20个功能,涉及31 519条Unigenes,其中代谢过程和细胞过程分别涉及7 617和7 200条;细胞组分含17个功能,涉及24 983条Unigenes,其中细胞和细胞组份分别涉及6 008和6 006条;分子功能含12个功能,涉及14 948条Unigenes,其中,催化活性有6 967条,结合的有6 448条。
| 表 1 铁皮石斛Unigene GO功能分类 Table 1 GO functional classification of Dendrobium officinale Unigenes |
KEGG注释的8 972条Unigenes中有7 890条获得Pathway注释(表 2),分为5大类19条代谢途径。遗传信息处理含有4条代谢途径,其中翻译的Unigenes数最多,为929条;环境信息处理含有信号转导和膜运输2条代谢途径;细胞过程和有机系统各含有1条代谢途径;代谢含有11条代谢途径,以碳水化合物代谢最多,1 118条。
| 表 2 KEGG注释的代谢途径 Table 2 Metabolism pathway annotated by KEGG |
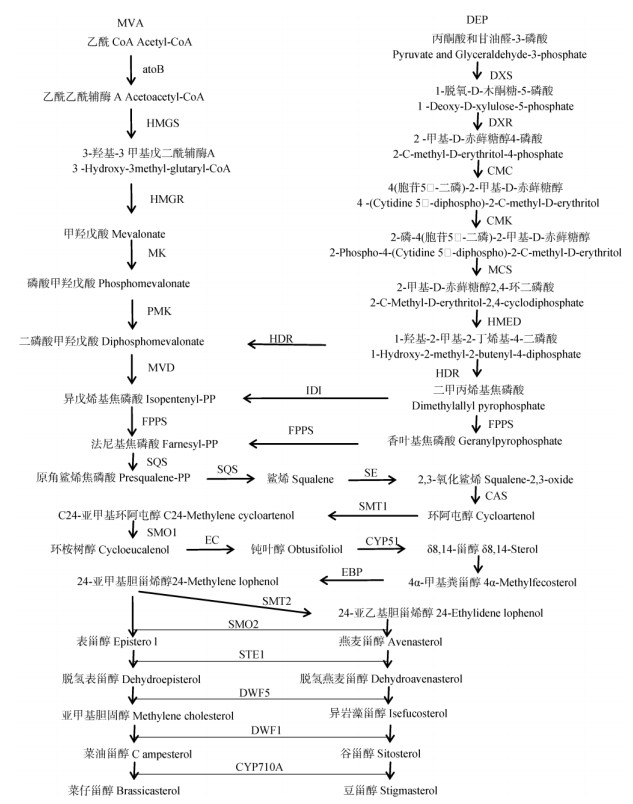
KEGG注释结果表明,共有50个Unigenes (30种酶)参与铁皮石斛植物甾醇的生物合成(表 3)。植物甾醇生物合成途径可分为萜类化合物骨架生物合成、倍半萜类和三萜类生物合成和甾族化合物合成3条代谢途径。
| 表 3 KEGG注释的铁皮石斛植物甾醇生物合成相关的Unigene数量 Table 3 Unigene number annotated by KEGG related to phytosterol biosynthesis in Dendrobium officinale |
根据Pathway分析结果预测铁皮石斛植物甾醇生物合成路径(图 3), 萜类化合物骨架生物合成有甲羟戊酸途径(MVA)和丙酮酸途径(DEP)两种,MVA途径从乙酰CoA到生成法尼基焦磷酸共7步7个酶(10个Unigenes)参与;DEP途径从丙酮酸和甘油醛- 3-磷酸到生成法尼基焦磷酸共11步10个酶(15个Unigenes)参与。倍半萜类和三萜类生物合成从法尼基焦磷酸到2, 3-氧化鲨烯共3步2个酶(4个Unigenes)参与。甾族化合物生物合成从2, 3-氧化鲨烯到菜仔甾醇和豆甾醇生成共16步12个酶(22个Unigenes)参与。
|
图 3 铁皮石斛植物甾醇生物合成途径 Fig. 3 Biosyntheic pathway of phytosterol in Dendrobium officinale |
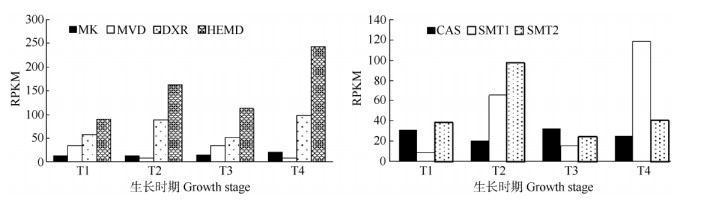
选择MK、MVD、DXR、HMED、CAS、SMT1和SMT2等7种关键酶基因,采用RPKM值分析他们在铁皮石斛生长期和成熟期茎、叶中的表达量。从图 4可以看出,MVA途径的MK和MVD表达量比DEP途径的DXR和HMED表达量低。CAS在生长期和成熟期的表达量差异不大,但在茎的表达量比叶片稍高。SMT1在成熟期茎、叶的表达量比生长期茎、叶高,SMT2则生长期表达量高于成熟期;同一时期,SMT1和SMT2在叶片表达量都比茎高。
|
图 4 铁皮石斛7个植物甾醇生物合成相关基因的表达模式。T1:生长期茎; T2:生长期叶; T3:成熟期茎; T4:成熟期叶。 Fig. 4 Expression patterns of seven genes related to phytosterol biosynthesis in Dendrobium officinale. T1: Stem at growth stage; T2: Leaf at growth stage; T3: Stem at mature stage; T4: Leaf at mature stage. |
本研究通过Illumina HiSeq 4000测序平台对铁皮石斛2个生育期的茎、叶进行转录组测序,经过de novo拼接后获得43 085条大于200 bp的Unigenes片段,其中24 459条在Nr、Swiss-prot、KOG和KEGG数据库获得注释。根据KEGG注释结果,铁皮石斛植物甾醇生物合成分成3个阶段,共有50个Unigenes (30种酶)参与。
植物甾醇合成第一阶段是法尼基焦磷酸的合成,有MVA和DEP两种途径。通过比较两种途径的2个关键酶基因的RPKM值,DEP途径的DXR和HMED表达明显高于MVA途径的MK和MED,说明铁皮石斛合成法尼基焦磷酸存在两种途径,但DEP途径强于MVA途径,这可能与铁皮石斛是兼性景天酸途径植物[19]有关。
植物甾醇根据侧链C-24位上烷基分为甲基甾醇和乙基甾醇,通过甾醇C-24甲基转移酶(SMT)在C-24位上分别通过1次和2次增加甲基的步骤完成[20-21]。SMT1把1个甲基从S-腺苷甲硫氨酸(SAT)转移到环阿屯醇的C-24位上,形成C-24甲烯基环阿屯醇;SMT2则催化在C-24甲烯基环阿屯醇的衍生物24-亚甲基胆甾烯醇的C-24甲基上再添加1个甲基,形成乙基甾醇[22-23],因此,SMT1是甲基甾醇和乙基甾醇合成限速酶,SMT2是乙基甾醇合成限速酶。在烟草植株中过表达SMT1,菜油甾醇和谷甾醇分别提高80%和50%,而环阿屯醇和胆固醇含量分别下降53%和34%。过表达SMT2显著降低了胆固醇和C-24甲基甾醇含量,而谷甾醇含量显著提高[24-25]。本研究发现相同生育期铁皮石斛的SMT1和SMT2在叶片中的表达量都明显高于茎,推测叶片中植物甾醇的合成比茎高。8月份的叶SMT2表达量明显高于SMT1,12月份则相反, 推测8月份叶片合成乙基甾醇多,而12月份则合成甲基甾醇多,这有待于对铁皮石斛SMT1和SMT2功能的进一步鉴定,分析不同生长阶段植物甾醇组分和含量。
| [1] |
ZHANG X C, HAN Z H. Sterols biosynthesis and their physiological role in plants[J]. Plant Physiol Commun, 2001, 37(5): 452-457. 张喜春, 韩振海. 植物体内甾醇的合成和生理作用[J]. 植物生理学通讯, 2001, 37(5): 452-457. DOI:10.13592/j.cnki.ppj.2001.05.033 |
| [2] |
DAI G H, WANG M. Property and function of phytosterol and its application in food[J]. J Kaifeng Inst Educ, 2016, 36(2): 261-262. 代广辉, 王敏. 植物甾醇性质、功能及其在食品中的应用[J]. 开封教育学院学报, 2016, 36(2): 261-262. DOI:10.3969/j.issn.1008-9640.2016.02.122 |
| [3] |
NES W D. Biosynthesis of cholesterol and other sterols[J]. Chem Rev, 2011, 111(10): 6423-6451. DOI:10.1021/cr200021m |
| [4] |
WU S M, WU M C, MA L. Antioxidant effect of phytosterols in high grade rapeseed cooking oil (Ⅰ): Antioxidant effect at normal temperature[J]. China Oils Fats, 2003, 28(4): 52-54. 吴时敏, 吴谋成, 马莉. 植物甾醇在菜籽高级烹调油中的抗氧化作用(Ⅰ):常温下抗氧化作用的研究[J]. 中国油脂, 2003, 28(4): 52-54. DOI:10.3321/j.issn:1003-7969.2003.04.017 |
| [5] |
RUDKOWSKA I. Plant sterols and stanols for healthy ageing[J]. Maturitas, 2010, 66(2): 158-162. DOI:10.1016/j.maturitas.2009.12.015 |
| [6] |
CAO M, OUYANG L. Study on development of anti-tumor effect of phytosterols[J]. Pract Pharm Clin Remed, 2015, 18(9): 1104-1107. 曹玫, 欧阳露. 植物甾醇的抗肿瘤作用及其机制研究进展[J]. 实用药物与临床, 2015, 18(9): 1104-1107. DOI:10.14053/j.cnki.ppcr.201509026 |
| [7] |
ZHOU L Y, XU C, WANG L Q, et al. Effect of β-sitosterol on proli-feration and apoptosis of lung cancer cell line A549[J]. Int J Lab Med, 2016, 37(7): 865-867. 周玲玉, 徐彩, 王乐琴, 等. β-谷甾醇对人肺癌A549细胞增殖及凋亡的影响[J]. 国际检验医学杂志, 2016, 37(7): 865-867. DOI:10.3969/j.issn.1673-4130.2016.07.001 |
| [8] |
CHENG X A, ZHOU X W, ZHANG S M, et al. Effects of phytosterol on growth inhibiting and apoptosis induction of melanoma cells[J]. Guangdong Agric Sci, 2014, 41(10): 94-97. 程杏安, 周晓武, 张淑明, 等. 植物甾醇对黑色素瘤细胞的生长抑制及凋亡诱导作用[J]. 广东农业科学, 2014, 41(10): 94-97. DOI:10.3969/j.issn.1004-874X.2014.10.023 |
| [9] |
ZHANG S, YUE W, WANG L, et al. Inhibitive effect of stigmasterol from hedyotis diffusa willd. on hepatoma cells in vitro & vivo and its influence on transplanted H22 tumor cell's multiplication cycle, apoptosis[J]. Progr Mod Biomed, 2008, 8(11): 2016-2018. 张硕, 岳旺, 王蕾, 等. 白花蛇舌草豆甾醇对肝癌细胞的体内外抑制作用及对其增殖周期、凋亡的影响[J]. 现代生物医学进展, 2008, 8(11): 2016-2018. DOI:10.13241/j.cnki.pmb.2008.11.017 |
| [10] |
LIAO J J, LI W J, LI J J, et al. Advances in the of constituents and pharmacological effects of Dendrobium candidum Wall. ex. Lind.[J]. J Guangdong Ind Techn Coll, 2015, 14(3): 16-19. 廖俊杰, 李文静, 李进进, 等. 铁皮石斛有效成分与功效研究进展[J]. 广东轻工职业技术学院学报, 2015, 14(3): 16-19. DOI:10.3969/j.issn.1672-1950.2015.03.004 |
| [11] |
CHEN S L, WU Z G, JIANG W, et al. Isolation and purification of three acidic polysaccharides from Dendrobium officinale and their antioxidant activities in vitro[J]. J Zhejiang Agric Sci, 2016, 57(6): 838-844. 陈松林, 吴志刚, 姜武, 等. 铁皮石斛3种酸性多糖的分离纯化及体外抗氧化活性[J]. 浙江农业科学, 2016, 57(6): 838-844. DOI:10.16178/j.issn.0528-9017.20160613 |
| [12] |
SUN H, HU Q, JIN H, et al. Research advances in chemical constituents and pharmacological activities of Dendrobii officinalis caulis[J]. Chin J Exp Trad Med Form, 2017, 23(11): 225-2348. 孙恒, 胡强, 金航, 等. 铁皮石斛化学成分及药理活性研究进展[J]. 中国实验方剂学杂志, 2017, 23(11): 225-234. DOI:10.13422/j.cnki.syfjx.2017110225 |
| [13] |
YANG L, LIU S J, HU J M, et al. Determination of volatile components from stem of Dendrobium officinale by GC-MS[J]. Mod Chin Med, 2013, 15(5): 362-364. 杨柳, 刘守金, 胡江苗, 等. GC-MS法检测铁皮石斛茎中挥发性成分[J]. 中国现代中药, 2013, 15(5): 362-364. DOI:10.3969/j.issn.1673-4890.2013.05.003 |
| [14] |
CHEN X M, YANG J S, GUO S X, et al. Studies on the chemical constituents of solid cultured Dendrobium officinale protocorms[J]. Mod Chin Med, 2014, 16(4): 265-268. 陈晓梅, 杨峻山, 郭顺星, 等. 固体培养铁皮石斛原球茎化学成分研究[J]. 中国现代中药, 2014, 16(4): 265-268. DOI:10.13313/j.issn.1673-4890.2014.04.001 |
| [15] |
TONG J J, YU H, ZENG W B, et al. Study on functional components of Dendrobium officinale from different culturing areas[J]. J Yunnan Univ Trad Chin Med, 2017, 40(5): 81-84. 仝晶晶, 虞泓, 曾文波, 等. 6个不同产地铁皮石斛功效成分的分析研究[J]. 云南中医学院学报, 2017, 40(5): 81-84. DOI:10.19288/j.cnki.issn.1000-2723.2017.05.018 |
| [16] |
WU C, PENG J, XIANG L, et al. Sequencing and analysis of the transcriptome of Dendrobium officinale[J]. Mol Plant Breed, 2016, 14(12): 3334-3346. 吴超, 彭娟, 向林, 等. 基于高通量测序的铁皮石斛叶片转录组分析[J]. 分子植物育种, 2016, 14(12): 3334-3346. DOI:10.13271/j.mpb.014.003334 |
| [17] |
GUO X, LI Y, LI C F, et al. Analysis of the Dendrobium officinale transcriptome reveals putative alkaloid biosynthetic genes and genetic markers[J]. Gene, 2013, 527(1): 131-138. DOI:10.1016/j.gene.2013.05.073 |
| [18] |
ZHANG J X, HE C M, WU K L, et al. Transcriptome analysis of Dendrobium officinale and its application to the identification of genes associated with polysaccharide synthesis [J/OL]. Front Plant Sci, 2016, 7: 5. doi: 10.3389/fpls.2016.00005.
|
| [19] |
SU W H, ZHANG G F. The photosynthesis pathway in leaves of Dendrobium officinale[J]. Acta Phytoecol Sin, 2003, 27(5): 631-637. 苏文华, 张光飞. 铁皮石斛叶片光合作用的碳代谢途径[J]. 植物生态学报, 2003, 27(5): 631-637. DOI:10.17521/cjpe.2003.0091 |
| [20] |
DIENER A C, LI H X, ZHOU W X, et al. STEROL METHYLTRANSFERASE 1 controls the level of cholesterol in plants[J]. Plant Cell, 2000, 12(6): 853-870. DOI:10.1105/tpc.12.6.853 |
| [21] |
SCHAEFFER A, BRONNER R, BENVENISTE P, et al. The ratio of campesterol to sitosterol that modulates growth in Arabidopsis is controlled by STEROL METHYLTRANSFERASE 2;1[J]. Plant J, 2001, 25(6): 605-615. DOI:10.1046/j.1365-313x.2001.00994.x |
| [22] |
BENVENISTE P. Biosynthesis and accumulation of sterols[J]. Annu Rev Plant Biol, 2004, 55: 429-457. DOI:10.1146/annurev.arplant.55.031903.141616 |
| [23] |
GREBENOK R J, GALBRAITH D W, PENNA D D. Characterization of Zea mays endosperm C-24 sterol methyltransferase: One of two types of sterol methyltransferase in higher plants[J]. Plant Mol Biol, 1997, 34(6): 891-896. DOI:10.1023/A:1005818210641 |
| [24] |
SITBON F, JONSSON L. Sterol composition and growth of transgenic tobacco plants expressing type-1 and type-2 sterol methyltransferases[J]. Planta, 2001, 212(4): 568-572. DOI:10.1007/s004250000417 |
| [25] |
HOLMBERG N, HARKER M, GIBBARD C L, et al. Sterol C-24 methyltransferase type 1 controls the flux of carbon into sterol biosynthesis in tobacco seed[J]. Plant Physiol, 2002, 130(1): 303-311. DOI:10.1104/pp.004226 |
 2019, Vol. 27
2019, Vol. 27


