在植物科学中,模式植物更容易被人们所认识和研究。模式植物的相关研究为经济作物提供了良好的借鉴,有时候也能被直接用来解决经济作物中的一些科学问题。然而,近年来越来越多的证据表明在模式植物和经济作物之间的代谢物生物合成中存在着许多明显的差异。茶树(Camellia sinensis)是重要的经济作物,因为它的叶片可以被用来加工制作成世界上的第二大饮料、仅次于净水的茶[1]。茶的广泛传播和流行与其特有的品质和功能密切相关。茶中含有丰富、复杂且多样的次生代谢物, 其中一些次生代谢物已经被证实是对人体健康有益的活性成分[2]。因此,茶是一种非常适合进行次生代谢物相关研究的植物。然而,关于茶的代谢物生物合成研究面临着巨大的困难,因为茶树的稳定遗传转化体系还未建立。解决茶相关的科学问题可以为植物的次生代谢物研究提供良好的参考模型。与其他植物类似,茶中的次生代谢物可以分为非挥发性代谢物和挥发性代谢物,这些代谢物在茶树的采前和采后阶段中形成。与采前阶段相比,更多的次生代谢物是在采后阶段中形成的[3]。在采前的茶树中,特征性非挥发性次生代谢物包括儿茶素、咖啡因和茶氨酸[2, 4]。跟其他植物一样,茶树的挥发性次生代谢物可根据合成途径的不同分为萜类挥发性物质、脂肪酸衍生类挥发性物质和苯丙素类/苯环型挥发性物(volatile phenylpropanoids/benzenoids, VPBs)[3, 5]。VPBs有与萜类和脂肪酸衍生类挥发性物质相类似的功能,即会影响茶香的品质,此外,VPBs在茶树中也发挥着重要的生态学功能。
VPBs分布的广泛程度在植物挥发性物质的分类中排第二[6]。一般情况下,脂肪酸衍生类和萜类挥发性物质所发挥的生态学功能主要是防御害虫, 而VPBs所发挥的生态学功能则是通过吸引授粉昆虫来参与植物的生殖繁育[7]。除了具有生态学功能外,VPBs也具有重要的经济价值和应用前景,如延长食物储存期、改善风味、提高记忆力、镇静作用[6, 8]。近年来关于VPBs的生物合成研究主要是在矮牵牛花(Petunia hybrida)上进行的,矮牵牛花是进行VPBs研究的模式植物,因为其较为简单的代谢背景有利于相关研究的开展[9-11]。此外,玫瑰(Rosa rugosa)等许多观赏性花卉也含有丰富的VPBs物质[12-14]。大部分的VPBs属于莽草酸代谢途径的, 且一般来自于L-苯丙氨酸。在该代谢途径中起决定作用的第一步是由L-苯丙氨酸生成肉桂酸的过程,该过程是在苯丙氨酸裂解酶催化下进行的[6]。一些VPBs合成是通过非乙酰辅酶A (CoA)的非β-氧化途径,也有些是通过CoA的β-氧化途径[15]。β-氧化途径是包括在肉桂酰-CoA酯作用下激活肉桂酸, 由CoA酯水合生成3-羟基-3-苯基丙酰基-CoA,和在羟基团的氧化下生成3-氧代-3-苯基丙酰-CoA等过程[15]。大多数情况下,关于VPBs的研究主要聚焦在VPBs生物合成的最后一步,如结构酶和基因的功能验证方面。近年来关于VPBs的上游研究也有了重大的突破,包括以下几个方面:① 3-脱氧-D-阿拉伯-庚磺酸盐7-磷酸合成酶是调控莽草酸途径的关键酶,主要是通过研究拟南芥(Arabidopsis thaliana)中细菌反馈不敏感型的3-脱氧-D-阿拉伯-庚磺酸盐7-磷酸合成酶的基因表达量[16]; ②通过在矮牵牛花中使用RNA干涉体系证明了分支酸变位酶基因参与来自于L-苯丙氨酸衍生的VPBs的形成[17]; ③在矮牵牛花中,L-苯丙氨酸是在预苯酸转氨酶和阿罗酸脱水酶的作用下从预苯酸经阿罗酸生成的[9, 18]。此外,植物也可以与一些微生物一样通过苯丙酮酸生成L-苯丙氨酸[19]; ④在矮牵牛花中CoA连接酶在苯环型物质的生物合成中发挥着重要的作用。矮牵牛花中肉桂酸:CoA连接酶(cinnamate: CoA ligase)基因(PhCNL)的下调表达可以导致甲基苯甲酸、苯甲酸-2-苯乙酯、苯甲酸苄酯等VPBs的释放量减少。此外,肉桂酰辅酶A是由定位在过氧化物酶体上的PhCNL酶催化形成的,是来自于L-苯丙氨酸形成苯甲酸的β-氧化途径中的一步关键反应[20]。苯甲醛、苯甲醇、苯乙醛、2-苯乙醇和香豆素等来自于L-苯丙氨酸衍生的挥发性物质在茶叶中发挥着重要的作用,其中苯甲醇和2-苯乙醇的含量相对较高[5]。关于茶树中这些物质的生物合成途径研究还远远落后于玫瑰、矮牵牛等其他富含VPBs物质的植物[5]。尽管近年来在茶树中VPBs的直接研究还相对较少,但是茶树中VPBs的生物合成引起了越来越多人的关注。因此,我们汇总了近年来在茶树中具代表性VPBs直接研究的进展,内容包括VPBs形成过程中参与的生物合成途径、关键酶/基因,以及VPBs形成的胁迫响应机制。同时也探讨了VPBs中一些非传统的生物合成途径,以及这些途径在某些胁迫条件下的响应机制。
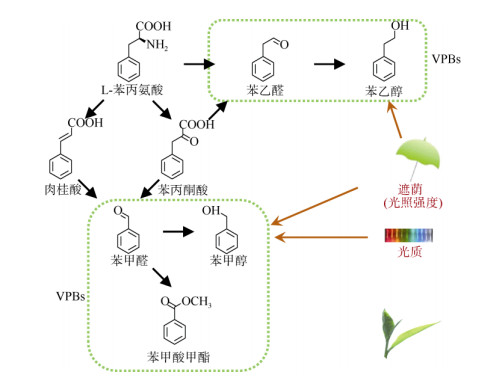
1 2-苯乙醇、苯乙醛等VPBs的生物合成及其对光胁迫的响应2-苯乙醇是一种具有玫瑰花香的芳香族香气, 是植物VPBs中研究较为深入的代谢物之一,因为它是玫瑰精油中的主要香气化合物[13]。与其他苯丙素类的化合物不同之处是苯乙醛和2-苯乙醇并不是通过肉桂酸生成的,而是由苯丙氨酸裂解酶直接催化L-苯丙氨酸底物生成而来的。在番茄(Lycoper- sicon esculentum)、玫瑰等植物的前期研究中, 从L-苯丙氨酸衍生而来的2-苯乙醇主要是通过另外一个VPB化合物——苯乙醛这个中间体生成的,其中涉及到的两个酶分别是苯乙醛合成酶(phenylacetal- dehyde synthase, PAAS)/氨基酸脱羧酶(amino acid decarboxylase, AADC)和苯乙醛还原酶(phenylace- taldehyde reductase, PAR)[12, 21-24]。在茶树中, PAAS/ AADC酶还未得到功能验证,但是能催化苯乙醛生成2-苯乙醇的PAR酶已经成功地得到了验证[25]。尽管已经普遍认为茶树中2-苯乙醇是由L-苯丙氨酸经苯乙醛途径生成而来,但仍需要更直接的体内证据来进一步证实这一推想(图 1)。近年来,2-苯乙醇的另外一条合成途径在玫瑰和甜瓜(Cucumis melo)中也已经被证实了,是从L-苯丙氨酸经苯丙酮酸和苯乙醛这两个中间体生成的,中间参与的酶包括芳香族氨基酸转移酶(aromatic amino acid aminotrans- ferase, AAAT)、苯丙酮酸脱羧酶和PAR[26-28]。在茶叶中AAATs具有L-苯丙氨酸转氨酶的功能,该酶在体外和体内都能催化L-苯丙氨酸生成苯丙酮酸[29]。此外,体外粗酶证据表明茶树中2-苯乙醇也是由L-苯丙氨酸经苯丙酮酸和苯乙醛生成而来的(图 1)[4]。除了从头合成外,2-苯乙醇还可能来自于糖苷体的水解。2-苯乙醇的樱草糖苷体是茶叶中2-苯乙醇的主要糖苷体[5]。2-苯乙醇的樱草糖苷体可以在β-樱草糖苷酶的作用下生成游离态的2-苯乙醇。茶树中的β-樱草糖苷酶是从一种适制绿茶的茶树品种(C. sinensis var. sinensis ‘Yabukita’)中分离纯化而来的,该酶的功能也已经得到了验证[30]。β-樱草糖苷酶能够专一性地催化β-樱草糖苷体,也就是能够水解糖苷配基和二糖之间形成的β-糖苷键,但是却不能催化香气与β-葡萄糖苷之间形成的键[30]。香气糖苷体一般储存在液泡中,但是具有水解作用的β-樱草糖苷酶却定位在细胞壁上[30-31]。细胞中β-樱草糖苷酶(酶)和香气糖苷体(底物)的定位隔离说明在正常完整的叶片中二者是无法接触和发生水解反应的,只有当细胞发生破碎时,如在红茶的加工阶段中,二者可以接触和发生水解反应[3, 31]。
|
图 1 茶中2-苯乙醇、苯乙醛及一些VPBs的生物合成及其对光胁迫的响应(汇总自[4, 29, 34-35]) Fig. 1 Biosyntheses of 2-phenylethanol, phenylacetaldehyde, some VPBs in tea leaves and their formations in response to light stress. VPBs: volatile phenylpropanoids/benzenoids. (Re-drawn from the references [4, 29, 34-35]) |
生物胁迫对植物挥发性物质的影响已有较多的研究报道,如昆虫侵害所引起的变化。在矮牵牛和玫瑰等花类植物中,2-苯乙醇的形成与释放主要是受内源性的生物钟调控和温度等非生物胁迫的调控[11, 28, 32]。在茶树中,2-苯乙醇并不受昆虫侵害和光质的调控[33-34],却能在黑暗条件下(如遮荫)显著上升,主要是由于其前驱体物质L-苯丙氨酸含量的增加(图 1)[35]。尽管在茶叶中含有丰富的2-苯乙醇, 但是它对茶香品质的影响是有限的,因为人类对2-苯乙醇的嗅觉阈值较高,要在水中高达1 000 μg L–1才能被人类闻到[3, 36]。在新鲜的茶叶中,苯乙醛的含量是远远低于2-苯乙醇的含量的,使得人们对苯乙醛的关注度远远低于2-苯乙醇的。由于茶树中苯乙醛和2-苯乙醇的生物学功能是未知的,因此研究这些物质在非生物胁迫下的作用具有重要的意义。
除了2-苯乙醇和苯乙醛外,茶叶中也含有相对含量较高的其他VPBs,如苯甲醇和苯甲醛。苯甲醇具有花香,苯甲醛则具有典型的杏仁香。由于这些香气物质在茶叶中的含量相对较高,所以能够影响茶成品的花香品质,如乌龙茶和红茶[5, 30]。但是, 还需要通过气相色谱-嗅辨仪(gaschromatography- olfactometry, GC-O)或气相色谱-质谱-嗅辨仪联机技术(gaschromatography-mass spectrometry-olfactometry, GC-MS-O)来评价这些香气物质在茶香中的贡献。基于在矮牵牛花中的研究表明,VPBs既可以直接来自于L-苯丙氨酸,也可以来自于肉桂酸[9-10]。通过以苯丙酮酸为底物的粗酶试验表明茶叶中的苯甲醛、苯甲醇,及另一个VPB物质(苯甲酸甲酯)都是来自于苯丙酮酸的[29],因此,在茶叶中可能存在两条生成VPBs的途径(图 1)。与2-苯乙醇相类似,苯甲醇和苯甲醛的含量在黑暗条件下(遮荫)也是显著增加的[35]。此外,与黑暗条件相比,蓝光和红光能进一步增加茶叶中这两个物质的含量,可能是由于激活了苯丙氨酸裂解酶而增加了催化L-苯丙氨酸生成肉桂酸的过程(图 1)[34]。该现象不同于2-苯乙醇的形成,说明不同的VPBs在相同光条件下所作出的响应可能不同,尽管这些物质都是来自于L-苯丙氨酸这个前驱体物质的。与2-苯乙醇相类似,苯甲醇也会以糖苷体的形式储存于茶叶体内,包括β-樱草糖苷体和β-葡萄糖苷体[5]。与β-樱草糖苷酶相比,β-葡萄糖苷酶的功能验证相对较晚。因为这个酶在许多植物和微生物中都是普遍存在的,如在大肠杆菌表达体系中,该微生物本身也含有大量的β-葡萄糖苷酶,所以该体系表达出来的β-葡萄糖苷酶不适合进行体外功能验证。最近,一个更加适合表达β-葡萄糖苷酶的酵母表达体系被成功的建立,所表达出来的β-葡萄糖苷酶可以被用来进行功能验证,该体系可以弥补在大肠杆菌表达体系中的不足[37]。利用这种酵母表达体系,3个来自于GH1、GH3和GH5家族的β-葡萄糖苷酶(CsGH1BG1、CsGH3BG1和CsGH5BG1)被重组表达,进一步的功能验证结果也证实了这些酶能够水解香气糖苷体形成游离态的香气物质,该结果也说明了β-葡萄糖苷酶对香气β-葡萄糖苷体的水解能力没有专一性。此外,也发现了另外一种有趣的现象:β-樱草糖苷酶仅定位在细胞壁上,而β-葡萄糖苷酶则有多种的定位。例如,CsGH5BG1定位在细胞壁上,而CsGH1BG1和CsGH3BG1则分别定位在胞质和液泡上[37]。这些酶在茶树体内的功能验证仍然是未知的。除了醇类的VPBs外,苯甲醛等一些非醇类的VPBs也会以糖苷体的形式储存于茶叶体内[5, 38]。洋李甙这种氰糖苷也是从茶的鲜叶中被分离、纯化和鉴定的。从茶叶中提取和纯化出来的粗酶能水解洋李甙而生成苯甲醛,表明洋李甙可能是苯甲醛的糖苷态前驱体物质[38]。
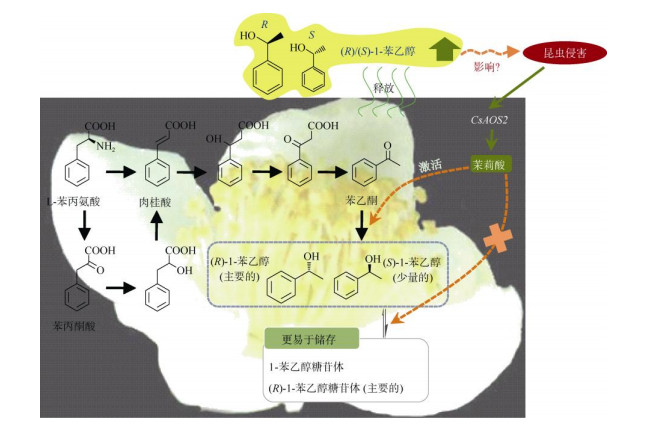
2 1-苯乙醇和苯乙酮的生物合成途径及其昆虫胁迫响应与其他VPBs相比,苯乙酮和1-苯乙醇在许多植物中并非是普遍存在的。苯乙酮是许多类似于杏(Amygdalus communis)、樱桃(Cerasus pseudocerasus)、茉莉(Jasminum sambac)和草莓(Fragaria ananassa)等植物香气的前驱体物质,而1-苯乙醇因其温和的花香味在化妆品行业被作为一种香味剂而广泛应用[39]。这两种物质在山茶属,尤其是茶树中高含量蓄积[40]。苯乙酮和1-苯乙醇这两个挥发性物质是茶花中的主要VPBs物质,但是在茶叶中含量却非常的低[41]。它们的合成途径在微生物和化学反应中都是已知的[42-44],但是在植物中仍然是未知的。在茶花中的稳定同位素饲喂实验表明可能存在两条生成苯乙酮和1-苯乙醇的途径:主要的一条途径是从L-苯丙氨酸经肉桂酸、3-羟基-3-苯基丙酸和苯乙酮生成1-苯乙醇;另外一条可能的途径是从L-苯丙氨酸经苯丙酮酸、苯乳酸、肉桂酸、3-羟基-3-苯基丙酸和苯乙酮生成1-苯乙醇(图 2)[40]。茶花和茶叶中都含有转化苯乙酮生成1-苯乙醇的酶,而1-苯乙醇在这两个组织之间存在差异的原因是由于苯乙酮可利用性的差异[41]。L-苯丙氨酸到苯乙酮的低转化率是造成茶叶中1-苯乙醇含量低的主要原因[41]。此外,稳定同位素标记的[2H8] L-苯丙氨酸和[2H5]苯乙酮的饲喂试验表明,大部分植物都含有催化1-苯乙醇生成苯乙酮的酶,且1-苯乙醇在茶花和其他植物存在蓄积差异的原因是由于它的前驱体物质苯乙酮在其他植物中缺失造成的[25]。1-苯乙醇具有不同的手性结构,分别是(R)-型和(S)-型。催化苯乙酮生成(R)/(S)-1-苯乙醇的酶已经得到了功能验证,是一种短链脱氢酶(short chain dehydrogenase, SDR)。茶花中许多SDR基因已经被克隆和功能验证。一些大肠杆菌重组表达的SDR蛋白具有催化苯乙酮生成(S)-1-苯乙醇(CsSPESs, > 99.0%)的功能, 仅有1个SDR蛋白能够专一性地产生(R)-1-苯乙醇(CsRPESs, 98.6%)[25, 45]。此外,茶花中也含有具有催化1-苯乙醇生成苯乙酮的CsSDR蛋白[46]。与2-苯乙醇相类似,(R)/(S)-1-苯乙醇在茶花中同样也会以糖苷体的形式存在。从茶花中总共分离到了四种糖苷态的1-苯乙醇,分别是(R)-1-苯乙醇β-D-葡萄糖苷体、(S)-1-苯乙醇β-D-葡萄糖苷体、(R)-1-苯乙醇β-樱草糖苷体和(S)-1-苯乙醇β-樱草糖苷体[47]。在花的不同阶段和不同器官中,1-苯乙醇β-D-葡萄糖苷体的含量远远高于1-苯乙醇β-樱草糖苷体。1-苯乙醇糖苷体可能不易于被水解生成游离态的1-苯乙醇, 因为β-樱草糖苷酶基因在花粉中的表达量不高,而花粉又是蓄积1-苯乙醇糖苷体和游离态1-苯乙醇的主要部位[47]。关于1-苯乙醇的相关研究有利于将来对废弃茶树花资源的开发利用[48-49]。
|
图 2 茶花中具代表性VPBs苯乙酮和1-苯乙醇的生物合成及其昆虫胁迫响应。CsAOS2:丙二烯氧化物合成酶2。(汇总自[40-41, 47, 50-51]) Fig. 2 Biosyntheses of characteristic VPBs acetophenone and 1-phenylethanol in tea flowers and their formations in response to insect attacks. CsAOS2: Allene oxide synthase 2. (Re-drawn from references [40-41, 47, 50-51]) |
在茶花中,内在的1-苯乙醇主要是以(R)-型为主, 但是(R)-型和(S)-型的比例在内在和释放的1-苯乙醇之间存在明显的差异。超过88%的内在1-苯乙醇是以(R)-型为主,但是两种构型在释放的1-苯乙醇中所占的比例相当[40]。对于造成这种差异的原因仍然是未知的。此外,1-苯乙醇β-D-葡萄糖苷体的两种构型的比例也不同于1-苯乙醇β-樱草糖苷体的两种构型[47]。更有趣的是田间受到昆虫侵害后的茶花所释放出来的(R)-1-苯乙醇和(S)-1-苯乙醇的比例不同于未受侵害茶花所释放出来的比例。蓟马(Thrips hawaiiensis)是切花和蔬菜作物的一种主要害虫,若将该虫人为接到未受侵害的茶花上,经过一定的取食时间后,也会造成释放的(R)-1-苯乙醇和(S)-1-苯乙醇的比例发生变化[50]。这种处理方式同样也会造成茉莉酸含量的上升,主要是通过激活茉莉酸合成途径上丙二烯氧化物合成酶2基因的表达量[51]。外源施加茉莉酸处理茶花也会引起释放出来的(R)-1-苯乙醇和(S)-1-苯乙醇的比例发生变化, 所呈现出来的构型比例与茶花蓟马侵害后的结果相类似,表明茉莉酸可能参与昆虫侵害造成茶花所释放出来的(R)-1-苯乙醇的比例发生变化的过程(图 2)[50]。此外,茶花蓟马处理不能显著引起1-苯乙醇糖苷体转化成游离态1-苯乙醇的过程,但是能影响苯乙酮生成1-苯乙醇的过程,从而造成释放的(R)-1-苯乙醇的比例发生变化(图 2)[50]。昆虫侵害造成1-苯乙醇的比例发生变化的原因及茶花做出该响应的机制仍然是未知的。
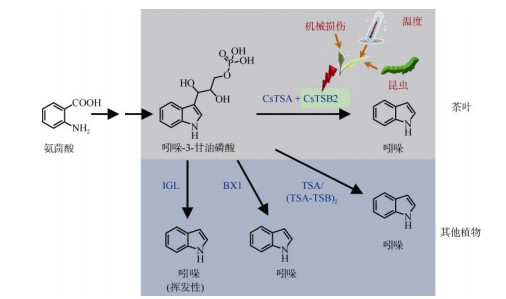
3 吲哚的生物合成及其在温度和机械损伤胁迫下的响应机制吲哚是一种具有芳香性的富电子杂环化合物, 由1个六元苯环熔合成1个五元吡咯环组成。已有报道吲哚在植物中具有多种功能,如是植物的生长素吲哚乙酸(indolyl-3-acetic acid, IAA)和色氨酸的重要前驱体物质[52-53]。作为挥发性物质,吲哚也具有重要的生态学防御功能,已在玉米(Zea mays)中得到证实[54]。在茶叶中,吲哚的积累也与昆虫侵害存在着一种密切的联系[33]。从植物的角度来说,作为挥发性物质的吲哚可以响应昆虫侵害,可能参与茶树防御昆虫侵害的过程[33]。此外,茶尺蠖(Ectropis oblique hypulina)、茶小卷叶蛾(Adoxophyes orana)、茶红蜘蛛(Grammostola mollicoma)等茶树的主要害虫都能造成茶树中吲哚的大量蓄积[33, 55], 这说明吲哚可能是茶树中防御害虫的共性物质。探索吲哚在茶树中是否具有抗虫作用,及其是否具有广谱性的抗虫作用等科学问题具有重要的意义。该问题的解析有利于提高茶的安全品质,因此在将来会引起越来越多茶领域工作者的关注。事实上,吲哚在茶中是发挥着双重作用的,除了前面所介绍的生态学功能外,若从食品的角度来看,吲哚还是茶香的主要贡献物质之一。吲哚在浓度很低时具有类似于花的香味,是许多花香的重要组分之一,如橘子花,但当浓度过高时却会产生刺鼻的粪便气味。通过GC-O和GC-MS-O的分析表明,吲哚是乌龙茶的主要贡献因子,且在这类茶中大量存在[31, 56]。但是, 在完好未受损失的茶叶中,吲哚含量非常低,处于痕量水平[57]。吲哚主要是在采后茶叶中形成的, 由乌龙茶加工过程中的机械损伤引起的。吲哚在茶树中的形成主要是由于胁迫引起的,在采前生长阶段是由于昆虫侵害引起的,在采后加工阶段主要是由于机械损伤和低温所引起的(图 3)[31, 33-34, 57-58]。通过不同光质和光强处理发现吲哚是不受光因子调控的[34]。吲哚代谢途径在多种植物中得到了较为全面的研究,特别是在拟南芥、玉米、草和小麦中[53, 59-61]。研究表明, 吲哚是在吲哚-3-甘油磷酸裂解酶作用下从吲哚-3-甘油磷酸(indole-3-glycerol phosphate, IGP)生成,而IGP是来自于氨茴酸的(图 3)。IGP是色氨酸依赖的生长素合成途径和苯并恶嗪酮合成途径中的关键节点[62-63]。IGP可以在苯并恶嗪酮合成酶1 (benzoxazineless1, BX1)的作用下裂解生成吲哚和甘油醛-3-磷酸,是植物中生成天然除草剂苯并恶唑嗪酮途径中的第一步反应[64]。BX1也能作为功能活性单体,可以在昆虫侵害的情况下催化产生挥发性的信号物质吲哚[65-66]。在色氨酸合成的过程中,可以在色氨酸α亚基(tryptophan synthase α-subunit, TSA)的作用下发生同样的反应(α-反应)[61]。不同于BX1催化所产生的吲哚,该类吲哚不能从植物体内释放出来,只能在色氨酸β亚基(tryptophan synthase β- subunit, TSB)的进一步催化下生成色氨酸(β-反应)。TSA的活性在很大程度上是依赖于TSB的[65]。在玉米和拟南芥中的TSA和TSB会以四聚体的形式存在(ααββ异四聚体)[53, 61]。因此,在这些植物中TSA和TSB蛋白之间是存在互作的。在茶树中, 通过利用稳定同位素标记的[15N]氨茴酸来饲喂茶叶的实验发现吲哚是来自于氨茴酸的,获得了生物合成途径的体内证据[31]。在茶中的IGP是形成吲哚的直接前驱体物质,与其他植物中的结果相类似[53, 61]。在功能验证试验中,只有CsTSA和CsTSB2蛋白结合时才能催化IGP而生成吲哚(图 3)[57]。此外,通过基因的表达量分析发现,在机械损伤和低温胁迫共同存在时能激活CsTSB2基因的表达[3, 57, 67]。因此, 可以推测CsTSB2基因是茶树中吲哚形成的关键基因。但是,玉米中的TSA却是影响吲哚形成的关键酶[53]。作为重要的上游信号物质,茉莉酸在植物挥发性物质形成中发挥着重要的作用。茉莉酸在茶树中确实也参与了吲哚的积累。通过外源性的施加茉莉酸可以促使茶树产生大量的吲哚,且该现象不会随着茶树品种的不同而发生改变[33]。此外,茉莉酸被认为是茶树中吲哚响应外界胁迫的上游信号物质(图 3)[3]。
|
图 3 茶和其他植物中吲哚的生物合成,以及茶中吲哚的胁迫响应。IGL:吲哚-3甘油磷酸裂解酶; BX1:苯并恶嗪酮合成酶1; TSA:色氨酸合酶α亚基; TSB:色氨酸合酶β亚基。(汇总自[33, 57-58, 61-62, 66]) Fig. 3 Biosynthesis of indole in tea leaves and other plants and its formation in tea leaves in response to stresses. IGL: Indole-3-glycerolphosphate lyases; BX1: Benzoxazineless1; TSA: Tryptophan synthase α-subunit; TSB: Tryptophan synthase β-subunit. (Re-drawn from references [33, 57-58, 61-62, 66]) |
本综述中,我们汇总了近年来关于茶树具代表性VPBs的生物合成,及其响应生物和非生物胁迫的形成机制。不同类型的VPBs对胁迫具有不同的响应。黑暗胁迫可诱导2-苯乙醇、苯乙醛等VPBs含量增加;昆虫胁迫可诱导1-苯乙醇的构型发生变化;低温和机械损伤胁迫可协同诱导吲哚的含量蓄积。植物激素,尤其茉莉酸是茶树中VPBs响应外界胁迫的重要上游信号物质。由于茶树遗传转化体系还未成功建立,许多体内的直接证据还未能在茶树体内获得,许多重要的科学问题还有待于在后续的研究中解决。
VPBs的许多生物合成途径有待于进一步的研究。茶树VPBs生物合成途径中的许多反应过程是参考其他已报道的植物。由于茶树的稳定遗传转化体系还未建立,稳定同位素示踪技术是获得茶树VPBs生物合成体内证据的一种有效可行的方法。
除了已知的VPB合成途径外,茶树中VPBs的一些非传统的生物合成途径有待于进一步的探索和研究。例如,苯丙酮酸衍生的路径可能在茶树VPBs的合成中发挥着重要的作用。
茶树中VPBs的一些合成酶已经得到了功能验证。通过大肠杆菌表达体系、昆虫细胞表达体系和模式植物的转基因体系,茶树中越来越多参与VPBs合成的酶得到了功能验证,也得到了更加全面的VPBs生物合成概貌。
将来的研究可以聚焦到阐明VPBs在茶香品质和生态学功能方面所发挥的作用。对于茶饮料而言,许多VPBs的研究有助于解析这些化合物是否是茶产品的香气品质贡献因子。对于茶树而言,阐明不同VPBs对胁迫做出不同响应的原因,及其所发挥的生态学功能具有重要的意义,也是将来需要开展的工作。此外,具有毒性的一些VPBs,如苯乙腈这类物质在受到昆虫侵害后会大量的产生[33]。关于该物质是否具有防御茶树害虫的作用,及其在多少浓度范围内不会影响茶的安全品质等问题都是将来值得探索的内容。
| [1] |
RIETVELD A, WISEMAN S. Antioxidant effects of tea: Evidence from human clinical trials[J]. J Nutr, 2003, 133(10): 3285S-3292S. DOI:10.1093/jn/133.10.3285S |
| [2] |
WAN X C, XIA T. Secondary Metabolism of Tea Plant[M]. Beijing: Science Press, 2015: 1-12. 宛晓春, 夏涛. 茶树次生代谢[M]. 北京: 科学出版社, 2015: 1-12. |
| [3] |
ZENG L T, WATANABE N, YANG Z Y. Understanding the biosyn- theses and stress response mechanisms of aroma compounds in tea (Camellia sinensis) to safely and effectively improve tea aroma[J]. Crit Rev Food Sci Nutr, 2019, 59(14): 2321-2334. DOI:10.1080/10408398.2018.1506907 |
| [4] |
WAN X C. Tea Biochemistry[M]. 3rd ed. Beijing: China Agriculture Press, 2003: 76-119. 宛晓春. 茶叶生物化学[M]. 第3版. 北京: 中国农业出版社, 2003: 76-119. |
| [5] |
YANG Z Y, BALDERMANN S, WATANABE N. Recent studies of the volatile compounds in tea[J]. Food Res Int, 2013, 53(2): 585-599. DOI:10.1016/j.foodres.2013.02.011 |
| [6] |
PICHERSKY E, NOEL J P, DUDAREVA N. Biosynthesis of plant volatiles: Nature's diversity and ingenuity[J]. Science, 2006, 331(5762): 808-811. DOI:10.1126/science.1118510 |
| [7] |
SCHIESTL F P. The evolution of floral scent and insect chemical communication[J]. Ecol Lett, 2010, 13(5): 643-656. DOI:10.1111/j.1461-0248.2010.01451.x |
| [8] |
SCHWAB W, DAVIDOVICH-RIKANATI R, LEWINSOHN E. Biosyn- thesis of plant-derived flavor compounds[J]. Plant J, 2008, 54(4): 712-732. DOI:10.1111/j.1365-313X.2008.03446.x |
| [9] |
MAEDA H, SHASANY A K, SCHNEPP J, et al. RNAi suppression of Arogenate dehydratase1 reveals that phenylalanine is synthesized predominantly via the arogenate pathway in petunia petals[J]. Plant Cell, 2010, 22(3): 832-849. DOI:10.1105/tpc.109.073247 |
| [10] |
NEGRE-ZAKHAROV F, LONG M C, DUDAREVA N. Floral scents and fruit aromas inspired by nature [M]// OSBOURN A E, LANZOTTI V. Plant-derived Natural Products: Synthesis, Function, and Application. New York, NY: Springer, 2009: 405-431. doi: 10.1007/978-0-387-85498-4_19.
|
| [11] |
CHENG S H, FU X M, MEI X, et al. Regulation of biosynthesis and emission of volatile phenylpropanoids/benzenoids in Petunia×hybrida flowers by multi-factors of circadian clock, light, and temperature[J]. Plant Physiol Biochem, 2016, 107: 1-8. DOI:10.1016/j.plaphy.2016.05.026 |
| [12] |
SAKAI M, HIRATA H, SAYAMA H, et al. Production of 2-phenyl- ethanol in roses as the dominant floral scent compound from L-phenyl- alanine by two key enzymes, a PLP-dependent decarboxylase and a phenylacetaldehyde reductase[J]. Biosci Biotechnol Biochem, 2007, 71(10): 2408-2419. DOI:10.1271/bbb.70090 |
| [13] |
BALDERMANN S, YANG Z Y, SAKAI M, et al. Volatile constituents in the scent of roses[M]// TEIXEIRA da S J A. Floriculture and Ornamental Biotechnology: Special Issue: Roses. London: Global Science Books, 2009: 89-97.
|
| [14] |
SUN P L, SCHUURINK R C, CAISSARD J C, et al. My way: Non- canonical biosynthesis pathways for plant volatiles[J]. Trends Plant Sci, 2016, 21(10): 884-894. DOI:10.1016/j.tplants.2016.07.007 |
| [15] |
BOATRIGHT J, NEGRE F, CHEN X L, et al. Understanding in vivo benzenoid metabolism in petunia petal tissue[J]. Plant Physiol, 2004, 135(4): 1993-2011. DOI:10.1104/pp.104.045468 |
| [16] |
TZIN V, MALITSKY S, BEN Z M M, et al. Expression of a bacterial feedback-insensitive 3-deoxy-D-arabino-heptulosonate 7-phosphate synthase of the shikimate pathway in Arabidopsis elucidates potential metabolic bottlenecks between primary and secondary metabolism[J]. New Phytol, 2012, 194(2): 430-439. DOI:10.1111/j.1469-8137.2012.04052.x |
| [17] |
COLQUHOUN T A, SCHIMMEL B C J, KIM J Y, et al. A petunia chorismate mutase specialized for the production of floral volatiles[J]. Plant J, 2010, 61(1): 145-155. DOI:10.1111/j.1365-313X.2009.04042.x |
| [18] |
MAEDA H, YOO H, DUDAREVA N. Prephenate aminotransferase directs plant phenylalanine biosynthesis via arogenate[J]. Nat Chem Biol, 2011, 7(1): 19-21. DOI:10.1038/nchembio.485 |
| [19] |
TZIN V, GALILI G. New insights into the shikimate and aromatic amino acids biosynthesis pathways in plants[J]. Mol Plant, 2010, 3(6): 956-972. DOI:10.1093/mp/ssq048 |
| [20] |
KLEMPIEN A, KAMINAGA Y, QUALLEY A, et al. Contribution of CoA ligases to benzenoid biosynthesis in petunia flowers[J]. Plant Cell, 2012, 24(5): 2015-2030. DOI:10.1105/tpc.112.097519 |
| [21] |
TIEMAN D, TAYLOR M, SCHAUER N, et al. Tomato aromatic amino acid decarboxylases participate in synthesis of the flavor volatiles 2-phenylethanol and 2-phenylacetaldehyde[J]. Proc Natl Acad Sci USA, 2006, 103(21): 8287-8292. DOI:10.1073/pnas.0602469103 |
| [22] |
YANG Z Y, SAKAI M, SAYAMA H, et al. Elucidation of the biochemical pathway of 2-phenylethanol from shikimic acid using isolated protoplasts of rose flowers[J]. J Plant Physiol, 2009, 166(8): 887-891. DOI:10.1016/j.jplph.2008.11.001 |
| [23] |
CHEN X M, KOBAYASHI H, SAKAI M, et al. Functional charac- terization of rose phenylacetaldehyde reductase (PAR), an enzyme involved in the biosynthesis of the scent compound 2-phenylethanol[J]. J Plant Physiol, 2011, 168(2): 88-95. DOI:10.1016/j.jplph.2010.06.011 |
| [24] |
HIRATA H, OHNISHI T, WATANABE N. Biosynthesis of floral scent 2-phenylethanol in rose flowers[J]. Biosci Biotechnol Biochem, 2016, 80(10): 1865-1873. DOI:10.1080/09168451.2016.1191333 |
| [25] |
ZHOU Y, PENG Q Y, ZENG L T, et al. Study of the biochemical formation pathway of aroma compound 1-phenylethanol in tea[Camellia sinensis (L.) O. Kuntze] flowers and other plants[J]. Food Chem, 2018, 258: 352-358. DOI:10.1016/j.foodchem.2018.03.095 |
| [26] |
GONDA I, BAR E, PORTNOY V, et al. Branched-chain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L. fruit[J]. J Exp Bot, 2010, 61(4): 1111-1123. DOI:10.1093/jxb/erp390 |
| [27] |
HIRATA H, OHNISHI T, ISHIDA H, et al. Functional characterization of aromatic amino acid aminotransferase involved in 2-phenylethanol biosynthesis in isolated rose petal protoplasts[J]. J Plant Physiol, 2012, 169(5): 444-451. DOI:10.1016/j.jplph.2011.12.005 |
| [28] |
HIRATA H, OHNISHI T, TOMIDA K, et al. Seasonal induction of alternative principal pathway for rose flower scent[J]. Sci Rep, 2016, 6: 20234. DOI:10.1038/srep20234 |
| [29] |
WANG X Q, ZENG L T, LIAO Y Y, et al. An alternative pathway for the formation of aromatic aroma compounds derived from L-pheny- lalanine via phenylpyruvic acid in tea[Camellia sinensis (L.) O. Kuntze] leaves[J]. Food Chem, 2019, 270: 17-24. DOI:10.1016/j.foodchem.2018.07.056 |
| [30] |
MIZUTANI M, NAKANISHI H, EMA J I, et al. Cloning of β-prime- verosidase from tea leaves, a key enzyme in tea aroma formation[J]. Plant Physiol, 2002, 130(4): 2164-2176. DOI:10.1104/pp.102.011023 |
| [31] |
GUI J D, FU X M, ZHOU Y, et al. Does enzymatic hydrolysis of glycolsidically bound volatile compounds really contribute to the formation of volatile compounds during the oolong tea manufacturing process?[J]. J Agric Food Chem, 2015, 63(31): 6905-6914. DOI:10.1021/acs.jafc.5b02741 |
| [32] |
ZENG L T, WANG X Q, DONG F, et al. Increasing postharvest high- temperatures lead to increased volatile phenylpropanoids/benzenoids accumulation in cut rose (Rosa hybrida) flowers[J]. Postharvest Biol Technol, 2019, 148: 68-75. DOI:10.1016/j.postharvbio.2018.10.012 |
| [33] |
DONG F, YANG Z Y, BALDERMANN S, et al. Herbivore-induced volatiles from tea (Camellia sinensis) plants and their involvement in intraplant communication and changes in endogenous nonvolatile metabolites[J]. J Agric Food Chem, 2011, 59(24): 13131-13135. DOI:10.1021/jf203396a |
| [34] |
FU X M, CHEN Y Y, MEI X, et al. Regulation of formation of volatile compounds of tea (Camellia sinensis) leaves by single light wavelength[J]. Sci Rep, 2015, 5: 16858. DOI:10.1038/srep16858 |
| [35] |
YANG Z Y, KOBAYASHI E, KATSUNO T, et al. Characterisation of volatile and non-volatile metabolites in etiolated leaves of tea (Camellia sinensis) plants in the dark[J]. Food Chem, 2012, 135(4): 2268-2276. DOI:10.1016/j.foodchem.2012.07.066 |
| [36] |
SCHUH C, SCHIEBERLE P. Characterization of the key aroma compounds in the beverage prepared from Darjeeling black tea: Quantitative differences between tea leaves and infusion[J]. J Agric Food Chem, 2006, 54(3): 916-924. DOI:10.1021/jf052495n |
| [37] |
ZHOU Y, ZENG L T, GUI J D, et al. Functional characterizations of β-glucosidases involved in aroma compound formation in tea (Camellia sinensis)[J]. Food Res Int, 2017, 96: 206-214. DOI:10.1016/j.foodres.2017.03.049 |
| [38] |
GUO W F, SASAKI N, FUKUDA M, et al. Isolation of an aroma precursor of benzaldehyde from tea leaves (Camellia sinensis var. sinensis cv. Yabukita)[J]. Biosci Biotechnol Biochem, 1998, 62(10): 2052-2054. DOI:10.1271/bbb.62.2052 |
| [39] |
SUNA C L, SARMIDI M R. Immobilised lipase-catalysed resolution of (R, S)-1-phenylethanol in recirculated packed bed reactor[J]. J Mol Catal B: Enzym, 2004, 28(2/3): 111-119. DOI:10.1016/j.molcatb.2004.02.004 |
| [40] |
DONG F, YANG Z Y, BALDERMANN S, et al. Characterization of L-phenylalanine metabolism to acetophenone and 1-phenylethanol in the flowers of Camellia sinensis using stable isotope labeling[J]. J Plant Physiol, 2012, 169(3): 217-225. DOI:10.1016/j.jplph.2011.12.003 |
| [41] |
DONG F, ZHOU Y, ZENG L T, et al. Elucidation of differential accumulation of 1-phenylethanol in flowers and leaves of tea (Camellia sinensis) plants[J]. Molecules, 2016, 21(9): 1106. DOI:10.3390/molecules21091106 |
| [42] |
YUN H, YANG Y H, CHO B K, et al. Simultaneous synthesis of enantiomerically pure (R)-1-phenylethanol and (R)-α-methylbenzy- lamine from racemic α-methylbenzylamine using ω-transaminase/ alcohol dehydrogenase/glucose dehydrogenase coupling reaction[J]. Biotechnol Lett, 2003, 25(10): 809-814. DOI:10.1023/A:1023500406897 |
| [43] |
BAILEY W F, LUDERER M R. Asymmetric addition of chiral methyl- magnesium alkoxides to benzaldehyde[J]. ARKIVOC, 2010, 2010(8): 108-115. DOI:10.3998/ark.5550190.0011.810 |
| [44] |
NAKATA Y, FUKAE T, KANAMORI R, et al. Purification and charac- terization of acetophenone reductase with excellent enantioselectivity from Geotrichum candidum NBRC 4597[J]. Appl Microbiol Biotechnol, 2010, 86(2): 625-631. DOI:10.1007/s00253-009-2329-5 |
| [45] |
ZHOU Y, PENG Q Y, ZHANG L, et al. Characterization of enzymes specifically producing chiral flavor compounds (R)- and (S)-1-phenyl- ethanol from tea (Camellia sinensis) flowers[J]. Food Chem, 2019, 280: 27-33. DOI:10.1016/j.foodchem.2018.12.035 |
| [46] |
ZHOU Y, ZHANG L, GUI J D, et al. Molecular cloning and charac- terization of a short-chain dehydrogenase showing activity with volatile compounds isolated from Camellia sinensis[J]. Plant Mol Biol Rep, 2015, 33(2): 253-263. DOI:10.1007/s11105-014-0751-z |
| [47] |
ZHOU Y, DONG F, KUNIMASA A, et al. Occurrence of glycosidically conjugated 1-phenylethanol and its hydrolase β-primeverosidase in tea (Camellia sinensis) flowers[J]. J Agric Food Chem, 2014, 62(32): 8042-8050. DOI:10.1021/jf5022658 |
| [48] |
DONG F, ZHOU Y, ZENG L T, et al. Optimization of the production of 1-phenylethanol using enzymes from flowers of tea (Camellia sinensis) plants[J]. Molecules, 2017, 22(1): 131. DOI:10.3390/molecules22010131 |
| [49] |
CHEN Y Y, ZHOU Y, ZENG L T, et al. Occurrence of functional molecules in the flowers of tea (Camellia sinensis) plants: Evidence for a second resource[J]. Molecules, 2018, 23(4): 790. DOI:10.3390/molecules23040790 |
| [50] |
ZHOU Y, ZENG L T, LIAO Y Y, et al. Insects[Thrips hawaiiensis (Morgan)] change the stereochemical configuration of 1-phenylethanol emitted from tea (Camellia sinensis) flowers[J]. RSC Adv, 2017, 7(51): 32336-32343. DOI:10.1039/C7RA03219F |
| [51] |
PENG Q Y, ZHOU Y, LIAO Y Y, et al. Functional characterization of an Allene oxide synthase involved in biosynthesis of jasmonic acid and its influence on metabolite profiles and ethylene formation in tea (Camellia sinensis) flowers[J]. Int J Mol Sci, 2018, 19(8): 2440. DOI:10.3390/ijms19082440 |
| [52] |
ÖSTIN A, ILIĆ N, COHEN J D. An in vitro system from maize seedlings for tryptophan-independent indole-3-acetic acid biosynthesis[J]. Plant Physiol, 1999, 119(1): 173-178. DOI:10.1104/pp.119.1.173 |
| [53] |
KRIECHBAUMER V, WEIGANG L, FIEßELMANN A, et al. Charac- terisation of the tryptophan synthase alpha subunit in maize[J]. BMC Plant Biol, 2008, 8: 44. DOI:10.1186/1471-2229-8-44 |
| [54] |
ERB M, VEYRAT N, ROBERT C A M, et al. Indole is an essential herbivore-induced volatile priming signal in maize[J]. Nat Commun, 2015, 6: 6273. DOI:10.1038/ncomms7273 |
| [55] |
CAI X M, SUN X L, DONG W X, et al. Herbivore species, infestation time, and herbivore density affect induced volatiles in tea plants[J]. Chemoecology, 2014, 24(1): 1-14. DOI:10.1007/s00049-013-0141-2 |
| [56] |
ZHU J C, CHEN F, WANG L Y, et al. Comparison of aroma-active volatiles in oolong tea infusions using GC-olfactometry, GC-FPD, and GC-MS[J]. J Agric Food Chem, 2015, 63(34): 7499-7510. DOI:10.1021/acs.jafc.5b02358 |
| [57] |
ZENG L T, ZHOU Y, GUI J D, et al. Formation of volatile tea consti- tuent indole during the oolong tea manufacturing process[J]. J Agric Food Chem, 2016, 64(24): 5011-5019. DOI:10.1021/acs.jafc.6b01742 |
| [58] |
KATSUNO T, KASUGA H, KUSANO Y, et al. Characterization of odorant compounds and their biochemical formation in green tea with a low temperature storage process[J]. Food Chem, 2014, 148: 388-395. DOI:10.1016/j.foodchem.2013.10.069 |
| [59] |
FREY M, CHOMET P, GLAWISCHNIG E, et al. Analysis of a chemical plant defense mechanism in grasses[J]. Science, 1997, 277(5326): 696-699. DOI:10.1126/science.277.5326.696 |
| [60] |
NOMURA T, ISHIHARA A, IWAMURA H, et al. Molecular charac- terization of benzoxazinone-deficient mutation in diploid wheat[J]. Phytochemistry, 2007, 68(7): 1008-1016. DOI:10.1016/j.phytochem.2007.01.007 |
| [61] |
ZHANG R, WANG B, OUYANG J, et al. Arabidopsis indole synthase, a homolog of tryptophan synthase alpha, is an enzyme involved in the Trp- independent indole-containing metabolite biosynthesis[J]. J Integr Plant Biol, 2008, 50(9): 1070-1077. DOI:10.1111/j.1744-7909.2008.00729.x |
| [62] |
OUYANG J, SHAO X, LI J Y. Indole-3-glycerol phosphate, a branch- point of indole-3-acetic acid biosynthesis from the tryptophan biosyn- thetic pathway in Arabidopsis thaliana[J]. Plant J, 2000, 24(3): 327-333. DOI:10.1046/j.1365-313x.2000.00883.x |
| [63] |
MAEDA H, DUDAREVA N. The shikimate pathway and aromatic amino acid biosynthesis in plants[J]. Annu Rev Plant Biol, 2012, 63: 73-105. DOI:10.1146/annurev-arplant-042811-105439 |
| [64] |
FREY M, SCHULLEHNER K, DICK R, et al. Benzoxazinoid biosyn- thesis, a model for evolution of secondary metabolic pathways in plants[J]. Phytochemistry, 2009, 70(15/16): 1645-1651. DOI:10.1016/j.phytochem.2009.05.012 |
| [65] |
SCHULLEHNER K, DICK R, VITZTHUM F, et al. Benzoxazinoid biosynthesis in dicot plants[J]. Phytochemistry, 2008, 69(15): 2668-2677. DOI:10.1016/j.phytochem.2008.08.023 |
| [66] |
FREY M, STETTNER C, PARÉ P W, et al. An herbivore elicitor activates the gene for indole emission in maize[J]. Proc Natl Acad Sci USA, 2000, 97(26): 14801-14806. DOI:10.1073/pnas.260499897 |
| [67] |
ZENG L T, ZHOU Y, FU X M, et al. Does oolong tea (Camellia sinensis) made from a combination of leaf and stem smell more aromatic than leaf-only tea? Contribution of the stem to oolong tea aroma[J]. Food Chem, 2017, 237: 488-498. DOI:10.1016/j.foodchem.2017.05.137 |
 2019, Vol. 27
2019, Vol. 27


