2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
1859年,达尔文在《物种起源》中描述加拉帕戈斯群岛达尔文雀(Coerebini)鸟喙的大小和形状时第一次引入了性状的概念[1],而功能性状(functional trait)正式提出则是在1946年卡特尔对人格的构成和测量的心理学研究中[2]。近20年来,植物功能性状的研究得到广泛关注和迅速发展[3]。植物功能性状包括了植物形态、生理、物候等特性[4],通过植物功能性状可以解释植物对不同环境的适应机理[5-6],预测植物的分布格局[7-8],探究群落的组成和功能[9-10],以及评估生态系统的功能和服务[11-12]。
目前比较常用的植物功能性状包括植物叶片经济学和植物水力结构有关的特征。具体而言,叶片经济学性状包括叶片光合速率、叶片比叶重、叶片寿命、叶片呼吸速率、叶片氮磷含量等[13];植物水力结构有关的性状则包括木质部的导水率、叶片凌晨和中午水势、叶片膨压丧失点、植物导水率丧失50%时的水势、水力安全系数(hydraulic safety margin)、木材密度等[14]。本文主要针对这些与植物的生长和分布密切相关的植物水力学和经济学功能性状,围绕气候因子对植物功能性状的影响以及功能性状之间的相互联系,从植物个体到全球尺度水平进行梳理和讨论。
1 种内水平植物功能性状与环境因子的关系 1.1 种内水平功能性状的空间变化研究单种植物功能性状随环境因子的变化有助于理解气候变化条件下植物适应环境的生理生态学机制,对认识植物的迁移和分布有着重要的指导意义。随着干旱的加剧,欧洲山毛榉(Fagus sylvatica)种群的枝条抗气穴化能力增加,纹孔膜的厚度增加,但导管直径变窄,说明植物可以增强自身抗气穴化能力, 有效应对干旱胁迫[15]。Liang等[16]对我国南方常绿阔叶林优势树种丝栗栲(Castanopsis fargesii)的研究表明,随着降水的增加,植物枝条的导水率、叶片密度和叶片膨压丧失点都显著升高, 说明植物的水力功能性状具有很强的可塑性,有助于植物适应气候变化背景下降水的改变,包括强度、频度和起始时间上的变化。此外, Schreiber等[17]对加拿大西部4个地点颤杨(Populus tremuloides)导管直径的研究也表明,导管直径具有很强的表型可塑性,与夏季降水具有显著的正相关关系。
1.2 时间尺度上种内植物功能性状与环境因子的关系研究植物种内功能性状与环境因子的关系在时间尺度上的变化,是揭示植物适应环境变化尤其当地气候变化的重要手段。有关植物功能性状随气候动态变化的相关研究较多,尤以年际动态和季节动态的研究居多,研究结果对如何保护和可持续利用当地森林具有科学指导意义。对加拿大颤杨树轮宽度的研究表明,由气候变暖引发的干旱降低了植物的径向生长,因此, 需要制定有效的灌溉措施以保护现有的森林[18]。此外,Gao等[19]研究了干旱对美国西南部3树种(Pseudotsuga menziesii, Pinus ponderosa, Pinus edulis)年轮径向生长的影响,认为干旱过程对植物的影响非常复杂,干旱频率和干旱时长的增加对树木的生长具有“累加效应”,即两者同时存在扩大了干旱对树木的影响,并降低了树木的抗旱性;而干旱起始时间和干旱强度的增加则对树木的径向生长具有“遗留效应”,即显著地影响树木后续的径向生长, 这说明除了干旱胁迫程度外, 不同的干旱过程对树木的影响也具有显著的差异。
1.3 物种的驯化与适应在功能性状上的差异物种的驯化(acclimation)是指在一个相对较短的时间内物种表型的可塑性,而物种的适应(adaptation)是指在长期的物种进化过程中物种多基因、多性状和多功能的改变[20-21]。驯化的对象一般指的是同一物种,而适应的对象一般指的是不同物种。这两个过程往往对植物性状有着不同甚至相反的影响。植物在高光驯化条件下,叶子会变厚、机械抗性会增强[22-23],而在光照充足的环境条件下, 常绿植物的适应往往表现为叶子变薄、机械抗性降低的特征[24-26]。另外,Rosas等[27]对西班牙加泰罗尼亚3种壳斗科(Fagaceae)和3种松科(Pinaceae)木本植物的研究表明,在湿润地区植物的适应表现为具有高的枝条导水率丧失50%时的水势(P50; 与植物的抗旱密切相关),而植物在驯化条件下P50则没有显著变化。
2 属和科水平植物功能性状的研究 2.1 同属植物功能性状随环境因子的变化同属植物虽然相比同种植物的基因型变化更大,但是研究同属植物功能性状的变化相比同种植物的取材范围更大,同时,相比跨属植物的研究, 又大大降低了基因型的差异对植物功能性状的影响。最近几年,研究环境因子对同属植物功能性状的影响也越来越多。Pfautsch等[28]对澳大利亚桉属(Eucalyptus)的28个种群导管直径的研究表明,植物的导管直径随着湿润指数的增加而增加, 植物木质部导水率也随之升高。Larter等[29]对世界上抗旱能力最强的23种澳洲柏属(Callitris)植物的研究表明, 该属植物木质部抗旱能力随着干旱程度的增加而增加,但植物木质部导水率与干旱指数无关。
2.2 同科植物功能性状的关系及其随环境因子的变化对一些具有特殊属性(如进化的原始性、分布的广泛性)的单一科植物进行研究,可以为物种的保育提供理论支持。Zhang等[30]对33种苏铁科(Cycadaceae)植物的研究表明,与被子植物相比, 苏铁科植物的叶片光合速率同样与叶片比叶面积、叶片氮磷含量呈正相关,但不同的是苏铁科植物的叶片光合速率与叶片导水速率不相关。Cao等[31]对具有浅根系且对土壤水分敏感的59种竹子(Bambusoideae)研究表明,竹子的高度受植物根压的影响。Kawai等[32]对温带森林广泛分布的8种壳斗科(Fagaceae)植物叶脉分级与叶片机械抗性、水力特征的关系进行研究,结果表明叶片一、二级叶脉影响叶片机械抗性,而末端叶脉影响叶片水分利用效率。Liu等[33]研究了27种木兰科(Magnoliaceae)植物的功能性状和进化的关系,结果表明木兰科植物与导水和养分利用有关的性状具有很强的进化生态位保守性,相比木莲属(Manglietia)、含笑属(Michelia)和木兰属(Magnolia)植物,玉兰属(Yulania)植物具有较高的导水速率和光合作用,但这是以牺牲抗旱能力为代价的。
3 不同类型植物功能性状的差异 3.1 裸子植物和被子植物裸子植物和被子植物由于进化时间的不同,不仅在结实方式上不同,在植物功能性状上也差异显著。被子植物的导管细胞管腔直径一般比较宽,所以导水效率高,而裸子植物的筛胞管腔比较细窄, 因此导水效率低[34-36]。但也正因为如此,裸子植物的木质部更不易发生气穴化,抗旱能力也更强[37-38]。研究表明,世界上最抗旱的植物便是裸子植物Callitris tuberculate[39]。
3.2 常绿植物和落叶植物常绿和落叶代表了植物叶片的两种不同生活型,常绿植物一般生长在较稳定的环境条件下,而落叶植物则常常生活在季节性比较强的环境中,根据引起落叶的原因不同,又分为干旱引起的落叶植物和低温引起的落叶植物。常绿植物和落叶植物由于叶片生长和存活时间的不同,导致了植物功能性状上的显著差异。常绿植物的叶片构建成本往往比落叶植物高,而比叶面积比落叶植物低[40-41]。Wang等对我国植物叶片碳稳定同位素(δ13C)的研究表明,常绿灌木的叶片δ13C要高于落叶灌木[42]。不仅如此,常绿植物与落叶植物在性状与环境的关系上也会出现不同甚至相反的结果,Kikuzawa等[43]报道常绿植物的叶片寿命跟温度呈负相关,而落叶植物的叶片寿命跟温度呈正相关,而与叶片氮含量的关系则正好相反。另外,有研究表明[44]落叶植物的叶片比叶重(LMA)在低光条件下比较低,这无论在同种还是不同种中都是成立的,而在同种常绿植物中也有相同结果,但不同种常绿植物在低光条件下LMA比较高。
3.3 阴生植物和阳生植物由于光环境不同,阴生植物和阳生植物往往表现出不同的生理特性,阴生植物在荫蔽环境条件下采取资源保守利用策略,而阳生植物则在光照充足的条件下发展出快速获取资源的策略。He等[26]对亚热带常绿林57种木本植物叶片功能性状的研究表明, 阴生植物的叶片机械抗性、叶片寿命比阳生植物高,而光合速率则比阳生植物低。Zhu等[45]对蕨类植物的叶片成本-收益分析表明,阳生蕨类植物的叶片营养元素利用效率比阴生蕨类更高,并且碳的偿还时间也更快。
3.4 C3和C4植物C3植物和C4植物由于光合途径的不同,二者往往表现出对温度、水分、CO2等不同的敏感性。一年生C3草本植物的叶片水力导度、气孔密度比C4草本植物更低,但是导管密度比C4草本植物更高[46]。Taylor等[47]报道C4植物比C3植物具有更高的光合速率、水分利用效率和氮的利用效率,但是气孔导度较低。不仅如此,C3和C4植物对CO2浓度升高的响应也不同,有研究表明在CO2升高条件下,C4草本植物叶片面积比C3草本植物增加得更大,而C3草本植物的分蘖则比C4草本植物更多[48]。此外,Reich等[49]对8种多年生草本植物(C3和C4植物各4种)长达20年的研究表明,前12年C3植物的生物量在CO2升高条件下,生物量显著升高, 而C4植物则没有显著变化,而之后的8年,情况则发生了反转,即C4植物的生物量在CO2升高条件下显著提高,而C3植物的则没有发生很大变化,这说明无论C3还是C4植物对大气CO2浓度的升高都是敏感的,从而挑战了在短期控制试验中得出的关于C4植物对CO2升高不敏感的经典研究结论。
3.5 木质藤本与直立木本植物在热带雨林中,藤本植物具有非常高的丰富度,往往比可自我支撑的木本植物在光照、水分和营养获取等方面具有竞争优势。有研究表明,在旱季,木质藤本植物可以利用更深层的土壤水分,相比同一生境的直立木本植物,木质藤本植物具有更高的边材导水率[50],且具有更高的气孔调节能力以减少水分的丧失;而在雨季其光合能力显著高于直立木本植物,从而保证了藤本植物的竞争优势[51]。另外,有研究表明木质藤本植物在旱季比直立木本植物生长速率更快[52],并且,与直立木本不同的是,木质藤本植物水力效率与水力安全之间不存在权衡关系,有利于藤本植物保持高的光合速率,同时不易受到干旱的胁迫[53]。
4 不同植被区系植物功能性状的差异气候的差异往往会促使植物形成不同的植被功能区系,如热带雨林、温带落叶森林、荒漠植被、北方苔原等。不同的植被类型除了在物种多样性、植被分层和土壤理化性质上不同之外,植物的功能性状也发生了很大的变化。Yuan等[54]对植物细根氮磷含量的研究表明,热带雨林植物的细根磷含量低于荒漠植被、苔原和北方森林,而细根氮磷比则高于后者。Bartlett等[55]对与植物叶片抗旱性密切相关的叶片膨压丧失点的水势和叶片饱和渗透势的研究表明,荒漠植物的这两种叶片性状的数值比热带雨林植物更低,说明荒漠植物的叶片具有更强抗旱能力。Choat等[37]报道地中海地区植物和温带森林植物的枝条水力安全系数比热带雨林更高,从而证明前者比后者更耐旱。另外,还有研究表明,我国南亚热带常绿林优势树种的水力安全系数比热带干旱森林和地中海地区植物更高,说明南亚热带常绿林植物在气候变化条件下,更不容易遭受水分胁迫的危害[56]。此外,地中海地区植被、温带季节森林物种比热带雨林物种的叶片导水率丧失50%时的水势与枝条导水率丧失50%时的水势之差更大, 说明干旱森林植物存在脆弱性分区,从而有利于干旱地区的植物叶片更有效地应对干旱胁迫[57]。
5 植物功能性状与群落动态变化 5.1 植物功能性状与群落演替不同森林演替阶段由于光环境、土壤养分、水分和温度的不同,植物的功能性状往往发生显著的变化。研究不同演替阶段植物功能性状的变化不仅可以深入理解植物随时间更替的过程,也有利于为森林的管理和重建提供指导[58]。Zhu等[6]研究了我国鼎湖山地区南亚热带森林不同演替阶段34种优势树种光合和水力特征,认为演替早期阶段植物叶片光合速率、气孔导度和枝条的导水率要显著高于演替晚期阶段的树种。Navas等[59]对法国南部42种植物的叶片功能性状的研究表明,随着演替的进行,叶片寿命增加,而叶片构建成本没有显著差异。此外,Poorter等[60]对拉丁美洲50个样点1 403个样方超过16 000棵树木材密度的研究表明,木材密度在干旱森林与湿润森林随演替的变化正好呈现相反的趋势,并随着演替时间的延长趋于收敛,即在湿润森林木材密度随演替的增加而增加,而在干旱森林木材密度随演替的增加而降低。这跟森林演替早期阶段的生境过滤有密切关系,干旱森林演替早期阶段木材密度的增加有利于提高植物抗干旱和防火能力,晚期阶段随着湿度增加、温度降低, 有利于产生具有低的木材密度的物种,而湿润森林演替早期阶段木材密度偏低则是为了更快的获取光照、营养物质并快速生长,演替晚期阶段木材密度的增加则有利于提高植物耐阴和抵抗病原菌的感染。
5.2 植物功能性状与物种多样性随着CO2浓度的升高、温度上升、氮沉降的增加、降水的改变,植物群落的组成也发生了明显的变化。例如,Zhou等[61-62]对我国鼎湖山地区常绿阔叶林32年(1978-2010年)的群落监测数据表明, 我国南亚热带成熟林随着氮沉降加剧、无降雨日数增加、土壤湿度降低、大气CO2浓度增加等环境变化,群落中大树(胸径 > 20 cm)的生物量和个体数在减少,而小树(1 cm≤胸径≤10 cm)的生物量和个体数在增加。Li等[10]的研究进一步表明,该地区森林植物在叶片光合和水力特征方面存在显著差异,近30多年来,与多度减少的物种相比,多度增加的物种具有更高的光合能力、叶片氮磷含量、枝条导水率和叶片膨压丧失点时的水势,从而更有利于适应气候的变化。类似的,Soudzilovskaia等[63]对俄罗斯西北高加索高山植物群落29年的研究也表明, 叶片比叶面积、叶片厚度、种子质量、根的氮含量和比根长度等功能性状可以用来解释物种多度与温度变化的关系。
5.3 植物功能性状与物种的生长和死亡物种的生长和死亡始终是生态学的核心问题, 已有大量的研究表明植物的生长和死亡除了与环境因子有关之外,与植物的功能性状也密切相关。有研究表明种子质量、叶片氮含量、比叶面积、叶片光合速率、树高等性状与植物的生长和死亡密切相关[64-69]。关于水力特征和水力安全对植物的生长和死亡影响方面,Fan等[70]研究了中国西南西双版纳40种热带树种,认为植物导管性状比木材密度可以更好地预测植物的生长速率。Liu等[71]对我国古田山24 hm2样地80树种1 300个体的研究表明,植物的枝条导水率也可以预测植物的生长速率。Anderegg等[72]研究了全球33个地点的475种植物,认为具有较低水力安全系数、木质部容易发生气穴化的植物,在全球变化背景下更容易死亡。
6 全球植被植物功能性状与环境因子的关系 6.1 植物功能性状谱系资源获取的快慢是物种的一个基本特性[73]。在资源缺乏的地区,植物叶片往往具有较长寿命和较强的抵抗力,而在资源丰富的地区植物往往具有高的碳同化速率,但植物叶片更易脱落[7],构成了叶片经济学谱的核心观点[13]。与叶片经济学谱相似,植物还存在根经济学谱——根的呼吸与根的氮含量、比根长呈正相关,而与根的干物质含量呈负相关[74];沙漠植物具有光合能力的枝条在碳的获取、水分传输和水分丧失之间存在着茎经济学谱[75];水力经济学谱是指木质部的生长与脆弱性之间的权衡关系[76];木材经济学谱表明具有高木材密度的物种存活率较高,而具有低木材密度的物种生长速率较高[77]。所有这些器官或组织的经济学谱组成了植物经济学谱[73],即具有快速资源获取策略的物种无论在器官还是个体水平,植物组织密度较低、水分传输速率较高、组织的寿命较短、资源周转速率较快,而具有慢速资源获取策略的物种则相反。
6.2 全球尺度上植物功能性状之间的关系除了功能性状经济学谱概念的提出,在全球尺度上,植物功能性状之间还存在着众多重要的关系,如植物抗旱性状、叶片膨压丧失点时的水势、叶片导水率丧失50%时的水势和枝条导水率丧失50%时的水势之间的协同关系[78];全球树高与水力特征,如导管直径、导管密度、枝条导水率丧失50%时的水势、枝条导水率、胡波尔值、木材密度之间的关系[79];不同级叶脉密度、叶脉直径与叶片大小的关系[80];全球植被叶片机械力与叶片寿命之间呈正相关关系[81]等。同时,有些植物功能性状之间虽然在理论上应该有很强的关系,但研究结果表明关系很弱或没有关系,即二者关系相对独立,如在全球尺度上,植物的水分传输速率与水力安全之间仅存在微弱的权衡关系[82];比叶面积、木材密度和种子质量与幼树的生长速率相关性不显著[83]; 植物形态特征(叶片大小、树高和种子质量)与叶片经济学谱特征(叶片氮含量和叶片比叶重)呈现解偶联的关系[84]。
6.3 环境因子对全球植物功能性状的影响随着世界经济的全球化与高速发展,科技也实现了大繁荣、大融合,并向着大数据发展。最近20年,在全球尺度上研究植物功能性状随环境因子的变化受到越来越多的关注,可以说涉及到了植物生态学领域的各个方面。Choat等[37]对全球81个地点226种植物的研究表明,大多数物种的水力安全系数很窄,说明无论该地点的降水条件如何,气候变化条件下物种都容易受到干旱胁迫。Wright等[85]研究了全球682个地点7 670物种13 705个样本的叶片大小,认为叶片在湿润、温暖且光照较好的条件下较大,而在干旱的条件下较小,在高纬度和高海拔地区也偏小。Maire等[86]对全球288个地点的1 509种植物叶片光合作用的研究表明,植物的光合速率受土壤pH的影响,而与土壤氮磷含量无关。Morris等[87]研究了全球2 332种木本被子植物的导管直径与气候的关系,认为植物的导管直径随温度和降水的升高而升高。除此之外,有关植物功能性状与环境因子之间关系的研究也很多,如叶片呼吸与温度的关系[88-89]、叶片13C含量与降水的变化[90-91]、植物高度与温度的关系[92]、森林林冠高度与降水的关系[93]、叶片氮磷含量与温度、纬度的关系[94]、叶片氮磷含量、比叶面积与土壤因子的关系[95]、叶片光合氮的利用效率与土壤氮含量的关系[96]、营养元素重吸收速率与温度、降水的关系[97]、细根氮磷含量随纬度的变化[54]、叶片寿命与温度的关系[43]、叶片机械抗性随温度、降水的变化[81]、叶片厚度、密度和叶片比叶重与环境因子的关系[98]、气候对叶片灰分含量的影响[99]、温度对生物量的影响[100]等。
7 展望本文从个体、科、属水平到群落、全球尺度综述了植物功能性状在性状-性状、性状-环境关系方面的最新研究进展(图 1)。虽然在每个尺度上都已经有大量的关于植物功能性状的研究,然而,以往对植物功能性状的研究,往往局限在研究单一尺度, 由于不同尺度植物功能性状的变异程度不同[101], 物种内、物种间以及不同植被功能型之间性状的关系往往存在着很大的差异[102]。Anderegg等[103]对全球叶片经济学的有关性状研究表明,种内性状的关系与全球植被种间的叶片经济学谱关系不同,有很多种植物的性状关系甚至是相反的,从而在种内水平挑战了叶片经济学谱的普适性规律。这是因为物种的进化和环境对性状都起到了至关重要的作用, 虽然研究种内植物功能性状的变化可排除进化的作用,但同时考虑基因型和环境对植物功能性状的影响是该研究领域未来发展的趋势。
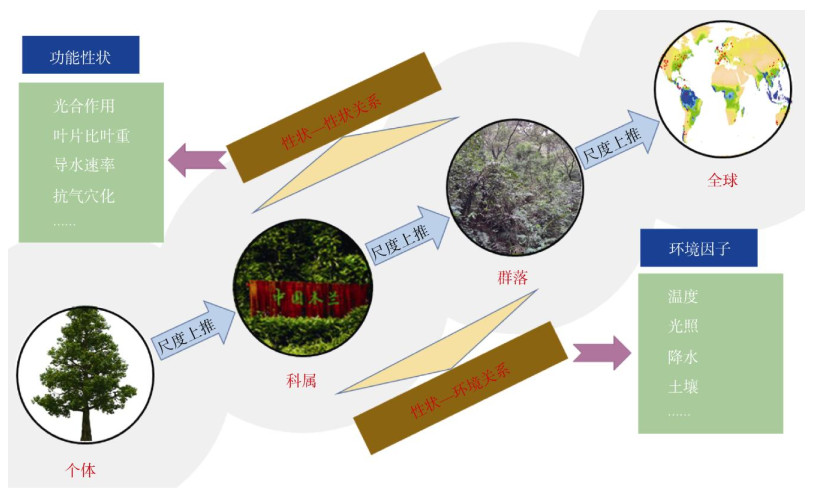
|
图 1 植物功能性状在不同尺度上的研究概念图 Fig. 1 Conceptual framework of plant functional traits at different scales |
另外,比较种间性状的不同,尤其在野外复杂的光、水和土壤环境条件下,不仅物种的适应在起作用,同时物种的驯化也在起作用,两者对植物性状影响的相对大小,直接决定了种间性状与环境之间的关系以及性状之间的关系[27, 104]。Umaña等[105]对波多黎各亚热带湿润森林16个不同海拔固定样地的植物叶片大小、叶片氮含量等的研究表明,性状之间的关系在种内不同个体、种间和种群水平上都是不同的,不能简单理解为种内功能性状之间的关系可以缩小种间功能性状之间的差异。因此,同时研究和比较种内不同个体水平、种间水平和种群水平植物功能性状与环境因子之间的关系,在将来的研究中是非常有必要的。
| [1] |
DARWIN C. On the Origin of Species by Means of Natural Selection: or the Preservation of Favoured Races in the Struggle for Life[M]. London: John Murray, 1859.
|
| [2] |
CATTELL R B. Personality structure and measurement: Ⅰ. The operational determination of trait unities[J]. Brit J Psychol Gen Sect, 1946, 36: 88-103. DOI:10.1111/j.2044-8295.1946.tb01110.x |
| [3] |
VIOLLE C, NAVAS M L, VILE D, et al. Let the concept of trait be functional![J]. Oikos, 2007, 116(5): 882-892. DOI:10.1111/j.0030-1299.2007.15559.x |
| [4] |
PÉREZ-HARGUINDEGUY N, DÍAZ S, GARNIER E, et al. New handbook for standardised measurement of plant functional traits worldwide[J]. Aust J Bot, 2013, 61(3): 167-234. DOI:10.1071/BT12225 |
| [5] |
WESTOBY M, FALSTER D S, MOLES A T, et al. Plant ecological strategies: Some leading dimensions of variation between species[J]. Annu Rev Ecol Syst, 2002, 33: 125-159. DOI:10.1146/annurev.ecolsys.33.010802.150452 |
| [6] |
ZHU S D, SONG J J, LI R H, et al. Plant hydraulics and photosynthesis of 34 woody species from different successional stages of subtropical forests[J]. Plant Cell Environ, 2013, 36(4): 879-891. DOI:10.1111/pce.12024 |
| [7] |
REICH P B, WALTERS M B, ELLSWORTH D S. From tropics to tundra: global convergence in plant functioning[J]. Proc Natl Acad Sci USA, 1997, 94(25): 13730-13734. DOI:10.1073/pnas.94.25.13730 |
| [8] |
POORTER L, KITAJIMA K, MERCADO P, et al. Resprouting as a persistence strategy of tropical forest trees: Relations with carbohydrate storage and shade tolerance[J]. Ecology, 2010, 91(9): 2613-2627. DOI:10.1890/09-0862.1 |
| [9] |
GARNIER E, CORTEZ J, BILL S G, et al. Plant functional markers capture ecosystem properties during secondary succession[J]. Ecology, 2004, 85(9): 2630-2637. DOI:10.1890/03-0799 |
| [10] |
LI R H, ZHU S D, CHEN H Y H, et al. Are functional traits a good predictor of global change impacts on tree species abundance dynamics in a subtropical forest?[J]. Ecol Lett, 2015, 18(11): 1181-1189. DOI:10.1111/ele.12497 |
| [11] |
HIGGINS S I, O'HARA R B, BYKOVA O, et al. A physiological analogy of the niche for projecting the potential distribution of plants[J]. J Biogeogr, 2012, 39(12): 2132-2145. DOI:10.1111/j.1365-2699.2012.02752.x |
| [12] |
MYERS-SMITH I H, THOMAS H J D, BJORKMAN A D. Plant traits inform predictions of tundra responses to global change[J]. New Phytol, 2019, 221(4): 1742-1748. DOI:10.1111/nph.15592 |
| [13] |
WRIGHT I J, REICH P B, WESTOBY M, et al. The worldwide leaf economics spectrum[J]. Nature, 2004, 428(6985): 821-827. DOI:10.1038/nature02403 |
| [14] |
CHOAT B, BRODRIBB T J, BRODERSEN C R, et al. Triggers of tree mortality under drought[J]. Nature, 2018, 558(7711): 531-539. DOI:10.1038/s41586-018-0240-x |
| [15] |
SCHULDT B, KNUTZEN F, DELZON S, et al. How adaptable is the hydraulic system of European beech in the face of climate change-related precipitation reduction?[J]. New Phytol, 2016, 210(2): 443-458. DOI:10.1111/nph.13798 |
| [16] |
LIANG X Y, HE P C, LIU H, et al. Precipitation has dominant influences on the variation of plant hydraulics of the native Castanopsis fargesii (Fagaceae) in subtropical China[J]. Agric For Meteorol, 2019, 271: 83-91. DOI:10.1016/j.agrformet.2019.02.043 |
| [17] |
SCHREIBER S G, HACKE U G, HAMANN A. Variation of xylem vessel diameters across a climate gradient: Insight from a reciprocal transplant experiment with a widespread boreal tree[J]. Funct Ecol, 2015, 29(11): 1392-1401. DOI:10.1111/1365-2435.12455 |
| [18] |
CHEN Y J, SCHNITZER S A, ZHANG Y J, et al. Physiological regulation and efficient xylem water transport regulate diurnal water and carbon balances of tropical lianas[J]. Funct Ecol, 2017, 31(2): 306-317. DOI:10.1111/1365-2435.12724 |
| [19] |
GAO S, LIU R S, ZHOU T, et al. Dynamic responses of tree-ring growth to multiple dimensions of drought[J]. Glob Change Biol, 2018, 24(11): 5380-5390. DOI:10.1111/gcb.14367 |
| [20] |
DEMMIG-ADAMS B, STEWART J J, ADAMS W W. Multiple feedbacks between chloroplast and whole plant in the context of plant adaptation and acclimation to the environment[J]. Philos Trans Roy Soc B Biol Sci, 2014, 369(1640): 20130244. DOI:10.1098/rstb.2013.0244 |
| [21] |
WATSON-LAZOWSKI A, LIN Y, MIGLIETTA F, et al. Plant adaptation or acclimation to rising CO2? Insight from first multigenerational RNA-Seq transcriptome[J]. Glob Change Biol, 2016, 22(11): 3760-3773. DOI:10.1111/gcb.13322 |
| [22] |
LOUDA S M, RODMAN J E. Insect herbivory as a major factor in the shade distribution of a native crucifer (Cardamine cordifolia A. Gray, Bittercress)[J]. J Ecol, 1996, 84(2): 229-237. DOI:10.2307/2261358 |
| [23] |
ONODA Y, SCHIEVING F, ANTEN N P R. Effects of light and nutrient availability on leaf mechanical properties of Plantago major: A conceptual approach[J]. Ann Bot, 2008, 101(5): 727-736. DOI:10.1093/aob/mcn013 |
| [24] |
COLEY P D. Herbivory and defensive characteristics of tree species in a lowland tropical forest[J]. Ecol Monogr, 1983, 53(2): 209-234. DOI:10.2307/1942495 |
| [25] |
KITAJIMA K, LLORENS A M, STEFANESCU C, et al. How cellulose-based leaf toughness and lamina density contribute to long leaf lifespans of shade-tolerant species[J]. New Phytol, 2012, 195(3): 640-652. DOI:10.1111/j.1469-8137.2012.04203.x |
| [26] |
HE P C, WRIGHT I J, ZHU S D, et al. Leaf mechanical strength and photosynthetic capacity vary independently across 57 subtropical forest species with contrasting light requirements[J]. New Phytol, 2019, 223(2): 607-618. DOI:10.1111/nph.15803 |
| [27] |
ROSAS T, MENCUCCINI M, BARBA J, et al. Adjustments and coordination of hydraulic, leaf and stem traits along a water availability gradient[J]. New Phytol, 2019, 223(2): 632-646. DOI:10.1111/nph.15684 |
| [28] |
PFAUTSCH S, HARBUSCH M, WESOLOWSKI A, et al. Climate determines vascular traits in the ecologically diverse genus Eucalyptus[J]. Ecol Lett, 2016, 19(3): 240-248. DOI:10.1111/ele.12559 |
| [29] |
LARTER M, PFAUTSCH S, DOMEC J C, et al. Aridity drove the evolution of extreme embolism resistance and the radiation of conifer genus Callitris[J]. New Phytol, 2017, 215(1): 97-112. DOI:10.1111/nph.14545 |
| [30] |
ZHANG Y J, CAO K F, SACK L, et al. Extending the generality of leaf economic design principles in the cycads, an ancient lineage[J]. New Phytol, 2015, 206(2): 817-829. DOI:10.1111/nph.13274 |
| [31] |
CAO K F, YANG S J, ZHANG Y J, et al. The maximum height of grasses is determined by roots[J]. Ecol Lett, 2012, 15(7): 666-672. DOI:10.1111/j.1461-0248.2012.01783.x |
| [32] |
KAWAI K, OKADA N, WATLING J. How are leaf mechanical properties and water-use traits coordinated by vein traits? A case study in Fagaceae[J]. Funct Ecol, 2016, 30(4): 527-536. DOI:10.1111/1365-2435.12526 |
| [33] |
LIU H, XU Q Y, HE P C, et al. Strong phylogenetic signals and phylogenetic niche conservatism in ecophysiological traits across divergent lineages of Magnoliaceae[J]. Sci Rep, 2015, 5: 12246. DOI:10.1038/srep12246 |
| [34] |
BOND W J. The tortoise and the hare: ecology of angiosperm dominance and gymnosperm persistence[J]. Biol J Linn Soc, 1989, 36(3): 227-249. DOI:10.1111/j.1095-8312.1989.tb00492.x |
| [35] |
SPERRY J S, HACKE U G, PITTERMANN J. Size and function in conifer tracheids and angiosperm vessels[J]. Amer J Bot, 2006, 93(10): 1490-1500. DOI:10.3732/ajb.93.10.1490 |
| [36] |
FEILD T S, WILSON J P. Evolutionary voyage of angiosperm vessel structure-function and its significance for early angiosperm success[J]. Int J Plant Sci, 2012, 173(6): 596-609. DOI:10.1086/666099 |
| [37] |
CHOAT B, JANSEN S, BRODRIBB T J, et al. Global convergence in the vulnerability of forests to drought[J]. Nature, 2012, 491(7426): 752-755. DOI:10.1038/nature11688 |
| [38] |
ANDEREGG L D L, HILLERISLAMBERS J. Drought stress limits the geographic ranges of two tree species via different physiological mechanisms[J]. Glob Change Biol, 2016, 22(3): 1029-1045. DOI:10.1111/gcb.13148 |
| [39] |
LARTER M, BRODRIBB T J, PFAUTSCH S, et al. Extreme aridity pushes trees to their physical limits[J]. Plant Physiol, 2015, 168(3): 804-807. DOI:10.1104/pp.15.00223 |
| [40] |
VILLAR R, MERINO J. Comparison of leaf construction costs in woody species with differing leaf life-spans in contrasting ecosystems[J]. New Phytol, 2001, 151(1): 213-226. DOI:10.1046/j.1469-8137.2001.00147.x |
| [41] |
POORTER H, NIINEMETS Ü, POORTER L, et al. Causes and consequences of variation in leaf mass per area (LMA): A meta-analysis[J]. New Phytol, 2009, 182(3): 565-588. DOI:10.1111/j.1469-8137.2009.02830.x |
| [42] |
WANG N, XU S S, JIA X, et al. Variations in foliar stable carbon isotopes among functional groups and along environmental gradients in China: A meta-analysis[J]. Plant Biol, 2013, 15(1): 144-151. DOI:10.1111/j.1438-8677.2012.00605.x |
| [43] |
KIKUZAWA K, ONODA Y, WRIGHT I J, et al. Mechanisms underlying global temperature-related patterns in leaf longevity[J]. Glob Ecol Biogeogr, 2013, 22(8): 982-993. DOI:10.1111/geb.12042 |
| [44] |
LUSK C H, REICH P B, MONTGOMERY R A, et al. Why are evergreen leaves so contrary about shade?[J]. Trends Ecol Evol, 2008, 23(6): 299-303. DOI:10.1016/j.tree.2008.02.006 |
| [45] |
ZHU S D, LI R H, SONG J, et al. Different leaf cost-benefit strategies of ferns distributed in contrasting light habitats of sub-tropical forests[J]. Ann Bot, 2016, 117(3): 497-506. DOI:10.1093/aob/mcv179 |
| [46] |
LIU H, TAYLOR S H, XU Q Y, et al. Life history is a key factor explaining functional trait diversity among subtropical grasses, and its influence differs between C3 and C4 species[J]. J Exp Bot, 2019, 70(5): 1567-1580. DOI:10.1093/jxb/ery462 |
| [47] |
TAYLOR S H, HULME S P, REES M, et al. Ecophysiological traits in C3 and C4 grasses: A phylogenetically controlled screening experiment[J]. New Phytol, 2010, 185(3): 780-791. DOI:10.1111/j.1469-8137.2009.03102.x |
| [48] |
WAND S J E, MIDGLEY G F, JONES M H, et al. Responses of wild C4 and C3 grass (Poaceae) species to elevated atmospheric CO2 concentration: A meta-analytic test of current theories and perceptions[J]. Glob Change Biol, 1999, 5(6): 723-741. DOI:10.1046/j.1365-2486.1999.00265.x |
| [49] |
REICH P B, HOBBIE S E, LEE T D, et al. Unexpected reversal of C3 versus C4 grass response to elevated CO2 during a 20-year field experiment[J]. Science, 2018, 360(6386): 317-320. DOI:10.1126/science.aas9313 |
| [50] |
CHEN L, HUANG J G, ALAM S A, et al. Drought causes reduced growth of trembling aspen in western Canada[J]. Glob Change Biol, 2017, 23(7): 2887-2902. DOI:10.1111/gcb.13595 |
| [51] |
CHEN Y J, CAO K F, SCHNITZER S A, et al. Water-use advantage for lianas over trees in tropical seasonal forests[J]. New Phytol, 2015, 205(1): 128-136. DOI:10.1111/nph.13036 |
| [52] |
SCHNITZER S A, van der HEIJDEN G M F. Lianas have a seasonal growth advantage over co-occurring trees[J]. Ecology, 2019, 100(5): e02655. DOI:10.1002/ecy.2655 |
| [53] |
van der SANDE M T, POORTER L, SCHNITZER S A, et al. The hydraulic efficiency-safety trade-off differs between lianas and trees[J]. Ecology, 2019, 100(5): e02666. DOI:10.1002/ecy.2666 |
| [54] |
YUAN Z Y, CHEN H Y H, REICH P B. Global-scale latitudinal patterns of plant fine-root nitrogen and phosphorus[J]. Nat Commun, 2011, 2: 344. DOI:10.1038/ncomms1346 |
| [55] |
BARTLETT M K, SCOFFONI C, SACK L. The determinants of leaf turgor loss point and prediction of drought tolerance of species and biomes: A global meta-analysis[J]. Ecol Lett, 2012, 15(5): 393-405. DOI:10.1111/j.1461-0248.2012.01751.x |
| [56] |
ZHU S D, LI R H, HE P C, et al. Large branch and leaf hydraulic safety margins in subtropical evergreen broad-leaved forest[J]. Tree Physiol, 2019. DOI:10.1093/treephys/tpz028 |
| [57] |
ZHU S D, LIU H, XU Q Y, et al. Are leaves more vulnerable to cavitation than branches?[J]. Funct Ecol, 2016, 30(11): 1740-1744. DOI:10.1111/1365-2435.12656 |
| [58] |
McGILL B J, ENQUIST B J, WEIHER E, et al. Rebuilding community ecology from functional traits[J]. Trends Ecol Evol, 2006, 21(4): 178-185. DOI:10.1016/j.tree.2006.02.002 |
| [59] |
NAVAS M L, DUCOUT B, ROUMET C, et al. Leaf life span, dynamics and construction cost of species from Mediterranean old-fields differing in successional status[J]. New Phytol, 2003, 159(1): 213-228. DOI:10.1046/j.1469-8137.2003.00790.x |
| [60] |
POORTER L, ROZENDAAL D M A, BONGERS F, et al. Wet and dry tropical forests show opposite successional pathways in wood density but converge over time[J]. Nat Ecol Evol, 2019, 3: 928-934. DOI:10.1038/s41559-019-0882-6 |
| [61] |
ZHOU G Y, WEI X H, WU Y P, et al. Quantifying the hydrological responses to climate change in an intact forested small watershed in Southern China[J]. Glob Change Biol, 2011, 17(12): 3736-3746. DOI:10.1111/j.1365-2486.2011.02499.x |
| [62] |
ZHOU G Y, PENG C H, LI Y L, et al. A climate change-induced threat to the ecological resilience of a subtropical monsoon evergreen broad-leaved forest in southern China[J]. Glob Change Biol, 2013, 19(4): 1197-1210. DOI:10.1111/gcb.12128 |
| [63] |
SOUDZILOVSKAIA N A, ELUMEEVA T G, ONIPCHENKO V G, et al. Functional traits predict relationship between plant abundance dynamic and long-term climate warming[J]. Proc Natl Acad Sci USA, 2013, 110(45): 18180-18184. DOI:10.1073/pnas.1310700110 |
| [64] |
POORTER L, BONGERS F. Leaf traits are good predictors of plant performance across 53 rain forest species[J]. Ecology, 2006, 87(7): 1733-1743. DOI:10.1890/0012-9658 |
| [65] |
POORTER L, WRIGHT S J, PAZ H, et al. Are functional traits good predictors of demographic rates? Evidence from five neotropical forests[J]. Ecology, 2008, 89(7): 1908-1920. DOI:10.1890/07-0207.1 |
| [66] |
KRAFT N J B, METZ M R, CONDIT R S, et al. The relationship between wood density and mortality in a global tropical forest data set[J]. New Phytol, 2010, 188(4): 1124-1136. DOI:10.1111/j.1469-8137.2010.03444.x |
| [67] |
WRIGHT S J, KITAJIMA K, KRAFT N J B, et al. Functional traits and the growth: Mortality trade-off in tropical trees[J]. Ecology, 2010, 91(12): 3664-3674. DOI:10.1890/09-2335.1 |
| [68] |
ADLER P B, SALGUERO-GóMEZ R, COMPAGNONI A, et al. Functional traits explain variation in plant life history strategies[J]. Proc Natl Acad Sci USA, 2014, 111(2): 740-745. DOI:10.1073/pnas.1315179111 |
| [69] |
ALEIXO I, NORRIS D, HEMERIK L, et al. Amazonian rainforest tree mortality driven by climate and functional traits[J]. Nat Clim Change, 2019, 9(5): 384-388. DOI:10.1038/s41558-019-0458-0 |
| [70] |
FAN Z X, ZHANG S B, HAO G Y, et al. Hydraulic conductivity traits predict growth rates and adult stature of 40 Asian tropical tree species better than wood density[J]. J Ecol, 2012, 100(3): 732-741. DOI:10.1111/j.1365-2745.2011.01939.x |
| [71] |
LIU X J, SWENSON N G, LIN D M, et al. Linking individual-level functional traits to tree growth in a subtropical forest[J]. Ecology, 2016, 97(9): 2396-2405. DOI:10.1002/ecy.1445 |
| [72] |
ANDEREGG W R L, KLEIN T, BARTLETT M, et al. Meta-analysis reveals that hydraulic traits explain cross-species patterns of drought-induced tree mortality across the globe[J]. Proc Natl Acad Sci USA, 2016, 113(18): 5024-5029. DOI:10.1073/pnas.1525678113 |
| [73] |
REICH P B, CORNELISSEN H. The world-wide 'fast-slow' plant economics spectrum: A traits manifesto[J]. J Ecol, 2014, 102(2): 275-301. DOI:10.1111/1365-2745.12211 |
| [74] |
ROUMET C, BIROUSTE M, PICON-COCHARD C, et al. Root structure-function relationships in 74 species: Evidence of a root economics spectrum related to carbon economy[J]. New Phytol, 2016, 210(3): 815-826. DOI:10.1111/nph.13828 |
| [75] |
ÁVILA-LOVERA E, ZERPA A J, SANTIAGO L S. Stem photosynthesis and hydraulics are coordinated in desert plant species[J]. New Phytol, 2017, 216(4): 1119-1129. DOI:10.1111/nph.14737 |
| [76] |
ELLER C B, de V BARROS F, BITTENCOURT P R L, et al. Xylem hydraulic safety and construction costs determine tropical tree growth[J]. Plant Cell Environ, 2018, 41(3): 548-562. DOI:10.1111/pce.13106 |
| [77] |
CHAVE J, COOMES D, JANSEN S, et al. Towards a worldwide wood economics spectrum[J]. Ecol Lett, 2009, 12(4): 351-366. DOI:10.1111/j.1461-0248.2009.01285.x |
| [78] |
BARTLETT M K, KLEIN T, JANSEN S, et al. The correlations and sequence of plant stomatal, hydraulic, and wilting responses to drought[J]. Proc Natl Acad Sci USA, 2016, 113(46): 13098-13103. DOI:10.1073/pnas.1604088113 |
| [79] |
LIU H, GLEASON S M, HAO G Y, et al. Hydraulic traits are coordinated with maximum plant height at the global scale[J]. Sci Adv, 2019, 5(2): eaav1332. DOI:10.1126/sciadv.aav1332 |
| [80] |
SACK L, SCOFFONI C, McKOWN A D, et al. Developmentally based scaling of leaf venation architecture explains global ecological patterns[J]. Nat Commun, 2012, 3: 837. DOI:10.1038/ncomms1835 |
| [81] |
ONODA Y, WESTOBY M, ADLER P B, et al. Global patterns of leaf mechanical properties[J]. Ecol Lett, 2011, 14(3): 301-312. DOI:10.1111/j.1461-0248.2010.01582.x |
| [82] |
GLEASON S M, WESTOBY M, JANSEN S, et al. Weak tradeoff between xylem safety and xylem-specific hydraulic efficiency across the world's woody plant species[J]. New Phytol, 2016, 209(1): 123-136. DOI:10.1111/nph.13646 |
| [83] |
PAINE C E T, AMISSAH L, AUGE H, et al. Globally, functional traits are weak predictors of juvenile tree growth, and we do not know why[J]. J Ecol, 2015, 103(4): 978-989. DOI:10.1111/1365-2745.12401 |
| [84] |
DÍAZ S, KATTGE J, CORNELISSEN J H C, et al. The global spectrum of plant form and function[J]. Nature, 2016, 529(7585): 167-171. DOI:10.1038/nature16489 |
| [85] |
WRIGHT I J, DONG N, MAIRE V, et al. Global climatic drivers of leaf size[J]. Science, 2017, 357(6354): 917-921. DOI:10.1126/science.aal4760 |
| [86] |
MAIRE V, WRIGHT I J, PRENTICE I C, et al. Global effects of soil and climate on leaf photosynthetic traits and rates[J]. Glob Ecol Biogeogr, 2015, 24(6): 706-717. DOI:10.1111/geb.12296 |
| [87] |
MORRIS H, GILLINGHAM M A, PLAVCOVÁ L, et al. Vessel diameter is related to amount and spatial arrangement of axial parenchyma in woody angiosperms[J]. Plant Cell Environ, 2018, 41(1): 245-260. DOI:10.1111/pce.13091 |
| [88] |
ATKIN O K, BLOOMFIELD K J, REICH P B, et al. Global variability in leaf respiration in relation to climate, plant functional types and leaf traits[J]. New Phytol, 2015, 206(2): 614-636. DOI:10.1111/nph.13253 |
| [89] |
HESKEL M A, O'SULLIVAN O S, REICH P B, et al. Convergence in the temperature response of leaf respiration across biomes and plant functional types[J]. Proc Natl Acad Sci USA, 2016, 113(14): 3832-3837. DOI:10.1073/pnas.1520282113 |
| [90] |
DIEFENDORF A F, MUELLER K E, WING S L, et al. Global patterns in leaf 13C discrimination and implications for studies of past and future climate[J]. Proc Natl Acad Sci USA, 2010, 107(13): 5738-5743. DOI:10.1073/pnas.0910513107 |
| [91] |
CORNWELL W K, WRIGHT I J, TURNER J, et al. Climate and soils together regulate photosynthetic carbon isotope discrimination within C3 plants worldwide[J]. Glob Ecol Biogeogr, 2018, 27(9): 1056-1067. DOI:10.1111/geb.12764 |
| [92] |
MOLES A T, WARTON D I, WARMAN L, et al. Global patterns in plant height[J]. J Ecol, 2009, 97(5): 923-932. DOI:10.1111/j.1365-2745.2009.01526.x |
| [93] |
TAO S L, GUO Q H, LI C, et al. Global patterns and determinants of forest canopy height[J]. Ecology, 2016, 97(12): 3265-3270. DOI:10.1002/ecy.1580 |
| [94] |
REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proc Natl Acad Sci USA, 2004, 101(30): 11001-11006. DOI:10.1073/pnas.0403588101 |
| [95] |
ORDOÑEZ J C, VAN BODEGOM P M, WITTE J P M, et al. A global study of relationships between leaf traits, climate and soil measures of nutrient fertility[J]. Glob Ecol Biogeogr, 2009, 18(2): 137-149. DOI:10.1111/j.1466-8238.2008.00441.x |
| [96] |
HIDAKA A, KITAYAMA K. Divergent patterns of photosynthetic phosphorus-use efficiency versus nitrogen-use efficiency of tree leaves along nutrient-availability gradients[J]. J Ecol, 2009, 97(5): 984-991. DOI:10.1111/j.1365-2745.2009.01540.x |
| [97] |
YUAN Z Y, CHEN H Y H. Global-scale patterns of nutrient resorption associated with latitude, temperature and precipitation[J]. Glob Ecol Biogeogr, 2009, 18(1): 11-18. DOI:10.1111/j.1466-8238.2008.00425.x |
| [98] |
NIINEMETS Ü. Global-scale climatic controls of leaf dry mass per area, density, and thickness in trees and shrubs[J]. Ecology, 2001, 82(2): 453-469. DOI:10.1890/0012-9658 |
| [99] |
HAN W X, CHEN Y H, ZHAO F J, et al. Floral, climatic and soil pH controls on leaf ash content in China's terrestrial plants[J]. Glob Ecol Biogeogr, 2012, 21(3): 376-382. DOI:10.1111/j.1466-8238.2011.00677.x |
| [100] |
LARJAVAARA M, MULLER-LANDAU H C. Temperature explains global variation in biomass among humid old-growth forests[J]. Glob Ecol Biogeogr, 2012, 21(10): 998-1006. DOI:10.1111/j.1466-8238.2011.00740.x |
| [101] |
ANDEREGG W R L. Spatial and temporal variation in plant hydraulic traits and their relevance for climate change impacts on vegetation[J]. New Phytol, 2015, 205(3): 1008-1014. DOI:10.1111/nph.12907 |
| [102] |
OSNAS J L D, KATABUCHI M, KITAJIMA K, et al. Divergent drivers of leaf trait variation within species, among species, and among functional groups[J]. Proc Natl Acad Sci USA, 2018, 115(21): 5480-5485. DOI:10.1073/pnas.1803989115 |
| [103] |
ANDEREGG L D L, BERNER L T, BADGLEY G, et al. Within-species patterns challenge our understanding of the leaf economics spectrum[J]. Ecol Lett, 2018, 21(5): 734-744. DOI:10.1111/ele.2945 |
| [104] |
SKELTON R P, ANDEREGG L D L, LAMARQUE L J. Examining variation in hydraulic and resource acquisition traits along climatic gradients tests our understanding of plant form and function[J]. New Phytol, 2019, 223(2): 505-507. DOI:10.1111/nph.15893 |
| [105] |
UMAÑA M N, SWENSON N G. Does trait variation within broadly distributed species mirror patterns across species? A case study in Puerto Rico[J]. Ecology, 2019. DOI:10.1002/ecy.2745 |
 2019, Vol. 27
2019, Vol. 27



