2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
由于矿物风化、植物对养分的吸收以及微生物新陈代谢活动的影响,森林土壤一直处在不断的自然酸化进程中[1]。工业革命以来,人类经济的高速发展增加了大气硫氧化物(SO2)与氮氧化物(NOX)的浓度,产生了极其严重的人为酸沉降问题,加速了森林土壤的酸化。在全球尺度上,酸沉降已经成为许多自然林与人工林生态系统土壤酸化的一个主要驱动力[2-4]。森林土壤酸化不仅会导致植物物种丰富度与森林生产力的降低[4-5],还会对森林集水区与溪流水质安全构成潜在威胁[6-7]。因此,充分认识森林土壤对酸沉降的响应规律与反馈机制,制订科学合理的应对措施,对人们可持续地经营森林,维持整个森林生态系统的稳定及其生态服务功能具有十分重要的现实意义。
虽然森林土壤拥有巨大的缓冲能力,会通过其内部一系列物理的、化学的或生化的反应来应对酸沉降的增加,但长期强酸性物质(H+、NO3–和SO42–)的持续输入将不可避免地降低森林土壤pH与酸缓冲能力(ANC)[3, 8-9]。然而,目前关于森林土壤如何缓冲酸沉降机理研究更多的是基于欧美温带森林的观测结果[6, 10-11],这些温带森林土壤具有阳离子交换量(CEC)大、盐基饱和度(BS)高的特点[2, 10, 12], 因此所得结论能否推广到那些风化程度较高、BS与pH均较低的酸性森林土壤(pH < 7)还未可知。特别是在热带、亚热带地区,广泛分布着砖红壤、红壤、赤红壤、黄壤等酸性土壤类型,而且该区森林土壤绝大部分亦为酸性土壤[13]。在人为酸沉降增加的背景下,这些酸性森林土壤盐基离子(Ca2+、Mg2+、K+和Na+)的流失与有毒物质(Al, Cd和Cu)的释放增加[14-15],有些森林土壤pH甚至已降到4以下,土壤酸化问题异常严峻[16-17]。由于酸性森林土壤的分布区域大多属于经济欠发达的国家或地区,人为酸沉降问题在短期内无法从根本上得到解决,这就需要人们对这些酸性森林土壤能否继续,又将如何继续缓冲酸沉降有一个比较深入的认识。
为此,本文综述了国内外相关研究成果,主要从土壤矿物风化与离子交换反应、有机质的作用, 以及其它生命与非生命因素方面去探讨酸性森林土壤缓冲酸沉降的关键机理,并就酸性森林土壤的改良措施与今后需重点关注的研究领域提供一些建议,旨在加深人们对森林土壤酸化过程与规律的理解,从而更好地为森林的可持续经营服务。
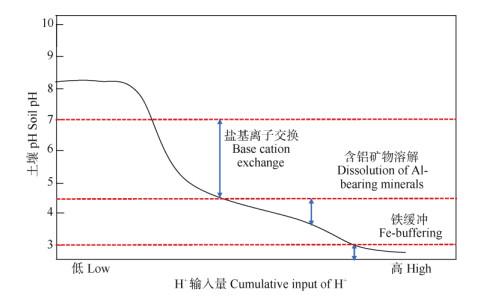
1 矿物风化与离子交换反应森林土壤是一个包含各种有机与无机组分的复杂系统,其对酸的缓冲可以简单地理解为所有组分都参与的质子化与去质子化的反应过程[13],这一点不仅适用于酸性土壤,同样存在于碱性或中性土壤的酸化反应中。总体而言,森林土壤会通过自身矿物风化、溶解,释放金属阳离子的方式来消耗酸沉降所携带的过量氢离子(H+),从而抑制pH的降低[2, 10, 18],但这一过程持续的关键在于酸沉降速率与矿物风化速率之间的动态平衡。一旦H+的输入速率超过土壤释放阳离子的速率,土壤pH与ANC就会降低[19]。不同于温带森林土壤较高数量的永久电荷,酸性森林土壤拥有较高数量的可变电荷[13]。这些可变电荷主要来自土壤黏土矿物与金属氧化物的表面[20-21]。因此,大部分酸性森林土壤都是通过硅酸盐黏土矿物的风化、溶解以及阳离子交换反应来缓冲酸沉降的[22]。由于金属阳离子在土壤表面的吸附能力遵从三价阳离子(Fe3+ > Al3+) > 二价阳离子(Mn2+ > Ca2+ > Mg2+) > 单价阳离子(K+ > Na+)的顺序[2], 所以低价的阳离子会最先参与到与H+交换反应的进程中。根据Bowman等[2]的不同pH土壤缓冲体系(图 1),当酸性森林土壤pH为4.5~7时,盐基离子与H+的交换反应主导了酸的缓冲进程,这将导致盐基离子的净流失与土壤BS的降低[2, 10, 23-24]。pH < 4.5的强酸性森林土壤对酸的缓冲主要依赖硅酸盐等含铝矿物的沉淀或溶解[19, 25-26],该进程在消耗H+同时将导致Al3+的净释放[26]。Li等[27]的研究表明,由于森林土壤酸化,Al3+浓度增加了44.7%。相比之下,铁(Fe)在酸性条件下的溶解度要远低于铝(Al), 但当土壤pH降至3以下时,Fe的主导作用将逐渐凸显[2, 28]。矿物风化与离子交换反应是土壤缓冲酸沉降的必然过程,该过程会一直持续,直到土壤阳离子库消耗殆尽。因此,酸性森林土壤持续缓冲酸沉降的能力与其自身可用于风化反应的矿物或阳离子库的数量密切相关。
作为土壤缓冲能力的重要指标,CEC (单位质量土壤上静电吸附的交换性阳离子的摩尔数)可以通过控制土壤交换性阳离子(如Ca2+、Mg2+、K+、Na+、Al3+和Fe3+)的供应[29],在维持土壤养分与pH缓冲方面扮演重要角色[30-31]。因此,那些拥有较高CEC的森林土壤往往具备较高的酸缓冲能力[3, 10, 17]。研究表明,CEC与2:1型黏土矿物的含量显著正相关[17]。在酸性的老成土中,绝大部分CEC来源于2:1型硅酸盐黏土矿物,由于Al3+能够占据2:1型硅酸盐黏土矿物的绝大多数阳离子交换位,所以土壤酸化会导致交换性Al3+在老成土的大量积累。然而,有研究表明,在酸缓冲进程中,硅酸盐黏土矿物含量较低的氧化土,交换性Al3+的比例较低[22]。酸性森林土壤大多位于热带、亚热带地区,高温高湿的气候条件加速了土壤矿物的风化,主要矿物组成已由原生的2:1型硅酸盐矿物转化为1:1型次生矿物(如高岭石黏土矿物)。相对于原生矿物,次生矿物对土壤CEC与BS的贡献较小[17],因此这些酸性森林土壤的酸缓冲能力相对较低[3]。然而,由于高岭石与Fe/Al氧化物之间的双电子层对质子有较强的吸附能力,所以拥有较多高岭石与Fe/Al氧化物的森林土壤仍能持续缓冲酸沉降,从而延缓酸化进程[32]。Jiang等[9]的研究表明,由于较高的Fe/Al氧化物与交换性Al3+含量,亚热带成熟阔叶林土壤的酸化进程在模拟酸雨处理下并未显著加速。所以, 高价的金属阳离子(尤其是Al3+)在酸性森林土壤缓冲酸化中的作用不容忽视。Tian等[24]的meta-analysis表明,不仅是酸性森林土壤,全球土壤对酸的缓冲也已开始由盐基离子向非盐基(如Al3+)转变。
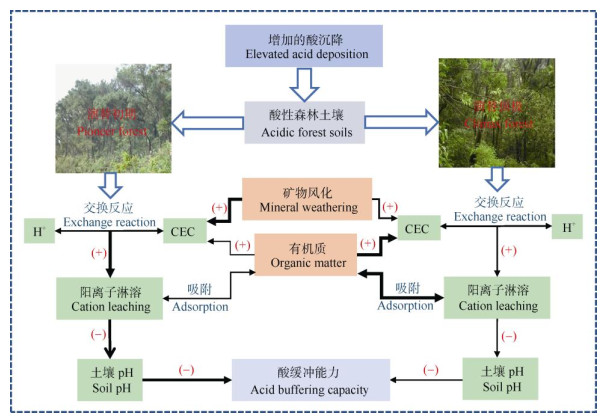
2 有机质的吸附调节作用土壤有机质(SOM)作为土壤的重要活性组分, 可在形成与分解的过程中作用于矿物风化、CEC或BS,从而影响土壤的酸缓冲能力。在强酸性森林土壤中,由于较低的pH抑制了土壤呼吸和微生物活性,SOM的积累增加[33]。这些SOM不仅能弥补土壤自身用于风化反应矿物的不足,还能提供更多阳离子交换位,抑制土壤的酸化进程。欧美许多学者很早就开始探究SOM对CEC的贡献与相关机理。例如,Kalisz等[34]通过大量美国森林样地的观测数据,证明了CEC与SOC间存在显著的正相关关系。Thompson等[35]通过土壤粒径分析,认为除了细的黏粒组分外,SOM可以解释各粒径土壤CEC变异的99%。在我国热带与亚热带地区,也有研究通过野外观测与室内模拟试验量化了SOM对CEC的直接贡献[3, 9, 16]。此外,在缺乏直接观测证据的情形下,一些研究者则采用模型推演的方式来论证CEC与SOM间的关系[25-26, 36]。相对于农田等耕作土壤,酸性森林土壤往往拥有较低的黏土矿物含量,因此SOM成了CEC的主要贡献者,在应对土壤酸化中扮演了不可或缺的角色[37]。所以,较高SOM含量的森林土壤往往具备较高的CEC与酸缓冲能力。Jiang等[9]在我国南亚热带酸性森林土壤开展的研究表明,在演替顶极的成熟森林,由于土壤发育程度高,积累的较高数量与质量的SOM是土壤缓冲酸沉降的主要贡献者。相比之下,处在演替初期的森林,土壤发育程度相对较低,SOM的积累较少,酸的缓冲更多还是依赖土壤矿物的风化、溶解(图 2)[9]。然而,由于SOM包含了较大数量的酸性官能团, 容易导致质子化点的密度与H+的释放增加,因此SOM对CEC贡献较大的酸性森林土壤的pH往往更低[37]。
|
图 2 不同演替阶段酸性森林土壤缓冲酸沉降的关键进程[9]。黑色箭头粗细表示反应程度的强弱;+:增加; -:降低。 Fig. 2 Key processes of acidic forest soils at different succession stages to buffer acid deposition[9]. The thickness of the black arrow indicates the strength of the reaction; +: Increase; -: Decrease. |
SOM能够成为CEC的重要来源,并在酸缓冲进程中扮演重要角色[11, 38],主要源于其巨大的比表面积与大量的负电荷数,因而具备了强大的阳离子吸附能力。所以,SOM在贡献CEC,提供阳离子交换位的同时,还能固定游离态的金属阳离子,降低其淋溶。SOM的吸附作用主要是通过与金属阳离子发生络合反应,形成稳定的有机-金属复合体,从而增加絮凝[11, 38]。这种稳定的有机-金属复合体大多发生在带负电荷的有机质组分(如羧基、酚羟基)与多价的金属阳离子(尤其是Al3+)之间[11, 26]。在pH < 4.5的强酸性森林土壤,Al的缓冲在消耗H+的同时, 也增加了土壤溶液中Al3+的浓度[25]。这些游离态的Al3+与SOM的络合反应,降低了Al3+的淋溶与植物生长的Al毒风险[36]。Jiang等[3]和Lu等[16]在鼎湖山季风常绿阔叶林开展的研究进一步证实了这一观点。他们认为,在强酸(pH=2.5)与高氮(150 kg N hm-2a-1)处理下,Al3+的淋溶均未显著增加。Al与SOM的有机络合已被认为是许多酸性森林土壤持续缓冲酸沉降的重要机理[25, 37, 39]。因此,如果酸性森林土壤具有较高的SOM含量且SOM中Al的饱和度较高,那么该土壤缓冲酸的能力就更强。反之,如果SOM中Al的饱和度较低,有机捆绑点就会倾向于去质子化,从而增加H+向土壤溶液的释放[37, 40]。另外,土壤中有机络合Al的比例也会因土层深度的不同而不同。Lange等[41]的研究表明,在15 cm土层深度有机络合Al的比例高达39%,而在40 cm土层,这一比例降至26%。这一现象可能归功于深层土壤较低的Al3+淋溶量与较低的SOM含量[42]。Al的有机络合同样会增加SOM的稳定性。在这一进程中,Al主要是通过中和有机分子表面的电荷来影响可溶性有机质(DOM)的浓度,从而降低SOM的流失[38]。除了贡献CEC、络合金属阳离子外,SOM的矿化进程(HC2O4–+H++1/2O2→2CO2+H2O)也会消耗部分H+,延缓土壤酸化[43-44]。
对酸性森林土壤而言,由于SOM在贡献CEC、络合金属阳离子中的巨大贡献,SOM的不断积累对酸的缓冲就显得尤为重要。然而,人类活动(如森林砍伐、开垦等)的干扰导致了森林土壤的侵蚀与退化,降低了SOM的含量[45],进而引起CEC与土壤酸缓冲能力的降低[29]。这可能主要源于以下两方面原因, 首先,随着SOM的降低,一些酸性官能团(如羧基和酚羟基)的溶解降低,引起土壤腐殖质表面负电荷数量的降低,削弱了SOM与交换性阳离子的络合作用[46]; 另一方面,由于SOM的降低,腐殖质与黏粒矿物之间阳离子的固定(桥接)作用降低, 增加了腐殖质-黏粒矿物复合体的不稳定[47]。
3 影响酸缓冲能力的其它因素作为植物生长的立地基础与养分源泉,森林土壤对酸沉降的缓冲自然会受到其它生命与非生命因素的影响[24]。这些因素与土壤缓冲体系的交互作用,无疑增加了人们理解酸性森林土壤持续缓冲酸沉降潜力与关键机理的难度。
与温带森林相比,热带、亚热带森林大多植根于酸性土壤,其更大生产力的维持导致对土壤阳离子更大的需求量[48],这种对阳离子的过度吸收无疑会加剧土壤酸化[22]。就种间差异而言,针叶树为主的森林通常比阔叶树主导的森林更能加速土壤酸化[47]。因为植物根系(尤其是细根)是有机酸的重要来源[49],针叶树在养分吸收过程中能够通过根系释放更多的有机酸到土壤中,以此来平衡过多阳离子(Ca2+、Mg2+和K+)的吸收[11, 26, 50],这一过程一方面加速了土壤盐基离子库的耗竭,一方面增加了土壤溶液中H+的浓度,加剧土壤酸化[51]。Augusto等[52]的研究表明,欧洲几种常见树种酸化土壤的能力依次为挪威云杉(Picea abies) > 冷杉(Abies alba) > 桦木(Betula pendula) > 栎树(Quercus robur) > 椴树(Tilia cordata)。Gruba等[11]的研究也得到类似结论。而且,针叶树凋落物分解过程所产生的更多可溶性有机碳(DOC),也是有机酸的一个重要来源[44]。Waller等[53]的研究表明,DOC的增加意味着自然产生的有机酸增加,这是许多欧美温带针叶林土壤ANC在人为酸沉降显著降低后依然增加缓慢的重要原因。Yan等[7]对不同类型亚热带森林DOC通量的研究也表明, 马尾松针叶林土壤DOC明显高于常绿阔叶林土壤,进一步证明了针叶林能够释放更多有机酸, 加剧土壤酸化。另外,针叶林凋落物的易分解组分与养分含量均较低(较高的碳氮比),凋落物层厚度较大,这些难分解的凋落物不利于养分离子的循环与土壤酸化的恢复[54]。相比之下,阔叶林凋落物质量较高,分解速率较快,能够通过分解释放更多的盐基离子到土壤中,促进土壤阳离子库的快速恢复,延缓土壤酸化[12, 55]。
在我国南方酸性土壤地区,由于分布了大量的马尾松针叶林,酸沉降输入的外源H+与内源有机酸的联合效应可能会进一步加剧这些森林土壤的酸化,导致整个森林生态系统的不稳定。然而,也有研究表明,在土壤酸化的环境下,许多植物可以通过根系释放有机酸(如柠檬酸和苹果酸)的方式改变根区Al的形态,从而达到降低Al毒的目的。这些有机酸不仅可以螯合自由的Al3+,降低其对植物生长的负效应,还能在一定程度上减轻土壤酸化[56]。另外,土壤微生物也能释放有机酸(如柠檬酸),破坏土壤黏粒结构,同时螯合自由的Al或Fe,增加其在土壤深层的积累[22]。
森林林冠层的截留作用,会使到达林地地表的酸性物质浓度发生改变,从而影响土壤的酸缓冲能力。Křeček等[57]的最新研究表明,成熟云杉森林的林冠可以降低大气酸沉降的27%~28%。在同一区域、相同酸沉降背景下,由于森林类型的不同,林冠的形态与结构也会存在明显差异,因而缓冲酸沉降的效应也不同。Shen等[58]通过对比我国亚热带酸性土壤地区不同类型人工林林冠截留酸雨的效应, 认为由于林冠的截留作用,马占相思林内穿透雨NO3–的浓度增加了44%,而且其穿透雨SO42–的浓度约为龙眼人工林的2倍,由此导致马占相思林土壤pH比龙眼人工林降低了约1.4个单位。刘菊秀等[59]在鼎湖山自然保护区的研究表明,阔叶林穿透雨pH要明显高于大气降水pH,而马尾松针叶林穿透雨pH却呈现进一步降低趋势,因此阔叶林林冠缓冲酸雨的能力要强于针叶林林冠。
土壤的酸缓冲能力还会受到土壤氮(N)、磷(P)有效性的影响。Lu等[17]的研究表明,N饱和的酸性森林土壤的酸缓冲能力要明显弱于N限制的森林土壤。究其原因,可能是因为N饱和森林NO3–的流失量相对较高,为了维持土壤溶液中的电荷平衡,这些NO3–流失的同时往往伴随着盐基离子的流失[17]。在酸雨或氮沉降增加的背景下,这一过程得到加强,土壤盐基离子库耗竭严重,酸化加剧。然而,也有研究表明,在高N沉降下,反硝化作用反而增强了土壤的酸缓冲能力,这主要是因为反硝化作用可以使NO3–转化成N2或N2O,降低其在土壤内部的淋溶[60],从而减少了盐基离子的流失。Fang等[61]通过15N同位素标记的方法进一步论证了反硝化作用所产生的气态N是森林土壤过量NO3–去除的主要途径。有研究表明,在潮湿的热带、亚热带酸性森林土壤,反硝化作用甚至贡献了大约80%的N汇[62]。与N不同的是,在pH较低的酸性森林土壤中,P一般是作为植物生长的限制因子存在。因为这些酸性森林土壤一般都已高度风化,P要么以有机的形态被大量淋失[63],要么因土壤酸化而被Al3+固定形成稳定化合物,不利于植物的吸收利用[64]。然而,正是由于这种稳定Al-P化合物组分的存在,才使得Al3+的淋溶与Al毒风险降低[1]。在热带缺P的酸性森林土壤,增施P肥通常会改变土壤养分状况,增加土壤pH,减轻土壤酸化[28], 这可能是因为P添加促进了植物对N的吸收[65],从而减少了NO3–的淋溶,以致盐基离子的流失降低[28, 66]。然而,在砂岩发育的酸性森林土壤,低P有效性往往会增加SOM的C/P比,在限制微生物矿化作用的同时,增加可溶性有机酸的产量,加剧土壤酸化[67-68]。
此外,自然气候条件也会显著影响土壤的酸化进程。在降水丰富地区,强烈的淋溶作用增加了金属阳离子的流失,土壤酸化加剧[69]。由于酸性森林土壤大多位于热带、亚热带气候区,较高的降水强度与频率,再加之人为酸沉降的影响,土壤酸化问题可能会愈发严重。
4 展望酸沉降背景下酸性森林土壤的酸化进程与缓冲机制一直是生态学研究的热点问题,该问题的深入探究将有助于加深人们对全球变化背景下森林生态系统物质循环规律的认识,从而更好地为林业生产、经营服务。在前人研究成果的基础上,本部分就酸性森林土壤的改良与今后需加强研究的领域进行展望,并提出参考建议。
4.1 酸性森林土壤改良建议鉴于森林土壤酸化对整个森林生产力及其生态服务功能的负面效应,改良酸性森林土壤显得迫在眉睫。然而,现有改良方法或多或少都存在一些弊端。比如,对盐基耗竭的酸性森林土壤而言, 喷洒石灰是一种改善土壤酸度,补充钙离子的有效方法[70]。方熊等[71]曾建议将土壤改良剂(石灰)在森林的上坡位喷洒,因为这样可以通过地表径流的迁移作用将其带至下坡位,增加改良面积。但是,地表喷洒的方式对下层土壤的改良作用比较有限[72]。工业副产品(如石膏、碱渣等),能够增加土壤CEC与BS[73];有机废物包含碳酸氢盐和去碳酸基[74],可以中和酸性土壤中的有机酸性阴离子; 城市污水不仅可以改良土壤,还能够解决城市污染问题[71]。然而,这些改良措施的背后都存在增加土壤重金属污染的风险,因此可能仅限用于非经济林土壤的修复[71]。在农业酸化土壤改良中广泛使用的添加生物炭方法取得了较好的效果。生物炭的碱性特性既能中和土壤酸度,增加土壤缓冲能力,又能通过有机官能团的专性吸附方式络合金属阳离子,降低Al毒[75]。但是,该方法能否较好地用于酸性森林土壤的改良,相关报道还不多见。
森林土壤不同于农田土壤,由于其地形、地势条件的复杂性,再加上广阔的面积,通过施用改良剂的方法改善土壤酸化显然不够现实。为此,一方面要大力推进经济发展模式的转变,减少SO2与NOX的排放,从源头上降低酸沉降;一方面要根据当地的环境、经济条件,在森林经营中,多推广耐酸性、对土壤养分需求相对较低的乡土树种,把土壤酸化的负面影响降至最低。
4.2 今后研究方向的思考尽管现有研究已经比较全面系统地探讨了酸沉降下酸性森林土壤的酸化进程与缓冲机制,但今后仍需加强以下几个方面的研究。
第一,现有研究更多着眼于森林集水区或小流域尺度,得出的结论能否推广到区域尺度或全球范围,还需进一步验证。因此,今后的研究要更加注重对大尺度范围内土壤酸化进程的观测研究,并结合气象因子,进行模型推演预测,提高研究结论的普适性与科学性。
第二,现有研究主要还是从土壤矿物风化、离子交换反应等物理、化学过程的层面探究酸性森林土壤缓冲酸沉降的相关机理,缺乏对土壤生物,特别是土壤微生物在酸缓冲进程中的贡献与作用机制的探讨。由于土壤微生物对土壤酸度的改变十分敏感,可能会通过其内部一系列的生化过程来调节自身的适应性,从而影响土壤的酸化进程,所以这应是今后需要重点加强的研究领域。
第三,土壤酸化是一个复杂的过程,会受到众多内在与外在因素的影响。因此,今后的研究要特别加强各影响因素之间的耦合研究(如矿物风化-有机质-微生物的耦合研究),深入探究酸沉降背景下酸性森林土壤的缓冲机制。
| [1] |
HUANG J, MO J M, ZHANG W, et al. Research on acidification in forest soil driven by atmospheric nitrogen deposition[J]. Acta Ecol Sin, 2014, 34(6): 302-310. DOI:10.1016/j.chnaes.2014.10.002 |
| [2] |
BOWMAN W D, ClEVELAND C C, HALADA Ĺ, et al. Negative impact of nitrogen deposition on soil buffering capacity[J]. Nat Geosci, 2008, 1(11): 767-770. DOI:10.1038/ngeo339 |
| [3] |
JIANG J, WANG Y P, YU M X, et al. Responses of soil buffering capacity to acid treatment in three typical subtropical forests[J]. Sci Total Environ, 2016, 563-564: 1068-1077. DOI:10.1016/j.scitotenv.2016.04.198 |
| [4] |
HOGBERG P, FAN H B, QUIST M, et al. Tree growth and soil acidification in response to 30 years of experimental nitrogen loading on boreal forest[J]. Glob Change Biol, 2006, 12(3): 489-499. DOI:10.1111/j.1365-2486.2005.01102.x |
| [5] |
LIKENS G E, DRISCOLL C T, BUSO D C. Long-term effects of acid rain:Response and recovery of a forest ecosystem[J]. Science, 1996, 272(5259): 244-246. DOI:10.1126/science.272.5259.244 |
| [6] |
DRISCOLL C T, DRISCOLL K M, MITCHELL M J, et al. Effects of acidic deposition on forest and aquatic ecosystems in New York State[J]. Environ Pollut, 2003, 123(3): 327-336. DOI:10.1016/S0269-7491(03)00019-8 |
| [7] |
YAN J H, LI K, WANG W T, et al. Changes in dissolved organic carbon and total dissolved nitrogen fluxes across subtropical forest ecosystems at different successional stages[J]. Water Resour Res, 2015, 51(5): 3681-3694. DOI:10.1002/2015WR016912 |
| [8] |
YANG J L, ZHANG G L, HUANG L M, et al. Estimating soil acidify-cation rate at watershed scale based on the stoichiometric relations between silicon and base cations[J]. Chem Geol, 2013, 337-338: 30-37. DOI:10.1016/j.chemgeo.2012.11.009 |
| [9] |
JIANG J, WANG Y P, YU M X, et al. Soil organic matter is important for acid buffering and reducing aluminum leaching from acidic forest soils[J]. Chem Geol, 2018, 501: 86-94. DOI:10.1016/j.chemgeo.2018.10.009 |
| [10] |
KIRK G J D, BELLAMY P H, LARK R M. Changes in soil pH across England and Wales in response to decreased acid deposition[J]. Glob Change Biol, 2010, 16(11): 3111-3119. DOI:10.1111/j.1365-2486.2009.02135.x |
| [11] |
GRUBA P, MULDER J. Tree species affect cation exchange capacity (CEC) and cation binding properties of organic matter in acid forest soils[J]. Sci Total Environ, 2015, 511: 655-662. DOI:10.1016/j.scitotenv.2015.01.013 |
| [12] |
van NEVEL L, MERTENS J, de SCHRIJVER A, et al. Forest floor leachate fluxes under six different tree species on a metal contaminated site[J]. Sci Total Environ, 2013, 447: 99-107. DOI:10.1016/j.scitotenv.2012.12.074 |
| [13] |
WANG Y, CHENG P F, LI F B, et al. Variable charges of a red soil from different depths:Acid-base buffer capacity and surface complexation model[J]. Appl Clay Sci, 2018, 159: 107-115. DOI:10.1016/j.clay.2017.08.003 |
| [14] |
HUANG B, LI Z W, HUANG J Q, et al. Aging effect on the leaching behavior of heavy metals (Cu, Zn, and Cd) in red paddy soil[J]. Environ Sci Pollut Res, 2015, 22(15): 11467-11477. DOI:10.1007/s11356-015-4386-x |
| [15] |
ZHU H H, CHEN C, XU C, et al. Effects of soil acidification and liming on the phytoavailability of cadmium in paddy soils of central subtropical China[J]. Environ Pollut, 2016, 219: 99-106. DOI:10.1016/j.envpol.2016.10.043 |
| [16] |
LU X K, MAO Q G, GILLIAM F S, et al. Nitrogen deposition contributes to soil acidification in tropical ecosystems[J]. Glob Change Biol, 2014, 20(12): 3790-3801. DOI:10.1111/gcb.12665 |
| [17] |
LU X K, MAO Q G, MO J M, et al. Divergent responses of soil buffering capacity to long-term N deposition in three typical tropical forests with different land-use history[J]. Environ Sci Technol, 2015, 49(7): 4072-4080. DOI:10.1021/es5047233 |
| [18] |
van BREEMEN N, DRISCOLL C T, MULDER J. Acidic deposition and internal proton sources in acidification of soils and waters[J]. Nature, 1984, 307(5952): 599-604. DOI:10.1038/307599a0 |
| [19] |
JOHNSON J, GRAF P E, CARNICELLI S, et al. The response of soil solution chemistry in European forests to decreasing acid deposition[J]. Glob Change Biol, 2018, 24(8): 3603-3619. DOI:10.1111/gcb.14156 |
| [20] |
KETROT D, SUDDHIPRAKARN A, KHEORUENROMNE I, et al. Interactive effects of iron oxides and organic matter on charge properties of red soils in Thailand[J]. Soil Res, 2013, 51(3): 222-231. DOI:10.1071/SR13021 |
| [21] |
LIU T X, LI X M, LI F B, et al. Effects of Al content and synthesis temperature on Al-substituted Fe oxides[J]. Soil Sci, 2014, 179(10/11): 468-475. DOI:10.1097/SS.0000000000000092 |
| [22] |
FUJⅡ K, SHIBATA M, KITAJIMA K, et al. Plant-soil interactions maintain biodiversity and functions of tropical forest ecosystems[J]. Ecol Res, 2018, 33(1): 149-160. DOI:10.1007/s11284-017-1511-y |
| [23] |
YANG Y H, JI C J, MA W H, et al. Significant soil acidification across northern China's grasslands during 1980s-2000s[J]. Glob Change Biol, 2012, 18(7): 2292-2300. DOI:10.1111/j.1365-2486.2012.02694.x |
| [24] |
TIAN D S, NIU S L. A global analysis of soil acidification caused by nitrogen addition[J]. Environ Res Lett, 2015, 10(2): 024019. DOI:10.1088/1748-9326/10/2/024019 |
| [25] |
LI W, JOHNSON C E. Relationships among pH, aluminum solubility and aluminum complexation with organic matter in acid forest soils of the northeastern United States[J]. Geoderma, 2016, 271: 234-242. DOI:10.1016/j.geoderma.2016.02.030 |
| [26] |
ROSS D S, MATSCHONAT G, SKYLLBERG U. Cation exchange in forest soils:The need for a new perspective[J]. Eur J Soil Sci, 2008, 59(6): 1141-1159. DOI:10.1111/j.1365-2389.2008.01069.x |
| [27] |
LI Y, SUN J, TIAN D S, et al. Soil acid cations induced reduction in soil respiration under nitrogen enrichment and soil acidification[J]. Sci Total Environ, 2018, 615: 1535-1546. DOI:10.1016/j.scitotenv.2017.09.131 |
| [28] |
MAO Q G, LU X K, ZHOU K J, et al. Effects of long-term nitrogen and phosphorus additions on soil acidification in an N-rich tropical forest[J]. Geoderma, 2017, 285: 57-63. DOI:10.1016/j.geoderma.2016.09.017 |
| [29] |
FANG K, KOU D, WANG G Q, et al. Decreased soil cation exchange capacity across Northern China's grasslands over the last three decades[J]. J Geophys Res-Biogeo, 2017, 122(11): 3088-3097. DOI:10.1002/2017jg003968 |
| [30] |
LUO W, NELSON P N, LI M H, et al. Contrasting pH buffering patterns in neutral-alkaline soils along a 3600 km transect in northern China[J]. Biogeosciences, 2015, 12(16): 13215-13240. DOI:10.5194/bgd-12-13215-2015 |
| [31] |
XU R K, ZHAO A Z, YUAN J H, et al. pH buffering capacity of acid soils from tropical and subtropical regions of China as influenced by incorporation of crop straw biochars[J]. J Soil Sediment, 2012, 12(4): 494-502. DOI:10.1007/s11368-012-0483-3 |
| [32] |
HOU T, XU R K, TIWARI D, et al. Interaction between electrical double layers of soil colloids and Fe/Al oxides in suspensions[J]. J Colloid Interf Sci, 2007, 310(2): 670-674. DOI:10.1016/j.jcis.2007.02.035 |
| [33] |
WU J P, LIANG G H, HUI D F, et al. Prolonged acid rain facilitates soil organic carbon accumulation in a mature forest in Southern China[J]. Sci Total Environ, 2016, 544: 94-102. DOI:10.1016/j.scitotenv.2015.11.025 |
| [34] |
KALISZ P J, STONE E L. Cation exchange capacity of acid forest humus layers[J]. Soil Sci Soc Amer J, 1980, 44(2): 407-413. DOI:10.2136/sssaj1980.03615995004400020040x |
| [35] |
THOMPSON M L, ZHANG H L, KAZEMI M, et al. Contribution of organic matter to cation exchange capacity and specific surface area of fractionated soil materials[J]. Soil Sci, 1989, 148(4): 250-257. DOI:10.1097/00010694-198910000-00003 |
| [36] |
POURPOINT F, TEMPLIER J, ANQUETIL C, et al. Probing the aluminum complexation by Siberian riverine organic matter using solid-state DNP-NMR[J]. Chem Geol, 2017, 452: 1-8. DOI:10.1016/j.chemgeo.2017.02.004 |
| [37] |
JOHNSON C E. Cation exchange properties of acid forest soils of the northeastern USA[J]. Eur J Soil Sci, 2002, 53(2): 271-282. DOI:10.1046/j.1365-2389.2002.00441.x |
| [38] |
HOBBIE S E, OGDAHL M, CHOROVER J, et al. Tree species effects on soil organic matter dynamics:The role of soil cation composition[J]. Ecosystems, 2007, 10(6): 999-1018. DOI:10.1007/s10021-007-9073-4 |
| [39] |
SKYLLBERG U, RAULUND-RASMUSSEN K, BORGGAARD O K. pH buffering in acidic soils developed under Picea abies and Quercus robur:Effects of soil organic matter, adsorbed cations and soil solution ionic strength[J]. Biogeochemistry, 2001, 56(1): 51-74. DOI:10.1023/A:1011988613449 |
| [40] |
GRUBA P, MULDER J. Relationship between aluminum in soils and soil water in mineral horizons of a range of acid forest soils[J]. Soil Sci Soc Am J, 2008, 72(4): 1150-1157. DOI:10.2136/sssaj2007.0041 |
| [41] |
LANGE H, SOLBERG S, CLARKE N. Aluminum dynamics in forest soil waters in Norway[J]. Sci Total Environ, 2006, 367(2/3): 942-957. DOI:10.1016/j.scitotenv.2006.01.033 |
| [42] |
LAWRENCE G B, HAZLETT P W, FERNANDEZ I J, et al. Declining acidic deposition begins reversal of forest-soil acidification in the northeastern U.S. and eastern Canada[J]. Environ Sci Technol, 2015, 49(22): 13103-13111. DOI:10.1021/acs.est.5b02904 |
| [43] |
POSS R, SMITH C J, DUNIN F X, et al. Rate of soil acidification under wheat in a semi-arid environment[J]. Plant Soil, 1995, 177(1): 85-100. DOI:10.1007/BF00010340 |
| [44] |
FUJⅡ K, HAYAKAWA C, PANITKASATE T, et al. Acidification and buffering mechanisms of tropical sandy soil in northeast Thailand[J]. Soil Till Res, 2017, 165: 80-87. DOI:10.1016/j.still.2016.07.008 |
| [45] |
MO J M, BROWN S, PENG S L, et al. Nitrogen availability in disturbed, rehabilitated and mature forests of tropical China[J]. For Ecol Manag, 2003, 175(1/2/3): 573-583. DOI:10.1016/s0378-1127(02)00220-7 |
| [46] |
CHAPIN F S Ⅲ, MATSON P A, MOONEY H A. Principles of Terrestrial Ecosystem Ecology[M]. New York: Springer, 2002. DOI:10.1007/b97397
|
| [47] |
MUELLER K E, EISSENSTAT D M, HOBBIE S E, et al. Tree species effects on coupled cycles of carbon, nitrogen, and acidity in mineral soils at a common garden experiment[J]. Biogeochemistry, 2012, 111(1/2/3): 601-614. DOI:10.1007/s10533-011-9695-7 |
| [48] |
FUJⅡ K, HARTONO A, FUNAKAWA S, et al. Acidification of tropical forest soils derived from serpentine and sedimentary rocks in East Kalimantan, Indonesia[J]. Geoderma, 2011, 160(3/4): 311-323. DOI:10.1016/j.geoderma.2010.09.027 |
| [49] |
HIRANO Y, TANIKAWA T, MAKITA N. Biomass and morphology of fine roots in eight Cryptomeria japonica stands in soils with different acid-buffering capacities[J]. For Ecol Manag, 2017, 384: 122-131. DOI:10.1016/j.foreco.2016.10.043 |
| [50] |
FINZI A C, CANHAM C D, van BREEMEN N. Canopy tree-soil interactions within temperate forests:Species effects on pH and cations[J]. Ecol Appl, 1998, 8(2): 447-454. DOI:10.2307/2641084 |
| [51] |
CLARHOLM M, SKYLLBERG U. Translocation of metals by trees and fungi regulates pH, soil organic matter turnover and nitrogen availability in acidic forest soils[J]. Soil Biol Biochem, 2013, 63: 142-153. DOI:10.1016/j.soilbio.2013.03.019 |
| [52] |
AUGUSTO L, RANGER J, BINKLEY D, et al. Impact of several common tree species of European temperate forests on soil fertility[J]. Ann For Sci, 2002, 59(3): 233-253. DOI:10.1051/forest:2002020 |
| [53] |
WALLER K, DRISCOLL C, LYNCH J, et al. Long-term recovery of lakes in the Adirondack region of New York to decreases in acidic deposition[J]. Atmos Environ, 2012, 46: 56-64. DOI:10.1016/j.atmosenv.2011.10.031 |
| [54] |
CREMER M, PRIETZEL J. Soil acidity and exchangeable base cation stocks under pure and mixed stands of European beech, Douglas fir and Norway spruce[J]. Plant Soil, 2017, 415(1/2): 393-405. DOI:10.1007/s11104-017-3177-1 |
| [55] |
JACOB M, WELAND N, PLATNER C, et al. Nutrient release from decomposing leaf litter of temperate deciduous forest trees along a gradient of increasing tree species diversity[J]. Soil Biol Biochem, 2009, 41(10): 2122-2130. DOI:10.1016/j.soilbio.2009.07.024 |
| [56] |
BURNHAM M B, CUMMING J R, ADAMS M B, et al. Soluble soil aluminum alters the relative uptake of mineral nitrogen forms by six mature temperate broadleaf tree species:Possible implications for watershed nitrate retention[J]. Oecologia, 2017, 185(3): 327-337. DOI:10.1007/s00442-017-3955-8 |
| [57] |
KŘEČEK J, PALÁN L, STUCHLÍK E. Impacts of land use policy on the recovery of mountain catchments from acidification[J]. Land Use Policy, 2019, 80: 439-448. DOI:10.1016/j.landusepol.2017.10.018 |
| [58] |
SHEN W J, REN H L, DARREL J G, et al. Atmospheric deposition and canopy exchange of anions and cations in two plantation forests under acid rain influence[J]. Atmos Environ, 2013, 64: 242-250. DOI:10.1016/j.atmosenv.2012.10.015 |
| [59] |
LIU J X, ZHANG D Q, ZHOU G Y, et al. A preliminary study on the chemical properties of precipitation, throughfall, stemflow and surface run-off in major forest types at Dinghushan under acid deposition[J]. Chin J Appl Ecol, 2003, 14(8): 1223-1228. 刘菊秀, 张德强, 周国逸, 等. 鼎湖山酸沉降背景下主要森林类型水化学特征初步研究[J]. 应用生态学报, 2003, 14(8): 1223-1228. DOI:10.3321/j.issn:1001-9332.2003.08.004 |
| [60] |
YU Q, ZHANG T, CHENG Z L, et al. Is surface water acidification a serious regional issue in China?[J]. Sci Total Environ, 2017, 584-585: 783-790. DOI:10.1016/j.scitotenv.2017.01.116 |
| [61] |
FANG Y T, KOBA K, MAKABE A, et al. Microbial denitrification dominates nitrate losses from forest ecosystems[J]. Proc Natl Acad Sci USA, 2015, 112(5): 1470-1474. DOI:10.1073/pnas.1416776112 |
| [62] |
YU L F, ZHU J, MULDER J, et al. Multiyear dual nitrate isotope signatures suggest that N-saturated subtropical forested catchments can act as robust N sinks[J]. Glob Change Biol, 2016, 22(11): 3662-3674. DOI:10.1111/gcb.13333 |
| [63] |
VITOUSEK P M, PORDER S, HOULTON B Z, et al. Terrestrial phosphorus limitation:Mechanisms, implications, and nitrogen-phosphorus interactions[J]. Ecol Appl, 2010, 20(1): 5-15. DOI:10.1890/08-0127.1 |
| [64] |
LIANG X Q, LIU J, CHEN Y X, et al. Effect of pH on the release of soil colloidal phosphorus[J]. J Soil Sediment, 2010, 10(8): 1548-1556. DOI:10.1007/s11368-010-0275-6 |
| [65] |
JIANG J, WANG Y P, YANG Y H, et al. Interactive effects of nitrogen and phosphorus additions on plant growth vary with ecosystem type[J]. Plant Soil, 2019, 440: 523-537. DOI:10.1007/s11104-019-04119-5 |
| [66] |
CHEN H, GURMESA G A, ZHANG W, et al. Nitrogen saturation in humid tropical forests after 6 years of nitrogen and phosphorus addition:Hypothesis testing[J]. Funct Ecol, 2016, 30(2): 305-313. DOI:10.1111/1365-2435.12475 |
| [67] |
WIEDER W R, CLEVELAND C C, TOWNSEND A R. Tropical tree species composition affects the oxidation of dissolved organic matter from litter[J]. Biogeochemistry, 2008, 88(2): 127-138. DOI:10.1007/s10533-008-9200-0 |
| [68] |
FUJⅡ K, UEMURA M, HAYAKAWA C, et al. Fluxes of dissolved organic carbon in two tropical forest ecosystems of East Kalimantan, Indonesia[J]. Geoderma, 2009, 152(1/2): 127-136. DOI:10.1016/j.geoderma.2009.05.028 |
| [69] |
LUCAS R W, KLAMINDER J, FUTTER M N, et al. A meta-analysis of the effects of nitrogen additions on base cations:Implications for plants, soils, and streams[J]. For Ecol Manag, 2011, 262(2): 95-104. DOI:10.1016/j.foreco.2011.03.018 |
| [70] |
WANG J, ZHANG B B, TIAN Y, et al. A soil management strategy for ameliorating soil acidification and reducing nitrification in tea plantations[J]. Eur J Soil Biol, 2018, 88: 36-40. DOI:10.1016/j.ejsobi.2018.06.001 |
| [71] |
FANG X, LIU J X, YIN G C, et al. Study the restoration technology of concentrated application-natural diffusion about amendments of acidified soil of hilly woodland[J]. Environ Sci, 2013, 34(1): 293-301. 方熊, 刘菊秀, 尹光彩, 等. 丘陵林地土壤酸化改良剂的集中施用-自然扩散修复技术研究[J]. 环境科学, 2013, 34(1): 293-301. |
| [72] |
TANG C, WELIGAMA C, SALE P. Subsurface soil acidification in farming systems: Its possible causes and management options[C]//Molecular Environmental Soil Science. Progress in Soil Science. Dordrecht: Springer, 2013: 389-412. doi: 10.1007/978-94-007-4177-5_13.
|
| [73] |
LI J Y, WANG N, XU R K, et al. Potential of industrial byproducts in ameliorating acidity and aluminum toxicity of soils under tea plantation[J]. Pedosphere, 2010, 20(5): 645-654. DOI:10.1016/S1002-0160(10)60054-9 |
| [74] |
WHALEN J K, CHANG C, CLAYTON G W, et al. Cattle manure amendments can increase the pH of acid soils[J]. Soil Sci Soc Amer J, 2000, 64(3): 962-966. DOI:10.2136/sssaj2000.643962x |
| [75] |
DAI Z M, ZHANG X J, TANG C, et al. Potential role of biochars in decreasing soil acidification:A critical review[J]. Sci Total Environ, 2017, 581-582: 601-611. DOI:10.1016/j.scitotenv.2016.12.169 |
 2019, Vol. 27
2019, Vol. 27