1b. 仲恺农业工程学院, 农业与生物学院, 广州 510225;
2. 中国科学院华南植物园, 中国科学院植物资源保护与可持续利用重点实验室, 广州 510650;
3. 中国科学院大学, 北京 100049
1b. College of Agriculture & Biology, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China;
2. Key Layboratory of Plant Resources Conservation and Sustainable Utilization, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
根据国家海关总署数据,2017年我国食用油籽进口量达1.02×108 t,已超过我国食用油籽消费量的70%,早已超过了国际粮油安全预警线,而我国食用油消费量最大的大豆油,2017年进口了9.554×107 t大豆原料,对外依存度高达87%。因此寻找新型食用油油料植物资源已成为克服我国粮食安全的重要途径之一。油莎豆(Cyperus esculentus)可作为主粮的有效补充和新的食物来源[1],干产量可达7.5 t hm–2以上[2]。2007年油莎豆油被我国认证为无公害农产品, 2012年又被认证为有机产品。此后农业部分别于2015年11月和2016年6月发文建议适宜地区示范推广种植油莎豆, 以调整种植结构和增加新的食用油来源[3]。
油莎豆又名油莎草、铁荸荠、洋地栗,是莎草科(Cyperaceae)莎草属的多年生草本植物,常作一年生作物栽培,以块茎繁殖,是目前已知的能够在块茎贮藏大量油脂的唯一作物[4]。原产于非洲地中海地区,1952年首次由北京植物园从苏联引进,1960年又再次从保加利亚引进[5]。油莎豆适应性极强, 全生育期为70~150 d,3月初至7月均可播种[2]。油莎豆喜温暖湿润气候,耐旱、耐涝、耐贫瘠且耐盐碱,最适宜沙壤土。
我国油莎豆的遗传多样性很低,现有优良品种很少。加之油莎豆在我国气候条件下一般不开花或者开花不结实,因此利用常规杂交方法培育新的优良品种比较困难[3]。而长期用块茎繁殖,易出现品种退化、遗传不稳定、品质下降、带菌严重等问题。组织培养是加速植物繁殖的一种简单、快捷的有效方法,可以实现优良品种的种质创新、种苗的规模化生产[6],在农业生产上得到越来越广泛的应用。目前,国内外对油莎豆的组织培养和快繁技术研究较少,大大限制了油莎豆的遗传育种和种质创新。因此,本文以油莎豆茎尖为外植体,以MS为基本培养基,通过添加不同浓度的6-BA、KT、NAA进行丛生芽诱导和生根诱导,从而建立油莎豆快速繁殖的离体培养体系,为高效繁育油莎豆优质种苗和种质资源优化奠定基础。
1 材料和方法 1.1 材料试验材料为中国科学院华南植物园能源植物组从云南省保山市收集并保存的小粒型油莎豆(Cyperus esculentus)块茎。
1.2 块茎处理选取饱满、无虫眼、带完整芽眼的块茎,将表面的须根与鳞片除净,用自来水冲洗后浸泡3 d, 期间经常换水。先用75%乙醇浸泡1 min,用无菌水清洗5~6次,再用7.5% (W/V)次氯酸钠浸泡50 min后用无菌水清洗1~2次。为彻底去除杂菌,用加有0.05% (V/V) Tween-20和500 mg L–1头孢的无菌水清洗2~3次,最后用无菌水清洗2~3次。置于无菌纸上吸干块茎表面水分,移至顶芽诱导培养基MS+0.2 mg L–1 NAA+0.5 mg L–1 6-BA+500 mg L–1头孢+30 g L–1蔗糖+8.0 g L–1琼脂,pH 5.8[7]。
1.3 丛生芽增殖培养以MS培养基为基本培养基,按表 1添加生长调节剂,调节pH至5.8。生长调节剂按L9 (3)4正交试验进行设计,生长调节剂有3种:6-BA、KT、NAA, 每种设置3个浓度水平,6-BA:0.5、1.0、2.0 mg L–1;KT:0、0.2、0.5 mg L–1;NAA:0、0.02、0.2 mg L–1。每瓶接种6个外植体,每处理接种7瓶,重复3次。每周观察试管苗生长情况,培养4周后统计肉眼可见的丛生芽个数,增殖系数=(丛生芽总数-外植体总数)/外植体总数。
| 表 1 油莎豆丛芽增值L9(3)4正交试验直观分析表 Table 1 Visual analysis of the L9(3)4 orthogonal experiment of Cyperus esculentus proliferattion |
以MS和1/2MS为基本培养基,以不添加生长调节剂、添加0.1 mg L–1 IBA或者NAA为处理,pH为5.8。每瓶接种6个外植体,每处理接种7瓶,重复3次。观察试管苗的生根时间和根生长状况,10 d后统计平均生根率和平均生根数,平均生根率=生根的外植体数/外植体总数; 平均生根数=生根总数/外植体总数。
培养温度为(25±2)℃,每天光照14 h,黑暗10 h, 相对湿度为(55±5)%,光强为150 μmol m–2s–1,所有培养基均添加3%蔗糖和0.8%琼脂。
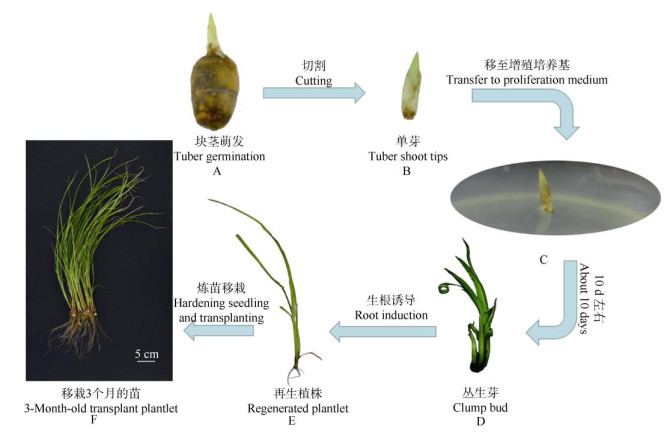
2 结果和分析 2.1 组织培养过程消毒后的块茎置于顶芽诱导培养基约1周,块茎开始萌发(图 1: A)。切割茎尖为单芽(图 1: B),用70%乙醇浸泡30 s,0.1%升汞浸泡10 min,用加有0.05% (V/V) Tween-20的无菌水清洗3次,再用无菌水冲洗5次,置于无菌纸上吸干表面水分,接种至MS+0.05 mg L–1 NAA+0.5 mg L–1 6-BA培养基上(图 1: C),pH 5.8,10 d左右可诱导出新芽(图 1: D),2个月后得到大量丛生芽(图 1: E)。选取长势一致的无菌苗为外植体进行生根诱导。
|
图 1 油莎豆的组织培养 Fig. 1 Tissue culture of Cyperus esculentus |
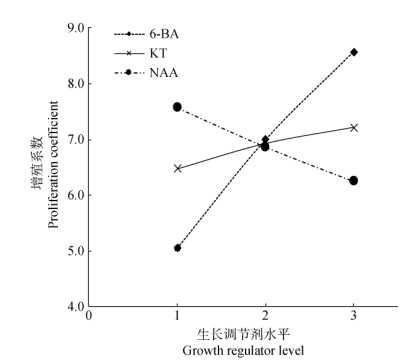
从表 1可见,3个生长调节剂对丛生芽增殖的影响为6-BA > NAA > KT。方差分析(表 2)表明,6-BA对丛生芽增殖的影响显著,NAA和KT的影响不显著。由图 2可以看出,6-BA对丛生芽增殖起促进作用,而NAA则起抑制作用。综合极差分析和方差分析,若仅考虑生长调节剂对丛生芽增殖的影响,生长调节剂的最佳组合为A3B2C1,即2.0 mg L–1 6-BA+0.5 mg L–1 KT,增值系数为9.49。但丛生芽的增殖系数不能成为油莎豆快繁的唯一指标,经观察6-BA虽对油莎豆丛生芽增殖有促进作用,但对叶状茎的生长随浓度增大有显著的不利作用,较高浓度的6-BA诱导出的新芽出现叶片卷曲、新生芽弱小的现象(图 3: S8, S9), 因此油莎豆试管苗增殖过程中6-BA的浓度不应过高。因此,生长调节剂的最佳组合为1.0 mg L–1 6- BA+0.2 mg L–1 KT,此时增殖系数为7.58。
| 表 2 油莎豆丛生芽增殖的方差分析 Table 2 Variance analysis of clump shoot proliferation of Cyperus esculentus |
|
图 2 油莎豆丛生芽增殖系数与生长调节剂水平的效应曲线 Fig. 2 Effect curve between level of growth regulator and proliferation coefficient of Cyperus esculentus |

|
图 3 油莎豆丛生芽培养4周的生长情况。S1~S9见表 1。 Fig. 3 Growth of clump shoots of Cyperus esculentus cultured for 4 weeks. S1-S9 see Table 1. |
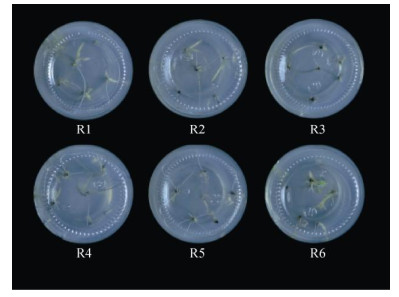
将丛生芽移至生根培养基中,芽能正常生长, 没有新的丛生芽增殖,2~3 d开始生根。从表 3可见, 不加任何生长调节剂,MS培养基的生根率和平均生根数均高于1/2MS培养基的,而添加0.1 mg L–1 IBA或NAA的情况则相反。从图 4可见,MS培养基诱导的根较为细长,虽然添加0.1 mg L–1 NAA的培养基(R3, R6)平均生根数较多,但是根短而粗。综合来看,最优生根培养基为MS培养基, 生根率可达88.10%,平均生根数为2.04。
| 表 3 油莎豆丛生芽的生根培养 Table 3 Root induction of clump shoots of Cyperus esculentus |
对于主要通过营养块茎、球茎、块根等繁殖的植物,如山药(Rhizoma dioscorea)、半夏(Pinellia ternata)、木薯(Manihot esculenta)等,传统繁殖方式不仅扩繁速度慢,耗费种茎多,成本高,且长期营养繁殖容易积累病害,以组织培养技术为基础的离体快繁是目前最广泛和最有效的一种高效繁育种苗和优化种质资源的技术。正交试验是多因素多水平分析的有利工具,可用最少的处理组合数来研究较多的试验因素。本研究同时分析了3种因素3个水平对油莎豆无菌苗增殖的影响,若不采用正交设计的方法,则需安排33=27组试验,采用正交设计只需要9组试验。正交设计方法已在北苍术(Atractylodes chinensis)[8]、金线莲(Anoectochilus roxburghii)[9]、山薯(Dioscorea fordii)[10]、康乃馨(Dianthus caryophyllus)[11]、空心莲子草(Alternanthera philoxeroides)[12]等植物组织培养中成功应用。
植物生长调节剂的种类、水平及组合对植物组织的增殖十分重要。细胞分裂素是植物组织培养过程中促进组织分化和生长的物质,不同细胞分裂素种类及浓度对组培苗的增殖效果不同[13-14]。本研究结果表明,对油莎豆丛生芽增殖影响最大的是6-BA, 诱导产生的丛生芽较多,但植株不够健壮;而KT诱导的丛生芽少,但生长较为健壮,这与张慧英等[15]对荸荠(Eleocharis tuberosa)的快繁研究结果一致。本研究中高浓度6-BA与KT配合使用并未达到丛生芽多且生长健壮的效果,可能与KT的浓度有关,这有待进一步的研究。
韩晓勇等[16]报道MS+0.5 mg L–1 6-BA+0.1 mg L–1 NAA培养基对铁棍山药茎段的不定芽诱导效果较好,丰锋等[17]认为MS+2.5 mg L–1 KT+0.04 mg L–1 NAA培养基对淮山药继代增殖培养效果较好,蔡建荣[18]报道MS+6-BA 0.5 mg L–1+NAA 0.1~0.5 mg L–1培养基较适合寸金薯茎段的不定芽诱导,潘梅等[19]认为MS+2.0 mg L–1 6-BA+0.3 mg L–1 NAA对‘桂淮6号’的不定芽增殖效果最好。这说明对同一物种不同基因型丛生芽增殖所需的植物生长调节剂种类和浓度存在一定的差异。目前对油莎豆的组织培养研究报道很少,瞿萍梅等[7]认为油莎豆增殖培养基为MS+0.5 mg L–1 6-BA,而本研究结果表明MS+1.0 mg L–1 6-BA+0.2 mg L–1 KT培养基对油莎豆丛生芽继代增殖较好,这可能与试验材料的基因型不同有关。
瞿萍梅等[7]报道油莎豆的最佳生根培养基为1/2MS+0.2 mg L–1 IBA,吴琼[20]认为油莎豆只能在1/2MS培养基中生根,而本研究结果表明,油莎豆丛生芽可以在MS培养基上生根,这可能与试验材料的基因型差异有关,说明本试验建立的油莎豆无菌苗快速繁殖体系需根据油莎豆的不同基因型做进一步的调整,但本快繁系统丛生芽诱导时间短, 数量较多,生长较健壮,生根诱导时无需添加任何生长调节剂,成本较低,可为油莎豆优质种苗的高效繁育及其种质资源的优化奠定基础。
| [1] |
ARAFAT S M, GAAFAR A M, BASUNY A M, et al. Chufa tubers (Cyperus esculentus L.):As a new source of food[J]. World Appl Sci J, 2009, 7(2): 151-156. |
| [2] |
DUAN J X, MA J. Cultivation of Yellow Nutsedge[M]. Beijing: Science Popular Press, 1983: 1-44. 段俊喜, 马杰. 油莎豆栽培[M]. 北京: 科学普及出版社, 1983: 1-44. |
| [3] |
YANG Z L. Characteristics and research progress of Cyperus esculent[J]. N Hort, 2017, 41(17): 192-201. 阳振乐. 油莎豆的特性及其研究进展[J]. 北方园艺, 2017, 41(17): 192-201. DOI:10.11937/bfyy.20170541 |
| [4] |
China Oil Plant Compilation Group. China Oil Plant[M]. Beijing: Science Press, 1987: 33-35. 中国油脂植物编写组. 中国油脂植物[M]. 北京: 科学出版社, 1987: 33-35. |
| [5] |
WU Y X. The oil of tigernet (Cyperus esculentus L.)[J]. Grain Sci Technol Econ, 1993(1): 30. 吴艳霞. 油莎豆油[J]. 粮油科技与经济, 1993(1): 30. |
| [6] |
TILKAT E, ONAY A. Direct shoot organogenesis from in vitro-derived mature leaf explants of pistachio[J]. In Vitro Cell Dev Biol Plant, 2009, 45(1): 92-98. DOI:10.1007/s11627-008-9168-4 |
| [7] |
QU P M, LONG C L, CHENG Z Y, et al. Tissue culture and rapid propagation of Cyperus esculentus L. var. sativus Boeck[J]. Plant Physiol Commun, 2007, 43(2): 331. 瞿萍梅, 龙春林, 程治英, 等. 油莎豆的组织培养和快速繁殖[J]. 植物生理学通讯, 2007, 43(2): 331. |
| [8] |
ZUO J J, YAN G Y, AN X N, et al. Tissue culture of Atractylodes chinensis by orthogonal design[J]. Chin Agric Bull, 2017, 33(11): 21-24. 左静静, 闫贵云, 安晓宁, 等. 正交设计优化北苍术组织培养研究[J]. 中国农学通报, 2017, 33(11): 21-24. DOI:10.11924/j.issn.1000-6850.casb16070023 |
| [9] |
WANG Y Y, LIN X H, HONG X. Studies on explants selection and callus induction of Anoectochilus roxburghii[J]. Subtrop Plant Sci, 2011, 40(3): 41-43. 王雅英, 林小华, 洪璇. 金线莲外植体筛选及愈伤组织诱导研究[J]. 亚热带植物科学, 2011, 40(3): 41-43. DOI:10.3969/j.issn.1009-7791.2011.03.011 |
| [10] |
YAN H B, YANG L T, LI Y R. Axillary shoot proliferation and tuberization of Dioscorea fordii Prain et Burk[J]. Plant Cell Tiss Organ Cult, 2011, 104(2): 193-198. DOI:10.1007/s11240-010-9818-1 |
| [11] |
CHEN Y L, PENG J P, LIU F, et al. An orthogonal design study of proliferation and flowering in vitro of Dianthus caryophyllus L.[J]. Chin J Trop Crops, 2017, 38(10): 1907-1912. 陈雨露, 彭洁平, 刘芳, 等. 基于正交设计的康乃馨试管苗增殖和开花诱导研究[J]. 热带作物学报, 2017, 38(10): 1907-1912. DOI:10.3969/j.issn.1000-2561.2017.10.022 |
| [12] |
GAO J M, LI J Z, LUO C B, et al. Callus induction and plant regeneration in Alternanthera philoxeroides[J]. Mol Biol Rep, 2011, 38(2): 1413-1417. DOI:10.1007/s11033-010-0245-5 |
| [13] |
JIN S, CHEN Z B, LI Y C, et al. Establishment of rapid propagation system of Pinellia ternata[J]. Lishizhen Med Mat Med Res, 2017, 28(7): 1759-1761. 靳松, 陈泽斌, 李育川, 等. 半夏组培快繁体系的建立[J]. 时珍国医国药, 2017, 28(7): 1759-1761. |
| [14] |
CHEN Z H, HUA S M, LI L H, et al. Optimization of technical conditions for tissue culture and rapid propagation of Chinese Yam[J]. Fujian J Agric Sci, 2018, 33(2): 164-170. 陈芝华, 华树妹, 李丽红, 等. 山药组培快繁技术条件的优化[J]. 福建农业学报, 2018, 33(2): 164-170. |
| [15] |
ZHANG H Y, WEI S L. Rapid propagation of Eleocharis tuberosa plantlet in vitro[J]. J Guangxi Agric Biol Sci, 2007, 26(S1): 99-102. 张慧英, 韦绍丽. 荸荠试管苗的快速繁殖[J]. 广西农业生物科学, 2007, 26(S1): 99-102. |
| [16] |
HAN X Y, YAN R X, YIN J M, et al. Research on tissue culture for rapid propagation and in vitro bulbils regeneration system of Dioscorea opposita Thunb.[J]. Acta Bot Boreali-Occid Sin, 2013, 33(10): 2120-2125. 韩晓勇, 闫瑞霞, 殷剑美, 等. 铁棍山药组织培养快繁及试管珠芽离体再生体系研究[J]. 西北植物学报, 2013, 33(10): 2120-2125. DOI:10.7606/j.issn.1000-4025.2013.10.2120 |
| [17] |
FENG F, YE C H, GUO J Y, et al. Study on the effects of growth inhibitors on the growth of Dioscorea alata Linn. in vitro[J]. Crops, 2007, 23(2): 29-31. 丰锋, 叶春海, 郭锦云, 等. 植物生长抑制剂对淮山药组培苗生长的影响[J]. 作物杂志, 2007, 23(2): 29-31. DOI:10.3969/j.issn.1001-7283.2007.02.009 |
| [18] |
CAI J R. Study on tissue culture of Dioscorea opposita [D]. Fuzhou: Fujian Agriculture and Forestry University, 2010: 1-32. 蔡建荣.山药组织培养技术的研究[D].福州: 福建农林大学, 2010: 1-32. http://cdmd.cnki.com.cn/Article/CDMD-10389-2010182010.htm |
| [19] |
PAN M, HUANG S, WANG J F, et al. Study on in vitro cultivation conditions and cultivating techniques of Dioscorea opposita[J]. Guizhou Agric Sci, 2014, 42(3): 125-129. 潘梅, 黄赛, 王景飞, 等. 山药茎段的离体培养与育苗基质筛选[J]. 贵州农业科学, 2014, 42(3): 125-129. DOI:10.3969/j.issn.1001-3601.2014.03.031 |
| [20] |
WU Q. The regeneration system of yellow nutsedge and the poly-ploid induction[D]. Lanzhou: Lanzhou University, 2009: 1-42. 吴琼.油莎豆再生体系的建立及多倍体诱导[D].兰州: 兰州大学, 2009: 1-42. http://d.wanfangdata.com.cn/Thesis/Y1515416 |
 2019, Vol. 27
2019, Vol. 27