2. 中国热带农业科学院热带生物技术研究所, 海口 571101
2. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China
植物的生长和发育离不开短命调控蛋白的有选择性降解,其中一种重要的降解方式就是泛素/ 26S蛋白酶体途径(Ub/26S途径)[1]。在这个途径中,泛素(ubiquitin, Ub)和26S蛋白酶体起着至关重要的作用,需要被降解的蛋白会通过泛素活化酶E1 (UBE1)、泛素结合酶E2 (UBE2)和泛素连接酶E3 (UBE3)参与并由Ub进行标记,随后标记蛋白会被26S蛋白酶体识别并降解[2-5]。经过这个循环, Ub/ 26S途径会有效地去除不正常的蛋白和大部分短命调控蛋白。Ub/26S途径是植物中高效专一蛋白降解调控机制之一,参与植物激素应答[6-7]、花的生长发育[8]、非生物胁迫应答[9-10]、植物免疫应答[11-12]、光形态建成[13]、花粉萌发和花粉管伸长[14-15]、自交不亲和的发生[16]等环节。在植物自交不亲和反应中,Ub/26S途径可以降解一些特异蛋白质,最终使花粉萌发受到抑制或花粉管停止生长[16–18]。目前有关Ub/26S途径关键酶的研究主要集中在UBE2和UBE3上,而对于UBE1的研究报道很少。虽然已经从香蕉(Musa nana)、番木瓜(Carica Papaya)、番茄(Lycopersicon esculentum)、玉米(Zea mays)、小麦(Triticum aestivum)、拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum)和茶树(Camellia sinensis)等植物中分离到UBE1基因,但UBE1的功能仍不清楚。有研究表明,UBE1可能参与了植物的逆境胁迫响应、果实成熟发育以及采后成熟过程[19-21]。而有关UBE1基因在植物的自交不亲和反应中的功能研究还未见报道。
无籽沙糖桔(Citrus reticulata ‘Wuzishatangju’)是本课题组从有籽沙糖桔芽变中选育的新品种[22], 属于配子体型自交不亲和[23]。我们的前期研究表明, WUBE1基因在无籽沙糖桔花药和自交后3 d的花柱中明显上调表达,而在异交授粉后3 d花柱中几乎不表达;酵母表达试验证明,加入外源WUBE1蛋白可以显著抑制无籽沙糖桔的花粉萌发率,推测WUBE1很可能参与了无籽沙糖桔自交不亲和反应[24]。本研究拟采用农杆菌介导法将来源于自交不亲和无籽沙糖桔的WUBE1基因导入烟草,为阐明WUBE1在无籽沙糖桔自交不亲和反应中的作用奠定基础。
1 材料和方法 1.1 材料以培养在MS培养基上的烟草(Nicotiana tabacum) W38叶片为材料。质粒为pBI121-WUBE1 [WUBE1基因来源于自交不亲和品种无籽沙糖桔(Citrus reticulata ‘Wuzishatangju’),农杆菌(Agrobacterium tumefaciens) EHA105菌株,均由本实验室保存。
1.2 方法烟草遗传转化和分子检测 通过根癌农杆菌介导的烟草叶盘转化法[25]将pBI121-WUBE1转化烟草,获得抗性植株。用改良CTAB法提取抗性植株叶片的总DNA[25],以pBI121-UBE1质粒为阳性对照,野生型植株叶片的基因组DNA为阴性对照,进行多重引物(NPT II、35S、WUBE1和ChvA)的PCR检测(表 1)。对PCR检测为阳性的植株基因组DNA用EcoR I内切酶于37℃水浴中酶切过夜, 用0.7%琼脂糖凝胶电泳后转移到尼龙膜上固定。用PCR-DIG探针标记试剂盒制备地高辛标记的NPT II探针片段,然后进行杂交、显影和定影[26]。用华越洋生物超快型植物RNA提取试剂盒提取转WUBE1基因单拷贝植株叶片总RNA。用M-MLV逆转录酶进行第一链cDNA的合成,具体步骤参照试剂说明书。以烟草β-actin为内参基因(表 1),用实时荧光定量PCR (qPCR)检测外源基因在不同转基因植株中的表达情况[27]。
| 表 1 用于检测的引物和PCR反应程序 Table 1 Primers and PCR procedure used in this study |
转基因烟草的花粉生活力和发芽率测定 将花粉均匀涂在1%琼脂+0.01%硼酸+10%蔗糖的培养基上,置于25℃~30℃培养箱中培养6 h,在显微镜下观察记录花粉生活力和发芽率。每个处理重复3次,每个重复观察3个视野,每个视野不少于30粒花粉。
转基因烟草授粉受精过程的观察 参照陶书田等[28]和史公军等[29]的方法并略作修改。以野生型自交和转WUBE1基因烟草自交及异交授粉后不同时间的雌蕊(柱头、花柱和子房)为材料,分别在授粉后1、2、3、4、5和6 d采集发育正常的雌蕊,用卡诺氏固定液I (无水酒精:冰醋酸=3:1)固定12~24 h,固定液中的酒精逐级下行过渡到蒸馏水为止。雌蕊纵切后用4% NaOH溶液软化透明,用蒸馏水洗净,置于载玻片上,0.1%苯胺蓝染液染色30 min,盖上盖玻片。在荧光显微镜(OLYMPUS BH2-RFCA,日本)下观察,用数码显微照相系统(OLYMPUS DP70,日本)进行拍照。
转基因烟草果荚中的种子数量 选取转基因烟草植株进行自花授粉和异花授粉(转WUBE1基因烟草×野生型烟草),以野生型烟草自花授粉为对照,种子成熟后,选取相同数量且大小一致的烟草果荚,分别统计单个果荚中的种子数量。
2 结果和分析 2.1 转WUBE1基因烟草的分子检测利用根癌农杆菌介导法将含有WUBE1基因的植物表达载体转化烟草,经过浸染、共培养、抗性筛选和生根培养,获得了132株抗卡那霉素(KanR)植株。用NPT II、35S、WUBE1和ChvA (农杆菌结合蛋白基因)引物对KanR植株进行PCR检测,有103株KanR植株扩增出的特异条带与阳性对照扩增出的特异条带一致,且没有农杆菌污染,而非转基因的烟草植株则没有特异性条带出现(图 1)。这初步表明外源基因UBE1已整合到烟草基因组中。
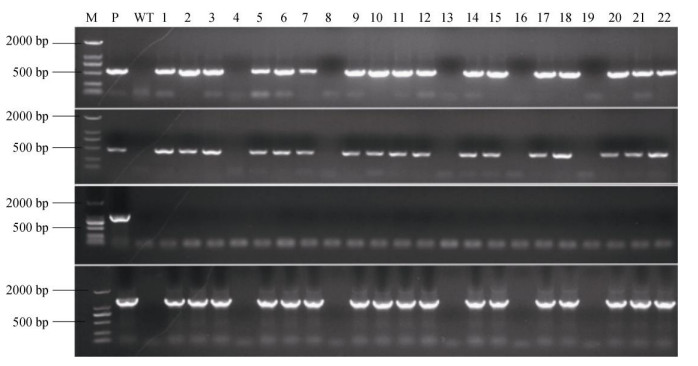
|
图 1 烟草植株的PCR检测。M: DL Marker 2000; P:阳性对照; WT:野生型; 1~22:转WUBE1基因抗性植株; A: NPT II引物; B: 35S引物; C: ChvA引物; D: WUBE1引物。 Fig. 1 PCR analyses of tobacco. M: DL Marker 2000; P: Positive control; WT: Wild type; 1-22: KanR transgenic plantlets with WUBE1; A: NPT II primer; B: 35S primer; C: ChvA primer; D: WUBE1 primer. |
对PCR鉴定结果进一步验证,阳性植株以DIG标记的NPT II基因为探针进行Southern杂交。结果表明,外源基因WUBE1以1~3个拷贝整合到烟草基因组中(图 2)。这说明外源基因WUBE1已成功整合到烟草基因组中。
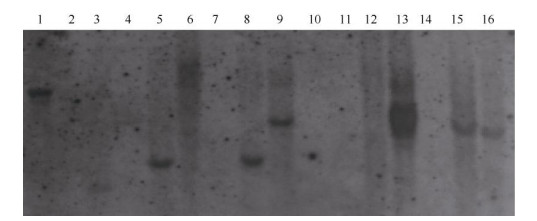
|
图 2 转WUBE1基因烟草植株的Southern杂交结果 Fig. 2 Southern blots of transgenic tobacco with WUBE1 |
分别提取转WUBE1基因烟草单拷贝植株和野生型植株叶片的RNA,并反转录合成cDNA第一链。以烟草β-actin为内参基因,用qPCR检测转基因烟草和野生型烟草叶片中外源WUBE1基因的相对表达量。由图 3可知,WUBE1在转基因烟草植株叶片中都有表达,而在野生型烟草中没有表达。
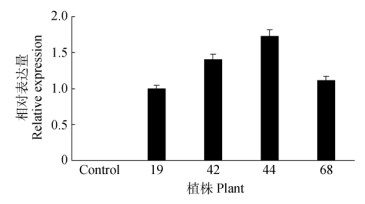
|
图 3 WUBE1基因在转基因烟草植株叶片中的表达 Fig. 3 Expression of WUBE1in leaves of transgenic tobacco |
结果表明,转WUBE1基因烟草和野生型烟草的花粉均可以正常萌发且有活力。转WUBE1烟草的花粉生活力和发芽率分别为82.6%和69.1%, 与野生型烟草的花粉生活力和发芽率无显著差异(表 2)。
| 表 2 野生型和转WUBE1基因烟草的花粉生活力和发芽率 Table 2 Viability and germination rate of pollen in transgenic WUBE1 and WT tobacco |
在荧光显微镜下,野生型烟草自交、转基因烟草自交和转基因烟草×野生型烟草异交授粉后花粉粒呈金黄色,花粉管与染色剂反应发出绿色荧光, 可见花粉管先端的精核和营养核亮点。授粉1 d后,自交和异交的花粉粒均已萌发,部分花粉管通过柱头乳突细胞间隙进入柱头(图 4: A1~C1);授粉2 d后,自交和异交的花粉粒都大量萌发,且大部分的花粉管都已进入花柱(图 4: A2~C2);授粉3 d后, 花粉管在花柱中不断伸长,且部分花粉管开始盘绕卷曲(图 4: A3~C3);授粉4 d后,不论是自交还是异交授粉,部分花粉管出现盘绕卷曲生长(图 4: A4~ C4);授粉5 d后花粉管到达花柱基部(图 4: A5~C5),但转WUBE1基因的自交授粉组合到达花柱基部的花粉管数量少于异交授粉和野生型自交组合,且部分花粉管出现停止生长的现象(图 4: B5);授粉6 d后,自交与异交的花粉管均已进入子房(图 4: A6~ C6)。由此可见,转WUBE1基因烟草自交和异交的花粉管都能完成授粉受精。
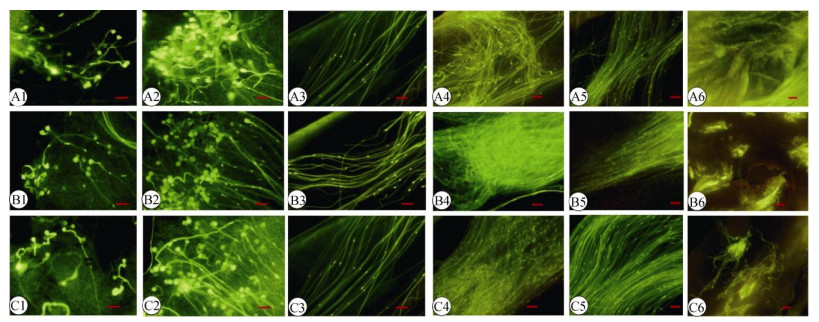
|
图 4 转WUBE1基因烟草授粉受精过程观察。A:野生型自交; B:转基因烟草自交; C:转基因烟草×野生型烟草。标尺=100 µm Fig. 4 Pollination and fertilization of transgenic tobacco with WUBE1. A: WT×WT; B: Transgenic tobacco×transgenic tobacco; C: Transgenic tobacco×WT. Bars=100 µm |
由图 5可知,转WUBE1基因烟草自交和异交授粉后平均每个成熟果荚中的种子数与野生型烟草相比,无显著差异。
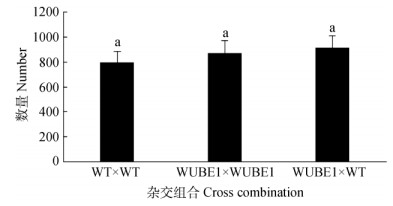
|
图 5 烟草成熟果荚中的种子数量 Fig. 5 Seed number per pod of tobacco |
UBE1是蛋白泛素化所需的第1个酶,在Ub/26S途径中发挥重要作用。UBE1具有1个保守的与泛素结合的Cys位点,同时还有1个保守的核苷酸结合位点,可以与ATP或AMP-Ub结合。UBE1的活性很高,在细胞中只要很低的浓度就可以激活泛素,通过水解ATP来获取能量,并通过其活性位置半胱氨酸残基与泛素的羧基末端形成高能硫酯键而激活泛素途径,然后UBE1将泛素转移到UBE2的丝氨酸残基上。最后,通过UBE3识别底物蛋白,泛素甘氨酸与底物蛋白质赖氨酸残基的ε-氨基酸形成异肽键, 将目标蛋白泛素化和降解[2, 4, 30]。Ub/26S途径是导致植物自交不亲和的重要途径, 其中UBE1、UBE2和UBE3会共同作用,通过调控信号传导元件泛素化并降解一些特异蛋白质如S- RNase,从而抑制花粉管的生长与延伸[16-18]。在配子体自交不亲和反应中,SLF是花粉S决定因子, 它含有1个F-box结构域,F-box蛋白是SCF E3复合体的底物识别蛋白[31]。在金鱼草(Antirrhinum majus)的异交授粉中,AhSLF-S2与Skp、Cullin-1ike蛋白结合,形成了SCF复合体,SCF AhSLF-S2这个具有UBE3活性的复合体会与非我S-RNases非特异性地结合,使S-RNases被泛素化,最后通过Ub/26S途径将S-RNase降解,花粉管得以继续生长[18]。在矮牵牛(Petunia inflata)中,所有的SLF都会直接或间接识别所有的非自我S-RNase,协助非自我S- RNase的聚泛素化,进而降解[32]。在孢子体自交不亲和反应中,单亚基的RING UBE3 ARC1 (arm repeat containing 1)是正向调控因子主要参与者之一。ARC1的下调会使部分自交不亲和信号的转导受到阻碍。自花授粉时, SRK会被SCR/SP11磷酸化,磷酸化的SRK激酶域使ARC1磷酸化,最后磷酸化的ARC1会与Exo70A1蛋白结合,并通过U-box结构与同源UBE2作用, 使底物泛素化,进而导致自交不亲和反应的发生[33]。这些研究表明,Ub/26S途径中的UBE2和UBE3参与了调控植物自交不亲和反应。UBE1作为Ub/26S途径的第1个参与酶,其在植物的自交不亲和反应中的作用尚不清楚。
本课题组的前期研究结果表明,UBE1很可能参与了无籽沙糖桔的自交不亲和反应[24]。本研究通过根癌农杆菌介导法将来源于自交不亲和无籽沙糖桔的WUBE1基因转化烟草,获得了转WUBE1基因烟草植株,经PCR、Southern和qPCR检测表明,外源基因WUBE1已整合到烟草基因组中并得到表达。对转WUBE1基因烟草授粉受精过程的观察表明,转WUBE1基因烟草自交花粉管在花柱延伸的过程中,部分花粉管停止伸长生长,这与酵母表达试验中的结果一致[24]。但转WUBE1基因烟草自交和异交的花粉管均能完成授粉受精,且平均每个成熟果荚中的种子数与野生型烟草无显著差异。这些研究结果表明,单独的WUBE1基因不能调控无籽沙糖桔自交不亲和反应,它很可能通过Ub/26S途径中的UBE2和UBE共同作用参与了无籽沙糖桔自交不亲和反应。
| [1] |
SHARMA B, JOSHI D, YADAV P K, et al. Role of ubiquitin-mediated degradation system in plant biology[J]. Front Plant Sci, 2016, 7: 806. DOI:10.3389/fpls.2016.00806 |
| [2] |
MORREALE F E, WALDEN H. Types of ubiquitin ligases[J]. Cell, 2016, 165(1): 248-248. DOI:10.1016/j.cell.2016.03.003 |
| [3] |
ISONO E, NAGEL M K. Deubiquitylating enzymes and their emerging role in plant biology[J]. Front Plant Sci, 2014, 5: 56. DOI:10.3389/fpls.2014.00056 |
| [4] |
VIERSTRA R D. The ubiquitin-26S proteasome system at the nexus of plant biology[J]. Nat Rev Mol Cell Biol, 2009, 10(6): 385-397. DOI:10.1038/nrm2688 |
| [5] |
MOON J, PARRY G, ESTELLE M. The ubiquitin-proteasome pathway and plant development[J]. Plant Cell, 2004, 16(12): 3181-3195. DOI:10.1105/tpc.104.161220 |
| [6] |
YU F F, WU Y R, XIE Q. Ubiquitin-proteasome system in ABA signaling:From perception to action[J]. Mol Plant, 2016, 9(1): 21-33. DOI:10.1016/j.molp.2015.09.015 |
| [7] |
KELLEY D R. E3 ubiquitin ligases:Key regulators of hormone signaling in plants[J]. Mol Cell Proteom, 2018, 17(6): 1047-1054. DOI:10.1074/mcp.MR117.000476 |
| [8] |
CUI X, LU F L, LI Y, et al. Ubiquitin-specific proteases UBP12 and UBP13 act in circadian clock and photoperiodic flowering regulation in Arabidopsis[J]. Plant Physiol, 2013, 162(2): 897-906. DOI:10.1104/pp.112.213009 |
| [9] |
FANG H M, MENG Q L, XU J W, et al. Knock-down of stress inducible OsSRFP1 encoding an E3 ubiquitin ligase with transcriptional activation activity confers abiotic stress tolerance through enhancing antioxidant protection in rice[J]. Plant Mol Biol, 2015, 87(4/5): 441-458. DOI:10.1007/s11103-015-0294-1 |
| [10] |
BAHMANI R, KIM D, LEE B D, et al. Over-expression of tobacco UBC1 encoding a ubiquitin-conjugating enzyme increases cadmium tolerance by activating the 20S/26S proteasome and by decreasing Cd accumulation and oxidative stress in tobacco (Nicotiana tabacum)[J]. Plant Mol Biol, 2017, 94(4/5): 433-451. DOI:10.1007/s11103-017-0616-6 |
| [11] |
HE Q, McLELLAN H, BOEVINK P C, et al. U-box E3 ubiquitin ligase PUB17 acts in the nucleus to promote specific immune pathways triggered by Phytophthora infestans[J]. J Exp Bot, 2015, 66(11): 3189-3199. DOI:10.1093/jxb/erv128 |
| [12] |
MILLYARD L, LEE J, ZHANG C J, et al. The ubiquitin conjugating enzyme, TaU4 regulates wheat defence against the phytopathogen Zymoseptoria tritici[J]. Sci Rep, 2016, 6: 35683. DOI:10.1038/srep35683 |
| [13] |
XU X S, PAIK I, ZHU L, et al. Phytochrome interacting factor1 enhances the E3 ligase activity of constitutive photomorphogenic1 to synergistically repress photomorphogenesis in Arabidopsis[J]. Plant Cell, 2014, 26(5): 1992-2006. DOI:10.1105/tpc.114.125591 |
| [14] |
CHANG L C, GUO C L, LIN Y S, et al. Pollen-specific SKP1-like proteins are components of functional SCF complexes and essential for lily pollen tube elongation[J]. Plant Cell Physiol, 2009, 50(8): 1558-1572. DOI:10.1093/pcp/pcp100 |
| [15] |
DOUCET J, LEE H K, GORING D R. Pollen acceptance or rejection:A tale of two pathways[J]. Trends Plant Sci, 2016, 21(12): 1058-1067. DOI:10.1016/j.tplants.2016.09.004 |
| [16] |
SUN P L, LI S, LU D H, et al. Pollen S-locus F-box proteins of Petunia involved in S-RNase-based self-incompatibility are themselves subject to ubiquitin-mediated degradation[J]. Plant J, 2015, 83(2): 213-223. DOI:10.1111/tpj.12880 |
| [17] |
STONE S L, ANDERSON E M, MULLEN R T, et al. ARC1 is an E3 ubiquitin ligase and promotes the ubiquitination of proteins during the rejection of self-incompatible Brassica pollen[J]. Plant Cell, 2003, 15(4): 885-898. DOI:10.1105/tpc.009845 |
| [18] |
QIAO H, WANG H Y, ZHAO L, et al. The F-box protein AhSLF-S2 physically interacts with S-RNases that may be inhibited by the ubiquitin/26S proteasome pathway of protein degradation during compatible pollination in Antirrhinum[J]. Plant Cell, 2004, 16(3): 582-595. DOI:10.1105/tpc.017673 |
| [19] |
ZHANG N, LIU J H, JIA C H, et al. The interaction of banana MADS-box protein MuMADS1 and ubiquitin-activating enzyme EMuUBA in post-harvest banana fruit[J]. Chin J Trop Crops, 2014, 35(2): 307-312. 张妮, 刘菊华, 贾彩红, 等. 香蕉MuMADS1与泛素激活酶(MuUBA)在采后果实中的相互作用[J]. 热带作物学报, 2014, 35(2): 307-312. DOI:10.3969/j.issn.1000-2561.2014.02.016 |
| [20] |
JUE D W, SANG X L, SHU B, et al. Expression pattern analysis of an ubiquitin-activating enzyme gene CpUBA1 in Carica papaya[J]. Guangdong Agric Sci, 2017, 44(11): 20-25. 决登伟, 桑雪莲, 舒波, 等. 番木瓜泛素活化酶基因CpUBA1的表达模式分析[J]. 广东农业科学, 2017, 44(11): 20-25. DOI:10.16768/j.issn.1004-874X.2017.11.004 |
| [21] |
LI X, ZHANG S S, MA J X, et al. TaUBA, a UBA domain-containing protein in wheat (Triticum aestivum L.), is a negative regulator of salt and drought stress response in transgenic Arabidopsis[J]. Plant Cell Rep, 2015, 34(5): 755-766. DOI:10.1007/s00299-015-1739-3 |
| [22] |
YE Z X, ZENG T, XU J K, et al. Wuzishatangju, a new mandarin cultivar[J]. J Fruit Sci, 2006, 23(1): 149-150. 叶自行, 曾泰, 许建楷, 等. 无子沙糖橘(十月橘)的选育[J]. 果树学报, 2006, 23(1): 149-150. DOI:10.3969/j.issn.1009-9980.2006.01.037 |
| [23] |
YE W J, QIN Y H, YE Z X, et al. Seedless mechanism of a new mandarin cultivar 'Wuzishatangju' (Citrus reticulata Blanco)[J]. Plant Sci, 2009, 177(1): 19-27. DOI:10.1016/j.plantsci.2009.03.005 |
| [24] |
MIAO H X, QIN Y H, YE Z X, et al. Molecular characterization and expression analysis of ubiquitin-activating enzyme E1 gene in Citrus reticulata[J]. Gene, 2013, 513(2): 249-259. DOI:10.1016/j.gene.2012.10.056 |
| [25] |
QIN Y H, HU G B. Experimental Guidance of Biotechnology for Horticultural Plants[M]. 2nd ed. Beijing: Chinese Agricultural Press, 2016: 51-53, 82-84. 秦永华, 胡桂兵. 园艺植物生物技术实验指导[M]. 第2版.北京: 中国农业出版社, 2016: 51-53, 82-84. |
| [26] |
MIAO H X, QIN Y H, DA SILVA J A T, et al. Cloning and expression analysis of S-RNase homologous gene in Citrus reticulata Blanco cv. Wuzishatangju[J]. Plant Sci, 2011, 180(2): 358-367. DOI:10.1016/j.plantsci.2010.10.012 |
| [27] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [28] |
TAO S T, ZHANG S L, CHEN D X, et al. Study on characteristics of in situ pollen germination and tube growth of Prunus mume[J]. J Fruit Sci, 2004, 21(4): 338-340. 陶书田, 张绍铃, 陈迪新, 等. 果梅花粉原位萌发及花粉管生长特性的研究[J]. 果树学报, 2004, 21(4): 338-340. DOI:10.3969/j.issn.1009-9980.2004.04.014 |
| [29] |
SHI G J, HOU X L. Measurement of self-incompatible by fluoroscope observation in non-heading Chinese cabbage[J]. J Wuhan Bot Res, 2004, 22(3): 197-200. 史公军, 侯喜林. 白菜自交不亲和性的荧光测定[J]. 武汉植物学研究, 2004, 22(3): 197-200. DOI:10.3969/j.issn.2095-0837.2004.03.003 |
| [30] |
SMALLE J, VIERSTRA R D. The ubiquitin 26S proteasome proteolytic pathway[J]. Annu Rev Plant Biol, 2004, 55: 555-590. DOI:10.1146/annurev.arplant.55.031903.141801 |
| [31] |
HUA Z H, VIERSTRA R D. The cullin-RING ubiquitin-protein ligases[J]. Annu Rev Plant Biol, 2011, 62: 299-334. DOI:10.1146/annurev-arplant-042809-112256 |
| [32] |
KUBO K I, ENTANI T, TAKARA A, et al. Collaborative non-self recognition system in S-RNase-based self-incompatibility[J]. Science, 2010, 330(6005): 796-799. DOI:10.1126/science.1195243 |
| [33] |
INDRIOLO E, GORING D R. A conserved role for the ARC1 E3 ligase in Brassicaceae self-incompatibility[J]. Front Plant Sci, 2014, 5: 181. DOI:10.3389/fpls.2014.00181 |
 2019, Vol. 27
2019, Vol. 27


