2. 国际竹藤中心竹藤资源基因科学研究所, 北京 100102;
3. 国际竹藤中心热带森林植物研究所, 海南 三亚 572000;
4. 河北省唐山市迁西县林业局, 河北 唐山 064300
2. Institute of Gene Science for Bamboo and Rattan Resources, International Center for Bamboo and Rattan(ICBR), Beijing 100102, China;
3. Institute of Tropical Forest Plant, ICBR, Sanya 572000, Hainan, China;
4. Qianxi County Forestry Bureau, Tangshan 064300, Hebei, China
染色体是在细胞周期的分裂中期形成的高度缢缩的结构,是遗传信息的载体。每种植物的体细胞都具有一定的染色体,其臂长、臂比、染色体长度比、着丝粒位置等特征各具特点,是区分不同物种的便捷形象表征,单个细胞中染色体数量与结构特征即核型[1]。植物体细胞的核型分析是一种通过观察染色体的数目、大小以及形态来分析染色体类型的技术方法。在核型分析中,主要是以染色体全长、着丝粒位置、臂长和随体等为依据[2]。核型分析技术为生物基因组学提供了系统直观的基础资料,对研究物种的遗传、变异、起源以及进化具有重要意义,对于植物系统分类和品种改良的育种实践具有重要意义。流式细胞术是一种对液流中排成单列的细胞或其它生物微粒逐个进行快速定量分析和分选的技术[3],被广泛应用于临床医学[4]、细胞生物学[5]、微生物学[6]、遗传学等领域,也被广泛应用于基因组大小的测定。研究物种的基因组大小可为基因组分析提供重要的参考依据。
棕榈藤为棕榈科(Palmae)省藤亚科(Calamoideae)省藤族(Calameae)植物,是热带森林的重要植物类群,全世界共有13属,约600种,主要分布在亚洲、非洲、大洋洲等热带地区[7]。在我国,棕榈藤主要集中分布在热带、南亚热带地区,约有3属40种21变种[8]。棕榈藤藤茎的强度、韧性、弹性以及易于造型等优良工艺特性,使其成为编制工业的优良材料,原藤是仅次于木材和竹材的重要林产品[9], 其开发利用已成为林业领域研究的热点之一。目前,我国的棕榈藤工业以传统编织为主,技术水平较高,但我国的藤资源短缺,大部分依靠进口。由于原藤进口价格的昂贵,如何更好的培育原藤资源,合理开发利用棕榈藤资源成为我国棕榈藤业发展的重要问题。为更好地开发利用棕榈藤资源,实现遗传改良,首先要了解其细胞学和遗传信息,然而对棕榈藤细胞学和遗传学的研究报道却寥寥无几。报道主要集中于省藤属(Calamus)植物[10-13], 如小省藤(C. gracilis)、盈江省藤(C. nambariensis var. yingjiangensis)、宽刺藤(C. platyacanthus)、高地省藤(C. nambariensis var. alpinus)。省藤属植物体细胞染色体数均为2n=26[10],泽生藤(C. palustris)的体细胞染色体数为2n=28[11]。黄藤(Daemonorops jenkinsiana)为棕榈科鳞果亚科(Lepidocaryoideae)省藤族(Calameae)黄藤属植物,是我国棕榈科单属单种植物[14],藤茎质地柔韧,抗拉强度高,具有良好的工艺特性,适于编制和家具制作;藤笋富含维生素、氨基酸和矿物质,是良好的蔬菜;藤种质地坚硬,可用于制作“佛珠”[15];黄藤果实具有较高的药用价值,可用于提取血竭,血竭具有活血化瘀、收敛止血、消肿止痛、补血益气等功效[16]。因此,黄藤是具较高经济价值和开发前景的多用途珍贵森林植物[17]。然而,黄藤的核型和基因组大小尚未见报道。对黄藤进行核型分析以及基因组大小的测定,将为研究黄藤的遗传变异和起源进化提供参考依据,对于黄藤的基因组分析、种质资源利用以及品种改良的育种实践具有重要意义。
1 材料和方法 1.1 材料从海南三亚甘什岭天然林林下(109°40′18.76″ E,18°23′06.56″ N,海拔261 m)挖取黄藤(Daemonorops jenkinsiana)实生苗(1年生)带回实验室, 在人工气候室内盆栽培养(26℃,光照强度200 μmol m-2s-1, 光/暗=16 h/8 h)。选择生长状况良好的藤苗,取根尖和茎尖为核型分析的试验材料,同时取叶片用于基因组大小分析,以番茄(Lycopersicon esculentum)叶片作为参比。
1.2 药品、耗材和仪器药品和耗材:2 mmol L-1 8-羟基喹啉、FAA固定液(无水乙醇:冰醋酸=3:1体积比)、1 mol L-1 HCl、改良苯酚品红溶液、碘化丙啶(PI)染色液、WPB裂解液、纤维素酶、果胶酶、载玻片、盖玻片、镊子、刀片、解剖针、滤纸、300目滤网、培养皿等。
仪器:Zeiss Axio Scope A1荧光显微镜以及配套的ProgRes CapturePro成像系统、Adobe Photoshop cc 2017图片处理软件、ImageJ测量软件、VIDEO-TEST-KYRYO 3.1核型分析软件、BD FACSCalibur流式细胞仪、离心机等。
1.3 染色体制片取黄藤的根尖或茎尖(长约0.5 cm),用蒸馏水冲洗干净,用2 mmol L-1 8-羟基喹啉预处理1 h; 将预处理后的黄藤根尖或茎尖用卡诺固定液(无水乙醇:冰醋酸=1:3, V/V)在4℃冰箱中固定5~24 h; 用1 mol L-1 HCl在60℃水浴锅中解离15 min,之后加入2%纤维素酶和1%果胶酶的混合酶液,在37℃水浴锅中解离2 h;用改良苯酚品红溶液染色10~15 min并进行压片;使用Zeiss Axio Scope A1荧光显微镜进行镜检,挑选染色体分散良好的细胞进行拍照。
1.4 染色体核型分析将具有完整细胞轮廓,且染色体分散良好的细胞用ProgRes CapturePro软件进行图像采集。根据一般统计要求,选择30个染色体分散良好的有丝分裂中期细胞进行观察,统计具有一致染色体数目的细胞,把85%以上细胞都具有的染色体数目定为该植物的染色体数目。另外,选取5个染色体形态清晰且无重叠的细胞,使用Adobe Photoshop cc 2017进行图片修整,利用VIDEOTEST- KYRYO 3.1核型分析软件对染色体进行分析,将染色体以着丝粒位置为基准拉直,并进行同源染色体匹配。将分析后的染色体核型图片放到ImageJ测量软件中对染色体的长度进行测量。参照李懋学等[18]的标准进行核型分析,用Leven[19]的公式进行染色体的相对长度的计算;按郭幸荣等[20]提出的染色体长度分类方法,对黄藤细胞染色体的相对长度系数(染色体长度/全组染色体平均长度)进行统计并分类;核型类型参照Stebbins[21]的标准,按核型中染色体长度比(最长染色体与最短染色体之比)以及臂比(r=长臂/短臂)大于2的染色体所占比例进行划分;采用Arano[22]的方法计算核不对称系数(As.K=长臂总长/全组染色体总长×100%)。
1.5 流式细胞仪样品制备和分析取黄藤实生苗叶片(约1.5 cm)洗净,放入培养皿中,加入800 μL裂解液浸泡30 min;用刀片将叶片切碎后补加800 μL裂解液,轻轻摇匀混合;用300目滤网过滤到10 mL玻璃管中,于4℃下129×g离心8 min;弃上清后加入300 μL的碘化丙啶(PI)染液在4℃下染色20 min;使用流式细胞仪(Beckman Coulter, Inc., Cell Lab Quanta SC)进行测量,样品变异系数控制在5%以内,设置3个重复。
已知番茄2C DNA含量为0.92 pg[23](1 pg=978 Mb), 并根据公式[24]计算黄藤的2C DNA含量= [(样品G1平均峰值)/(番茄G1平均峰值)]×番茄2C DNA含量(pg)。
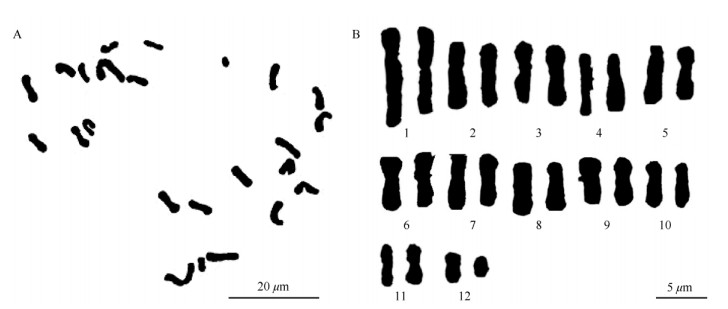
2 结果和分析 2.1 染色体数目将黄藤茎尖和根尖的染色体制片在显微镜下镜检,由茎尖细胞制片可观测到大量的细胞,且容易找到处于有丝分裂中期、染色体分散良好的细胞进行图像采集,而根尖制片效果较差。因此,以黄藤茎尖制片进行统计测量。根据核型分析标准化建议择优挑选出30个具有完整中期分裂相的细胞,进行细胞染色体数目统计。结果表明,有26个细胞的染色体数目为24,因此黄藤的染色体数目为2n=24 (图 1)。
|
图 1 黄藤染色体图。A:中期染色体; B:核型。 Fig. 1 Chromosome of Daemonorops jenkinsiana. A: Metaphase chromosome; B: Karotype. |
选择5个染色体形态清晰无重叠的细胞,进行染色体核型参数的测量计算。结果表明,染色体的相对长度为1.554%~7.683%,其中短臂相对长度为0.586%~3.143%,长臂相对长度为0.968%~4.540%;相对长度系数为0.373 03~1.843 89 (表 1)。根据染色体相对长度系数对染色体进行分类,黄藤的长染色体(L)有2条,中长染色体(M2)有9条,中短染色体(M1)有10条,短染色体(S)有3条;黄藤染色体的长度比是1.55%;臂比为1~3.217,黄藤染色体的着丝粒位置为m型的有17条,st型的有1条,sm型的有5条,M型的有1条。黄藤染色体中有20.83%的臂比大于2,最长与最短染色体比值为4.94。因此, 黄藤的核型为“2C”型,其核不对称系数为61.20%。
| 表 1 黄藤染色体核型 Table 1 Karyotype of Daemonorops jenkinsiana |
使用Excel软件根据染色体相对长度[25]作图, 得到黄藤染色体核型模式图(图 2)。

|
图 2 黄藤染色体核型模式图 Fig. 2 Karotype idiogram of Daemonorops jenkinsiana |
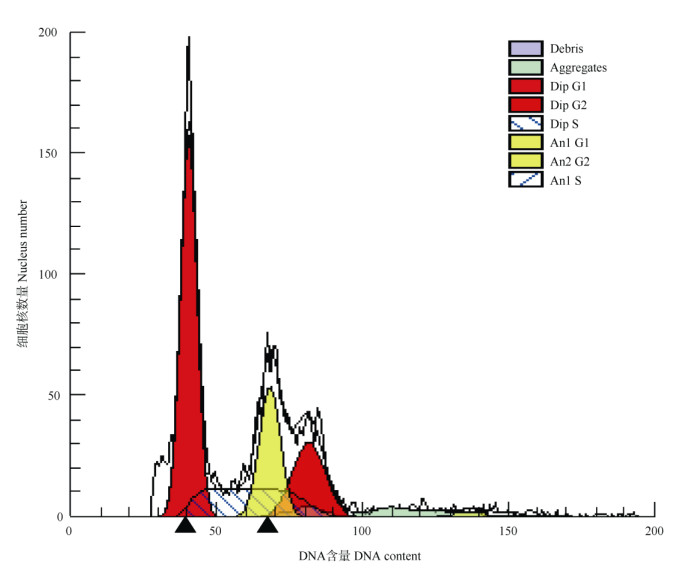
以番茄为内标,应用流式细胞术分析黄藤的DNA相对含量。结果表明,碘化丙啶(PI)着色后检测到的G1期细胞的荧光分布呈高斯曲线分布,其中红色为对照番茄的峰值出现在约41.01位置, 黄藤的则出现在约68.67的位置;G2期拥有2倍G1期细胞的DNA含量,呈现2倍于G1信号的高斯峰(Dip G2, An1 G2) (图 3)。
|
图 3 以番茄为内标测定黄藤的流式细胞图。番茄: Dip G1、Dip G2和Dip S; 黄藤: An1 G1、An1 G2和An1 S; ▲: G1期的峰值。 Fig. 3 Flow cytometry diagram of Daemonorops jenkinsiana using Lycopersicon esculentum as internal reference. L. esculentum: Dip G1, Dip G2 and Dip S; L. jenkinsiana: An1 G1, An1 G2 and An1; ▲: Peaks at G1 phase. |
根据已知番茄的DNA含量,估算出黄藤的DNA含量为1.57 pg,黄藤为二倍体植物(2n= 24),按照1 pg=978 Mb,黄藤的基因组大小约为1 539.53 Mb。
3 讨论细胞染色体制片受很多因素的影响,合适的试验取材是非常重要的一个因素。一般认为植物茎尖细胞生长旺盛,叶绿素含量较多,不适宜用于观察染色体,因此多选用植物的根尖分生区进行染色体观察。腰希申等[26]的研究表明,黄藤茎尖可长期保持分生能力,因此本试验同时选择黄藤的根尖和茎尖作为试验材料进行核型分析。解离可去除细胞间的果胶层,使细胞壁软化,便于压片[27],本试验对茎尖和根尖采用酸解法、酶解法和先酸解后酶解法等分别处理后进行镜检比较,结果表明使用先酸解后酶解的解离方法对黄藤茎尖的效果最好,能够得到更多良好的染色体图像,同时茎尖的制片效果优于根尖。这可能是因为黄藤茎尖是包被在多层叶片内部,比较幼嫩且叶绿素含量较低,而黄藤实生苗的根数量较少,且主根分支较少,根尖相对老化所致。
染色体是细胞核中遗传物质的载体,通常是在细胞周期的分裂中期形成的高度集缩的结构,染色体是不同物种基因组最简单明了的形象表现。本试验结果表明,黄藤具有24条染色体,核型为“2C”型,核不对称系数为61.02%,核型公式为K(2n)= 1M+17m+5sm+1st。这是首次对黄藤进行核型分析,为黄藤属植物的起源进化研究以及物种分类提供了理论依据。
基因组大小是指1个基因组中所拥有的DNA的含量,是一个物种所特有的遗传学参数,其与物种分类和进化位置具有一定关系,一般认为植物进化程度越高,其基因组越大[28]。随着流式细胞术的不断发展,已经在基因组大小测定方面有着非常广泛的应用[29]。本试验参考田新民等[30]的方法选择番茄为参照,在流式细胞样品的制备过程中,选择木本植物缓冲液WPB解离液[31]提取黄藤细胞核,选择具有较高的分辨率及较低的毒性的PI染料[24]进行染色,结果黄藤的基因组大小为1.57 pg。有报道黄藤属D. verticillaris的基因组大小4C DNA为11.10 pg[32],这可能与采用的方法和物种倍性不同有关。
随着物种的不断繁衍进化,杂交、多倍体及无融合生殖,使原本可以识别的类群之间的界限变的模糊不清,形成多倍体复合体,给分类学处理带来了极大的困难[33],分子水平与细胞水平研究的结合是生命科学发展趋势所向。染色体核型分析作为一项融合细胞生物学、遗传学、染色体工程学等多学科的基础实验技术,对植物进行核型分析、构建染色体图谱、植物亲缘关系鉴定以及起源进化研究具有重要意义,可以为植物系统分类提供重要依据。棕榈藤是热带森林中的多用途植物资源,黄藤是具有较高经济价值和开发前景的藤种之一,本研究测定黄藤为二倍体,基因组大小约为1 539.53 Mb。黄藤的倍性与基因组大小对于更为深入地开展细胞生物以及分子生物研究将具有极大的促进作用,同时也为开展其它棕榈藤的研究提供了一定的参考依据。
| [1] |
DENG K J, QU Z C, SHEN D L. Advances in plant chromosome image analysis[J]. J Cell Biol, 1995, 17(2): 80-82. 邓可京, 曲志才, 沈大棱. 植物染色体图象分析的现状与展望[J]. 细胞生物学杂志, 1995, 17(2): 80-82. |
| [2] |
TU C X. Introduction of a new method for plant chromosome staining[J]. Chin J Cell Biol, 1985, 7(1): 33-34, 31. 涂传馨. 介绍一种新的植物染色体染色的方法[J]. 细胞生物学杂志, 1985, 7(1): 33-34, 31. |
| [3] |
WEI X Y, NIU R F. The development history, mechanism and appli-cation of flow cytometer[J]. Mod Instr, 2006, 12(4): 8-11. 魏熙胤, 牛瑞芳. 流式细胞仪的发展历史及其原理和应用进展[J]. 现代仪器, 2006, 12(4): 8-11. DOI:10.3969/j.issn.1672-7916.2006.04.003 |
| [4] |
ZHOU L, GAO C F, ZHONG R Q. Progress in the application of flow cytometry in clinical medicine[J]. Lab Med, 2007, 22(3): 225-229. 周琳, 高春芳, 仲人前. 流式细胞术在临床医学领域的应用进展[J]. 检验医学, 2007, 22(3): 225-229. DOI:10.3969/j.issn.1673-8640.2007.03.002 |
| [5] |
LIU H, ZHANG L X. Application of flow cytometry in the experimental teaching reform of cytobiology course[J]. J Anhui Agric Sci, 2012, 40(11): 6958-6959. 刘华, 张林西. 流式细胞仪在细胞生物学实验教学改革中的应用[J]. 安徽农业科学, 2012, 40(11): 6958-6959. DOI:10.3969/j.issn.0517-6611.2012.11.222 |
| [6] |
YANG H D, ZHANG C J, LI X Y, et al. The application of flow cytometry in the microbiology[J]. Med Recapitulate, 2006, 12(13): 825-827. 杨怀德, 张才军, 李秀义, 等. 流式细胞术在微生物学中的应用[J]. 医学综述, 2006, 12(13): 825-827. DOI:10.3969/j.issn.1006-2084.2006.13.026 |
| [7] |
LI R S, XU H C, YIN G T, et al. Rattan resources, production and its prospect in the world[J]. World Bamboo Rattan, 2003, 1(1): 1-5. 李荣生, 许煌灿, 尹光天, 等. 世界棕榈藤资源、产业及其前景展望[J]. 世界竹藤通讯, 2003, 1(1): 1-5. DOI:10.3969/j.issn.1672-0431.2003.01.001 |
| [8] |
XU H C, YIN G T, LI Y D, et al. The natural distribution and utilization of rattan resources in China[J]. For Res, 1993, 6(4): 380-389. 许煌灿, 尹光天, 李意德, 等. 我国棕榈藤天然分布及其利用研究[J]. 林业科学研究, 1993, 6(4): 380-389. DOI:10.13275/j.cnki.lykxyj.1993.04.005 |
| [9] |
KOU L. Relationship of growth dynamics between root system and aboveground part of Daemonorops margaritae[D]. Beijing: Chinese Academy of Forestry, 2012: 1-52. 寇亮.黄藤根系与地上部分生长动态关系的研究[D].北京: 中国林业科学研究院, 2012: 1-52. http://cdmd.cnki.com.cn/Article/CDMD-82201-1012423577.htm |
| [10] |
WANG K L, XIE J, ZHANG T, et al. A karyological study of four species in Calamus (Palmae:Calamoideae)[J]. Acta Bot Yunnan, 2005, 27(1): 87-91. 王慷林, 谢静, 张挺, 等. 省藤属四种植物的核型分析[J]. 云南植物研究, 2005, 27(1): 87-91. DOI:10.3969/j.issn.2095-0845.2005.01.011 |
| [11] |
INDIRA E P, ANTO P V. Karyotype analysis in Calamus palustris Griff[J]. J Bamboo Rattan, 2002, 1(3): 199-203. DOI:10.1163/156915902760184268 |
| [12] |
RÖSER M. Variation and evolution of karyotype characters in palm subfamily Coryphoideae s.l.[J]. Bot Acta, 1993, 106(2): 170-182. DOI:10.1111/j.1438-8677.1993.tb00354.x |
| [13] |
SARKAR A K, DATTA N. Cytology of Calamus L. (Palmae) as an aid to their taxonomy[J]. Cell Chrom Res, 1985, 8: 69-73. |
| [14] |
YANG L S, WU Y Z. Status and tendency of rattan cane utilization[J]. World Bamboo Rattan, 2008, 6(3): 1-5. 杨丽森, 吴玉章. 棕榈藤材的利用现状及发展趋势[J]. 世界竹藤通讯, 2008, 6(3): 1-5. DOI:10.3969/j.issn.1672-0431.2008.03.001 |
| [15] |
JIANG Z H, WANG K L. Rattan in China[M]. Beijing: Science Press, 2013: 90-91. 江泽慧, 王慷林. 中国棕榈藤[M]. 北京: 科学出版社, 2013: 90-91. |
| [16] |
YANG J C, XU H C, YIN G T, et al. Medicinal value of Daemonorops[J]. Plants, 2002(3): 26. 杨锦昌, 许煌灿, 尹光天, 等. 黄藤属植物的药用价值[J]. 植物杂志, 2002(3): 26. |
| [17] |
XU H C, YIN G T, ZENG B S, et al. Research on the bio-ecological characteristics of Daemonorops margaritae[J]. For Res, 1994, 7(1): 20-26. 许煌灿, 尹光天, 曾炳山, 等. 黄藤生态生物学特性的研究[J]. 林业科学研究, 1994, 7(1): 20-26. DOI:10.3321/j.issn:1001-1498.1994.01.008 |
| [18] |
LI M X, CHEN R Y. A suggestion on the standardization of karyotype analysis in plants[J]. J Wuhan Bot Res, 1985, 3(4): 297-302. 李懋学, 陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究, 1985, 3(4): 297-302. |
| [19] |
LEVAN A, FREDGA K, SANDBERG A A. Nomenclature for centro-meric position on chromosome[J]. Hereditas, 1964, 52(2): 201-202. DOI:10.1111/j.1601-5223.1964.tb01953.x |
| [20] |
KUO S R, WANG T T, HUANG T C. Karyotype analysis of some Formosan gymnosperms[J]. Taiwania, 1972, 17(1): 66-80. |
| [21] |
STEBBINS G L. Chromosomal Evolution in Higher Plants[M]. London: Edward Arnol Ltd., 1971: 87-93.
|
| [22] |
ARANO H L. Cytological studies in subfamily Carduoideae (Com-positae) of Japan, Ⅸ. The karyotype analysis and phylogenic consi-derations on Pertya and Ainsliaea[J]. Shokubutsug Zasshi, 1963, 76(895): 32-39. DOI:10.15281/jplantres1887.76.32 |
| [23] |
The Tomato Genome Consortium. The tomato genome sequence provides insights into fleshy fruit evolution[J]. Nature, 2012, 485(7400): 635-641. DOI:10.1038/nature11119 |
| [24] |
JIN L, XU W W, LI X B, et al. Application of DNA flow cytometry to plant genetics and breeding[J]. Chin J Cell Biol, 2016, 38(2): 225-234. 金亮, 徐伟韦, 李小白, 等. DNA流式细胞术在植物遗传及育种中的应用[J]. 中国细胞生物学学报, 2016, 38(2): 225-234. DOI:10.11844/cjcb.2016.02.0308 |
| [25] |
QIAO Y G, SONG Y. Making a nuclear pattern diagram using EXCLE[J]. Agric Network Inf, 2006(10): 97-98. 乔永刚, 宋芸. 利用EXCLE制作核型模式图[J]. 农业网络信息, 2006(10): 97-98. DOI:10.3969/j.issn.1672-6251.2006.10.036 |
| [26] |
LI Y, YAO X S, XU H C, et al. The observation with E. M. of rattan[J]. Sci Silv Sin, 1998, 34(3): 173-176. 李旸, 腰希申, 许煌灿, 等. 棕榈藤的电镜观察[J]. 林业科学, 1998, 34(3): 173-176. DOI:10.3321/j.issn:1001-7488.2002.01.030 |
| [27] |
GU W, PU H D, ZHANG C Y, et al. Optimization of chromosome sectioning and karyotype analysis of Schisandra sphenanthera Rehd. et Wils[J]. Acta Bot Boreali-Occid Sin, 2008, 28(2): 262-266. 顾蔚, 卜海东, 张成艳, 等. 华中五味子染色体制片优化及核型分析[J]. 西北植物学报, 2008, 28(2): 262-266. DOI:10.3321/j.issn:1000-4025.2008.02.009 |
| [28] |
LIU J, LI K X, KONG G H, et al. Genome size and variation analysis of mango (Mangifera indica L.) germplasms in Yunnan by flow cytometry[J]. J Trop Subtro Bot, 2015, 23(4): 386-390. 柳觐, 李开雄, 孔广红, 等. 云南芒果种质基因组大小测定与变异分析[J]. 热带亚热带植物学报, 2015, 23(4): 386-390. DOI:10.11926/j.issn.1005-3395.2015.04.004 |
| [29] |
JIAO X W, ZHAO S J. Applications of flow cytometry in higher plant research[J]. J Trop Subtrop Bot, 2006, 14(4): 354-358. 焦旭雯, 赵树进. 流式细胞术在高等植物研究中的应用[J]. 热带亚热带植物学报, 2006, 14(4): 354-358. DOI:10.3969/j.issn.1005-3395.2006.04.016 |
| [30] |
GONG N, TIAN X M, ZHOU X Y, et al. Applications of flow cytometry in plant research:Analysis of nuclear DNA content and ploidy level in plant cells[J]. Chin Agric Sci Bull, 2011, 27(9): 21-27. 弓娜, 田新民, 周香艳, 等. 流式细胞术在植物学研究中的应用:检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27. |
| [31] |
WANG L H, LÜ Y, LUO Z, et al. Establishment and application of a method for chromosome ploidy identification and genome size estimation using flow cytometry in Ziziphus jujuba[J]. J Agric Biotechnol, 2018, 26(3): 511-520. 王利虎, 吕晔, 罗智, 等. 流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J]. 农业生物技术学报, 2018, 26(3): 511-520. DOI:10.3969/j.issn.1674-7968.2018.03.017 |
| [32] |
RÖSER M, JOHNSON M A T, HANSON L. Nuclear DNA amounts in palms (Arecaceae)[J]. Bot Acta, 1997, 110(1): 79-89. DOI:10.1111/j.1438-8677.1997.tb00614.x |
| [33] |
CHEN R Y, LI X L, SONG W Q, et al. Chromosome Atlas of Major Economic Plants Genome in China, Tomus Ⅳ. Chromosome Atlas of Various Bamboo Species[M]. Beijing: Science Press, 2003. 陈瑞阳, 李秀兰, 宋文琴, 等. 中国主要经济植物基因组染色体图谱, 第四册中国竹类染色体图谱[M]. 北京: 科学出版社, 2003. |
 2019, Vol. 27
2019, Vol. 27



