2. 广东省农业科学院环境园艺研究所, 广东省园林花卉种质创新综合利用实验室, 广州 510640
2. Enviromental Horticulture Research Institute, Guangdong Key Laboratory of Ornamental Plant Germplasm Innovation and Utilization, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
叶绿素是植物光合作用所必需的重要色素, 植物体叶绿素合成代谢失衡会严重影响其生长发育[1]。合成途径中原叶绿素酸酯氧化还原酶(protochloro- phyllide oxidoreductase, NADPH; POR, EC 1.3.1.33)是黄化质体膜蛋白的主要组成部分[2]。植物早期阶段的前质体在黑暗条件下形成黄化质体,光照后进一步发育形成叶绿体,在此过程中,POR催化原叶绿素酸酯生成叶绿素酸酯是唯一一步需光的反应, 只有在光下POR才能催化原叶绿素酸酯D环双键还原形成叶绿素酸酯a,POR在植物光形态建成中发挥重要作用[3-5]。
POR主要以PORA和PORB两种形式存在被子植物中[3],目前只在拟南芥(Arabidopsis thaliana)中报道第3种蛋白质PORC[6]。研究表明,在水稻(Oryza sativa) OsPORB突变体中抑制OsPORA表达和拟南芥AtPORB和AtPORC双突变体植株会黄化致死[2, 7],而过表达PORB可明显改变转基因植株中叶绿素含量, 并对植物叶绿体的发育有着重要的调节作用[8-11]。
墨兰‘达摩’(Cymbidium sinense ‘Dharma’)为兰科(Orchidaceae)兰属多年生草本植物,是我国的传统名贵花卉,其在长期栽培过程中选育出多种叶色变异品种,具有极高的观赏价值和经济价值。研究表明,不同品种墨兰的叶片形态、细胞结构和叶色表型差异显著,墨兰叶艺性状与其叶绿素合成代谢和叶绿体发育特性紧密相关[12-13]。但到目前为止,墨兰‘达摩’叶艺性状中POR功能的研究尚未见报道。
本研究中以墨兰‘达摩’栽培植株作为试验材料,从其嫩叶中克隆得到叶绿素合成代谢中关键酶CsPORB基因,并对其编码的蛋白进行生物信息学分析,利用qRT-PCR技术分析其在墨兰‘达摩’不同组织和不同发育时期表达量与叶色变异之间的关系。并通过构建35S:CsPORB转基因拟南芥植株进行表型分析,检测其叶绿素代谢途径关键酶活性和叶绿素含量,首次鉴定并初步阐明墨兰‘达摩’叶绿素合成途径中关键酶基因CsPORB的功能,为深入解析墨兰‘达摩’合成代谢途径及其对叶色变异的调控提供前期研究基础。
1 材料和方法 1.1 材料试验材料墨兰‘达摩’品系(Cymbidium sinense ‘Dharma’)选自广东省农业科学院环境园艺研究所, 挑选长势良好的株系,分别采集墨兰绿叶‘达摩’(没有叶艺)根、茎、叶(苗期嫩叶、老叶)、叶芽(1、2和3周),以及墨兰叶艺‘达摩’同一叶片的黄、绿色区,所有材料收集后用液氮速冻,保存于-80℃冰箱中待用。

|
图 1 墨兰‘达摩’绿叶(左)和叶艺(右) Fig. 1 Cymbidium sinense 'Dharma' green leaf (left) and leaf color variation (right) |
选取长势相同的12盆墨兰绿叶‘达摩’植株,分别黑暗处理0、0.5、1、2、3和4 h后转移至光照下继续处理0、0.5、1、2、3、4 h,收集每个处理的叶片,用液氮速冻,保存于-80℃冰箱中待用。
1.3 菌株、载体和试剂RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441)、FastQuant cDNA第1链合成试剂盒(去基因组)、琼脂糖凝胶回收试剂盒(普通离心柱型)、快速质粒小提试剂盒(离心柱型)、DH5α大肠杆菌感受态细胞购于天根生化科技有限公司(北京);Phanta Max DNA Polymerase和ChamQTM SYBR® qPCR Master Mix、GV1301农杆菌感受态细胞购于维诺赞生物科技有限公司。
1.4 CsPORB的克隆利用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取墨兰总RNA,以总RNA为模板,用FastQuant cDNA第1链合成试剂盒(去基因组)合成cDNA。根据GenBank上已登录的PORB基因(XP_020593560.1)保守序列,利用Premier premier 5.0设计引物Cs-PCR-F: 5′-TCTCAGAGAGTCCTCCATGGC-3′, Cs-PCR-R: 5′-GAAGAGCATCGGGCATCAAG-3′,以墨兰‘达摩’嫩叶cDNA为模板,扩增CsPORB基因,反应总体系为25 μL,包含模板cDNA 1.0 μL,Phanta Max DNA Polymerase 0.5 μL, 2× Phanta Max buffer 12.5 μL,dNTP Mix 0.5 μL,正、反向引物各1 μL,用ddH2O补足。扩增程序为:95℃预变性5 min;95℃变性30 s,57.5℃退火15 s,72℃延伸1 min,35个循环;最后72℃延伸10 min,8℃保存。PCR产物在1%的琼脂糖凝胶上电泳检测, 对目的片段进行切胶、回收,回收产物与pUM19-T vector链接,转化DH5α大肠杆菌感受态细胞,菌液PCR,挑选阳性克隆进行测序。
1.5 CsPORB生物信息学分析cDNA序列在NCBI (https://www.ncbi.nlm.nizgov/)进行BLAST搜索和同源性比较,在ExPASy-ProtParam (http://web.expasy.org/protparam/)上分析氨基酸理化性质,利用DNAMAN (Ver. 7.0)软件对PORB同源性较高的氨基酸序列进行比对、亲疏水性分析,利用MEGA (Ver. 6.0)软件进行不同物种进化树的构建。
1.6 CsPORB表达分析根据CsPORB基因序列,设计qRT-PCR引物, CsPORB-qPCR-F: 5′-CTGCGAAAGGGAAATGTCGTG-3′,CsPORB-qPCR-R: 5′-TCGAGGTGCATGATGCTGTAA-3′。以CsACTIN为内参基因[14],并设计引物: CsACTIN-F: 5′-CAATGAGCTTCGTGTTGCCC-3′,CsACTIN-R: 5′-GATACGAACCAGTTGTGCGG-3′。荧光定量PCR扩增体系为20 μL, 根据ChamQTM SYBR® qPCR Master Mix试剂盒说明书进行操作。每个样品设置3次重复,共进行3次独立试验,采用2-△△CT法分析结果。
1.7 转基因拟南芥验证CsPORB功能超表达载体的构建:根据CsPORB基因CDS测序结果,设计1对带有酶切位点的引物:CsPORB-sacI-F: 5′-AAAGAGCTCATGGCACTCCAGGCCTCCT-3′,CsPORB-SmaI-R: 5′-TCCCCCGGGTCAAGCCAGGGCGAGCAAC-3′。使用Phanta Max DNA Polymerase高保真酶扩增目的片段,表达载体PC- AM1300经改造后,用Sac I/Sma I对载体和片段进行双酶切、连接,转化DH5α大肠杆菌感受态细胞,37℃下培养12~16 h,挑选阳性克隆进行测序,根据测序结果,将正确的重组载体转入GV1301农杆菌感受态细胞中,28℃培养48 h,PCR检测,筛选阳性克隆。
采用菌液侵染花序方式转化野生型拟南芥(Arabidopsis thaliana),将收获的T0代植株在含有40 mg L-1潮霉素的1/2MS培养基上培养1周左右, 筛选阳性植株。挑选T3代长势良好的10个转基因拟南芥株系,以野生型植株为对照,进行荧光定量PCR检测分析(用拟南芥ACTIN为内参基因),方法同上。
1.8 叶绿素合成途径中关键酶活性检测参照植物酶联免疫分析试剂盒,对35S:PORB转基因拟南芥植株叶片叶绿素合成途径中关键酶活性进行检测。采用SPSS 19.0统计软件进行数据方差分析,用EXCEL进行数据的处理和作图。
2 结果和分析 2.1 CsPORB的克隆分析以墨兰‘达摩’嫩叶cDNA为模板,通过PCR扩增得到特异性条带,经测序后得到长1 200 bp的片段,共编码399个氨基酸,编码的蛋白分子量为43.13 kDa,理论等电点为9.30,编码的蛋白包含原叶绿素酸酯氧化还原酶(light-dependent protochloro- phyllide erductase, LPOR-like)功能区,属于经典短链脱氢酶(classical short chain dehydrogenase, SDR- c-like)亚类群,并含有Rossmann折叠NAD (P)(+)-结合蛋白(图 2)[14]。

|
图 2 墨兰‘达摩’CsPORB核苷酸序列和推测的氨基酸序列。划线部分为POR保守结构域。 Fig. 2 Nucleotide sequence and amino acid sequence of CsPORB in Cymbidium sinense 'Dharma'. Underline indicate POR conserved domain. |
在NCBI数据库中用BLASTp检索CsPORB和拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、烟草(Nicotiana tabacum)和小麦(Triticum aestivum)等物种POR序列的相似性(图 3),结果表明,墨兰‘达摩’ CsPORB与4种植物的POR有极高的相似性, 同源性分别为73%、74%、73%和74%,都含有高度保守的典型辅因子NADPH结合位点(TGASSG- LG)和活性位点(YK2DSK)[15]。因此,CsPORB属于POR类蛋白家族。

|
图 3 CsPORB与其他物种的POR序列的多重比对。方框为高度保守的NADPH结合位点(TGASSGLG)和活性位点(YKDSK)。CsPOR:墨兰; AtPOR:拟南芥; OsPOR:水稻; NtPOR:烟草; TaPOR:小麦。 Fig. 3 Multiple alignment of CsPORB sequences and POR sequences in other species. The boxes indicate highly conserved NADPH binding site (TGASSGLG) and active site (YKDSK). CsPOR: Cymbidium sinense; AtPOR: Arabidopsis thaliana; OsPOR: Oryza sativa; NtPOR: Nicotiana tabacum; TaPOR: Triticum aestivum. |
进一步研究CsPORB与POR蛋白家族的进化关系,利用MEGA (Version 6.0)软件,采用邻接法(Neighbour-joining)构建系统发育树,Bootstarp校正值设置为1 000,从图 4可见,墨兰‘达摩’CsPORB蛋白与单子叶植物凤梨(Ananas comosus)、铁皮石斛(Dendrobium catenatum)、蝴蝶兰(Phalaenopsis equestris)的POR蛋白亲缘关系最近,聚为PORB类,与禾本科植物的PORA相距较远,与双子叶植物拟南芥的3种类型POR分离,初步推测CsPORB属于PORB类蛋白家族。

|
图 4 CsPORB与其他物种的POR系统进化树。CsPOR:墨兰; AcPOR:凤梨; ZmPOR:玉米; HvPOR:大麦; AtPOR:拟南芥; OsPOR:水稻; NtPOR:烟草; TaPOR:小麦; RsPOR:萝卜; PePOR:蝴蝶兰; DcPOR:铁皮石斛; SbPOR:高粱。 Fig. 4 Phylogenetic tree of CsPORB and POR in other species. CsPOR: Cymbidium sinense; AcPOR: Ananas comosus; ZmPOR: Zea mays; HvPOR: Hordeum vulgare; AtPOR: Arabidopsis thaliana; OsPOR: Oryza sativa; NtPOR: Nicotiana tabacum; TaPOR: Triticum aestivum; RsPOR: Raphanus sativus; PePOR: Phalaenopsis equestris; DcPOR: Dendrobium catenatum; SbPOR: Sorghum bicolor. |
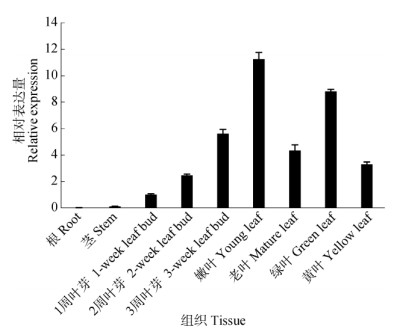
结果表明(图 5),CsPORB在不同组织的表达水平差异明显,在根和茎中表达量偏低,在叶片有较高表达;在叶芽生长发育的不同时期表达模式各不相同,CsPORB在生长1周的叶芽中表达量最低, 随叶芽发育表达量逐渐升高,且在生长旺盛的嫩叶中表达量达到最高,在老叶中又下降。同时, CsPORB的表达量在同一片叶的绿色区显著高于黄色区,说明CsPORB基因在墨兰‘达摩’的叶绿素生物合成过程中有重要调节作用。
|
图 5 CsPORB在墨兰‘达摩’组织中的表达 Fig. 5 Expression of CsPORB in tissues of Cymbidium sinense 'Dharma' |
POR基因家族成员对光照响应有差异,从而发挥不同的生物学功能。结果表明(图 6),黑暗处理0~4 h的CsPORB表达并无显著变化。而在黑暗处理4 h后移至光下,在光0~1 h的CsPORB表达瞬时增加,随后随着光照时间的延长表达逐渐下降, 并在复光4 h后表达量基本恢复至处理前水平,说明CsPORB可能受光强调控。

|
图 6 光照处理对墨兰‘达摩’ CsPORB表达的影响 Fig. 6 Effect of light on CsPORB expression in Cymbidium sinense 'Dharma' |
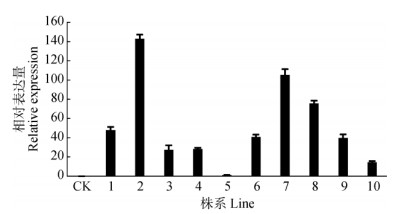
超表达植株验证 将PCAM1300:CsPORB载体转入拟南芥植株中,在获得的阳性苗中随机选取10株进行实时荧光定量PCR检测(图 7)。结果表明,野生型中无法检测到CsPORB表达, 10株转基因株系中CsPORB表达量有显著提高(5~140倍),说明已获得35S:CsPORB转基因拟南芥植株。
|
图 7 CsPORB超表达株系中CsPORB的表达。CK:野生型。 Fig. 7 Expression of CsPORB in CsPORB over-expressing lines of Arabidopsis. CK: Wild type. |
表型变化 挑选3个转基因株系, CsPORB表达量依次为line 2 > line 7 > line 5,这些植株的叶绿素a (Chl a)、叶绿素b (Chl b)、总叶绿素(Chl a+b)和总类胡萝卜素(TCC)含量均高于野生型。经黑暗处理1周后,野生型的Chl a、Chl b、Chl a+b和TCC含量明显降低,而这些超表达植株下降的较少(表 1)。从表型上看野生型和CsPORB超表达植株叶片出现叶色变黄现象,且野生型株系变黄现象更为严重(图 8);在转基因株系中,CsPORB表达量低的株系比表达量高的株系变黄现象严重。这表明黑暗处理影响了拟南芥超表达植株叶绿素降解的进程, CsPORB基因是通过提高POR活性来促进叶绿素的合成,使得植株中叶绿素含量增加,从而使黑暗处理的CsPORB超表达植株中叶绿素的减少量要低于对照。
| 表 1 黑暗处理对CsPORB超表达植株的光合色素含量的影响 Table 1 Effect of dark on photosynthetic pigments content in CsPORB over-expression lines |

|
图 8 CsPORB超表达植株黑暗处理后的表型。WT:野生型。 Fig. 8 Phenotype of CsPORB over-expression lines after dark treatment. WT: Wild type. |
关键酶活性变化 选取35S:CsPORB转基因株系中表达量最高的line 2,对其叶片叶绿素合成代谢途径中14种关键酶活性进行了检测(图 9)。结果表明,CsPORB超表达植株叶绿素合成代谢途径中的POR活性比野生型植株明显增高,在POR参与反应前的阶段中,BDPG (胆色素原脱氨酶, hydroxymethylbilane synthase)显著降低,CPD (粪卟啉原氧化脱羧酶, coproporphyrinogen oxidative decarboxylase)明显增高。而在POR参与反应后的阶段, 各关键酶活性都相应增高,尤其以POR和MDCase (脱镁螯合酶, Mg chelatase)增高显著。这说明超表达CsPORB基因提高了拟南芥叶绿素合成代谢途径中的POR活性,并且参与叶绿素合成途径的调节。

|
图 9 CsPORB超表达植株叶绿素合成代谢关键酶活性。BDPG:胆色素原脱氨酶; UROS:尿卟啉Ⅲ合酶; UROD:尿卟啉原脱羧酶; CPD:粪卟啉原氧化脱羧酶; PPOX:原卟啉原氧化酶; PPIXM:镁原卟啉Ⅸ甲基转移酶; DLR:二乙烯还原酶; POR:原叶绿素酸酯氧化还原酶; CS:叶绿素合成酶; CLH:叶绿素酶; CAO:叶绿素酸酯a氧化酶; MDCase:脱镁螯合酶; PAO:脱镁叶绿酸a氧化酶; RCCR:红色叶绿素降解产物还原酶。 Fig. 9 Activities of key enzymes involved in chlorophyll synthetic pathway of CsPORB over-expression lines. BDPG: Hydroxymethylbilane; UROS: synthaseUroporphyrinogen Ⅲ synthase; UROD: Uroporphyrinogen decarboxylase; CPD: Coproporphyrinogen oxidative decarboxylase; PPOX: Protoporphyrinogen oxidase; PPIXM: Mg-protoporphyrin Ⅸ methyltransferase; DLR: Divinyl reductase; POR: Protochlorophyllide oxidoreductase; CS: Chlorophyll synthase; CLH: Chlorophyllase; CAO: Chlorophyllide a oxygenase; MDCase: Mg chelatase; PAO: Chlorophyllide a oxygenase; RCCR: Red chlorophyll catabolite reductase. |
光在植物生长发育过程中具有重要作用[16], 不仅为植物的光合作用提供能源,还参与植物生长的一系列生理生化反应。在植物叶绿素合成途径中, POR对光信号十分敏感[17]。Sakuraba等[18]的研究表明,水稻OsPORA表达受光抑制,主要在叶发育的早期阶段发挥功能;OsPORB在整个叶片发育中表达相对稳定,特别在高光条件下, 它是光依赖叶绿素合成途径的关键因子,类似于拟南芥中AtPORA和AtPORB的表达模式,并与叶绿体合成途径有一定联系,可见POR蛋白作为叶绿素合成代谢途径中的最关键酶之一,对植物生长发育有重要作用。
本研究从墨兰‘达摩’品系中克隆得到叶绿素合成关键酶基因CsPORB,其编码蛋白CsPORB与铁皮石斛、凤梨等物种的PORB同源性较近, 且与POR蛋白类似,有高度保守结构域,初步推测CsPORB属于PORB蛋白家族。表达模式分析表明,CsPORB表达量随墨兰‘达摩’叶芽的生长逐渐升高,在嫩叶中达到顶峰,而老叶中明显降低;在暗处理4 h后再见光CsPORB表达量显著上升,并在随后的4 h内逐渐降至正常水平,这与Runge等[19]和Holtorf等[20]的研究结果一致,即CsPORB伴随叶片发育的整个过程,且其表达有可能受光照强度调节。对比墨兰叶艺‘达摩’叶片的绿色、黄色区CsPORB表达量,绿色区的表达均高于黄色区, 推测墨兰‘达摩’叶色变异可能是由于CsPORB发生突变或者是其表达量发生变化造成的。在模式植物拟南芥中高表达CsPORB后,明显提高植物的叶绿素含量,同时, 超表达植株的POR活性明显增高,且POR参与反应后的阶段中各关键酶活性都相应增高,但合成途径早期的BDPG却有所降低,表明CsPORB在不同物种间功能高度保守且与叶绿素合成代谢途径存在反馈调节机制。
| [1] |
Wu Z M, Zhang X, He B, et al. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis[J]. Plant Physiol, 2007, 145(1): 29-40. DOI:10.1104/pp.107.100321 |
| [2] |
Masuda T, Fusada N, Oosawa N, et al. Functional analysis of isoforms of NADPH:Protochlorophyllide oxidoreductase (POR), PORB and PORC, in Arabidopsis thaliana[J]. Plant Cell Physiol, 2003, 44(10): 963-974. DOI:10.1093/pcp/pcg128 |
| [3] |
Reinbothe S, Reinbothe C, Lebedev N, et al. PORA and PORB, two light-dependent protochlorophyllide-reducing enzymes of angiosperm chlorophyll biosynthesis[J]. Plant Cell, 1996, 8(5): 763-769. DOI:10.1105/tpc.8.5.763 |
| [4] |
Masuda T, Takamiya K I. Novel insights into the enzymology, regulation and physiological functions of light-dependent protochloro-phyllide oxidoreductase in angiosperms[J]. Photosynth Res, 2004, 81(1): 1-29. DOI:10.1023/B:PRES.0000028392.80354.7c |
| [5] |
Dahlin C, Aronsson H, Almkvist J, et al. Protochlorophyllide-independent import of two NADPH:Pchlide oxidoreductase proteins (PORA and PORB) from barley into isolated plastids[J]. Physiol Plant, 2000, 109(3): 298-303. DOI:10.1034/j.1399-3054.2000.100311.x |
| [6] |
Su Q X, Frick G, Armstrong G, et al. POR C of Arabidopsis thaliana:A third light-and NADPH-dependent protochlorophyllide oxidoreductase that is differentially regulated by light[J]. Plant Mol Biol, 2001, 47(6): 805-813. DOI:10.1023/A:1013699721301 |
| [7] |
Frick G, Su Q, Apel K, et al. An Arabidopsis porB porC double mutant lacking light-dependent NADPH:Protochlorophyllide oxidore-ductases B and C is highly chlorophyll-deficient and developmentally arrested[J]. Plant J, 2010, 35(2): 141-153. DOI:10.1046/j.1365-313X.2003.01798.x |
| [8] |
Sperling U, van Cleve B, Frick G, et al. Overexpression of light-dependent PORA or PORB in plants depleted of endogenous POR by far-red light enhances seedling survival in white light and protects against photooxidative damage[J]. Plant J, 2010, 12(3): 649-658. DOI:10.1046/j.1365-313X.1997.00649.x |
| [9] |
Paddock T N, Mason M E, Lima D F, et al. Arabidopsis protochlorophyllide oxidoreductase A (PORA) restores bulk chloro-phyll synthesis and normal development to a porB porC double mutant[J]. Plant Mol Biol, 2010, 72(4/5): 445-457. DOI:10.1007/s11103-009-9582-y |
| [10] |
WU W J, Elsheery N, WEI Q, et al. Defective etioplasts observed in variegation mutants may reveal the light-independent regulation of white/yellow sectors of Arabidopsis leaves[J]. J Integr Plant Biol, 2011, 53(11): 846-857. DOI:10.1111/j.1744-7909.2011.01079.x |
| [11] |
Gao X L, LI S J, Shao J F, et al. Preliminary study on isolation, mapping, and function of NADPH:Protochlorophyllide oxidoreductase (POR) gene in rice (Oryza sativa)[J]. Plant Physiol J, 2015, 51(6): 860-868. 高小丽, 李素娟, 邵健丰, 等. 水稻POR基因的分离、定位与功能的初步研究[J]. 植物生理学报, 2015, 51(6): 860-868. DOI:10.13592/j.cnki.ppj.2015.0105 |
| [12] |
Zhu G F, Yang F X, Shi S S, et al. Transcriptome characterization of Cymbidium sinense 'Dharma' using 454 pyrosequencing and its appli-cation in the identification of genes associated with leaf color variation[J]. PLoS One, 2015, 10(6): e0128592. DOI:10.1371/journal.pone.0128592 |
| [13] |
XU Q Q, YANG F X, YE Q S, et al. Comparison of photosynthetic pigments content, chlorophyll fluorescence kinetics parameters and chloroplast ultrastructure of leaf mutant cultivars of Cymbidium sinense 'Damo'[J]. Chin J Trop Crops, 2017, 38(7): 1210-1215. 许庆全, 杨凤玺, 叶庆生, 等. 墨兰'达摩'叶艺品系光合色素含量、叶绿素荧光特性和叶绿体超微结构的比较[J]. 热带作物学报, 2017, 38(7): 1210-1215. DOI:10.3969/j.issn.1000-2561.2017.07.006 |
| [14] |
JIANG K Y. Cloning and functional analysis of key genes involved in chlorophyll biosynthetic pathway in Pseudosasa japonica cv. Akebobosuji[D]. Hangzhou: Zhejiang Agricultural & Forest University, 2013: 44-55. 姜可以.花叶矢竹叶绿素生物合成关键基因PjPORB和PjCAO的克隆与功能分析[D].杭州: 浙江农林大学, 2013: 44-55. http://cdmd.cnki.com.cn/Article/CDMD-10341-1014103872.htm |
| [15] |
Gabruk M, Stecka A, Strzałka W, et al. Photoactive proto-chlorophyllide-enzyme complexes reconstituted with PORA, PORB and PORC proteins of A. thaliana:Fluorescence and catalytic properties[J]. PLoS One, 2015, 10(2): e0116990. DOI:10.1371/journal.pone.0116990 |
| [16] |
Li H M, Culligan K, Dixon R A, et al. CUE1:A mesophyll cell-specific positive regulator of light-controlled gene expression in Arabi-dopsis[J]. Plant Cell, 1995, 7(10): 1599-1610. DOI:10.1105/tpc.7.10.1599 |
| [17] |
Armstrong G A, Runge S, Frick G, et al. Identification of NADPH:Protochlorophyllide oxidoreductases A and B:A branched pathway for light-dependent chlorophyll biosynthesis in Arabidopsis thaliana[J]. Plant Physiol, 1995, 108(4): 1505-1517. DOI:10.1104/pp.108.4.1505 |
| [18] |
Sakuraba Y, Rahman M L, CHO S H, et al. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions[J]. Plant J, 2013, 74(1): 122-133. DOI:10.1111/tpj.12110 |
| [19] |
Runge S, Sperling U, Frick G, et al. Distinct roles for light-dependent NADPH:Protochlorophyllide oxidoreductases (POR) A and B during greening in higher plants[J]. Plant J, 2010, 9(4): 513-523. DOI:10.1046/j.1365-313X.1996.09040513.x |
| [20] |
Holtorf H, Reinbothe S, Reinbothe C, et al. Two routes of chlorophyllide synthesis that are differentially regulated by light in barley (Hordeum vulgare L.)[J]. Proc Natl Acad Sci USA, 1995, 92(8): 3254-3258. DOI:10.1073/pnas.92.8.3254 |
 2019, Vol. 27
2019, Vol. 27



