2. 广州中医药大学中医药数理工程研究院, 广州 510006
2. Mathematical Engineering Academy of Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
爵床科(Acanthaceae)为泛热带分布的大科,在我国主要分布于长江以南的各省份,以云南分布最多[1-2]。本科植物种类繁多,《中国植物志》记载我国有68属300多种,形态多样,有乔木、灌木、草本和藤本等;分布范围广,森林、荒漠、郊野、甚至红树林均有分布,故一直被认为属于研究难度大的科[1-3]。爵床科多种植物可供药用,其中不少为知名中药材,如板蓝(Baphicacanthus cusia)、穿心莲(Andrographis paniculata)、尖药花(Aechmanthera tomentosa)、枪刀药(Hypoestes purpurea)、九头狮子草(Peristrophe japonica)等;当中的穿心莲更是祛热解毒、消炎止痛之良药,对细菌性与病毒性上呼吸道感染及痢疾有特殊疗效,被誉为天然抗生素药物[4]。目前,以穿心莲为主要原料,已有多个广泛应用于临床的中成药,如穿心莲内酯片、炎琥宁、穿琥宁等[5]。可见,爵床科植物具有明显药用价值,明星药材“穿心莲”更是被制作成多种中成药用于治疗多种疾病,且效果显著。据此,天然药物化学家们对爵床科植物的研究产生了巨大兴趣,并致力于该科植物的化学成分与生物活性研究。
山壳骨属(Pseuderanthemum)约有60~100种植物,分布于泛热带,亚洲约20种,其中我国暂有8种[3]。目前,国内对山壳骨属植物的化学成分与生物活性研究尚属空白,因此对该属植物进行系统的化学成分及生物活性研究,发掘拥有潜在药理活性的品种,具有重要科学意义。山壳骨(P. latifolium)隶属山壳骨属植物,产于广东(徐闻)、海南(保亭、儋州)、广西(龙州)、云南(西双版纳)[3]。本研究对山壳骨的化学成分与生物活性进行研究,运用LS- MS联用技术快速分离鉴定山壳骨的主要化学成分,并对获得的化学成分进行生物活性评价, 旨在发掘山壳骨的药用价值,弥补山壳骨研究的空白, 同时为综合开发与利用山壳骨提供科学依据。
1 材料和方法 1.1 仪器、试剂和耗材质谱:Waters 3100 SQDMS (低分辨ESI);核磁共振谱:Bruker Avance Ⅲ 500型核磁共振仪,以氘代试剂残留溶剂峰为内标;液相色谱与质谱联用仪:Waters 2695 LC偶联Waters Acquity ELSD、Waters 3100 SQDMS;分析色谱柱型号:Waters Sunfire® RP C-18,3.5 μm, 4.6 mm×100 mm;CO2细胞培养箱(上海力申科学仪器有限公司);垂直超净工作台(上海智城分析仪器制造有限公司);低速离心机(科大创新股份有限公司中佳分公司);MK3型酶标仪(美国Thermo Fisher公司);超低温冰箱(日本三洋SANYO公司);FM-500型倒置荧光生物显微镜(上海普丹光学仪器有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司)。
Cell Counting Kit-8 (CCK-8)细胞增殖-毒性检测试剂盒(日本同仁化学研究所);Greiss NO试剂盒(碧云天生物技术研究所);MTT噻唑兰(美国Sigma公司);叔丁基过氧化氢(t-BHP)(成都格雷西亚化学技术有限公司);200~300、300~400目柱层析硅胶均为青岛海洋化工厂生产;TLC预制薄层板: HSGF254为德国Merck公司生产;葡聚糖凝胶Sephadex LH-20 (Pharmacia Biotech AB、Uppsala、Sweden); MCI树脂:CHP20P (75~150 μm), Mitsubishi Chemical Corporation生产;96孔细胞培养板(美国CORNING公司);胎牛血清(FBS) (澳大利亚Gibco公司);青-链霉素(P/S)(Thermo公司);DMEM培养基(美国Gibco公司);RPMI-1640培养基(德国Biological Industries公司);DMSO溶液(美国Sigma公司); HPLC分析用乙腈(Merck公司); 实验用水由美国Millipore公司纯水、超纯水系统提供;其他有机溶剂均为国产分析纯产品;TLC显色剂为5%香兰素乙醇液。
1.2 材料山壳骨(Pseuderanthemum latifolium)全株15 kg, 2018年4月,采集于广东省揭阳市,标本号为20180401。
1.3 细胞株神经细胞株:人神经母细胞瘤SH-SY5Y;购自中国科学院上海生命科学研究院细胞资源中心。
细菌细胞株:金黄色葡萄球菌Staphylococcus aureus CMCC26003、大肠杆菌Escherichia coli ATCC8739和耐甲氧西林金黄色葡萄球菌MASA JCSC4474;购自广东省微生物研究所微生物菌种保藏中心。
1.4 LC-MS分析条件分析仪器:Waters 2695-2998-2424-3100SQDMS; 色谱柱:Waters Sunfire® RP C18, 3.5 μm, 4.6 mm× 100 mm;HPLC梯度:色谱乙腈-0.005%三氟乙酸/去离子水-0.005%三氟乙酸梯度洗脱,起始浓度5%色谱乙腈-0.005%三氟乙酸,结束浓度95%色谱乙腈- 0.005%三氟乙酸;运行时间25 min;流速:1 mL min–1。
1.5 LC-MS导向分离山壳骨(15 kg),粉碎后用95%工业酒精室温浸泡3次,每次5 d,合并提取液,减压浓缩至无乙醇味。将得到的总浸膏用水悬浮,然后用乙酸乙酯萃取,减压浓缩萃取液,得到水部分(205 g)和乙酸乙酯部分(85 g)。
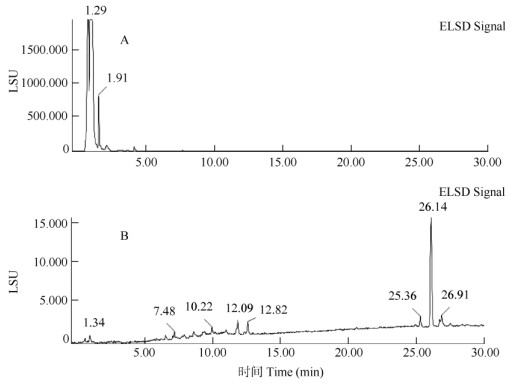
运用LS-MS联用技术,对获得的水部分(205 g)和乙酸乙酯部分(85 g)进行分析。水部分化合物的保留时间集中在0~2 min,提示为大极性类化合物(图 1: A)。质谱分析结果显示,保留时间tR=1.91 min的化合物分子量为180,推导为葡萄糖;而保留时间tR≈ 1.29 min的化合物分子量在质谱上响应不明显,结合其大极性特点,推导为无机盐类成分。据此,本研究将不对山壳骨提取物水部分进行深入研究。
|
图 1 山壳骨提取物水部分(A)和乙酸乙酯部分(B) LC-ELSD色谱图 Fig. 1 LC-ELSD chromatography of water fraction (A) and EaOAc fraction (B) |
乙酸乙酯部分主要化合物的保留时间集中在26.14 min (图 1: B)。随后对保留时间tR=26.14 min的色谱峰进行质谱分析,该色谱峰存在着2个分子量(426、412),揭示其包含2个化合物。据此,本研究选择对山壳骨提取物乙酸乙酯部分进行深入研究,分离鉴定tR=26.14 min的主要化合物。选用MCI柱层析处理乙酸乙酯部分,以乙醇-水(50%、70%、95%乙醇)为流动相梯度洗脱,富集tR=26.14 min的化合物,根据其弱极性特征,该类化合物将富集在95%乙醇的洗脱组分中(组分A)。
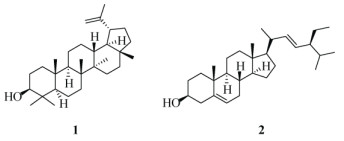
随后,采用硅胶柱层析(200~300目)对组分A进行处理,正己烷:乙酸乙酯[10:1~1:1, (V/V, 下同)]梯度洗脱,薄层色谱(TLC)检测合并,获得子组分A1~A3。子组分A2经凝胶柱层析处理,氯仿:甲醇(1:1)洗脱,得到组分B2A~B2C;接下来对得到的子组分B2B再进行硅胶(300~400目)柱层析处理,正己烷:乙酸乙酯(10:1~1:1)洗脱,最后获得化合物1 (18 g)和2 (15 g)(图 2)。
|
图 2 化合物1和2的结构 Fig. 2 Structures of compounds 1 and 2 |
化合物 1 白色粉末; 1H NMR (500 MHz, CDCl3): δH 2.36 (1H, m, H-19), 4.56 (1H, s, Ha-29), 4.68 (1H, s, Hb-29), 1.67 (3H, s, H-30); 13C NMR (125 MHz, CDCl3): δC 38.6 (C-1), 27.3 (C-2), 78.9 (C-3), 40.0 (C-4), 55.2 (C-5), 18.0 (C-6), 34.2 (C-7), 40.8 (C-8), 50.4 (C-9), 37.1 (C-10), 20.88 (C-11), 25.0 (C-12), 38.0 (C-13), 42.8 (C-14), 27.9 (C-15), 35.5 (C-16), 42.9 (C-17), 48.2 (C-18), 47.9 (C-19), 151.0 (C-20), 29.7 (C-21), 38.8 (C-22), 27.3 (C-23), 15.4 (C-24), 15.9 (C-25), 16.1 (C-26), 14.5 (C-27), 18.2 (C-28), 109.3 (C-29), 19.2 (C-30)。以上数据与文献[6]报道的一致,故鉴定为羽扇豆醇。
化合物 2 白色粉末; 1H NMR (500 MHz, CDCl3): δH 0.68 (3H, s, H-18), 1.01 (3H, s, H-19), 0.93 (3H, d, J = 6.7 Hz, H-21), 0.80 (3H, d, J = 6.7 Hz, H- 27), 0.82 (3H, t, J = 7.2 Hz, H-29), 0.84 (3H, d, J = 6.7 Hz, H-26), 5.35 (1H, m, H-6), 5.14 (1H, dd, J = 15.1, 8.7 Hz, H-22), 5.02 (1H, dd, J = 15.1, 8.7 Hz, H- 23), 3.53 (1H, m, H-3); 13C NMR (125 MHz, CDCl3): δC 37.4 (C-1), 29.2 (C-2), 71.8 (C-3), 42.4 (C-4), 140.7 (C-5), 121.7 (C-6), 31.7 (C-7), 32.0 (C-8), 50.2 (C-9), 36.6 (C-10), 21.2 (C-11), 39.9 (C-12), 42.4 (C-13), 56.9 (C-14), 24.4 (C-15), 29.2 (C-16), 56.7 (C-17), 11.8 (C-18), 18.7 (C-19), 39.9 (C-20), 19.0 (C-21), 138.3 (C-22), 129.2 (C-23), 51.4 (C-24), 32.0 (C-25), 21.0 (C-26), 21.2 (C-27), 21.3 (C-28), 12.4 (C-29)。以上数据与文献[6]报道的一致,故鉴定为豆甾醇。
1.7 生物活性筛选体外神经保护活性筛选 将SH-SY5Y细胞以6×109 L–1的密度接种于经多聚赖氨酸包被过的培养皿中,加入含有10% FBS和1% P/S的DMEM培养基,置于37℃、5% CO2培养箱中培养。每天全量换液1次,隔天传代,并在显微镜下观察。将SH- SY5Y细胞以6×105 L–1的密度接种于多聚赖氨酸包被的96孔板中,每孔100 μL。将细胞分为0 (正常组)、50、100和200 μmol L–1的t-BHP组,每组6个复孔。待细胞融合度达到80%~90%时,吸净培养基,加入含有相应浓度t-BHP的培养基,置于37℃、5% CO2培养箱中分别培养3、6、12和24 h,观察SH- SY5Y细胞衰老情况。将SH-SY5Y细胞以6×109 L–1的密度接种于多聚赖氨酸包被的96孔板中,每孔100 μL。将细胞分为正常组、模型组、给药组(含有25、50、100和200 μg mL–1大叶紫金牛酚的模型组),每组6个复孔。置于37℃、5% CO2培养箱中培养24 h, 观察化合物1、2对SH-SY5Y细胞衰老的保护情况。MTT法检测各组SH-SY5Y细胞的存活率。
体外抗MRSA(耐甲氧西林金黄色葡萄球菌)活性筛选 本实验使用96孔板梯度稀释技术,测定化合物的最低抑菌浓度。首先将7.5 mL的指示剂溶液(100 μg mL–1的刃天青水溶液)与5 mL的待测菌溶液(1.25×106 cfu mL–1)混匀,并向第1至第8列的所有测试孔中各加入100 μL混合菌液。然后将20 μL待测样品的DMSO溶液和80 μL混合菌液加入到第1列的各个板孔中,均匀混合后取出100 μL的溶液转移到第2列相应的板孔中,并用同样的方法倍增稀释到第8列。最后,将加好样品的孔板放入到恒温培养箱,37℃培养10~12 h。菌液变红色为无抑菌活性,蓝色为有抑菌活性,菌液维持蓝色的最低稀释浓度被认为是待测化合物的最低抑菌浓度, 每个样品做2组并重复测定3次。阳性对照为万古霉素(vancomycin)。
2 结果和讨论 2.1 体外神经保护活性评价现代研究表明神经细胞保护是防治神经退行性疾病,如老年性痴呆、重症抑郁症、帕金森症和中风等疾病的重要机制[7-10]。评价并筛选出具有显著神经保护活性的化合物,对开发治疗神经退行性疾病药物至关重要。因此,本研究通过探讨化合物1、2是否可以延缓SH-SY5Y细胞衰老,评价化合物1、2是否具有神经保护作用。试验结果表明, 化合物1、2与模型组相比,不能延缓SH-SY5Y细胞衰老,因此在SH-SY5Y模型下,化合物1、2不具有神经保护作用。
2.2 体外抗MRSA活性评价耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcu saureus,MRSA)被称为“超级细菌”, 已成为全球院内感染的首要致病菌,与HBV、HIV并列成为世界范围的三大难题[11-15]。MRSA具有多重耐药性,对β-内酰胺等几乎所有临床常用抗生素表现出耐药性;万古霉素曾一度被认为是治疗MRSA感染的首选抗生素,但该抗生素毒副作用大,长期大剂量使用对肾脏损害严重,容易造成耳聋[16-19]。因此,寻找新的能抑制MRSA的抗生素迫在眉捷。
本研究评价了化合物1、2对革兰氏阴性菌(大肠杆菌E. coli ATCC8739)、革兰氏阳性菌(金黄色葡萄球菌S. aureus CMCC26003)、耐甲氧西林金黄色葡萄球菌(MRSA JCSC4474)的抑制活性。从表 1可知,化合物1、2均对MRSA JCSC4474表现出中等抑制活性,MIC值为50 μg mL–1。
| 表 1 化合物1和2的体外抑菌活性 Table 1 In vitro antibacterial activities of 1 and 2 against bacteria strains |
本研究首次对爵床科山壳骨植物进行化学成分和生物活性研究,运用LC-MS联用技术快速分离山壳骨中主要化学成分,并使用核磁共振波谱技术进行结构解析,鉴定为羽扇豆醇(1)和豆甾醇(2)。同时本研究评价了化合物的体外神经保护以及抗MRSA活性,试验结果揭示这些化合物具有中等抗MRSA活性但不具有神经保护作用,为综合开发与利用山壳骨提供科学依据。
| [1] |
QIU M L, CUI T C, ZHANG S Z. The species and landscaping utilization characteristics of jacobinia magnifica in Shenzhen Fairylake Botanical Garden[J]. J Guangdong Landsc Arch, 2011, 33(5): 47-53. 邱茉莉, 崔铁成, 张寿洲. 深圳仙湖植物园爵床科植物种类与园林应用特征[J]. 广东园林, 2011, 33(5): 47-53. DOI:10.3969/j.issn.1671-2641.2011.05.015 |
| [2] |
TANG H M, LIAO L J. Species of acanthaceae plants and its application in landscape[J]. Mod Agric Sci Technol, 2013(9): 194-195. 汤慧敏, 廖凌娟. 爵床科植物种类及其在园林中的应用[J]. 现代农业科技, 2013(9): 194-195. DOI:10.3969/j.issn.1007-5739.2013.09.126 |
| [3] |
Deletis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Edite. Florae Reipublicae Popularis Sinicae, Tomus 70[M]. Beijing: Science Press, 2002. 中国植物志编委会. 中国植物志, 第70卷[M]. 北京: 科学出版社, 2002. |
| [4] |
XIE X, REN Y L, ZHANG H M, et al. Research progress on pharmaco- logical action and application of Rhizolactone[J]. Chin J Integr Med Cardio-/Cerebrovasc Dis, 2018, 16(19): 2809-2812. 谢璇, 任莹璐, 张惠敏, 等. 穿心莲内酯的药理作用和应用研究进展[J]. 中西医结合心脑血管病杂志, 2018, 16(19): 2809-2812. DOI:10.12102/j.issn.1672-1349.2018.19.011 |
| [5] |
WANG F, ZHAI W T, LI Y L, et al. Research progress on new preparations and pharmacokinetic of andrographolide[J]. China Pharmac, 2013, 22(9): 1-4. 王芳, 翟文婷, 李艳丽, 等. 穿心莲内酯制剂及药代动力学的研究进展[J]. 中国药业, 2013, 22(9): 1-4. DOI:10.3969/j.issn.1006-4931.2013.09.001 |
| [6] |
ZHAI X Y, XIAO W, YANG B, et al. Study on chemical constituents from seed of Oroxylum indicum[J]. China J Chin Mat Med, 2015, 40(15): 3013-3016. 翟翔宇, 萧伟, 杨彪, 等. 木蝴蝶种子的化学成分研究[J]. 中国中药杂志, 2015, 40(15): 3013-3016. DOI:10.4268/cjcmm20151519 |
| [7] |
EKSHYYAN O, AW T Y. Apoptosis:A key in neurodegenerative disorders[J]. Curr Neurovasc Res, 2004, 1(4): 355-371. DOI:10.2174/1567202043362018 |
| [8] |
OKOUCHI M, EKSHYYAN O, MARACINE M, et al. Neuronal apoptosis in neurodegeneration[J]. Antioxid Redox Signal, 2007, 9(8): 1059-1096. DOI:10.1089/ars.2007.1511 |
| [9] |
CHI H, CHANG H Y, SANG T K. Neuronal cell death mechanisms in major neurodegenerative diseases[J]. Int J Mol Sci, 2018, 19(10): 3082. DOI:10.3390/ijms19103082 |
| [10] |
SWEENEY M D, KISLER K, MONTAGNE A, et al. The role of brain vasculature in neurodegenerative disorders[J]. Nat Neurosci, 2018, 21(10): 1318-1331. DOI:10.1038/s41593-018-0234-x |
| [11] |
XIAO Y H, WANG J, LI Y, et al. Bacterial resistance surveillance in China:A report from Mohnarin 2004-2005[J]. Eur J Clin Microbiol Infect Dis, 2008, 27(8): 697-708. DOI:10.1007/s10096-008-0494-6 |
| [12] |
SALMENLINNA S, LYYTIKAINEN O, VAINIO A, et al. Human cases of methicillin-resistant Staphylococcus aureus CC398, Finland[J]. Emerg Infect Dis, 2010, 16(10): 1626-1629. DOI:10.3201/eid1610.091571 |
| [13] |
ARÊDE P, MILHEIRIÇO C, de LENCASTRE H, et al. The anti-repressor MecR2 promotes the proteolysis of the mecA repressor and enables optimal expression of β-lactam resistance in MRSA[J]. PLoS Pathog, 2012, 8(7): e1002816. DOI:10.1371/journal.ppat.1002816 |
| [14] |
LEWIS P O, HEIL E L, COVERT K L, et al. Treatment strategies for persistent methicillin-resistant Staphylococcus aureus bacteraemia[J]. J Clin Pharm Ther, 2018, 43(5): 614-625. DOI:10.1111/jcpt.12743 |
| [15] |
KOECK M, COMO-SABETTI K, BOXRUD D, et al. Burdens of invasive methicillin-susceptible and methicillin-resistant Staphylococcus aureus disease, minnesota, USA[J]. Emerg Infect Dis, 2019, 25(1): 171-174. DOI:10.3201/eid2501.181146 |
| [16] |
PATEL M. Community-associated meticillin-resistant staphylococcus aureus infections:Epidemiology, recognition and management[J]. Drugs, 2009, 69(6): 693-716. DOI:10.2165/00003495-200969060-00004 |
| [17] |
WELTE T, PLETZ M W. Antimicrobial treatment of nosocomial meticillin-resistant Staphylococcus aureus (MRSA) pneumonia:Current and future options[J]. Int J Antimicrob Agents, 2010, 36(5): 391-400. DOI:10.1016/j.ijantimicag.2010.06.045 |
| [18] |
KEMUNG H M, TAN L T H, KHAN T M, et al. Streptomyces as a prominent resource of future anti-MRSA drugs[J]. Front Microbiol, 2018, 9: 2221. DOI:10.3389/fmicb.2018.02221 |
| [19] |
CHEN S J, POPOVICH J, ZHANG W W, et al. Superior ion release properties and antibacterial efficacy of nanostructured zeolites ionexchanged with zinc, copper, and iron[J]. RSC Adv, 2018, 8(66): 37949-37957. DOI:10.1039/C8RA06556J |
 2019, Vol. 27
2019, Vol. 27


