2. 广州中医药大学第一附属医院, 广州 510405;
3. 佛山市气象局, 广东 佛山 528000;
4. 广州中医药大学中医药数理工程研究院, 广州 510006
2. The First Affiliated Hospital, Guangzhou University of Chinese Medicine, Guangzhou 510405, China;
3. Foshan Meteorological Bureau, Foshan 528000, Guangdong, China;
4. Mathematical Engineering Academy of Chinese Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
大叶紫金牛酚[1]是具有顺式取代的十七碳直链烯烃的间苯二酚衍生物,因大量存在于紫金牛科(Myrsinaceae)植物大叶紫金牛(Ardisia gigantifolia)中,并成为其特征性成分。大叶紫金牛酚结构独特,母体为苯酚结构,连接长链烯烃取代基,致使化合物脂溶性显著提高;此外苯环结构上带有易发生氧化反应的酚羟基活泼基团,同时侧链烯烃基团处于不稳定的顺式取代模式。大叶紫金牛酚独特新颖的结构吸引了药物化学家们的研究兴趣。Guan等[2]对大叶紫金牛酚进行了抗肺结核活性研究,并揭示其具有潜在的抗肺结核活性。然而目前对大叶紫金牛酚的研究还是严重不足的,继续深入研究、开发与评价其新颖生物活性将具有显著意义。
大叶紫金牛在我国广东、广西、江西、云南等地有分布;其干燥根及根茎即为跌打损伤良药走马胎。作为岭南民间常用中药,走马胎始载于清代《生草药性备要》[3],有祛风除湿、壮筋骨、活血化瘀等功效,主治风湿筋骨疼痛、产后血瘀、痈疽溃疡等[4]。可见,走马胎具有多方面的生物活性;此外,近年来的现代药理学研究发现,走马胎还具有多种药理作用,如抗肿瘤、抗血栓和抗氧化作用等[5-6]。
鉴于走马胎多种药理活性已被证实,现代临床将之用于痛风性关节炎[7]、类风湿关节炎[8]、骨质增生症[9]、骨伤骨折[10]等疾病的治疗,效果显著, 引起了对走马胎包括化学成分和药理学在内全面研究的热潮。随着研究的深入,走马胎多种化学成分被陆续报道,主要包括苯酚类、香豆精类、三萜皂苷类、甾醇类等成分[5]。然而目前国内外学者对走马胎化学成分的研究,一直侧重于三萜皂苷类和岩白菜素类化学成分,未见基于走马胎临床药效对大叶紫金牛酚进行全面和深入的研究。同时,大叶紫金牛酚作为走马胎的主要活性成分,阐明其药理活性,将为明确走马胎的药效物质基础,同时合理使用走马胎提供科学依据。
1 材料和方法 1.1 仪器、试剂和耗材质谱:Waters 3100 SQDMS (低分辨ESI);核磁共振谱:Bruker Avance III 500型核磁共振仪, 以氘代试剂残留溶剂峰为内标;液相色谱与质谱联用仪:Waters 2695 LC偶联Waters Acquity ELSD、Waters 3100 SQDMS,分析色谱柱型号:Waters Sunfire® RP C-18,3.5 μm, 4.6 mm×100 mm;CO2细胞培养箱(上海力申科学仪器有限公司);垂直超净工作台(上海智城分析仪器制造有限公司);低速离心机(科大创新股份有限公司中佳分公司);MK3型酶标仪(美国Thermo fisher公司);超低温冰箱(日本三洋SANYO公司);FM-500型倒置荧光生物显微镜(上海普丹光学仪器有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司)。
Cell Counting Kit-8 (CCK-8)细胞增殖-毒性检测试剂盒(日本同仁化学研究所);Greiss NO试剂盒(碧云天生物技术研究所);MTT噻唑兰(美国Sigma公司);叔丁基过氧化氢(t-BHP)(成都格雷西亚化学技术有限公司);200~300、300~400目柱层析硅胶(青岛海洋化工厂生产);HSGF254 TLC预制薄层板(德国Merck公司);葡聚糖凝胶Sephadex LH-20 (Pharmacia Biotech AB, Uppsala,Sweden);CHP20P MCI树脂(75~150 μm) (Mitsubishi Chemical Corporation);96孔细胞培养板(美国CORNING公司);胎牛血清(FBS) (澳大利亚Gibco公司);青-链霉素(P/S)(Thermo公司);DMEM培养基(美国Gibco公司);RPMI-1640培养基(德国Biological Industries公司);DMSO溶液(美国Sigma公司);HPLC分析用乙腈(Merck公司);实验用水由美国Millipore公司纯水、超纯水系统提供;其他有机溶剂均为国产分析纯产品;TLC显色剂为5%香兰素乙醇液。
1.2 材料走马胎15 kg,2017年12月购于中山市健禾中药饮片有限公司,标本号No. 20171201。
1.3 细胞株炎症细胞株:脂多糖诱导的小鼠单核细胞RAW264.7;肿瘤细胞株:人非小细胞肺癌A549和人大细胞肺癌NCI-H460;神经细胞株:人神经母细胞瘤SH-SY5Y。均来自中国科学院上海生命科学研究院细胞资源中心。
1.4 大叶紫金牛酚的提取和分离走马胎(15 kg),粉碎后用95%工业酒精室温浸泡3次,每次5 d,合并提取液,减压浓缩至无乙醇味。将得到的总浸膏用水悬浮,然后用乙酸乙酯萃取,减压浓缩萃取液,得到乙酸乙酯部位800 g。将乙酸乙酯部位用MCI柱层析处理,以乙醇-水(50%、70%、95%乙醇)为流动相梯度洗脱,得到3个组分A、B和C。
结合化合物结构特征,首先对组分C (605 g)用硅胶(200~300目)柱层析,正己烷:乙酸乙酯[10:1~1:1, V/V(下同)]梯度洗脱,薄层(TLC)检测合并,共获到6个子组分B1~B6。
组分B2经凝胶柱层析,氯仿:甲醇(1:1)洗脱, 得到3个子组分B2A~B2C;B2B经硅胶(300~400目)柱层析,正己烷:乙酸乙酯(10:1~1:1)洗脱, 最后获得化合物1 (102 g),含量约为0.68%。
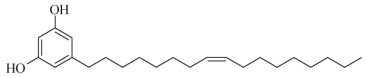
1.5 结构鉴定化合物1 棕色油状物, ESI-MS m/z: 347.28 [M + H]+,1H NMR (500 MHz, CDCl3): δH 6.18 (1H, s, H-2), 6.24 (1H, s, H-4), 6.24 (1H, s, H-6), 2.35 (2H, t, J = 7.2 Hz, H-1′), 1.56 (2H, m, H-2′), 1.27 (2H, over- lapped, H-3′), 1.27 (2H, overlapped, H-4′), 1.27 (2H, overlapped, H-5′), 1.27 (2H, overlapped, H-6′), 2.01 (2H, overlapped, H-7′), 5.35 (1H, overlapped, H-8′), 5.35 (1H, overlapped, H-9′), 2.01 (2H, overlapped, H- 10′), 1.27 (2H, overlapped, H-11′), 1.27 (2H, over- lapped, H-12′), 1.27 (2H, overlapped, H-13′), 1.27 (2H, overlapped, H-14′), 1.27 (2H, overlapped, H-15′), 1.27 (2H, overlapped, H-16′), 0.88 (3H, t, J = 6.5 Hz, H- 17′)。以上数据与大叶紫金牛酚(图 1) [11]的一致。
|
图 1 大叶紫金牛酚结构式 Fig. 1 Structure of gigantifolinol |
体外抗炎活性筛选 采用比色法[11-12],用NO试剂盒测定小鼠巨噬细胞的NO。将小鼠巨噬细胞RAW264.7以5x105浓度接种于96孔板中,置于37℃,5% CO2细胞培养箱中孵育过夜。然后加入10% FBS、LPS和大叶紫金牛酚,轻轻摇晃96孔板,然后继续放置于培养箱中培养,18 h后取100 μL培养基上清液,加入Greiss试剂,室温放置10 min, 然后以完全培养基加显色剂作为空白对照,在420 nm下用酶标仪测定各孔的吸光度(OD值)。阳性对照: L-氮甲基精氨酸(L-NMMA)。
体外抗肿瘤活性筛选 采用MTT法[13],通过测定大叶紫金牛酚对A549和NCI-H460细胞的增殖抑制作用来评价。将MTT溶于磷酸缓冲液(PBS),配成浓度为5 mg mL–1的MTT溶液备用。取对数生长期肿瘤细胞,以RPMI 1640培养液调整细胞悬液浓度为1x105 cfu mL–1,接种于96孔培养板内,每孔加入100 μL,然后分别加入2、4、8、12和16 μg mL–1大叶紫金牛酚100 μL,每个浓度6个复孔,同时设空白对照组(只加培养基)。置于37℃ 5% CO2培养箱中培养72 h后,每孔加入5 mg mL–1的MTT溶液30 μL,继续培养4 h,在160×g下离心22 min,弃上清液,每孔加入100 μL DMSO溶解。酶标仪快速震荡60 s后,570 nm波长处测定吸光度(OD值),计算细胞增殖抑制率和IC50。细胞增殖抑制率IR(%)=(1-OD实验组/OD空白对照)×100%。阳性对照:多柔比星。
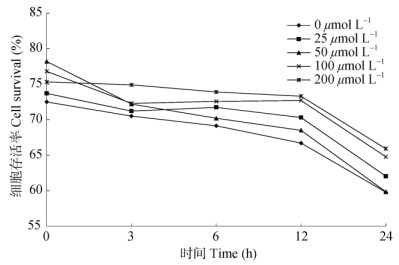
体外神经保护活性筛选 用MTT法[13]检测SH-SY5Y细胞的存活率。将SH-SY5Y细胞以6×109 L–1的浓度接种于经多聚赖氨酸包被过的培养皿中,加入含有10% FBS和1% P/S的DMEM培养基,置37℃ 5% CO2培养箱中培养。每天全量换液1次,隔天传代,并在显微镜下进行观察。将SH- SY5Y细胞以6×105 L–1的浓度接种于多聚赖氨酸包被的96孔板中,每孔100 μL。将细胞分为0 (正常组)、50、100和200 μmol L–1的t-BHP组,每组6个复孔。待细胞融合度达到80%~90%时,吸净培养基,加入含有相应浓度t-BHP的培养基,置于37℃ 5% CO2培养箱中分别培养3、6、12和24 h,观察SH-SY5Y细胞衰老情况。将SH-SY5Y细胞以6×109 L–1的密度接种于多聚赖氨酸包被的96孔板中, 每孔100 μL。将细胞分为正常组、模型组、给药组(含有25、50、100和200 μg mL–1大叶紫金牛酚的模型组),每组6个复孔。置于37℃ 5% CO2培养箱中培养24 h,观察大叶紫金牛酚对SH-SY5Y细胞衰老的保护情况。
2 结果和讨论 2.1 大叶紫金牛酚抗炎活性评价尽管在岭南民间,走马胎一直被用于治疗类风湿关节炎等多种炎症类疾病,疗效也同时被现代临床学研究所证实;然而走马胎治疗炎症类疾病的药效基础一直未见报道。本试验通过大叶紫金牛酚对脂多糖诱导RAW264.7细胞炎症的抑制作用来评价。结果表明,大叶紫金牛酚具有良好的体外抗炎活性,IC50为17.85 μmol L–1。因此,大叶紫金牛酚为走马胎治疗炎症类疾病的药效基础之一。
2.2 大叶紫金牛酚抗肿瘤活性评价现代药理学研究证实,走马胎具有抗肿瘤作用[5-6], 并表明三萜皂苷类成分是走马胎抗肿瘤作用的药效物质之一。大叶紫金牛酚作为走马胎中主要化学成分之一,但尚未见报道其是否具有抗肿瘤作用。本试验通过大叶紫金牛酚对A549和NCI-H460细胞的增殖抑制作用来评价。结果表明,大叶紫金牛酚具有中等抗肿瘤作用,对A549和NCI-H460肿瘤细胞的IC50分别为38.01和12.21μmol L–1。
2.3 大叶紫金牛酚神经保护活性评价细胞衰老是指正常细胞在通路调控下不可逆地进入生长停滞期,在形态学上表现为细胞核膜崩解、细胞膜脆性增加、选择性通透能力下降、多种细胞器和细胞内结构发生退行性形变等状态[14-17]。为综合开发与利用走马胎,本试验通过探讨大叶紫金牛酚是否可以延缓SH-SY5Y细胞衰老来评价其是否具有神经保护作用[18-19]。结果表明(图 2),不给药的模型组对SH-SY5Y细胞存活率有抑制作用,而不同浓度的大叶紫金牛酚则不同程度地对t-BHP的抑制作用有所逆转。因此,大叶紫金牛酚对SH- SY5Y细胞衰老有保护作用,并且与浓度有依赖关系。
|
图 2 MTT法测定SH-SY5Y的存活能力 Fig. 2 SH-SY5Y cell viability determined by MTT |
本研究对大叶紫金牛酚进行了系统研究,首次报道大叶紫金牛酚的抗炎、抗肿瘤以及神经保护活性。实验结果显示,大叶紫金牛酚具有良好的抗炎和抗肿瘤活性,以及具有一定的神经保护活性。明确了大叶紫金牛酚是走马胎治疗炎症类疾病和抗肿瘤的药效物质基础之一,为综合开发与利用走马胎提供科学依据。
| [1] |
LU W J, WANG X F, CHEN J Y, et al. Studies on the chemical constituents of Ardisia gigantifolia Stapf[J]. W China J Pharm Sci, 1990, 5(3): 136-138. 卢文杰, 王雪芬, 陈家源, 等. 大叶紫金牛化学成分的研究[J]. 华西药学杂志, 1990, 5(3): 136-138. DOI:10.13375/j.cnki.wcjps.1990.03.005 |
| [2] |
GUAN Y F, SONG X, QIU M H, et al. Bioassay-guided isolation and structural modification of the anti-TB resorcinols from Ardisia gigantifolia[J]. Chem Biol Drug Des, 2016, 88(2): 293-301. DOI:10.1111/cbdd.12756 |
| [3] |
DAI W B, DONG P P, MEI Q X. The research on the herbal of the Ardisia gigantifolia Stapf and its confusing products[J]. J Chin Med Mat, 2017, 40(9): 2220-2223. 戴卫波, 董鹏鹏, 梅全喜. 走马胎及其混淆品的本草考证[J]. 中药材, 2017, 40(9): 2220-2223. DOI:10.13863/j.issn1001-4454.2017.09.051 |
| [4] |
Guangdong Food and Drug Administration. Standard of Guangdong Traditional Chinese Medicine[M]. Guangzhou: Guangdong Science and Technology Press, 2004: 101-104. 广东省食品药品监督管理局. 广东省中药材标准[M]. 广州: 广东科学技术出版社, 2004: 101-104. |
| [5] |
WEI R, FU J Q, XIE S M, et al. Research progress on the resources and applications of Ardisia gigantifolia[J]. Guangdong For Sci Technol, 2015, 31(5): 94-98. 魏蓉, 负建全, 谢思明, 等. 走马胎资源与利用研究进展[J]. 广东林业科技, 2015, 31(5): 94-98. DOI:10.3969/j.issn.1006-4427.2015.05.019 |
| [6] |
LONG J C, XU C G, WEI G Y, et al. Progress in research of traditional Chinese medicine zoumatai (Ardisia gigantifolia)[J]. Guid J Trad Chin Med Pharm, 2017, 23(21): 75-79. 龙杰超, 徐传贵, 韦贵元, 等. 中药走马胎研究进展[J]. 中医药导报, 2017, 23(21): 75-79. DOI:10.13862/j.cnki.cn43-1446/r.2017.21.024 |
| [7] |
YANG S J. 37 treatment cases of gouty arthritis with Tongyao[J]. J Med Pharm Chin Minorit, 2007, 2(2): 47. 杨圣金. 侗药治疗痛风性关节炎37例[J]. 中国民族医药杂志, 2007, 2(2): 47. DOI:10.3969/j.issn.1006-6810.2007.02.052 |
| [8] |
TANG A P. The clinical observation on treatment of rheumatoid arthritis with the Ardisia gigantifolia Stapf[J]. J Sichuan Trad Chin Med, 2007, 25(1): 54-55. 唐亚平. 中药走马胎治疗类风湿关节炎的临床观察[J]. 四川中医, 2007, 25(1): 54-55. DOI:10.3969/j.issn.1000-3649.2007.01.028 |
| [9] |
LONG Z Z. 48 treatment cases of hyperosteogeny with Guanguan mixture of Tongyao[J]. J Med Pharm Chin Minorit, 2007, 13(11): 13-14. 龙智忠. 侗药走观合剂治疗骨质增生症48例[J]. 中国民族医药杂志, 2007, 13(11): 13-14. DOI:10.3969/j.issn.1006-6810.2007.11.012 |
| [10] |
LONG K E, XIAO C W, LONG S, et al. The study on the treatment technology of fractures of skeletal fractures (6):Clinical observation on 4118 treatmen cases of various bone fractures[J]. J Med Pharm Chin Minorit, 2013, 19(5): 22-24. 龙开娥, 萧成纹, 龙驶, 等. 侗医骨伤骨折治疗技术研究(六)——侗医药治疗各类骨伤骨折4118例临床疗效观察[J]. 中国民族医药杂志, 2013, 19(5): 22-24. DOI:10.3969/j.issn.1006-6810.2013.05.015 |
| [11] |
PARK S H, PARK K H, OH M H, et al. Anti-oxidative and anti- inflamematory activities of caffeoyl hemiterpene glycosides from Spiraea prunifolia[J]. Phytochemistry, 2013, 96: 430-436. DOI:10.1016/j.phytochem.2013.09.017 |
| [12] |
ZHONG W M, CUI Z M, LIU Z K, et al. Three minor new compounds from the aerial parts of Leonurus japonicus[J]. Chin Chem Lett, 2015, 26(8): 1000-1003. DOI:10.1016/j.cclet.2015.05.004 |
| [13] |
HEILMANN J, WASESCHA M R, SCHMIDT T J. The influence of glutathione and cysteine levels on the cytotoxicity of helenanolide type sesquiterpene lactones against KB cells[J]. Bioorg Med Chem, 2001, 9(8): 2189-2194. DOI:10.1016/S0968-0896(01)00131-6 |
| [14] |
ZHANG C, ZHANG J, HUANG J, et al. Analysis based on stem cells kidney essence theory and mechanism of aging[J]. Liaoning J Trad Chin Med, 2014, 41(9): 1877-1879. 张晨, 张进, 黄进, 等. 基于干细胞的"肾精"理论与衰老机制探析[J]. 辽宁中医杂志, 2014, 41(9): 1877-1879. |
| [15] |
SHI A W, LU Q, HOU L L, et al. Mechanism study of Bushen Kang- shuai decoction on senescence of Caenorhabditis elegans[J]. Liaoning J Trad Chin Med, 2013, 40(1): 52-54. 史爱武, 陆勤, 侯莉莉, 等. 补肾抗衰汤影响秀丽隐杆线虫衰老的机制研究[J]. 辽宁中医杂志, 2013, 40(1): 52-54. |
| [16] |
NALETOVA I, SATRIANO C, CURCI A, et al. Cytotoxic phenan- throline derivatives alter metallostasis and redox homeostasis in neuro-blastoma cells[J]. Oncotarget, 2018, 9(91): 36289-36316. DOI:10.18632/oncotarget.26346 |
| [17] |
PENG Y, XING S N, TANG H Y, et al. Influence of glucose transporter 1 activity inhibition on neuroblastoma in vitro[J]. Gene, 2018, 689: 11-17. DOI:10.1016/j.gene.2018.12.010 |
| [18] |
MENDELL A L, MACLUSKY N J. The testosterone metabolite 3α-androstanediol inhibits oxidative stress-induced ERK phosphorylation and neurotoxicity in SH-SY5Y cells through an MKP3/DUSP6- dependent mechanism[J]. Neurosci Lett, 2019, 696: 60-66. DOI:10.1016/j.neulet.2018.12.012 |
| [19] |
GETACHEW B, CSOKA A B, ASCHNER M, et al. Nicotine protects against manganese and iron-induced toxicity in SH-SY5Y cells:Implication for Parkinson's disease[J]. Neurochem Int, 2018, 124: 19-24. DOI:10.1016/j.neuint.2018.12.003 |
 2019, Vol. 27
2019, Vol. 27


