土壤盐渍化是植物生长面临的常见逆境。中国是遭受土壤盐渍化危害较为严重的国家之一,我国盐渍土总面积约3.6×107 hm2,约占全国可利用土地面积的4.88%[1]。由于全球气候变化以及人类活动的干扰, 中国干旱、半干旱地区土壤盐渍化问题更是日趋严重[2]。土壤盐渍化对土壤的通气性、透水性以及养分的有效性均会带来负面影响,最终抑制植物的正常生长[3]。
喜树(Camptotheca acuminata)为蓝果树科(Nyssaceae)喜树属植物。喜树既是优良的园林树种,也是具有抗癌作用的药用植物[4],目前被列为国家Ⅱ级保护植物[5]。据研究,在NaCl胁迫下,喜树幼苗虽然具有一定的渗透调节能力和自由基清除能力,但对盐胁迫依然比较敏感[6]。因此,要想在我国分布广泛的盐渍化土壤中种植喜树,首先要解决喜树特别是幼苗的抗盐栽培问题。
5-氨基乙酰丙酸(5-aminolevulinic acid, ALA)是亚铁血红素生物合成的前体物质[7]。有研究表明, ALA可显著提高植物的抗逆性,促进植物的生长[8-10]。喜树是重要的药用树种,在选择外源调节物质提高喜树抗逆性时,对人的无害性和安全性是我们首先考虑的因素。ALA作为一种外源生长调节剂,就具有易降解、无残留且对人体无毒的优点[11]。ALA这种无毒无残留的特性对于药用植物喜树的抗逆栽培而言就显得弥足珍贵。
需要强调的是,ALA对植物生长的促进作用和抗逆效果会受到施用浓度、施用方式和施用时间的影响,并且因植物种类而异[12]。ALA对喜树逆境条件下缓解效应的研究也还没有系统展开。为此,我们研究了不同浓度的ALA对盐胁迫下喜树幼苗生理生化特性的影响,以期探明ALA缓解喜树幼苗盐害胁迫的合适浓度及其生理生化机理, 为喜树幼苗的抗盐栽培提供一些理论依据和技术支撑。
1 材料和方法 1.1 试验材料选取长势一致(茎粗约7 mm, 株高约30 cm)、生长健壮的1年生喜树幼苗为试验材料,将喜树幼苗种植在大小相同装有等量基质的营养钵(13 cm× 13 cm)中,所用栽培基质为纯砂。
1.2 试验设计本试验以Hoagland营养液+0.5% NaCl为对照,设3个处理, 分别添加40、80和120 mg L–1 ALA喷叶。每处理20株幼苗,3次重复,每试验组60株幼苗。每天早晨10:00,每个营养钵用量筒浇灌含0.5% NaCl的Hoagland营养液100 mL,保持栽培基质基本湿润。
ALA溶液中添加0.01% Triton作展着剂,每隔6 d用家用喷水壶将ALA均匀喷在喜树幼苗的叶片上,每处理用量均为150 mL, 叶片背面和正面均喷施。连续处理3次。在第3次处理后的第6天,每个处理任选5株,测定相关指标。
1.3 方法气体交换参数和叶绿素荧光参数的测定 晴天早上9:00-11:00用美国LI-COR公司的Li-6400便携式光合仪进行测量,分别测定净光合速率(Pn)、气孔导度(Cond)、蒸腾速率(Tr);使用Li-6400-40荧光叶室测量PSⅡ光化学效率(Fv/Fm)、电子传递速率(ETR)、非光化学猝灭系数(NPQ)、光化学猝灭系数(qP)。设定测定温度为25℃,湿度为70%。
叶绿素含量和叶氮含量的测定 选取从上往下数的第2片叶子,使用TYS-3N型植物营养测定仪测定叶绿素含量和叶氮含量。
抗氧化酶活性的测定 超氧化物歧化酶(SOD)活性用氮蓝四唑光还原法测定,过氧化物酶活性(POD)用愈创木酚法测定, 过氧化氢酶(CAT)活性用高锰酸钾滴定法测定[13]。
幼苗干质量的测定 在试验结束时,完整挖出喜树幼苗,漂洗干净,在80℃的烘箱烘干,用电子天平称量干质量。
1.4 数据计算和分析采用Excel 2013和SPSS 16.0进行数据处理, 采用Duncan’s法对数据进行差异显著性分析。
2 结果和分析 2.1 ALA对盐胁迫下叶片光合指标的影响由表 1可以看出,不同浓度ALA处理对喜树幼苗叶片光合特性的影响不同。整体而言,喷施ALA后,喜树幼苗在盐胁迫下的光合作用得到显著的提高。80 mg L–1 ALA对盐胁迫下喜树幼苗叶片光合指标的促进作用最为明显,净光合速率(Pn)、气孔导度(Cond)和蒸腾速率(Tr)分别比对照显著增加了45.38%、47.83%和38.37%。喷施40 mg L–1 ALA后,Pn、Cond和Tr分别比对照显著增加了29.82%、28.26%和19.02%,而喷施120 mg L–1 ALA的Pn、Cond和Tr分别比对照显著增加了26.12%、17.39%和17.83%。
| 表 1 ALA对喜树幼苗光合指标的影响 Table 1 Effect of ALA on photosynthetic indexes of Camptotheca acuminata seedlings |
ALA的喷施浓度不同,对盐胁迫下喜树幼苗叶片叶绿素含量的影响不同(图 1)。用80 mg L–1 ALA喷施喜树幼苗叶片后,叶绿素的含量显著高于对照,是对照的1.43倍。40和120 mg L–1 ALA喷施后,叶片叶绿素含量分别比对照高21.92%和13.37%, 但差异不显著。

|
图 1 ALA对喜树幼苗叶绿素含量的影响 Fig. 1 Effect of ALA on chlorophyll content of Camptotheca acuminata seedlings |
由表 2可知,ALA喷施浓度不同,对盐胁迫下喜树幼苗叶片叶绿素荧光特性的影响不同。喷施ALA,可使喜树幼苗叶片的PSⅡ光化学效率(Fv/ Fm)、电子传递速率(ETR)和光化学猝灭系数(qP)显著增高,非光化学猝灭系数显著降低。80 mg L–1ALA处理的效果最佳,Fv/Fm、ETR和qP分别比对照高24.35%、61.09%和57.43%。
| 表 2 ALA对喜树幼苗叶片叶绿素荧光特性的影响 Table 2 Effects of ALA on chlorophyll fluorescence characteristics of Camptotheca acuminata seedlings |
从表 3可见, 80 mg L–1 ALA对喜树幼苗叶片SOD和POD活性的促进作用更为明显,分别比对照显著高41.57%和71.00%。40和120 mg L–1 ALA对SOD活性亦有显著的促进作用。喷施ALA后,喜树幼苗叶片的CAT活性均增高,但与对照的差异并不显著。
| 表 3 ALA对喜树幼苗抗氧化酶活性的影响 Table 3 Effect of ALA on antioxidant enzyme activities of Camptotheca acuminata seedlings |
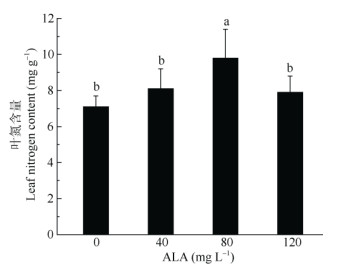
由图 2可以看出,盐胁迫下喜树幼苗叶片氮含量因ALA喷施浓度不同存在差异。和对照相比, 喜树幼苗喷施ALA后,叶片氮含量均有提高。80 mg L–1 ALA处理对喜树幼苗叶片氮含量的促进作用最为明显,比对照显著高38.03%。40和120mg L–1 ALA喷施喜树幼苗叶片后,叶片氮含量亦有提高,分别比对照高11.41%和11.13%。
|
图 2 ALA对喜树幼苗叶片氮素含量的影响 Fig. 2 Effect of ALA on leaf nitrogen content of Camptotheca acuminata seedlings |
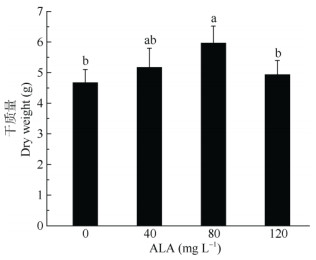
由图 3可以看出,喷施不同浓度ALA,对盐胁迫下喜树幼苗干重的影响存在差异。80 mg L–1 ALA处理对盐胁迫下喜树幼苗干重的促进作用最为显著,比对照高27.62%。40和120 mg L–1ALA喷施后,对盐胁迫下喜树幼苗的干重亦有一定的促进作用,分别比对照高10.71%和5.57%。
|
图 3 ALA对喜树幼苗干质量的影响 Fig. 3 Effect of ALA on dry weight of Camptotheca acuminata seedlings |
喜树对盐胁迫较为敏感,要想在盐渍化土壤中广泛栽培,有必要研究外源调节物质对喜树盐害的缓解作用。ALA具备无残留、无毒性且可提高植物抗逆性的特点[11],是逆境胁迫下喜树外源调节物质的重要选择。本研究结果表明,喷施ALA后,植物幼苗的盐害能够得到一定程度的缓解,这和徐晓洁等[14]的研究结果一致。
但是,ALA对喜树幼苗盐胁迫的缓解效果并没有随ALA浓度的增加而增强,本研究结果表明, 80 mg L–1 ALA处理的缓解效果最佳,盐胁迫下喜树幼苗叶片中的保护酶活性,特别是POD,显著高于对照;光合色素和净光合速率均高于对照40%以上,使幼苗受到的盐害得到了一定程度的缓解,最终幼苗的干重比对照高27.62%。但是,40和120 mg L–1 ALA处理效果均比不上80 mg L–1的。因此, ALA对喜树幼苗盐胁迫的缓解有明显的剂量效应。
3.2 外源ALA与叶片保护酶活性的关系盐胁迫打破了植物体活性氧生成和清除的动态平衡,使活性氧自由基过多积累,最终对植物细胞造成伤害[14-16]。而SOD、POD和CAT这3种抗氧化酶可以协同作用清除细胞内的H2O2和氧分子,进而维持活性氧的代谢平衡[17]。本研究结果表明, 喷施ALA后,喜树幼苗叶片中的SOD和POD活性均显著升高,以80 mg L–1 ALA处理的效果最佳。随着SOD和POD活性的增强,喜树幼苗对活性氧的清除能力进一步提高,膜脂过氧化反应得到一定程度的抑制,光合膜的破坏作用也会得到缓解[18], 这对喜树幼苗的光合作用而言显然是有利的。
同时,虽然ALA是亚铁血红素生物合成的前体物质[10],POD是以亚铁血红素为辅基的酶类[19]。但本研究中,随着ALA喷施浓度的提高,POD活性呈先增高再降低的趋势,两者并不存在线性关系。因此,我们并不能得出ALA被喜树幼苗吸收后能够转化为亚铁血红素,并最终提高POD活性的结论。
3.3 外源ALA与叶片氮含量和叶绿素含量的关系氮(N)作为叶绿素的组成元素,可以直接影响到叶绿体的数目和叶绿体的基粒结构。此外,N还是Rubisco等许多光合关键酶的组成元素。本研究结果表明,喜树幼苗喷施ALA后,叶片中的氮含量均有所增高,以80 mg L–1 ALA的促进作用最为明显。这和俞建良等[11]的研究结果相近。喜树幼苗N含量的提高,对光合关键酶类和叶绿素含量的提高都会有一定的促进作用。
ALA能够在前质体或叶绿体中形成原叶绿素酸脂,再经过光还原作用最终形成叶绿素[20]。本研究结果表明,随喷施ALA浓度升高,喜树幼苗叶片的叶绿素含量呈先增加再下降的趋势,以80 mg L–1 ALA处理达到峰值。这说明外源ALA和喜树幼苗叶片的叶绿素含量间并不存在线性关系。由此推断,ALA喷施叶片后,很可能并不是作为叶绿素合成前体在起作用,而只是作为生长调节物质参与喜树叶绿素合成并调节喜树幼苗生长[21],这还有待于深入研究。
ALA对盐胁迫下喜树幼苗叶绿素的保护作用可能是因为其降低了逆境条件下叶绿素酶活性并促进了原叶绿素酸脂还原酶复合体的合成有关[22-23]。叶绿素含量与净光合速率呈显著正相关[22],较高的叶绿素含量对于净光合速率的提高具有很好的促进作用。
3.4 外源ALA与光合作用的关系植物通过光合作用将无机物质转化为有机物, 同时固定太阳光能。光合作用也是绿色植物对各种内外因子最敏感的生理过程之一[24-25]。本研究结果表明,喷施ALA能显著促进盐胁迫下喜树幼苗的光合作用,喷施80 mg L–1 ALA后,叶片的净光合速率、气孔导度和蒸腾速率均显著增加,这与常青山等[26]和张春平等[27]的研究结果类似。
叶绿素荧光动力学技术被视为植物光合作用的无伤探针而被广泛应用于植物逆境生理研究[28-29]。光化学猝灭(qP)反映了光能用于光化学反应电子传递的份额,也在一定程度上反映了PSII反应中心的开放程度;非光化学猝灭(NPQ)反映了由热耗散引起的荧光猝灭[30-31]。本研究结果表明, 喷施ALA后喜树幼苗的Fv/Fm、ETR和qP显著增加, NPQ则显著下降。这表明喷施外源ALA后, 盐胁迫下喜树幼苗PSⅡ受到的破坏得到了缓解,PSⅡ的潜在光合作用活力得到了提高,最终Fv/Fm显著增高。
关于ALA促进植物生物量增加的报道已有很多[21, 27, 32-33]。盐胁迫往往会引起植物叶片凋落并抑制植物的生长。本研究结果表明,80 mg L–1 ALA处理,喜树幼苗的生物量显著高于对照,比对照高27.62%。这表明适宜浓度的ALA对喜树幼苗的盐害胁迫有很好的缓解作用,很好地抑制了叶片凋落。当然,喜树幼苗干重的增加也是盐胁迫下光合作用危害减少,光合活力得到维持的结果。
综上所述, ALA之所以能够缓解盐害对喜树幼苗的伤害,主要是因为适宜浓度ALA可促进SOD和POD等关键抗氧化酶的活性[34],缓解了细胞膜脂过氧化;适宜浓度ALA可显著提高盐胁迫下喜树幼苗叶片中的氮和叶绿素含量,确保了幼苗叶片中叶绿体的数目和光合关键酶的活性[11, 35];适宜浓度ALA能够使盐胁迫下喜树幼苗PSⅡ受到的破坏得到缓解、光能捕获效率和光合效率得到提高,进而促进光合碳同化能力[36]。
| [1] |
WANG J L, HUANG X J, ZHONG T Y, et al. Review on sustainable utilization of salt-affected land[J]. Acta Geogr Sin, 2011, 66(5): 673-684. 王佳丽, 黄贤金, 钟太洋, 等. 盐碱地可持续利用研究综述[J]. 地理学报, 2011, 66(5): 673-684. DOI:10.11821/xb201105010 |
| [2] |
LIU Q M, CHENG Q M, WANG X, et al. Soil salinity inversion in Hetao Irrigation district using microwave radar[J]. Trans Chin Soc Agric Eng, 2016, 32(16): 109-114. 刘全明, 成秋明, 王学, 等. 河套灌区土壤盐渍化微波雷达反演[J]. 农业工程学报, 2016, 32(16): 109-114. DOI:10.11975/j.issn.1002-6819.2016.16.016 |
| [3] |
GAO F, HUANG Q, SUN X Y, et al. Study on dynamic changes of the soil salinization in the upper stream of the Tarim River based on RS and GIS[J]. Procedia Environ Sci, 2011, 11: 1135-1141. DOI:10.1016/j.proenv.2011.12.171 |
| [4] |
WANG Y, DAI S J, YAN X F. Effects of light intensity on secondary metabolite camptothecin production in leaves of Camptotheca acuminata seedlings[J]. Acta Ecol Sin, 2004, 24(6): 1118-1122. 王洋, 戴绍军, 阎秀峰. 光强对喜树幼苗叶片次生代谢产物喜树碱的影响[J]. 生态学报, 2004, 24(6): 1118-1122. DOI:10.3321/j.issn:1000-0933.2004.06.004 |
| [5] |
KANG J Q, ZHANG J Q, LI Z J, et al. A newly recorded national key protected plant of Camptotheca acuminate from Shaanxi Province[J]. J Shaanxi Norm Univ (Nat Sci), 2017, 45(2): 68-70. 康菊清, 张建强, 李智军, 等. 陕西省国家重点保护植物一分布新记录种——喜树(Camptotheca acuminata)[J]. 陕西师范大学学报(自然科学版), 2017, 45(2): 68-70. DOI:10.15983/j.cnki.jsnu.2017.02.324 |
| [6] |
HAO F G, ZHOU J G, ZHOU X M. Effects of NaCl stress on leaf physiological characteristics and growth of Camptotheca acuminata seedlings[J]. J NE For Univ, 2010, 38(1): 18-19. 郝峰鸽, 周俊国, 周秀梅. NaCl胁迫对喜树幼苗生长和叶片生理特性的影响[J]. 东北林业大学学报, 2010, 38(1): 18-19. DOI:10.3969/j.issn.1000-5382.2010.01.006 |
| [7] |
SASAKI K, WATANABE M, TANAKA T, et al. Biosynthesis, biotechnological production and applications of 5-aminolevulinic acid[J]. Appl Microbiol Biotechnol, 2002, 58(1): 23-29. DOI:10.1007/s00253-001-0858-7 |
| [8] |
WANG L J, JIANG W B, HUANG B J. Promotion of photosynthesis by 5-aminolevulinic acid (ALA) during and after chilling stress in melon seedlings grown under low light condition[J]. Acta Hort Sin, 2004, 31(3): 321-326. 汪良驹, 姜卫兵, 黄保健. 5-氨基乙酰丙酸对弱光下甜瓜幼苗光合作用和抗冷性的促进效应[J]. 园艺学报, 2004, 31(3): 321-326. DOI:10.3321/j.issn:0513-353X.2004.03.007 |
| [9] |
HOTTA Y, TANAKA T, TAKAOKA H, et al. New physiological effects of 5-aminolevulinic acid in plants:The increase of photosynthesis, chlorophyll content, and plant growth[J]. Biosci Biotechnol Biochem, 1997, 61(12): 2025-2028. DOI:10.1271/bbb.61.2025 |
| [10] |
LIU W Q, KANG L, WANG L J. Effects on strawberry photosynthesis and relations to anti-oxidant enzymes of ALA[J]. Acta Bot Boreali-Occid Sin, 2006, 26(1): 57-62. 刘卫琴, 康琅, 汪良驹. ALA对草莓光合作用的影响及其与抗氧化酶的关系[J]. 西北植物学报, 2006, 26(1): 57-62. DOI:10.3321/j.issn:1000-4025.2006.01.011 |
| [11] |
YU J L, GUO X X, XIONG J Q. Research progress of application of 5-aminolevulinic acid[J]. Chem Bioengin, 2015, 10(9): 10-15. 俞建良, 郭孝孝, 熊结青. 5-氨基乙酰丙酸的应用研究进展[J]. 化学与生物工程, 2015, 10(9): 10-15. DOI:10.3969/j.issn.1672-5425.2015.09.003 |
| [12] |
KANTHA T, CHAIYASUT C, KANTACHOTE D, et al. Selection of photosynthetic bacteria producing 5-aminolevulinic acid from soil of organic saline paddy fields from the Northeast region of Thailand[J]. Afr J Microbiol Res, 2010, 4(17): 1848-1855. |
| [13] |
LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 98-100. 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 98-100. |
| [14] |
XU X J, ZOU Z R, QIAO F, et al. Effects of ALA on tomato in photosynthesis, activity of protective enzymes and yield under NaCl stress[J]. Agric Res Arid Areas, 2008, 26(4): 131-135. 徐晓洁, 邹志荣, 乔飞, 等. ALA对NaCl胁迫下不同品种番茄植株光合作用、保护酶活性及果实产量的影响[J]. 干旱地区农业研究, 2008, 26(4): 131-135. |
| [15] |
ZHU Q Z, JIANG S, ZHANG Z H. Effects of chitosan on protective enzyme activities in seedlings of wheat under drought stress[J]. J Arid Land Resour Environ, 2012, 26(5): 145-147. 朱启忠, 姜山, 张真豪. 干旱胁迫下壳聚糖对小麦幼苗保护酶活性的影响[J]. 干旱区资源与环境, 2012, 26(5): 145-147. DOI:10.13448/j.cnki.jalre.2012.05.010 |
| [16] |
AROCA R, IRIGOYEN J J, S NCHEZ-D AZ M. Photosynthetic characteristics and protective mechanisms against oxidative stress during chilling and subsequent recovery in two maize varieties differing in chilling sensitivity[J]. Plant Sci, 2001, 161(4): 719-726. DOI:10.1016/S0168-9452(01)00460-5 |
| [17] |
ZHANG F, YU J H, JIE J M, et al. Influence of exogenous ALA and Spd on photosynthesis and antioxidant system of low temperature and poor light affected pepper seedlings[J]. Sci Agric Sin, 2013, 46(11): 2298-2306. 张帆, 郁继华, 颉建明, 等. 外源ALA和Spd对低温弱光下辣椒幼苗光合作用及抗氧化系统的影响[J]. 中国农业科学, 2013, 46(11): 2298-2306. DOI:10.3864/j.issn.0578-1752.2013.11.014 |
| [18] |
LI T L, LI M, SUN Z P. Regulation effect of calcium and salicylic acid on defense enzyme activities in tomato leaves under sub-high temperature stress[J]. Chin J Appl Ecol, 2009, 20(3): 586-590. 李天来, 李淼, 孙周平. 钙和水杨酸对亚高温胁迫下番茄叶片保护酶活性的调控作用[J]. 应用生态学报, 2009, 20(3): 586-590. DOI:10.13287/j.1001-9332.2009.0097 |
| [19] |
van HUYSTEE R B. Porphyrin and peroxidase synthesis in cultured peanut cells[J]. Can J Bot, 1977, 55(10): 1340-1344. DOI:10.1139/b77-155 |
| [20] |
WANG Z. Plant Physiology[M]. Beijing: China Agricultural Press, 2000: 102-103. 王忠. 植物生理学[M]. 北京: 中国农业出版社, 2000: 102-103. |
| [21] |
HOTTA Y, TANAKA T, TAKAOKA H, et al. New physiological effects of 5-aminolevulinic acid in plants:The increase of photosynthesis, chlorophyll content, and plant growth[J]. Biosci Biotechnol Biochem, 1997, 61(12): 2025-2028. DOI:10.1271/bbb.61.2025 |
| [22] |
MENG J, CHEN W F, XU Z J, et al. Study on photosynthetic rate and chlorophyll content[J]. J Shenyang Agric Univ, 2001, 32(4): 247-249. 孟军, 陈温福, 徐正进, 等. 水稻剑叶净光合速率与叶绿素含量的研究初报[J]. 沈阳农业大学学报, 2001, 32(4): 247-249. DOI:10.3969/j.issn.1000-1700.2001.04.002 |
| [23] |
van ASSCHE F, CLIJSTERS H. Effects of metals on enzyme activity in plants[J]. Plant Cell Environ, 1990, 13(3): 195-206. DOI:10.1111/j.1365-3040.1990.tb01304.x |
| [24] |
PAN R C. Plant Physiology[M]. Beijing: Higher Education Press, 2004: 83-86. 潘瑞炽. 植物生理学[M]. 北京: 高等教育出版社, 2004: 83-86. |
| [25] |
YUN J Y, YANG J D, ZHAO H L. Research progress in the mechanism for drought and high temperature to affect plant photosynthesis[J]. Acta Bot Boreali-Occid Sin, 2006, 26(3): 641-648. 云建英, 杨甲定, 赵哈林. 干旱和高温对植物光合作用的影响机制研究进展[J]. 西北植物学报, 2006, 26(3): 641-648. DOI:10.3321/j.issn:1000-4025.2006.03.036 |
| [26] |
CHANG Q S, ZHANG L X, MI Y F, et al. Effects of exogenous ALA on antioxidant capacities and photosynthetic characteristics in Prunella vulgaris seedlings under salt stress[J]. J Nucl Agric Sci, 2017, 31(10): 2055-2062. 常青山, 张利霞, 米银法, 等. 外源ALA对盐胁迫下夏枯草幼苗抗氧化能力与光合特性的影响[J]. 核农学报, 2017, 31(10): 2055-2062. DOI:10.11869/j.issn.100-8551.2017.10.2055 |
| [27] |
ZHANG C P, ZHOU H, HE P, et al. Effect of exogenous 5-amino-levulinic acid on photosynthesis and chlorophyll fluorescence characteristics of Coptis chinensis Franch. seedlings under NaCl stress[J]. Acta Bot Boreali-Occid Sin, 2014, 34(12): 2515-2524. 张春平, 周慧, 何平, 等. 外源5-氨基乙酰丙酸对盐胁迫下黄连幼苗光合参数及其叶绿素荧光特性的影响[J]. 西北植物学报, 2014, 34(12): 2515-2524. DOI:10.7606/j.issn.1000-4025.2014.12.2515 |
| [28] |
CAI J G, WEI M Q, ZHANG Y, et al. Effects of shading on photo-synthetic characteristics and chlorophyll fluorescence parameters in leaves of Hydrangea macrophylla[J]. Chin J Plant Ecol, 2017, 41(5): 570-576. 蔡建国, 韦孟琪, 章毅, 等. 遮阴对绣球光合特性和叶绿素荧光参数的影响[J]. 植物生态学报, 2017, 41(5): 570-576. DOI:10.17521/cjpe.2016.0245 |
| [29] |
LI Z, TAN X F, LU K, et al. Influence of drought stress on the growth, leaf gas exchange, and chlorophyll fluorescence in two varieties of tung tree seedlings[J]. Acta Ecol Sin, 2017, 37(5): 1515-1524. 李泽, 谭晓风, 卢锟, 等. 干旱胁迫对两种油桐幼苗生长、气体交换及叶绿素荧光参数的影响[J]. 生态学报, 2017, 37(5): 1515-1524. DOI:10.5846/stxb201509201939 |
| [30] |
van KOOTEN O, SNEL J F H. The use of chlorophyll fluorescence nomenclature in plant stress physiology[J]. Photosynth Res, 1990, 25(3): 147-150. DOI:10.1007/BF00033156 |
| [31] |
GOVIDJEE. A role for a light-harvesting antenna complex of photosystem Ⅱ in photoprotection[J]. Plant Cell, 2002, 14: 1663-1668. DOI:10.1105/tpc.140810 |
| [32] |
SONG Y L, RAO J P, WANG T, et al. Effects of ALA on post-harvest quality and storability of spinach[J]. Acta Agric Boreali-Occid Sin, 2008, 17(3): 258-262. 宋永令, 饶景萍, 王婷, 等. 采前5-氨基乙酰丙酸(ALA)处理对菠菜品质及耐贮性的影响[J]. 西北农业学报, 2008, 17(3): 258-262. DOI:10.7606/j.issn.1004-1389.2008.03.056 |
| [33] |
AL-KHATEEB S A. Promotive effect of 5-aminolevulinic acid on growth, yield and gas exchange capacity of barley (Hordeum vulgare L.) grown under different irrigation regimes[J]. J King Saud Univ, Agric Sci, 2006, 18(2): 103-111. |
| [34] |
ZHAO Y Y, HU X H, ZOU Z R, et al. Effects of seed soaking with different concentrations of 5-aminolevulinic acid on the germination of tomato (Solanum lycopersicum) seeds under NaCl stress[J]. Acta Ecol Sin, 2013, 33(1): 62-70. 赵艳艳, 胡晓辉, 邹志荣, 等. 不同浓度5-氨基乙酰丙酸(ALA)浸种对NaCl胁迫下番茄种子发芽率及芽苗生长的影响[J]. 生态学报, 2013, 33(1): 62-70. DOI:10.5846/stxb201110311628 |
| [35] |
LI H Z, SUN J L, ZHAO B L, et al. Foliar spray of 5-aminolevulinic acid on photosynthetic characteristics of wild jujube under NaCl stress[J]. Acta Bot Boreali-Occid Sin, 2017, 37(5): 952-958. 李汉钊, 孙军利, 赵宝龙, 等. 外源5-氨基乙酰丙酸对NaCl胁迫下酸枣光合特性的影响[J]. 西北植物学报, 2017, 37(5): 952-958. DOI:10.7606/j.issn.1000-4025.2017.05.0952 |
| [36] |
LIN Y Y, YANG X M, YANG Y G. Effects of 5-ALA on seed germination and growth of Poa pratensis under abiotic stress[J]. Acta Agrest Sin, 2017, 25(4): 782-789. 林艳艳, 杨雪梅, 杨云贵. 五氨基乙酰丙酸对逆境下草地早熟禾萌发及生长的影响[J]. 草地学报, 2017, 25(4): 782-789. DOI:10.11733/j.issn.1007-0435.2017.04.014 |
 2019, Vol. 27
2019, Vol. 27

