2. 中国科学院华南植物园, 中国科学院植物资源保护与可持续利用重点实验室, 广州 510650
2. Key Laboratory of Plant Resources Conservation and Sustainable Utilization, Guangdong Provincial Key Laboratory of Applied Botany, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China
癌症是严重威胁人类生命和健康的重大疾病。据统计,2014年全国恶性肿瘤估计死亡病例229.6万例,肿瘤死亡率0.17%,肺癌和乳腺癌分别位居男女性发病的第1位[1]。寻找新的抗肿瘤先导化合物具有重要意义。一些酚类物质在甲醚化后抗肿瘤活性有所提高,例如:黄酮类化合物白杨素甲醚化后生成5, 7-二甲氧基黄酮,能够降低急性淋巴细胞白血病细胞增殖水平[2]。二苯乙烯类植物多酚白藜芦醇(3, 5, 4′-三羟基二苯乙烯)及其类似物的生物活性, 可因结构中甲氧基及其取代位置的不同而变化。Weng等[3-4]报道白藜芦醇及其甲氧基类似物如三甲氧基白藜芦醇可抑制肝癌细胞的转移和浸润性质, 还对非小细胞肺癌A549细胞增殖有明显抑制作用,而白藜芦醇对A549细胞无效;白藜芦醇和三甲氧基白藜芦醇在25 μmol L–1工作浓度下对乳腺癌MDA-MB-231细胞的生长有明显抑制作用[5]。
豆科植物树豆[Cajanus cajan (Linn.) Mill.](又名木豆)叶有多方面的药理作用, 文献报道,12-羟基木豆菧酸具有良好的自由基清除活性和体外抗肿瘤活性[6];木豆素体外作用于乳腺癌细胞可引起细胞周期停滞并诱导细胞凋亡[7];木豆菧H具有体外诱导人骨髓间充质细胞分化为成骨细胞的作用,并对多种肿瘤细胞表现出中等强度抑制作用[8];木豆素C对多种人源肿瘤细胞株的增殖表现出明显抑制作用[9-10];树豆酮酸A经动物试验,具有显著降低糖尿病大鼠的血糖、血脂的作用[11]。树豆二苯乙烯类成分的结构与白藜芦醇相似,其甲氧基类似物有可能也具有抗肿瘤生物活性,所以我们对源自于树豆叶的4个二苯乙烯类成分木豆素C、树豆酮酸A、Cajanotone和木豆素进行甲醚化反应[12],反应产物经硅胶柱层析纯化和波谱分析确定结构。以白藜芦醇及其甲氧基衍生物为对照,检测相关化合物的体外抗肿瘤活性。本文报道这类甲醚化衍生物的制备、结构鉴定,以及体外抗肿瘤活性的测试结果。
1 材料和方法 1.1 仪器、试剂和耗材DRX-400核磁共振仪、EQUINOX55型红外波谱仪(德国Bruker公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);C506- Triple TOF 5600系统(美国AB SCIEX公司);LC6000型高效制备液相色谱仪、LC3000型高效制备液相色谱仪(北京创新通恒有限公司);UV D-170U、Chro- meleon色谱工作站高效液相色谱仪(美国Dionex公司);SHIM-PACK色谱柱(日本SHIMADZU公司); 硅胶(200~300目)、硅胶TLC薄层预制板(青岛海洋化工厂分厂);Sephadex LH-20葡聚糖凝胶(美国GE Healthcare公司);HPLC分析,使用Merck公司甲醇; 其他溶剂和试剂均为国产分析纯产品。TLC显色剂为6%香兰素乙醇液-12%高氯酸溶液等体积混合液。
细胞培养基RPMI 1640 (德国Biological Industries公司,批号0012118);胎牛血清(FBS)(澳大利亚Gibco公司,批号1704206)。
CO2细胞培养箱(上海力申科学仪器有限公司); 垂直超净工作台(上海智城分析仪器制造有限公司); 倒置光学显微镜(日本Olympus公司);低速离心机(科大创新股份有限公司中佳分公司);MK3型酶标仪(美国Thermo fisher公司);Cell Counting Kit-8 (CCK-8)细胞增殖-毒性检测试剂盒(日本同仁化学研究所)。
1.2 反应原料木豆素C,树豆酮酸A,Cajanotone和木豆素均从树豆叶分离得到[8, 10, 13]。
1.3 细胞株人乳腺癌MDA-MB-231细胞、人宫颈癌HeLa细胞、人肝癌HepG2细胞、人结肠癌SW480细胞、人非小细胞肺癌A549、NCI-H1299和NCI-H460均来自中国科学院上海生命科学研究院细胞资源中心。
1.4 树豆菧类成分的甲醚化木豆素C (500 mg, 1.7 mmol)溶于乙腈(5 mL), 加入无水碳酸钾(400 mg, 2.9 mmol),于室温(28℃~ 32℃)下搅拌20 min,缓慢滴入200 μL碘甲烷(460 mg, 3.2 mmol),搅拌3 h (经TLC检测反应至终点),加水5 mL淬灭反应;加乙酸乙酯15 mL萃取反应液3次,合并乙酸乙酯溶液,减压蒸干,得粗产物;粗产物经硅胶(200~300目)柱层析,以正己烷-乙酸乙酯(50:1)洗脱,得产物1 (317 mg,图 1),收率60.6%。
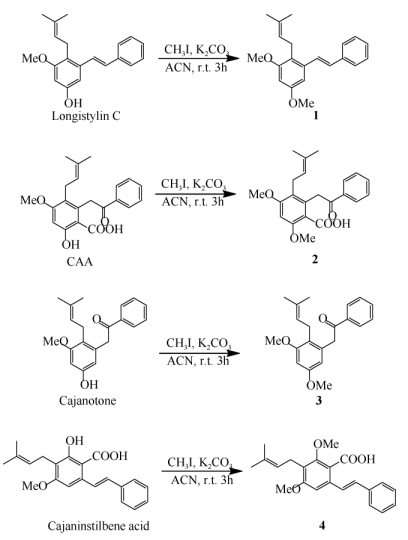
|
图 1 甲醚化产物1~4的结构 Fig. 1 Structures of methoxylated products 1-4 |
树豆酮酸A (93 mg, 0.26 mmol)溶于乙腈(5 mL), 加入无水碳酸钾(120 mg, 0.87 mmol),缓慢滴入20 μL碘甲烷(46 mg, 0.32 mmol),后续处理过程与制备化合物1的相同,硅胶柱层析流动相为正己烷-乙酸乙酯(20:1~10:1),得化合物2 (35.6 mg,图 1),收率36.8%。
以Cajanotone (40 mg, 0.13 mmol)溶于乙腈(5 mL), 加入无水碳酸钾(60 mg, 0.44 mmol),缓慢滴入10 μL碘甲烷(23 mg, 0.16 mmol),后续处理过程与制备化合物1的相同,硅胶柱层析流动相为正己烷-乙酸乙酯(20:1~10:1),得化合物3 (14.3 mg,图 1),收率34.2%。
木豆素(236 mg, 0.70 mmol)溶于乙腈(5 mL),加入无水碳酸钾(300 mg, 2.17 mmol),缓慢滴入80 μL碘甲烷(184 mg, 1.28 mmol),后续处理过程与制备化合物1的相同,硅胶柱层析流动相为正己烷-乙酸乙酯(50:1~20:1),得化合物4 (35 mg,图 1),收率14.8%。
1.5 结构鉴定化合物1 白色粉末,ESI-MS m/z: 308.9 [M + H]+。1H NMR (400 MHz, CDCl3): δ 7.55 (2H, d, J = 7.6 Hz, H-2′, H-6′), 7.42 (2H, m, H-3′, H-5′), 7.41 (1H, m, H-4′), 7.30 (2H, d, J = 12 Hz, H-7, H-8), 6.79 (1H, d, J = 2.4 Hz, H-4), 6.46 (1H, d, J = 2 Hz, H-6), 5.16 (1H, t, J = 6.4 Hz, H-2”), 3.95 (3H, s, 3-OCH3), 3.88 (3H, s, 5-OCH3), 3.48 (2H, d, J = 9.2 Hz, H-1”), 1.84 (3H, s, H-4”), 1.71 (3H, s, H-5”); 13C NMR (100 MHz, CDCl3): δ 158.5 (C, C-3), 158.3 (C, C-5), 137.5 (C, C-1, C-1′), 130.9 (CH, C-3”), 130.3 (CH, C-7), 128.6 (CH, C-3′, C-5′), 127.6 (CH, C-4”), 126.8 (CH, C-8), 126.5 (CH, C-2′, C-6′), 123.4 (CH, C-2”), 121.1 (C, C-2), 101.4 (CH, C-4), 98.1 (CH, C-6), 55.6 (CH3, 3-OCH3), 55.3 (CH3, 5- OCH3), 25.9 (CH3, C-4”), 24.4 (CH2, C-1”), 17.9 (CH3, C-5”)。以上数据与5-O-methyl-longistilin C一致[14]。
化合物2 白色粉末,ESI-MS m/z: (neg.) 367.1 [M-H]–。1H NMR (400 MHz, CDCl3): δ 11.59 (1H, s, H-COOH), 8.06 (2H, s, J = 7.6 Hz, H-2′, H-6′), 7.61 (1H, t, J = 7.2 Hz, H-4′), 7.52 (2H, t, J = 7.6 Hz, H-3′, H-5′), 6.46 (1H, s, H-3), 4.95 (1H, t, J = 7.2 Hz, H-7), 3.85 (3H, s, 4-OCH3), 3.48 (3H, s, 2-OCH3), 3.27 (2H, d, J = 6 Hz, H-1”), 1.61 (3H, s, H-4”), 1.59 (3H, s, H-5”); 13C NMR (100 MHz, CDCl3): δ 197.1 (C, C-8), 171.2 (C, 1-COOH), 163.6 (C, C-4), 162.5 (C, C-2), 137.0 (C, C-1′), 136.7 (C, C-6), 133.0 (C, C-4′), 131.6 (C, C-3”), 128.7 (CH, C-3′, C-5′), 123.1 (C, C-5), 122.7 (CH, C-2”), 105.2 (C, C-1), 98.6 (CH, C-3), 55.7 (CH3, 4-OCH3), 51.9 (CH3, 2-OCH3), 41.6 (CH2, C-7), 25.6 (CH3, C-5”), 24.9 (CH2, C-1”), 17.8 (CH3, C-4”)。以上数据与5-O-methyl-cajanonic acid A的一致[15]。
化合物3 白色粉末,ESI-MS m/z: (pos.) 347.0 [M + Na]+。1H NMR (400 MHz, CDCl3): δ 8.01 (2H, d, J = 7.6 Hz, H-2′, H-6′), 7.57 (1H, t, J = 7.2 Hz, H-4′), 7.46 (2H, t, J = 7.2 Hz, H-3′, H-5′), 6.41 (1H, d, J = 2 Hz, H-6), 5.00 (1H, t, J = 6.4 Hz, H-2”), 4.26 (2H, s, H-7), 3.78 (3H, s, 3-OCH3), 3.74 (3H, s, 5- OCH3), 3.26 (2H, d, J = 6.4 Hz, H-1”), 1.59 (3H, s, H- 4”), 1.51 (3H, s, H-5”); 13C NMR (100 MHz, CDCl3): δ 197.8 (C, C-8), 158.4 (C, C-3, C-5), 136.7 (C, C-1′), 134.9 (C, C-1), 133.1 (CH, C-4′), 131.2 (C, C-3”), 128.6 (CH, C-2′, C-6′), 123.2 (CH, C-2”), 121.1 (C, C-2), 106.6 (CH, C-4), 97.5 (CH, C-6), 55.6 (CH3, 3- OCH3), 55.2 (CH3, 5-OCH3), 43.2 (CH2, C-7), 25.6 (CH3, C-5”), 24.8 (CH2, C-1”), 17.8 (CH3, C-4”)。因此,化合物3的结构确定为5-O-methyl-cajanotone (表 1,图 2)[16]。
| 表 1 Cajanotone与化合物3的核磁数据(溶剂为CDCl3) Table 1 NMR data of cajanotone and compound 3 (in CDCl3) |
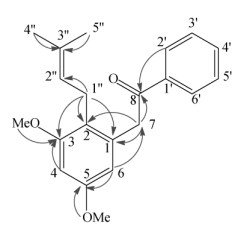
|
图 2 化合物3主要的HMBC(  |
化合物4 白色粉末,ESI-MS m/z: (neg.) 351.0 [M-H]–。1H NMR (400 MHz, CDCl3): δ 11.74 (1H, s, COOH), 7.75 (1H, d, J= 16 Hz, H-8), 7.53 (2H, t, J = 7.6 Hz, H-2′, H-6′), 7.39 (2H, t, J = 7.6 Hz, H-3′, H-5′), 6.81 (1H, d, J = 16 Hz, H-7), 6.62 (1H, s, H-5), 5.23 (1H, t, H-2”), 3.94 (3H, s, 4-OCH3), 3.93 (3H, s, 2-OCH3), 3.40 (2H, d, J = 8 Hz, H-1”), 1.81 (3H, s, H-4”), 1.69 (3H, s, H-5”); 13C NMR (100 MHz, CDCl3): δ 171.9 (C, 1-COOH), 161.4 (C, C-4), 161.3 (C, C-2), 140.3 (C, C- 6), 137.4 (C, C-1′), 131.9 (C, C- 3”), 130.6 (CH, C-8), 128.7 (CH, C-3′, C-5′), 127.7 (CH, C-7), 126.5 (CH, C-2', C-6'), 122.0 (CH, C-2”), 116.6 (C, C-3), 104.4 (C, C-1), 102.8 (CH, C-5), 55.6 (CH3, 4-OCH3), 52.3 (CH3, 2-OCH3), 25.8 (CH3, C-4”), 22.1 (CH2, C-1”), 17.8 (CH3, C-5”)。以上数据与5-O- methyl-cajaninstilbene acid的一致[17]。
1.6 体外抗肿瘤活性研究样品对HeLa、SW480、HepG2、A549、NCI- H460、NCI-H1299、MDA-MB-231细胞的增殖抑制试验(CCK-8法):胰酶消化收集生长良好的细胞, 用新鲜培养液配成5×104个mL–1的单细胞悬液,按每孔100 μL接种于96孔板中,置于孵育箱中培养24 h使细胞贴壁。将样品用细胞培养液稀释至需要的百分浓度,按每孔100 μL替换原有的细胞培养液,每个浓度设3个复孔。试验设置不含药物的阴性对照,并对每个药物作用浓度设置不含细胞的药物空白对照。将细胞板置于孵育箱孵育72 h后取出, 每孔加入10 μL CCK-8,再置于孵育箱孵育1.5 h。取出细胞培养板,于450 nm检测每孔吸收值A。样品对肿瘤细胞增殖的抑制率(%)=100×(A阴性-A药物)/ (A阴性-A空白),并求得其对细胞增殖的半数抑制浓度IC50,即细胞增殖抑制率为50%时的作用浓度。
2 结果和讨论我们利用树豆天然二苯乙烯类成分木豆素C、树豆酮酸A、Cajanotone和木豆素作为原料,以碘甲烷为甲醚化反应试剂,进行甲醚化反应,得到了2-异戊烯基-3, 5-二甲氧基二苯乙烯(1)、树豆酮酸A-O-甲醚(2)、5-O-methyl cajanotone (3)和3-O-甲基木豆素(4)。其中化合物3是新化合物。Zhang等报道, Cajanotone和木豆素对肺癌A549细胞的IC50分别为5.9和4.4 μmol L–1,对肝癌HepG2细胞的IC50为12.2~17.9 μmol L–1;木豆素C对这几种肿瘤细胞呈显著细胞毒活性(IC50为3.5~6.0 μmol L–1)[16]; 木豆素C的甲氧基衍生物对肝癌HepG2细胞的IC50为3.7 μmol L–1[14]。三甲氧基白藜芦醇对MDA-MB- 231、HeLa、SW480和HepG2细胞具有较强细胞毒作用,IC50分别为3.0、9.2、14.5和13.0 μmol L–1。三甲氧基白藜芦醇的体外抗肿瘤活性最强,4′-甲氧基白藜芦醇次之,白藜芦醇较弱。从表 2可见,树豆叶二苯乙烯类成分中,木豆素C对7种肿瘤细胞株均呈显著的细胞增殖抑制作用(IC50为14.4~29.6 μmol L–1),木豆素对除HeLa和SW480外的其余5个细胞株均呈较弱的细胞毒活性(IC50为44.9~ 78.3 μmol L–1),但甲醚化产物1~4对参试7种肿瘤细胞株均无明显细胞毒作用(IC50>100 μmol L–1)。这4种甲醚衍生物的甲氧基数目和取代位置与三甲氧基白藜芦醇有较大差别。有报道,3, 4, 5, 4′-四甲氧基二苯乙烯在体外对人宫颈癌HeLa细胞、人前列腺癌LNCaP细胞、人结肠腺癌HT-29细胞、人肝癌HepG2细胞的抑制作用显著增强[18]。由此推测,甲氧基数目和取代位置对树豆叶二苯乙烯类成分的抗肿瘤活性有显著影响。我们的试验为树豆叶二苯乙烯类成分通过结构修饰改变体外抗肿瘤活性提供了参考依据。
| 表 2 化合物1~4对人肿瘤细胞增殖的影响(IC50, μmol L–1) Table 2 Effects of compounds 1-4 on the proliferation of human tumor cell lines (IC50, μmol L–1) |
| [1] |
CHEN W Q, SUN K X, ZHENG R S, et al. Report of cancer incidence and mortality in different areas of China, 2014[J]. China Cancer, 2018, 27(1): 1-14. 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1-14. DOI:10.11735/j.issn.1004-0242.2018.01.A001 |
| [2] |
GOTO H, YANAGIMACHI M, GOTO S, et al. Methylated chrysin reduced cell proliferation, but antagonized cytotoxicity of other anticancer drugs in acute lymphoblastic leukemia[J]. Anti-Cancer Drugs, 2012, 23(4): 417-425. DOI:10.1097/CAD.0b013e32834fb731 |
| [3] |
WENG J C, YANG Y T, HO T H, et al. Mechanisms of apoptotic effects induced by resveratrol, dibenzoylmethane, and their analogues on human lung carcinoma cells[J]. J Agric Food Chem, 2009, 57(12): 5235-5243. DOI:10.1021/jf900531m |
| [4] |
WENG J C, WU C F, HUANG H W, et al. Evaluation of anti-invasion effect of resveratrol and related methoxy analogues on human hepatocarcinoma cells[J]. J Agric Food Chem, 2010, 58(5): 2886-2894. DOI:10.1021/jf904182y |
| [5] |
HSIEH C T, WONG C, BENNETT J D, et al. Regulation of p53 and cell proliferation by resveratrol and its derivatives in breast cancer cells:An in silico and biochemical approach targeting integrin αvβ3[J]. Int J Cancer, 2011, 129(11): 2732-2743. DOI:10.1002/ijc.25930 |
| [6] |
FU Y J, YU P. Method for synthesizing anti-form stilbene compounds and application of method in preparing anti-tumor medicines: China, CN201010592686.X[P]. 2012-07-11. 付玉杰, 余平.一种合成反式芪类化合物的方法及其在制备抗肿瘤药物中的应用: 中国, CN201010592686.X[P]. 2012-07-11. |
| [7] |
FU Y J, KADIOGLU O, WIENCH B, et al. Cell cycle arrest and induction of apoptosis by cajanin stilbene acid from Cajanus cajan in breast cancer cells[J]. Phytomedicine, 2015, 22(4): 462-468. DOI:10.1016/j.phymed.2015.02.005 |
| [8] |
CAI J Z, TANG R, YE G F, et al. A halogen-containing stilbene derivative from the leaves of Cajanus cajan that induces osteogenic differentiation of human mesenchymal stem cells[J]. Molecules, 2015, 20(6): 10839-10847. DOI:10.3390/molecules200610839 |
| [9] |
ASHIDI J S, HOUGHTON P J, HYLANDS P J, et al. Ethnobotanical survey and cytotoxicity testing of plants of south-western Nigeria used to treat cancer, with isolation of cytotoxic constituents from Cajanus cajan Mill. leaves[J]. J Ethnopharmacol, 2010, 128(2): 501-512. DOI:10.1016/j.jep.2010.01.009 |
| [10] |
CAI J Z. Chemical constituents from leaves of Ardisia crenata and Cajanus cajan and anticancer effects[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2012: 83-100. 蔡佳仲.朱砂根和树豆叶的化学成分及抗肿瘤作用研究[D].广州: 广州中医药大学, 2012: 83-100. |
| [11] |
SHEN X L, WANG L, HU Y J, et al. Application of pigeon pea ketonic acid A in terms of preparation of medicines for accompanied diseases of diabetes mellitus and hyperlipidaemia: China, CN201210119665.5[P]. 2012-09-19. 沈小玲, 王璐, 胡英杰, 等.树豆酮酸A在制备糖尿病伴随症及高脂血症药物中的应用: 中国, CN201210119665.5[P]. 2012-09-19. |
| [12] |
GUO R X. Studies on structural modification of quercetin, isoalantolactone and alantolactone[D]. Shijiazhuang: Hebei Medical University, 2014: 15-17. 郭瑞霞.槲皮素、异土木香内酯和土木香内酯的结构修饰研究[D].石家庄: 河北医科大学, 2014: 15-17. |
| [13] |
HU Y L, SHEN X L, CHEN M G, et al. Structural identification on the saponification products of raw cajanolactone A[J]. J Trop Subtrop Bot, 2017, 25(1): 93-97. 胡阳亮, 沈小玲, 陈梅果, 等. 树豆内酯A粗品皂化产物的化学结构鉴定[J]. 热带亚热带植物学报, 2017, 25(1): 93-97. DOI:10.11926/jtsb.3617 |
| [14] |
SHAN Y, HONG T, WANG Y F, et al. Synthesis and cytotoxicity of longistylin C derivatives[J]. Chin J Nat Med, 2015, 13(4): 311-315. DOI:10.1016/S1875-5364(15)30021-2 |
| [15] |
WANG Y N, GE P, HU Y J, et al. Synthesis method of diethylstilbestrol compound methyl pigeon pea ketonic acid A: China, CN201410032181. 6[P]. 2015-05-27. 王亚农, 戈平, 胡英杰, 等.一种菧类化合物甲基树豆酮酸A的合成方法: 中国, CN201410032181.6[P]. 2015-05-27. |
| [16] |
ZHANG N L, ZHU Y H, HUANG M R, et al. Two new stilbenoids from Cajanus cajan[J]. Z Naturforsch B, 2012, 67(12): 1314-1318. DOI:10.5560/znb.2012-0184 |
| [17] |
LI Z R, JI X Y, XUE S T, et al. Cajanin compound with similar structures, as well as preparation method and application thereof: China, CN201110439374.X[P]. 2013-06-26. 李卓荣, 季兴跃, 薛司徒, 等.一组木豆素结构类似化合物、制备方法和应用: 中国, CN201110439374.X[P]. 2013-06-26. |
| [18] |
GOSSLAU A, CHEN M, HO C T, et al. A methoxy derivative of resveratrol analogue selectively induced activation of the mitochondrial apoptotic pathway in transformed fibroblasts[J]. Br J Cancer, 2005, 92(3): 513-521. DOI:10.1038/sj.bjc.6602300 |
 2019, Vol. 27
2019, Vol. 27


