蛇足石杉[Huperzia serrata (Thunb.) Trev.]隶属于石杉科(Huperziaceae)石杉属,系多年生蕨类植物[1]。蛇足石杉的次生代谢产物石杉碱甲(Huperzine A, HupA)是一种高效、可逆的乙酰胆碱酯酶抑制剂, 能有效改善记忆力衰退,对阿尔兹海默症有显著疗效[2]。目前,HupA制剂来源以野生蛇足石杉为主,但其生长周期长达15~20 a之久[3],且对生长环境要求苛刻,加之被过度采收,加剧了野生资源的枯竭。因此,除人工繁殖外,探寻HupA新资源的生物技术已成为本领域研究热点,且取得了可喜的成果。Szypuła等[4]通过组织培养小杉兰(H. selago)获得了HupA。本实验室通过组织培养技术诱导蛇足石杉茎段得到了离体叶状体[5],添加天冬氨酸培养叶状体,其生物量与HupA含量均有提高[6], 叶丽婻等[7]用H2O2诱变叶状体,获得了产HupA的离体叶状体高产株系。
有研究表明,液体培养能更大限度地扩大培养效率,对珍稀植物自动化工业生产经济次生代谢产物的应用具有良好前景。去除助凝剂的液体培养方式可节约培养基成本,且能打破传统固体组培技术的局限,节省大量运行与劳动成本[8]。为此,有关液体培养对培养物的生长和次生代谢产物变化的研究已有较多报道。高先富[9]的研究表明,液体培养对三七(Panax notoginseng)不定根具有增殖效应, 并建立了三七不定根体外液体培养体系。胡之壁[10]采用液体培养方式对三尖杉(Cephalotaxus fortunei)细胞进行培养,其生长速率是固体培养的3倍,且总生物碱增加了近1倍。浅层液体培养过程中无需震荡即可解决通气问题,然而浅层液体培养蛇足石杉离体叶状体的研究尚未见报道。本研究采用前期建立的具有累积HupA能力的蛇足石杉离体叶状体[11], 以不同用量培养液培养,探究浅层液体培养对叶状体生长效应和HupA含量的影响,以期为蛇足石杉离体培养工厂化生产奠定应用技术基础。
1 材料和方法 1.1 材料研究材料取自本实验室建立的蛇足石杉[Huperzia serrate (Thunb.) Trev.]离体培养36世代(经多次分割并连续继代培养)的无菌叶状体繁殖系[5]。当代的叶状体培养50 d,在无菌条件下取出分割成小块进行接种。诱导和增殖培养按涂艺声等[5]的方法进行。
石杉碱甲标准品购自中国食品药品检定研究院(产品批号为100243-201603)。
1.2 液体培养基的配制与叶状体的培养固体培养基为1/4MS,参照吉枝单[11]的方法配制,液体培养基则去除琼脂成分。
叶状体的培养:在100 mL锥形瓶中分别装入10、15、20、25、50 mL培养液,以50 mL固体培养基为对照。每瓶接种量相同,各处理设9次重复。接种后置于(22±1)℃培养箱中静置培养,光照强度为377 μmol m-2s-1,光照时间为15 h d-1。
培养40、50、60、70、80 d时分别取样测定3种抗氧化酶的活性;培养至50、60、70、80 d时分别取样测定内源激素ABA、IAA、GA和HupA的含量。
1.3 叶状体生长指标测定叶状体培养80 d后从培养基中取出,洗净吸干水分,称量鲜质量。在40℃烘箱中烘至恒重,称量干质量。叶状体生长量(g L-1)=(收获量-接种量)/1 L; 叶状体相对增长率(%)=(收获量-接种量)/接种量×100%;折干率(%)=干燥后叶状体质量/干燥前叶状体鲜质量×100%;石杉碱甲生产率(μg L-1)=培养80 d后1 L培养基的叶状体干质量(g)×每克干叶状体的石杉碱甲含量(μg g-1)。
1.4 叶状体生化指标的测定用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性[12],愈创木酚比色法测定过氧化物酶(POD)活性[13],紫外光光度法测定过氧化氢酶(CAT)活性[14];采用双抗体一步夹心法酶联免疫吸附试验(ELISA)测定内源激素ABA、IAA、GA含量,试剂盒由上海酶联生物科技有限公司提供。
1.5 石杉碱甲的检测石杉碱甲的提取 参考陈曼等[6]的方法提取。叶状体干燥后磨成细粉,用2%酒石酸浸泡过夜后超声提取3次,离心并收集上清液合并,上清液pH调至9后蒸干,经甲醇洗脱得石杉碱甲混合液,定容,以0.22 μm滤嘴抽滤后采用高效液相色谱(high performance liquid chromatography fluorescence, HPLC)检测。
色谱分析 (1)色谱条件:高效液相色谱仪采用岛津(LC-20 AT), 色谱柱为Waters C18柱(4.6 mm×250 mm, 5 μm)。流动相为甲醇:醋酸铵溶液(0.08 mol L-1, pH 6.00)=3:7 (V/V);流速0.8 mL min-1; 检测器:紫外光,波长308 nm;柱温25℃;进样量为20 μL,记录石杉碱甲色谱图(图 1)。(2)线性关系分析:取配制好的20、40、60和80 μg mL-1石杉碱甲溶液分别注入液相色谱仪检测,记录面积积分值,以质量浓度ρ (μg mL-1)为横坐标,峰面积积分值Y为纵坐标,回归方程为Y=53300.5ρ-166916 (R=0.999 695 5)。(3)系统适用性实验:从图 1可见,标准品石杉碱甲的保留时间为13.600 min,样品保留时间为13.588 min,并且与其它成分分离良好,理论塔板数按石杉碱甲峰计不低于3 000。(4)精密度实验:取配制的80 μg mL-1石杉碱甲标准品溶液进行HPLC检测。重复进样6次,记录峰面积, 相对标准偏差(RSD)为1.00%。(5)回收率实验:取已知石杉碱甲含量的蛇足石杉提取样品200 μL, 精确加入40 μg mL-1标准品溶液200 μL,进样量20 μL, 计算回收率为(98.54±2.8)%。(6)样品测定:取制备的石杉碱甲提取液测定蛇足石杉石杉碱甲的含量。
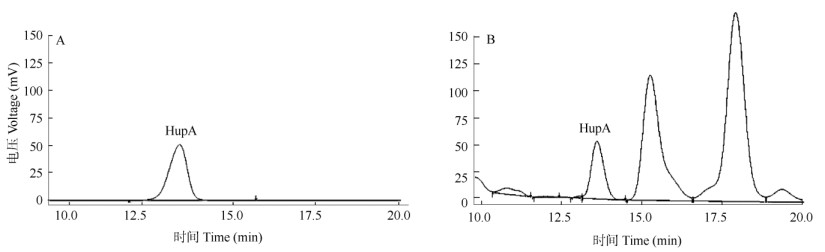
|
图 1 石杉碱甲标准品(A)和叶状体提取物(B)的HPLC图 Fig. 1 HPLC of huperzine A standard (A) and extract (B) of Huperzia serrata thallus in vitro |
数据采用Excel 2013和SPSS 19.0软件进行统计分析并作图,数据以平均值±标准误差表示,采用单因素方差分析(ANOVA)进行差异分析,根据Duncan新复极差法在0.05水平上比较处理间的差异性,并采用皮尔森(Pearson)法进行相关性分析。
2 结果和分析 2.1 叶状体生物量的变化与固体培养基(对照)相比,各液体培养的叶状体生长量均明显提高(表 1),10、15、20和25 mL培养液处理的分别提高了49.13%、73.37%、16.30%和5.22% (P < 0.05);仅50 mL培养液与对照的叶状体生长量相当,无显著差异。随着培养液量的增加,叶状体相对增长量呈上升趋势,但1 L培养液的生长量呈下降趋势,以15 mL浅层液体培养的生长量最高,是对照的1.73倍。
| 表 1 不同用量培养液培养蛇足石杉叶状体生物量的变化 Table 1 Effect of different dosage of the liquid medium on the biomass of Huperzia serrata thallus |
不同用量培养液处理叶状体折干率也存在差异(表 1)。折干率反映了干物质的累积量,干物质量与石杉碱甲产量成正比。随着培养液用量的增加, 折干率呈先增后减的变化趋势,其中15 mL培养液培养时,折干率最大,达16.35%,是对照的1.25倍,说明深层液体培养基并不适合叶状体积累干物质,以15 mL的浅层液体培养基对干物质积累效果最好。
2.2 叶状体HupA生产率的变化石杉碱甲生产率是指收获时每升培养基中叶状体的总石杉碱甲含量。采用HPLC检测,不同用量培养液培养80 d的叶状体石杉碱甲生产率具有显著差异(P < 0.05)(图 2)。当培养液为15 mL时,石杉碱甲生产率最高,达3 115.159 μg L-1, 是对照的2.20倍。培养液用量增加,石杉碱甲生产率骤减, 显著低于对照,50 mL培养液的石杉碱甲生产率为369.037 μg L-1。因此,以培养液为15 mL的浅层培养的效果最佳,液体过深或过浅都不利于叶状体的生长与石杉碱甲的积累。

|
图 2 培养液用量对蛇足石杉叶状体石杉碱甲生产率的影响 Fig. 2 Effect of different dosage of liquid medium on HupA productivity of thallus in Huperzia serrate |
从图 3可见,液体和固体培养的叶状体SOD活性的变化趋势基本一致,浅层液体培养各时期的SOD活性均高于对照,但差异不明显,且均在培养60 d时达最高。培养40~60 d时,浅层液体培养的叶状体POD活性显著高于对照,但CAT活性显著低于对照;而培养60~80 d则相反,浅层液体培养的叶状体POD活性逐渐下降,而CAT活性不断增强,表现出酶活性交互调节的特性,即浅层液体培养的叶状体POD活性先增强,而CAT活性后增强,协同清除体内活性氧(ROS)来维持叶状体的内生境,这可能为叶状体生长和累积高含量石杉碱甲具备了良好的生化特征基础。
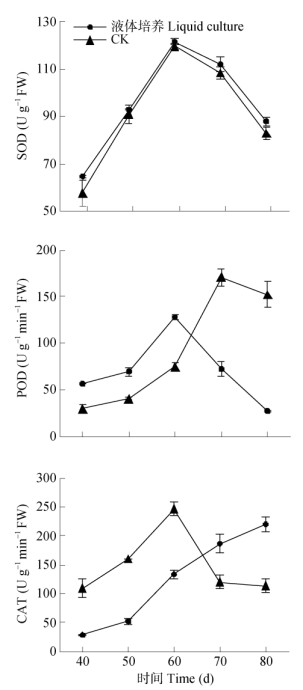
|
图 3 叶状体的SOD、POD和CAT活性变化 Fig. 3 Changes in SOD, POD and CAT activities in Huperzia serrata thallus |
培养60 d时,固体培养的IAA/ABA与GA/ABA分别为73.07和0.70, 均高于液体培养的31.83与0.32,结合表 1可知,固体培养的叶状体比液体培养的鲜质量大,但干物质累积却显著低于液体培养的。从图 4可见,培养50~60 d,液体培养的叶状体ABA含量显著高于固体培养的,此时期液体培养的HupA含量变化相似(P < 0.05), 相关分析表明,全培养期HupA含量与ABA含量呈极显著相关(r= 0.748, P=0.000 < 0.01)。这说明内源激素水平对离体培养的叶状体的生长及代谢具有重要影响, 较高的IAA与GA含量有利于叶状体生长势的增强,但主要增长为含水量,而较高的内源ABA含量对叶状体干物质提高和HupA的累积作用明显。
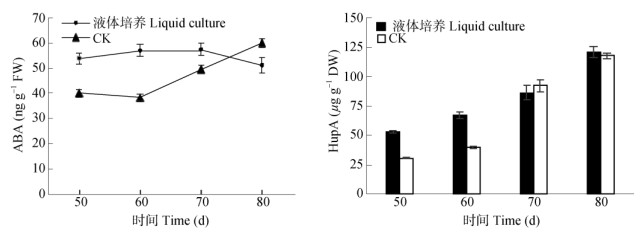
|
图 4 ABA和HupA含量的变化 Fig. 4 HupA and ABA contents in Huperzia serrata thallus |
改进培养方式是调节植物生长和次生代谢产物产量的重要手段。液体培养基能为培养物提供均衡的营养物质,且其可流动性使之易于实现自动化控制,可在不更换培养容器的情况下实现培养基的更新,有望配置较大的培养容器[15]。本研究结果表明,蛇足石杉离体叶状体在液体培养下的效果优于固体培养,其中15 mL浅层液体培养的叶状体HupA生产率是50 mL深层培养的8.441倍。在15~ 50 mL液体培养下,随着液体培养基的增多,叶状体浸没程度加深,可能因溶氧量变少,收获叶状体干重与HupA含量均呈下降趋势,而更浅层的10 mL处理,因培养后期培养液枯竭,叶状体生长缓慢。可见,适当的空气接触与必须的营养供应是浅层培养的关键。
有研究表明,植物受到胁迫时,会导致活性氧(ROS)积累,此时抗氧化酶系统和非酶系统也会发生响应[16]。本研究结果表明,15 mL浅层液体培养的叶状体SOD活性高于对照固体培养,POD活性在培养前期比对照提高,CAT活性在培养后期比对照提高。同时,15 mL浅层液体培养的叶状体内源激素ABA含量一直维持在较高水平,且次生代谢产物HupA产率亦明显增加。这说明浅层液体培养时,叶状体因一部分浸没于液体中受到了一定的低氧胁迫,导致体内ROS累积增多,激发了3种抗氧化酶活性,协同清除ROS分子,以维持叶状体内生境的稳态,有助于叶状体的生长;与此同时,特异性成分HupA累积增多,可能是逆境内源激素ABA与ROS分子作为信号调节了叶状体次生代谢HupA途径的响应,这与相关报道的生物响应类似[16]。
本研究结果显示,浅层液体培养使蛇足石杉离体叶状体受到低氧胁迫,而这种适度的胁迫有利于其干物质和有效成分HupA的累积。本技术亦为其他植物离体培养提高次生代谢产物的产量研究提供了借鉴。
| [1] |
YU H Y, SUN Y M, YANG Y J. Advances in studies on Huperzia serrata[J]. Chin Trad Herb Drugs, 2001, 32(3): 279-9281. 余红英, 孙远明, 杨跃进. 草药蛇足石杉的研究进展[J]. 中草药, 2001, 32(3): 279-281. DOI:10.3321/j.issn:0253-2670.2001.03 |
| [2] |
FERREIRA A, RODRIGUES M, FORTUNA A, et al. Huperzine A from Huperzia serrata:A review of its sources, chemistry, pharmacology and toxicology[J]. Phytochem Rev, 2016, 15(1): 51-85. DOI:10.1007/s11101-014-9384-y |
| [3] |
LU R L, ZHOU Z Z, BAO S L, et al. Blological features of Huperzia serrata an important medicine plant[J]. J Univ Sci Technol Chin, 1999, 29(1): 118-121. 鲁润龙, 周忠泽, 鲍时来, 等. 药用植物蛇足石杉的生物学特性[J]. 中国科学技术大学学报, 1999, 29(1): 118-121. |
| [4] |
SZYPULA W, PIETROSIUK A, SUCHOCKI P, et al. Somatic embryogenesis and in vitro culture of Huperzia selago shoots as a potential source of huperzine A[J]. Plant Sci, 2005, 168(6): 1443-1452. DOI:10.1016/j.plantsci.2004.12.021 |
| [5] |
XU X Z, TU Y S, JI Z D, et al. In vitro-cultured morphological changes in Huperzia serrata and accumulation of huperzine A[J]. Chin Bull Bot, 2015, 50(6): 733-738. 徐贤柱, 涂艺声, 吉枝单, 等. 蛇足石杉离体培养物形态变化与石杉碱甲积累的研究[J]. 植物学报, 2015, 50(6): 733-738. DOI:10.11983/CBB14220 |
| [6] |
CHEN M, TU Y S, YE L N, et al. Effect of amino acids on thallus growth and huperzine-A accumulation in Huperzia serrata[J]. Chin Bull Bot, 2017, 52(2): 218-224. 陈曼, 涂艺声, 叶丽婻, 等. 氨基酸对蛇足石杉叶状体增殖及石杉碱甲积累的影响[J]. 植物学报, 2017, 52(2): 218-224. DOI:10.11983/CBB16033 |
| [7] |
YE L N, TU Y S, HUANG Q, et al. Studies on H2O2 induced effect on Huperzia serrata in vitro[J]. J Trop Subtrop Bot, 2017, 25(6): 587-593. 叶丽婻, 涂艺声, 黄倩, 等. H2O2对蛇足石杉离体培养物诱变效应的研究[J]. 热带亚热带植物学报, 2017, 25(6): 587-593. DOI:10.11926/jtsb.3766 |
| [8] |
WATT M P. The status of temporary immersion system (TIS) technology for plant micropropagation[J]. Afr J Biotechnol, 2012, 11(76): 14025-14035. DOI:10.5897/AJB12.1693 |
| [9] |
GAO X F, XU Z H, LIU J J, et al. Adventitious root induction and in vitro culture of Panax notoginseng[J]. China J Chin Mat Med, 2006, 31(18): 1485-1488. 高先富, 徐朝晖, 刘佳健, 等. 三七不定根的离体诱导与培养[J]. 中国中药杂志, 2006, 31(18): 1485-1488. DOI:10.3321/j.issn:1001-5302.2006.18.001 |
| [10] |
HU Z B, ZHOU J Y, LIU D. Influence of different culture methods to composition and content of alkaloid in cultured cells of Cephalotaxus fortunei[J]. J Shanghai Univ Trad Chin Med, 1999, 13(1): 60-62. 胡之璧, 周吉燕, 刘涤. 不同培养方式对三尖杉培养细胞中生物碱组成和含量的影响[J]. 上海中医药大学学报, 1999, 13(1): 60-62. DOI:10.16306/j.1008-861x.1999.01.020 |
| [11] |
JI Z D, TU Y S, CHEN M, et al. Conditional optimization and kinetic research on producing huperzine A using Huperzia serrata in vitro[J]. Chin Trad Herb Drugs, 2016, 47(3): 488-492. 吉枝单, 涂艺声, 陈曼, 等. 蛇足石杉离体培养产石杉碱甲的条件优化及动力学研究[J]. 中草药, 2016, 47(3): 488-492. DOI:10.7501/j.issn.0253-2670.2016.03.023 |
| [12] |
DU B G, NIAN H, ZHANG Z S, et al. Effects of aluminum on superoxide dismutase and peroxidase activities, and lipid peroxidation in the roots and calluses of soybeans differing in aluminum tolerance[J]. Acta Physiol Plant, 2010, 32(5): 883-890. DOI:10.1007/s11738-010-0476-z |
| [13] |
FANG H, ZOU Q, HE Y, et al. Detection of activity of POD in tomato leaves based on hyperspectral imaging technology[J]. Spectrosc Spect Anal, 2012, 32(8): 2228-2233. 方慧, 邹强, 何勇, 等. 基于高光谱的番茄叶片过氧化物酶活力测定[J]. 光谱学与光谱分析, 2012, 32(8): 2228-2233. DOI:10.3964/j.issn.1000-0593(2012)08-2228-06 |
| [14] |
LUNA C M, PASTORI G M, DRISCOLL S, et al. Drought controls on H2O2 accumulation, catalase (CAT) activity and CAT gene expression in wheat[J]. J Exp Bot, 2005, 56(411): 417-423. DOI:10.1093/jxb/eri039 |
| [15] |
SHI K, ZHENG C X, ZHANG Y T, et al. The technology of temporary immersion in liquid culture and its application in micropropagation of berry plants[J]. Plant Physiol J, 2017, 53(4): 513-520. 石琨, 郑彩霞, 张运涛, 等. 间歇浸没式液体培养技术及其在莓类果实植物微扩繁中的应用[J]. 植物生理学报, 2017, 53(4): 513-520. DOI:10.13592/j.cnki.ppj.2017.0032 |
| [16] |
BRAY R C, COCKLE S A, FIELDEN E M, et al. Reduction and inacti-vation of superoxide dismutase by hydrogen peroxide[J]. Biochem J, 1974, 139(1): 43-48. DOI:10.1042/bj1390043 |
 2019, Vol. 27
2019, Vol. 27



