2. 福州大学生物科学与工程学院, 福州 350001
2. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350001, China
内生菌是一类在植物生长过程中与寄主植物共生、寄生或腐生的微生物[1]。内生菌种类多、数量大,能够产生许多具有生物活性的次生代谢产物。目前,从植物内生菌中分离到的天然活性产物包括植物生长调节剂、免疫抑制剂、抗生素、杀虫剂、自由基清除剂等[2]。研究还表明,植物内生菌能够产生较高含量的新颖化合物,是寻找新型高效活性物质的重要资源,并且在内生菌与宿主植物协同进化的过程中产生的次级代谢产物具有高度协同性和相似性[3]。这些特性使植物内生菌研究成为热点。
植物内生菌具有丰富的多样性,存在于植株的各种器官中,如根、茎、叶、花、果和种子等组织细胞内或细胞间隙,包含细菌、真菌和放线菌。植物内生菌可通过传统培养方法分离,谭小明等[4]采用常规分离方法从广西金线莲(Anoectochilus roxburghii)中分离出6株能够产生活性物质的内生真菌;张毓妹等[5]从小麦(Triticum aestivum)中分离出4株对纹枯病菌有拮抗作用的内生细菌。在现有技术条件下,环境中可培养的微生物仅占总量1%左右,绝大多数微生物还未被广泛认识[6],且这些不可培养菌株蕴藏着丰富的生物资源。Handlesman等[7]提出的宏基因组学技术,绕过了传统纯培养技术瓶颈,能够直接构建文库克隆环境微生物DNA,真实可靠地反映微生物原始组成情况。目前该技术已在内生菌研究中广泛应用,陈倩倩等[8]提取了金线莲根部内生细菌宏基因组DNA,分析内生细菌群落结构组成;李如华等[9]基于分子可操作分类单元分析了北京地区杨树(Populus sp.)内生葡萄座腔菌属(Botryosphaeria)真菌的多样性;赵芹等[10]富集纯化幼苗期小麦内生菌的宏基因组DNA,探究小麦幼苗内生细菌和真菌的遗传多样性。
茉莉花[Jasminum sambac (L.) Ait]隶属于木犀科(Oleaceae)素馨属植物,喜温暖湿润,广泛植栽于亚热带地区。茉莉鲜花是花茶和香精的重要原料, 其花、叶和根也可入药,药用价值极高,是重要的经济、药用作物[11]。目前,对茉莉花的研究主要集中在植株生长外部影响因素、病害防控及鲜花品质方面[12-13],关于茉莉花体内微生物群落结构研究还未见报道。植株内生菌群落对维持植株的生态系统平衡,促进植株生长等具有重要作用。本研究对茉莉花开花期(6-10月)的植株内生细菌宏基因组进行富集纯化,通过PCR扩增方法构建内生细菌的16S rDNA文库,分析细菌多样性和群落结构,探究季节气候和土壤营养成分对茉莉花植株内生细菌多样性与群落结构的影响,能够为发掘利用对茉莉花植株有益的内生菌资源,控制潜在有害内生菌,维持植株生态系统平衡奠定基础。
1 材料和方法 1.1 材料材料 茉莉花[Jasminum sambac (L.) Ait]植株采自福建省福州福清市华石村茉莉花基地,于2016年花期的6-10月中旬采用5点取样法剪取植株上端8~10 cm的枝条。
仪器和试剂 ABI GeneAmp 9700型PCR仪(ABI公司),AxyPrepDNA凝胶回收试剂盒(AXYGEN公司),QuantiFluorTM-ST蓝色荧光定量系统(Promega公司),NanoDrop 2000超微量分光光度计(Thermo Fisher公司),DNA抽提试剂盒(Omega Bio-Tik和MP公司),Illumina Miseq测序平台(Illumina公司)。
1.2 宏基因组DNA提取、纯化和测序参考陈倩倩等[7]的方法,取5 g枝条洗净,表面消毒灭菌后,研磨成浆,提取内生细菌,采用MP试剂盒提取内生细菌的宏基因组DNA,采用Omega胶回收试剂盒对DNA进行纯化,通过超微量分光光度计对DNA浓度和纯度进行测定,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
采用引物338F和806R对总DNA进行PCR扩增, 引物分别为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系为20 μL,包含4 μL 5×FastPfu Buffer、2 μL 2.5 mol L–1 dNTPs、0.8 μL正向引物(5 μmol L–1)、0.8 μL反向引物(5 μmol L–1)、0.4 μL FastPfu Polymerase、0.2 μL BSA和10 ng Template DNA,去离子水补足体积。PCR扩增条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,共27个循环;72℃延伸10 min。PCR产物用2%琼脂糖凝胶电泳检测,切胶回收PCR产物,TrisHCl洗脱;2%琼脂糖电泳检测。通过QuantiFluorTM-ST蓝色荧光定量系统进行定量检测,利用TruSeqTM DNA Sample Prep Kit构建PE文库,在Illumina Miseq平台上进行测序。
1.3 生物信息学分析物种组成和分析 首先把标签(Tags)中可能由于测序错误造成的单例标签(只有1条对应的reads序列)过滤掉,而后将Tags聚类成分类操作单元(operational taxonomic units, OTU)。进一步利用usearch软件进行聚类(相似度97%),对聚类后的序列进行嵌合体过滤后,得到用于物种分类单元OTU,每个OTU被认为可代表 1个物种[14-15]。利用Usearch平台,根据不同的相似度水平,对所有序列进行OTU划分,选择97%的相似水平下的OTU进行生物信息统计分析。采用VennDiagram软件生成Venn图,反映不同月份的茉莉花植株中共有和独有的内生细菌物种数量。
物种组成丰度月份分布 采用RDP Classifier (Version 2.2)贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,挑选代表OTU序列,与已知物种的16S数据库(http://greengenes.lbl.gov)进行比对,鉴定物种组成;根据OTU序列条数,计算各OTU的丰度值[15]。本研究统计不同月份茉莉花内生细菌在门、纲、目、科、属水平上的群落组成。
物种多样性指数 利用Usearch (Version 7.1)平台分析物种多样性(α-多样性),包括物种指数、物种丰富度Chao1指数、Shannon多样性指数、Simpson多样性指数、Good’s物种覆盖度(coverage)和谱系多样性指数(phylogenetic diversity, PD_whole_ tree)等。
稀释曲线绘制 通过16S rDNA序列中已知的各种OTU的相对比例,计算抽取n个reads时各α-多样性指数的期望值(n < reads序列总数),根据n值与其相对应的α-多样性指数的期望值绘制出稀释性曲线[15]。
物种主成分分析 主成分分析(principal component analysis, PCA)通过分析不同样本群落组成(OTUs,97%相似性),可以反映样本间的差异和距离,样本物种组成越相似,则距离越近。本研究PCA是利用物种(包括OTU)丰度表,基于欧氏距离直接作图,探讨不同月份茉莉花植株内生细菌属水平群落构成差异。
科水平内生细菌物种热图分析 物种热图(heatmap)是根据物种样本间丰度的相似性进行聚类,并将结果呈现在群落heatmap上,可使高丰度和低丰度的物种分块聚集,通过颜色变化与相似程度来反映不同分组(或样本)在各分类水平上群落组成的相似性和差异性。本研究的heatmap中纵向和横向分别代表不同月份茉莉花植株和不同科的聚类情况。1个颜色代表 1个样本的1科的丰度,颜色越蓝表明丰度越低,反之,颜色越红代表丰度越高,通过区域颜色的深浅变化可以直观反映出不同样品间细菌群落结构的相似性和差异性。
物种和环境因子的冗余分析 冗余分析(redundancy analysis, RDA)是基于线性模型分析环境因子(土壤营养成分)、植株样本、菌群三者间的关系。样本点的空间距离表示样本之间的距离,样本点到环境因子向量的投影距离表示样本受环境因子影响的程度。样本点向环境因子做垂线,投影点在箭头方向上,表示为环境因子与样本之间呈正相关,反之呈负相关。物种与环境因子之间的夹角表示为物种与环境因子间的相关性(锐角:正相关; 钝角:负相关;直角:无相关性)。本研究中,土壤营养成分用红色箭头表示,细菌门用蓝色箭头表示,月份用绿色圆点表示;分析不同月份细菌及丰度前3的细菌门与土壤营养成分(有机质、全磷、全氮和全钾含量)的关系。
物种与环境因子的相关性分析 物种热图(heatmap)用于评估微生物分类与环境因子的相关性,聚类结果加上样本的处理或取样环境分组信息,可以直观观察到相同处理或相似环境样本的聚类情况,并直接反映了样本群落组成的相似性和差异性。本研究选择总丰度前50的物种数据矩阵进行分析,heatmap是以颜色梯度来代表数据矩阵中数值的大小,相关性heatmap中红色部分表示正相关,绿色部分表示负相关。
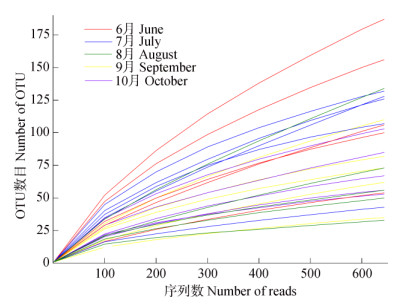
2 结果和分析 2.1 宏基因测序结果分析对25个茉莉花植株样本进行测序,通过筛选、过滤、嵌合体去除、宿主植物线粒体和叶绿体去除后,以序列数最少的样本为基准,对所有样品测序数据进行抽平。选择97%相似度的OTU,采用随机抽样的方法,以抽取的序列数与对应的OTU数绘制稀释曲线(图 1)。可见,每个样本的OTU数量均随着测序深度增加而增加,而后趋于平稳,说明测序数据量合理,能够较好地反映茉莉花植株内生细菌菌群情况。
|
图 1 茉莉花植株内生细菌16S rDNA相似水平为97%的稀释性曲线 Fig. 1 Rarefaction curves of endophytic bacteria of Jasminum sambac with 97% similar of 16S rDNA |
对各月份茉莉花植株中的内生细菌物种OTU数目进行统计并作Venn图(图 2)。结果表明,6-10月茉莉花植株的内生细菌物种OTUs分别为420、374、247、233和228,细菌物种OTU总数为916,隶属于38门78纲150目257科和434属,其中各月共有的OUT为50,占5.5%。不同月份的内生细菌物种数量存在差异(表 1)。在门水平上,细菌物种数量为6月(29种) > 7月(26种) > 8月(23种) > 9和10月(均19种);在纲和目水平上,细菌物种数量月份分布趋势相似,为6月> 7月> 8月> 9月> 10月;在科水平上,细菌物种数量月份分布趋势和门水平相似;在属水平上,细菌物种数量为6月> 7月> 10月> 8和9月,这表明茉莉花植株在6月份的内生细菌物种数目最多。

|
图 2 茉莉花植株内生细菌物种OTU组成的Venn图 Fig. 2 Venn map of endophytic bacteria of Jasminum sambac |
| 表 1 不同月份茉莉花植株中的细菌物种数量 Table 1 Number of bacterial of Jasminum sambac in different month |
表 2为不同月份茉莉花植株中的主要细菌物种丰度。在门水平上,6-10月内生细菌物种组成丰度较高的菌门有:变形菌门(Proteobacteria, 70.3%~85.7%)、放线菌门(Actinobacteria, 8.3%~10.6%)、壁厚菌门(Firmicutes, 1.0%~6.0%)、拟杆菌门(Bacteroidetes, 0.9%~3.2%)和绿弯菌门(Chloroflexi, 0.6%~ 4.2%)。随时间变化,变形菌门数量先上升后下降, 以8月份的最高;壁厚菌门数量先下降后上升,以8月份的最低;拟杆菌门数量先下降后上升,以9月份的最低;绿弯菌门数量逐渐下降,至10月份最低。
| 表 2 茉莉花植株主要内生细菌物种丰度(%)的月份分布 Table 2 Monthly distribution of species abundance (%) of endophytic bacterial in Jasminum sambac |
在纲水平上,6-10月份内生细菌物种组成丰度大于1%的有α-变形菌纲(Alphaproteobacteria, 51.0%~81.3%)、放线菌纲(Actinobacteria, 8.1%~ 10.6%)、β-变形菌纲(Betaproteobacteria, 1.5%~ 11.1%)和γ-变形菌纲(Gammaproteobacteria, 1.4%~ 6.5%)。α-变形菌纲数量先上升后下降,以8月份的最高;β-变形菌纲数量先下降后上升,以8月份的最低。
在目水平上,6-10月份内生细菌物种组成丰度大于1%的有甲基杆菌目(Rhizobiales, 14.2%~ 68.4%)、鞘脂单胞菌目(Sphingomonadales, 12.6%~ 35.4%)、伯克氏菌目(Burkholderiales, 1.1%~10.5%)、动孢囊菌目(Kineosporiales, 1.4%~4.9%)、假单胞菌目(Pseudomonadales, 1.0%~4.3%)和微球菌目(Micrococcales, 1.3%~4.2%)。随时间变化,鞘脂单胞菌目在6月份最高,8月份最低;甲基杆菌目在8月份最高,6月份最低;伯克氏菌目数量先下降后上升,以8月份的最低;动孢囊菌目数量先下降后上升,以9月份的最低;假单胞菌目数量逐渐下降,以10月份的最低;微球菌目数量先上升后下降,以8月份的最高。
在科水平上,6-10月份内生细菌物种组成丰度较高的有甲基杆菌科(Methylobacteriaceae, 10.2%~ 58.2%)、鞘脂单胞菌科(Sphingomonadaceae, 12.6%~ 35.1%)、丛毛单胞菌科(Comamonadaceae, 0.6%~ 7.8%)、动孢囊菌科(Kineosporiaceae, 1.4%~4.9%)、假单胞菌科(Pseudomonadaceae, 0.9%~3.9%)、橙单胞菌科(Aurantimonadaceae, 0~9.7%)和微杆菌科(Microbacteriaceae, 0.9%~3.9%)。随时间变化,鞘脂单胞菌科在6月份最高,8月份最低;甲基杆菌科在8月份最高,6月份最低;丛毛单胞菌科数量先下降后上升,以8月份最低;动孢囊菌科数量先下降后上升,以9月份最低;假单胞菌科数量逐渐下降,以10月份最低;微球菌科和橙单胞菌科数量先上升后下降,以8月份最高。
在属水平上,6-10月份内生细菌物种组成丰度较高的有甲基杆菌属(Methylobacterium, 10.3%~ 58.1%)、鞘脂单胞菌属(Sphingomonas, 12.0%~ 31.1%)、新鞘脂菌属(Novosphingobium, 0~4.3%)、假单胞菌属(Pseudomonas, 0.8%~4.0%)、Quadrisphaera (0.9%~4.0%)、赖氨酸单胞菌属(Lysinimonas, 0~2.4%)和气单胞菌属(Aureimonas, 0~9.5%)。随时间变化,鞘脂单胞菌属在6月份最高,8月份最低;甲基杆菌属在8月份最高,6月份最低;新鞘脂菌属在10月份最高;Quadrisphaera和假单胞菌属数量先下降后上升,以9月份最低;气单胞菌属在9月份最高。
2.4 物种多样性指数从表 3可见,茉莉花植株内生细菌群落的Chao 1丰富度指数为122.64~301.24,Shannon多样性指数为2.29~3.13,Good’s物种覆盖度指数为88%~95%,有较高的文库覆盖度,能够真实地反应细菌多样性。
| 表 3 茉莉花植株的内生细菌多样性指数 Table 3 Diversity index of endophytic bacteria in Jasminum sambac |
Shannon指数反映了细菌数量和分布均匀度, 数值越大,说明群落多样性越高,数量越大,分布越均匀[16]。6-10月茉莉花植株内生细菌群落的Shannon指数分别是3.13、3.14、2.40、2.30和2.61,以6和7月较大,8、10月次之,9月最小。Simpson指数反映群落的集中程度,数值越大,种类的分布越集中,优势群落越明显[17]。6-10月茉莉花植株内生细菌群落的Simpson指数分别为0.14、0.13、0.21、0.25和0.18,7月的最小。因此,茉莉花植株内生细菌群落多样性在7月最高,分布最为均匀。
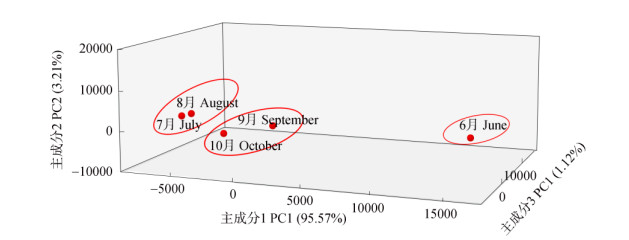
2.5 物种组成主成分分析以属水平的内生细菌物种丰度为指标,构建数据矩阵,进行主成分分析,分别以第1、2和3主成分作为X、Y、Z轴构建二维和三维空间的散点图(图 3)。PCA分析前3个主成分贡献率分别为95.57%、3.21%和1.12%,累计贡献率达到99.90%,说明前3个主成分能够代表所有物种理化指标的大部分信息,符合主成分分析的要求。PCA结果表明,在属水平上7和8月、9和10月的茉莉花植株内生细菌群落的构成相近,分别聚为一类,6月茉莉花植株的内生细菌群落结构与其他月份的差异最大, 另聚为一类。
|
图 3 茉莉花植株内生细菌在属水平上的PCA分析 Fig. 3 PCA analysis of endophytic bacteria at genus level in Jasminum sambac |
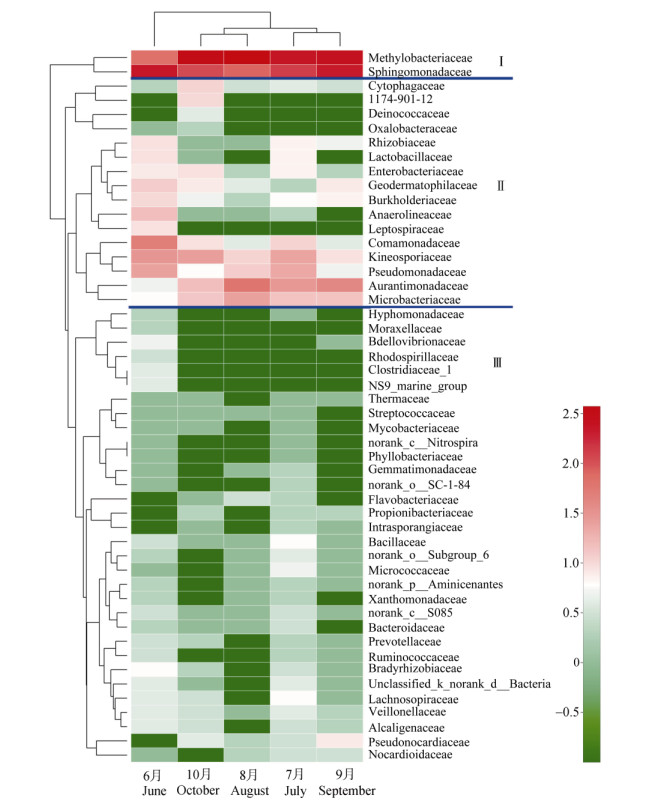
图 4为不同月份的茉莉花植株内生细菌物种丰度的heatmap。在科水平上,植株内生细菌丰度可分为3个簇,且第Ⅰ簇 > 第Ⅱ簇 > 第Ⅲ簇。
|
图 4 茉莉花植株内生细菌在科水平的细菌丰度heatmap分析 Fig. 4 Heatmap of endophytic bacterial at family level in Jasminum sambac |
第Ⅰ簇为高丰度细菌,主要为甲基杆菌科(Methylobacteriaceae)和鞘酯单胞菌科(Sphingomonadaceae),甲基杆菌科在6月的丰度(浅粉)明显低于其他月份(红色);鞘酯菌科在8和10月的丰度(浅粉色)显著低于其他月份(红色)。
第Ⅱ簇为中丰度细菌,主要有微杆菌科(Microbacteriaceae)、橙单胞菌科(Aurantimonadaceae)、假单胞菌科(Pseudomonadaceae)、动孢囊菌科(Kineosporiaceae)、丛毛单胞菌科(Comamonadaceae)、钩端螺旋体科(Leptospiraceae)、厌氧绳菌科(Anaerolineaceae)、地嗜皮菌科(Geodermatophilaceae)、肠杆菌科(Enterobacteriaceae)、乳杆菌科(Lactobacillaceae)、根瘤菌科(Rhizobiaceae)和噬纤维细菌科(Cytophagaceae)。不同月份的优势菌群明显不同,微杆菌科在6月的丰度很低(白色),而在其他月份较高(浅粉~粉红);橙单胞菌科在6月的丰度很低(浅绿),在其他月份较高(粉色~红色);假单胞菌科在9和10月的丰度很低(浅绿色),在其他月份高(浅粉~粉红); 噬纤维细菌科在10月的丰度较高(浅粉),在其他月份较低(浅绿~白色);厌氧绳菌科和钩端螺旋体科在6月的丰度较高(浅粉),在其他月份较低(浅绿~白色);地嗜皮菌科在7和8月的丰度很低(浅绿色~绿色);根瘤菌科在6和7月的丰度高于其他月份(绿色~白色)。
第Ⅲ簇为微丰度细菌,重要种类有伪诺卡氏菌科(Pseudonocardiaceae)、毛螺菌科(Lachnospiraceae)、微球菌科(Micrococcaceae)、杆菌科(Bacillaceae)。伪诺卡氏菌科在9月的丰度高(浅粉),其他月份低(白色~浅绿色);毛螺菌科、微球菌科和杆菌科在7月的丰度较高(白色),其他月份很低(浅绿色~深绿色)。
根据细菌群落的物种丰度组成,5个月份的植株内生细菌物种丰度可以聚成3类,7和9月、8和10月分别聚为一类,6月份单独聚为一类。
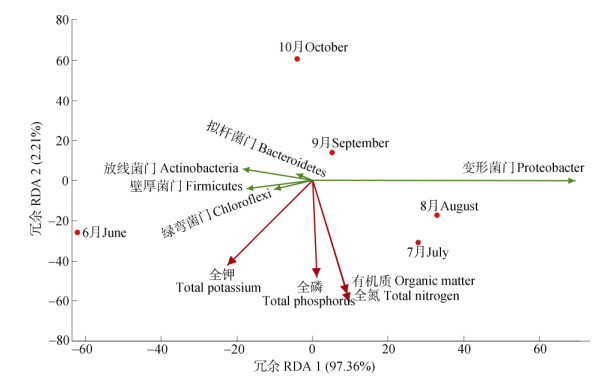
2.7 内生细菌和环境因子的冗余分析对茉莉花植株内生细菌在门水平上的群落结构与土壤营养成分的关联性进行了RDA分析(图 5)。结果表明,变形菌门与全钾含量夹角为钝角, 呈负相关;与全磷、全氮和有机质含量夹角均为锐角,呈正相关;放线菌门、拟杆菌门与全钾含量为锐角,呈正相关,与全磷、全氮和有机质含量为钝角,呈负相关;厚壁菌门、绿弯菌门和全钾、全磷含量为锐角,呈正相关,与全氮、有机质含量为钝角,呈负相关。
|
图 5 茉莉花植株内生细菌门水平的群落结构和土壤营养成分的RDA分析 Fig. 5 RDA between community structure of endophytic bacteria at phylum level in Jasminum sambac and soil nutrients |
相关性分析表明,6、7和8月茉莉花植株内生细菌群落结构到4个环境因子向量的投影点在箭头方向上,而9和10月的投影点均不在箭头方向上(反方向),表明6、7和8月的茉莉花植株内生细菌群落结构与环境因子呈正相关,而其他月份的为负相关。
2.8 内生细菌与环境因子的相关性热图分析应用相关性heatmap分析茉莉花植株内生细菌群落结构与土壤营养成分的关联性(图 6)。结果表明,细菌中与全磷呈显著负相关的门只有1个,为WCHB1-60;与全氮和有机质含量呈显著负相关的有WCHB1-60、疣微菌门(Verrucomicrobia)和迷踪菌门(Elusimicrobia),其中疣微菌门与有机质含量呈极显著负相关(P < 0.01);未发现与全钾有显著相关的细菌门。这表明,疣微菌门和迷踪菌门与全氮和有机质含量呈显著负相关,其含量随着全氮和有机质含量增加而降低。

|
图 6 热图分析主要细菌OTUs与环境因子相关性。*: P < 0.05; **: P < 0.01。 Fig. 6 Correlation between dominant OTUs of bacteria and soil nutrients by heatmap. *: P < 0.05; **: P < 0.01. |
植物内生细菌在植物体中的生物量很少,但其可代谢产生生物活性物质或通过信号传导方式影响寄主,能够增强植物对外界环境的抵抗能力,促进氮吸收能力,维持系统生态平衡[18]。内生细菌也被认为是研究植物-微生物相互作用的模式生物,郑斯平[19]研究表明,小叶满江红(Azolla imbricata)叶腔内栖息有蓝藻(固氮蓝细菌),细菌是满江红-蓝藻共生体中的第3个共生伙伴,形成了一种特殊的共生模式。目前已报道的植物内生细菌已超过129种(54属),常见的属有假单胞菌属(Pseudomonas)、肠杆菌属(Eterobacter)、芽胞杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea)、甲基杆菌属(Methylobacterium)等[3]。
植物不同,其内生细菌种类、数量和分布不同。滑桃树(Trewia nudiflora)茎皮的优势内生细菌为放线菌门和变形菌门[20];龙眼(Dimocarpus longan)果实内生细菌有肠杆菌属、果胶杆菌属(Pectobacterium)、克吕沃尔氏菌属(Kluyvera)和沙门氏杆菌属(Salmonella)[21];香蕉(Musa paradisiaca)的内生细菌有蓝细菌门、绿弯菌门、放线菌门、变形杆菌门、拟杆菌门、厚壁菌门和绿菌门(Chlorobi) 7大类群[22]; 金线莲(Anoectochilus roburghii)内生细菌有不可培养细菌、不可培养堆肥细菌、肠杆菌科(Enterobacteriaceae)、类芽胞杆菌属(Paenibacillus)、芽胞杆菌属和短芽胞杆菌属(Breuibacillus)等[8];小麦幼苗内生细菌有γ-变形菌纲肠杆菌科、梭菌纲(Clostridia)和不可培养细菌[10];金钗石斛(Dendrobium nobile)组培苗内生细菌主要由变形菌门、蓝细菌门和厚壁菌门组成,其中变形菌门和蓝细菌门为主要类群[23]; 上海青(Brassica chinensis)根内生细菌主要由变形杆菌门、放线菌门、拟杆菌门和厚壁菌门细菌组成[24]。本研究中,茉莉花枝条内生细菌主要有变形菌门、放线菌门、厚壁菌门、拟杆菌门和绿弯菌门等,其中变形菌门和放线菌门的丰度较高,分别达70.3%~85.7%和8.1%~10.5%,这5大菌门都是常见的植物内生细菌门,表明茉莉花内生细菌具有一般植物内生细菌的特点。一般土壤中常见细菌为变形菌门、酸杆菌门、放线菌门、拟杆菌门和绿弯菌门等,这证实了植物内生细菌主要来源于根际土壤微生物,但植物内生细菌门的组成和数量与土壤存在明显差异,说明植物样本内生细菌菌群具有其独特的生境类型[25-27]。
生存环境、生长阶段、气候条件等因素也会对植物内生群结构产生影响,İnceoğlu等[28]的研究表明,土豆(Solanum tuberosum)不同基因型和不同生长阶段对β-变形菌菌群都会产生影响。张爱梅等[29]对甘南高寒地区不同海拔的西藏沙棘(Hippophae rhamnoides)根瘤内生细菌多样性进行了研究,结果表明在海拔3 251 m的放线菌门和变形菌门数量最多,而蓝细菌门数量最少。本研究结果表明,6月的茉莉花植株内生细菌物种数目最多;7月植株内生细菌群落多样性最高,分布最为均匀,9月最低;6-10月气温呈先上升后下降的变化趋势,细菌数量也随之发生变化,厚壁菌门和拟杆菌门数量呈先下降后上升,变形菌门数量则是先上升后下降,绿弯菌门数量逐渐下降;7和8月、9和10月的茉莉花植株内生细菌群落构成相近,而6月与其他月份的差异最大,表明气温可能是影响茉莉花植株内生细菌含量变化的重要原因。
植物内生细菌主要来源于土壤微生物,土壤的营养成分供给可能会对植株内生细菌多样性产生影响。本研究结果表明,茉莉花植株内生细菌群落受土壤全氮、全钾、全磷和有机质含量影响,变形菌门数量与全钾含量呈负相关,与全磷、全氮和有机质含量呈正相关;放线菌门、拟杆菌门数量与全钾含量呈正相关,与全磷、全氮和有机质含量呈负相关,全氮和有机质含量对微生物菌门有显著影响。这将为发掘利用对茉莉花植株有益的内生菌资源, 控制潜在有害内生菌,保持生态系统平衡奠定基础。
| [1] | BACON C W, WHITE J F Jr. Microbial Endophytes[M]. New York: Marcel Dekker Inc., 2000: 389-420. |
| [2] | ALVIN A, MILLER K I, NEILAN B A. Exploring the potential of endophytes from medicinal plants as sources of antimycobacterial compounds[J]. Microbiol Res, 2014, 169(7/8): 483-495. DOI:10.1016/j.micres.2013.12.009 |
| [3] |
CHEN L, LIANG Z N, ZHU H. Research advances in the studies of plant entophytic[J].
Biotechnol Bull, 2015, 31(8): 30-34. 陈龙, 梁子宁, 朱华. 植物内生菌研究进展[J]. 生物技术通报, 2015, 31(8): 30-34. DOI:10.13560/j.cnki.biotech.bull.1985.2015.08.005 |
| [4] |
TAN X M, GUO S X, ZHOU Y Q, et al. Isolation of endophytic fungi from Anoectochiusr roxburghü (Wall) Lindl. and its antimicrobial activity[J].
Chin Pharm J, 2010, 45(3): 178-181. 谭小明, 郭顺星, 周雅琴, 等. 广西金线莲内生真菌的分离及抗菌活性研究[J]. 中国药学杂志, 2010, 45(3): 178-181. |
| [5] |
ZHANG Y M, Li H B, BI M Z, et al. Screening of wheat endophytic bacteria W-1 and the inhibition to Rhizoctonia cerealis[J].
Acta Agric Boreali-Sin, 2015, 30(S1): 278-282. 张毓妹, 李寒冰, 毕铭照, 等. 小麦内生细菌W-1的分离筛选及其对小麦纹枯病菌的抑制作用[J]. 华北农学报, 2015, 30(S1): 278-282. DOI:10.7668/hbnxb.2015.S1.050 |
| [6] | Ellis R J, Morgan P, Weightman A J, et al. Cultivation-dependent and -independent approaches for determining bacterial diversity in heavy-metal-contaminated soil[J]. Appl Environ Microbiol, 2003, 69(6): 3223-3230. DOI:10.1128/AEM.69.6.3223-3230.2003 |
| [7] | Handelsman J, Rondon M R, Brady S F, et al. Molecular biological access to the chemistry of unknown soil microbes:A new frontier for natural products[J]. Chem Biol, 1998, 5(10): R245-R249. DOI:10.1016/S1074-5521(98)90108-9 |
| [8] |
CHEN Q Q, LIU B, GUAN X, et al. Analysis of Anoectochilus roxburghii root microbial diversity by metagenomic technology[J].
J Agric Biotechnol, 2014, 22(11): 1441-1446. 陈倩倩, 刘波, 关雄, 等. 金线莲根部内生菌多样性宏基因组的分析[J]. 农业生物技术学报, 2014, 22(11): 1441-1446. DOI:10.3969/j.issn.1674-7968.2014.11.015 |
| [9] |
LI R H, YAN D H, FENG X H, et al. Diversity of Botryosphaeria spp., as endophytes in poplars in Beijing, based on molecular operational taxonomic units[J].
Sci Silv Sin, 2014, 50(1): 109-115. 李如华, 严东辉, 冯小慧, 等. 基于分子可操作分类单元的北京地区杨树内生葡萄座腔菌属真菌多样性[J]. 林业科学, 2014, 50(1): 109-115. DOI:10.11707/j.1001-7488.20140117 |
| [10] |
ZHAO Q, DENG Y Y, LI W, et al. Analysis of endophytes diversity in wheat seedlings by metagenomic technology[J].
Acta Phytopathol Sin, 2017, 47(3): 313-324. 赵芹, 邓渊钰, 李伟, 等. 小麦幼苗内生菌多样性的宏基因组分析[J]. 植物病理学报, 2017, 47(3): 313-324. DOI:10.13926/j.cnki.apps.000044 |
| [11] | YE Q P, JIN X Y, WEI S Q, et al. Effect of subcritical fluid extraction on the high quality of headspace oil from Jasminum sambac (L.) Aiton[J]. J AOAC Int, 2016, 99(3): 725-729. DOI:10.5740/jaoacint.15-0308 |
| [12] |
WANG X M, ZENG D P, MIN Q W, et al. Soil stoichiometric ratio and its effect on carbon release potential of Jasminum sambac plantations in Fuzhou[J].
Sci Soil Water Conserv, 2015, 13(1): 118-126. 汪旭明, 曾冬萍, 闵庆文, 等. 福州茉莉花种植园土壤化学计量比及其对碳释放潜力的影响[J]. 中国水土保持科学, 2015, 13(1): 118-126. DOI:10.3969/j.issn.1672-3007.2015.01.019 |
| [13] |
SHEN B Q, WANG Q F, LI J. Effect of different kinds of iron fertilizer sprayed on the growth and quality of jasmine plants[J].
Agric Technol, 2017, 37(18): 8, 89 沈邦琼, 王琼芳, 李娟. 喷施不同种类不同浓度铁肥对茉莉植株长势产量及品质的影响[J]. 农业与技术, 2017, 37(18): 8, 89 |
| [14] | EDGAR R C. UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J]. Nat Methods, 2013, 10: 996-998. DOI:10.1038/nmeth.2604 |
| [15] |
LIU B, WANG J P, CHEN Q Q, et al. Metagenomic analysis of microbial community in a microbial fermentation-bed for pig raising[J].
Fujian J Agric Sci, 2016, 31(6): 630-648. 刘波, 王阶平, 陈倩倩, 等. 养猪发酵床微生物宏基因组基本分析方法[J]. 福建农业学报, 2016, 31(6): 630-648. DOI:10.19303/j.issn.1008-0384.2016.06.015 |
| [16] | Klose S, Acosta-Martínez V, Ajwa H A. Microbial community composition and enzyme activities in a sandy loam soil after fumi-gation with methyl bromide or alternative biocides[J]. Soil Biol Biochem, 2006, 38(6): 1243-1254. DOI:10.1016/j.soilbio.2005.09.025 |
| [17] | Maguran A E. Ecological Diversity and Its Measurement[M]. Princeton: Princeton University Press, 1988: 141-162. |
| [18] |
SHI J Y, CHEN W X, LIU A Y. Advances in the study of endophytes and their effects on control of plant diseases[J].
Acta Ecol Sin, 2006, 26(7): 2395-2401. 石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展[J]. 生态学报, 2006, 26(7): 2395-2401. DOI:10.3321/j.issn:1000-0933.2006.07.044 |
| [19] |
ZHENG S P, CHEN B, GUAN X, et al. Diversity analysis of endo-phytic bacteria within Azolla microphylla using PCR-DGGE and electron microscopy[J].
J Agric Biotechnol, 2008, 16(3): 508-514. 郑斯平, 陈彬, 关雄, 等. 小叶满江红内生细菌多样性的PCR-DGGE及电子显微镜分析[J]. 农业生物技术学报, 2008, 16(3): 508-514. DOI:10.3969/j.issn.1674-7968.2008.03.025 |
| [20] | Wang H X, Geng Z L, Zeng Y, et al. Enriching plant microbiota for a metagenomic library construction[J]. Environ Microbiol, 2008, 10(10): 2684-2691. DOI:10.1111/j.1462-2920.2008.01689.x |
| [21] |
ZHU Y J, WANG Q H, CHEN L, et al. Isolation and fatty-acid identi-fication of endophytes in longan fruits[J].
Subtrop Plant Sci, 2008, 37(4): 22-25. 朱育菁, 王秋红, 陈璐, 等. 龙眼内生菌的分离与脂肪酸鉴定[J]. 亚热带植物科学, 2008, 37(4): 22-25. DOI:10.3969/j.issn.1009-7791.2008.04.006 |
| [22] |
LIU F F, Li C, LIU Y Q, et al. Analysis of entophytic bacteria community structure in banana by PCR-DGGE technique[J].
J Fruit Sci, 2012, 29(2): 235-240. 刘菲菲, 李赤, 刘勇勤, 等. 香蕉植株内生细菌群落的PCR-DGGE分析[J]. 果树学报, 2012, 29(2): 235-240. DOI:10.13925/j.cnki.gsxb.2012.02.017 |
| [23] |
GAO Y. Endophytes diversity and the correlation with the dendrobine content in Dendrobium nobile Lindl.[D]. Guiyang: Guizhou Normal University, 2017: 17-21.
高阳.金钗石斛内生菌多样性与石斛碱含量的相关性研究[D].贵阳: 贵州师范大学, 2017: 17-21. |
| [24] |
LEI S N, CHENG Z Q, XIONG J, et al. Composition and structure of root endophyte in Brassica chinensis L. infected by clubroot[J].
Chin Agric Sci Bull, 2017, 33(33): 39-45. 雷少楠, 程志强, 熊娟, 等. 患根肿病的上海青根内生菌组成和结构的研究[J]. 中国农学通报, 2017, 33(33): 39-45. |
| [25] | BAI Y, M LLER D B, SRINIVAS G, et al. Functional overlap of the Arabidopsis leaf and root microbiota[J]. Nature, 2015, 528(7582): 364-369. DOI:10.1038/nature16192 |
| [26] | BULGARELLI D, ROTT M, SCHLAEPPI K, et al. Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota[J]. Nature, 2012, 488(7409): 91-95. DOI:10.1038/nature11336 |
| [27] | SCHLAEPPI K, DOMBROWSKI N, OTER R G, et al. Quantitative divergence of the bacterial root microbiota in Arabidopsis thaliana relatives[J]. Proc Natl Acad Sci USA, 2014, 111(2): 585-592. DOI:10.1073/pnas.1321597111 |
| [28] | İnceoğlu, SallesJ F, van OverbeekL, 等. Effects of plant genotype and growth stage on the betaproteobacterial communities associated with different potato cultivars in two fields[J]. Appl Environ Microbiol, 2010, 76(11): 3675-3684. DOI:10.1128/AEM.00040-10 |
| [29] |
ZHANG A M, HANG X Y, ZHANG S H, et al. Diversity of root nodule endophytic bacteria in Hippophae thibetana at different altitudes in Gannan area[J].
Biotic Resour, 2018, 40(2): 114-119. 张爱梅, 韩雪英, 张世虎, 等. 甘南高寒地区不同海拔西藏沙棘根瘤内生菌多样性[J]. 生物资源, 2018, 40(2): 114-119. DOI:10.14188/j.ajsh.2018.02.004 |
 2018, Vol. 26
2018, Vol. 26


