2. 贵州省山地珍稀动物与经济昆虫重点实验室, 贵阳 550005
2. Guizhou Provincial Key Laboratory for Rare Animal and Economic Insect of the Mountainous Region, Guiyang 550005, China
黄秋葵(Abelmoschus esculentus)为锦葵科(Malvaceae)秋葵属一年生草本植物,是一种药食兼用型保健蔬菜[1-2]。该物种起源于非州,西非地区的野生资源最为丰富[3]。黄秋葵富含各种维生素和矿物质,其根、茎、叶和花皆可入药[4]。基于重要的食用和药用价值,近年来黄秋葵成为国内外研究的热点。
干旱是当前农业生产中面临的严峻问题,缺水会抑制植物的生长、代谢,进而降低产量,造成巨大的经济损失[5]。Clavel等[6]研究表明,干旱对作物生长的影响取决于作物的生长时期和水分胁迫的程度。Wang等[7]的研究表明,干旱胁迫会抑制水稻(Oryza sativa)幼苗的生长,显著降低茎和叶的干重。Lemoine等[8]的研究表明,干旱胁迫对植物地上部分的影响要高于地下部分。黄秋葵为热带作物,虽具有一定的耐旱性,但水分对黄秋葵种子萌发仍至关重要,缺水同样也会影响幼苗的生长和发育。韦吉等[9]研究表明,干旱胁迫下结荚期黄秋葵叶片的相对含水量和叶绿素含量下降,离体失水率、相对电导率、游离脯氨酸和可溶性蛋白质含量升高。Haq等[10]研究表明,黄秋葵苗期和整个生育期的耐盐特性无差异,说明苗期耐盐材料的筛选可作为种质资源抗性鉴定的重要基础,从而缩短育种进程。目前,关于黄秋葵抗干旱胁迫的研究较少,尚不明确其生理和分子机制。本研究采用不同浓度PEG-6000模拟干旱胁迫,探讨干旱胁迫对杂交黄秋葵‘纤指’和‘红秋葵’种子萌发和幼苗生理特性的影响,为揭示黄秋葵对干旱胁迫的应答机制提供参考依据。
1 材料和方法 1.1 材料黄秋葵(Abelmoschus esculentus)杂交品种‘纤指’种子由浙江省农业科学院提供,‘红秋葵’种子由湖南省农业科学院提供。PEG-6000溶液为模拟干旱胁迫处理剂,购自于贵州恒英试剂公司。
1.2 干旱胁迫PEG-6000浓度分别设为5%、10%、15%和20%,共4个干旱胁迫处理。以清水浸种为对照,每处理5次重复。
1.3 种子萌发2个黄秋葵品种各随机选取500粒大小一致、饱满种子,用5%次氯酸溶液消毒后,再用蒸馏水冲洗3次,摆放在铺有两层滤纸的培养皿内,每个培养皿20粒种子,种子的3/4浸没于处理溶液中。培养皿在光照培养箱(25℃)中发芽,光照12 h d–1, 相对湿度为(70±1)%。每隔3 d换1次液体,从种子置床至第6天,每天测定种子吸水量,并记录发芽种子数。
在种子萌发期测定种子的吸水量、发芽率、发芽势、根长、下胚轴长、苗鲜重和干重,并计算发芽指数、活力指数、简易活力指数和旱害率。每处理随机选取10粒种子或幼苗进行测量,取平均值。
吸水量(%)=(Wi-W)/W,发芽率(%)=第7天发芽的种子数/供试种子数×100%,发芽指数=∑Gt/ Dt, 发芽势(%)=3 d内发芽种子数/供试种子数× 100%,活力指数=S×∑Gt/Dt,简易活力指数=S×发芽率,旱害率(%)=(对照值-处理值)/对照值× 100%,式中,Wi为第i天的种子质量(g),W为种子的干质重(g);Gt为置床后t日的发芽数,Dt为相应的发芽天数;S为苗鲜重。
1.4 幼苗生理生化指标测定种子萌发第6天取幼苗叶片测量生理生化指标。采用考马斯亮蓝法[11]测定可溶性蛋白含量,采用蔥酮比色法[12]测定可溶性糖含量,采用茚三酮法[9]测定游离脯氨酸含量。参照石芸[13]的方法测定MAD含量和POD活性,参照Hwang等[14]的方法稍改进测定SOD活性,KMnO4滴定法[13]测定CAT活性。每处理均5次重复。
1.5 统计分析试验数据采用Excel 2010进行统计整理,采用SPASS 10.0进行分析, 以P < 0.05和P < 0.01分别表示处理间差异显著和极显著。
2 结果和分析 2.1 对种子吸水量的影响由图 1可看出,干旱胁迫下,黄秋葵两品种的种子吸水率总体上均明显低于其对照,且种子的吸水率随PEG-6000浓度的增加而降低。20% PEG- 6000处理‘红秋葵’种子吸水率持续降低,其余处理的吸水率均呈先上升后下降再升高的变化趋势; ‘纤指’的种子吸水率均呈先上升后下降再上升的变化趋势,这说明干旱胁迫会抑制黄秋葵种子对水分的吸收,降低其吸水率。
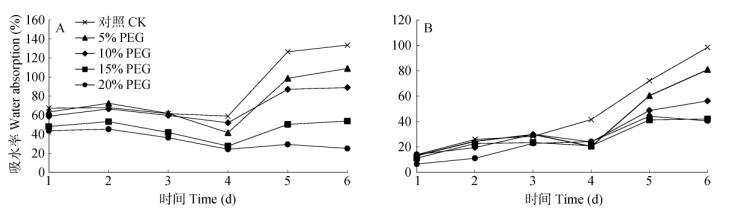
|
图 1 ‘红秋葵’(A)和‘纤指’(B)种子在PEG-6000处理下的吸水率 Fig. 1 Water absorbing rate of 'Red okra' (A) and 'Qianzhi" (B) seeds treated by PEG-6000 |
由表 1可知,‘纤指’和‘红秋葵’种子的发芽势、发芽率、发芽指数、活力指数、简易活力指数和幼苗的下胚轴长、根长、苗鲜重和苗干重均随着PEG-6000浓度的增加而降低。在PEG-6000浓度为20%时,‘纤指’和‘红秋葵’种子均未发芽,当PEG-6000浓度为15%时,‘红秋葵’种子的发芽势为0。‘纤指’种子的发芽率和活力指数和‘红秋葵’种子的发芽率、发芽指数和活力指数在不同处理间均差异显著(P < 0.05);与对照相比,在PEG-6000浓度为5%和10%时,‘纤指’种子的发芽势、发芽率、发芽指数、活力指数、简易活力指数和苗下胚轴长的下降幅度明显高于‘红秋葵’;而在PEG-6000浓度为20%时则是‘纤指’的明显低于‘红秋葵’。在PEG-6000浓度低于15%时,‘纤指’幼苗根长和鲜重的下降幅度均高于‘红秋葵’。这说明干旱胁迫抑制了黄秋葵种子的萌发和幼苗的生长,重度胁迫(20%的PEG-6000)下黄秋葵种子不能萌发。
| 表 1 干旱胁迫下黄秋葵种子萌发性状的变化 Table 1 Changes in seed germination of two okra varieties under drought stress |
由表 2可以看出,‘纤指’和‘红秋葵’各性状的旱害率随PEG-6000浓度的增加而增加。PEG-6000浓度为5%和10%时,‘纤指’各性状的旱害率明显高于‘红秋葵’;PEG-6000浓度为20%时,‘纤指’种子的发芽势、发芽率、发芽指数、苗干重的旱害率却低于‘红秋葵’。PEG-6000浓度为5%~10%时,‘纤指’各性状旱害率的增加幅度明显高于‘红秋葵’, PEG- 6000浓度为10.00%~15.00%时,‘纤指’的增加幅度明显低于‘红秋葵’。这说明干旱胁迫越严重,对黄秋葵种子萌发的抑制作用也越强。总体而言,干旱胁迫对‘纤指’种子萌发的抑制作用要低于‘红秋葵’。
| 表 2 干旱胁迫下黄秋葵性状的旱害率(%) Table 2 Drought-injury rate (%) of traits of two okra varieties under drought stress |
结果表明(表 3),‘纤指’和‘红秋葵’幼苗叶片的可溶性糖、可溶性蛋白、游离脯氨酸、丙二醛含量均随着PEG-6000浓度的增加而增加。5%、10%和15% PEG-6000处理的‘纤指’幼苗叶片可溶性糖含量与对照差异显著,但处理间差异不显著。PEG- 6000浓度为10%和15%时,‘纤指’幼苗叶片的可溶性蛋白含量与对照差异显著,但PEG-6000浓度为5%的与对照差异不显著。在PEG-6000浓度为5%时,‘纤指’幼苗叶片的游离脯氨酸含量与对照差异不显著,但PEG-6000浓度为10%和15%时则与对照差异极显著。PEG-6000处理的‘纤指’幼苗叶片丙二醛含量均差异显著,且PEG-6000浓度为10%和15%的与5%和对照的均差异极显著。这说明干旱胁迫会提高黄秋葵幼苗细胞内含物的含量,但轻度胁迫时(PEG-6000浓度为5%)时增加不明显。
| 表 3 干旱胁迫下黄秋葵幼苗叶片的可溶性蛋白、游离脯氨酸、可溶性糖和丙二醛含量 Table 3 Soluble protein, proline, soluble sugar and malondialdehyde contents in seedling leaves of two okra varieties under drought stress |
在PEG-6000浓度为5%时,‘红秋葵’幼苗叶片的可溶性糖含量与对照差异不显著,但PEG-6000浓度为10%和15%时与对照和5%的均差异极显著。PEG-6000处理的‘红秋葵’幼苗叶片可溶性蛋白含量均差异显著,且PEG-6000浓度为10%和15%的与对照和5%的均差异极显著。在PEG-6000浓度为5%时,‘红秋葵’幼苗叶片的游离脯氨酸含量与对照差异不显著,但PEG-6000浓度为10%和15%时与对照和5%的均差异极显著。PEG-6000处理的‘红秋葵’幼苗叶片丙二醛含量与对照均差异极显著。与对照相比,在PEG-6000浓度为5%时,‘纤指’幼苗叶片的可溶性糖、可溶性蛋白、游离脯氨酸和丙二醛含量增加幅度明显高于‘红秋葵’。与对照相比,在PEG-6000浓度为10%和15%时,‘纤指’幼苗叶片的可溶性糖、可溶性蛋白、游离脯氨酸和丙二醛含量增加的幅度明显低于‘红秋葵’。这说明干旱胁迫下, ‘纤指’幼苗叶片的细胞内含物的含量高于‘红秋葵’, 表现出较强的耐旱性。
2.5 对SOD、POD和CAT活性的影响从表 4可见,‘纤指’和‘红秋葵’幼苗叶片的SOD、POD和CAT活性均随PEG-6000浓度的增加而显著增加。‘纤指’幼苗叶片的SOD、POD和CAT活性在处理间均差异极显著。‘红秋葵’幼苗叶片的SOD活性在处理间均差异极显著。PEG-6000浓度为5%时,‘红秋葵’幼苗叶片珠POD和CAT活性与对照差异不显著,但其余处理间均差异极显著。与对照相比,在PEG-6000浓度为5%时,‘纤指’幼苗叶片的SOD、POD和CAT活性的增加幅度明显高于‘红秋葵’。与对照相比,在PEG-6000浓度为10%和15%时,‘纤指’幼苗叶片的SOD、POD和CAT活性的增加幅度明显低于‘红秋葵’。这说明干旱胁迫会影响黄秋葵幼苗叶片的抗氧化酶活性,但对不同品种黄秋葵幼苗叶片的影响程度有所不同。
| 表 4 干旱胁迫下黄秋葵的SOD、POD和CAT活性 Table 4 Activities of SOD, POD and CAT in seedling leaves of two okra varieties under drought stress |
本研究结果表明,用不同浓度(5%、10%、15%和20%)的PEG-6000溶液模拟干旱胁迫,黄秋葵2品种种子的吸水率、发芽势、发芽率、发芽指数、活力指数、简易活力指数和幼苗的下胚轴长、根长、鲜重和干重均随干旱胁迫程度增加呈降低的趋势, 其旱害率随着胁迫程度增加而增加。这说明干旱胁迫明显抑制黄秋葵种子的萌发,且影响程度与干旱程度相关,这与Altaf等[15]的研究结果相同。由于影响植物生长发育的细胞因子、生理生化作用等与干旱胁迫因子间的互作十分复杂,因此,造成植物对干旱胁迫的响应也十分复杂[16]。干旱胁迫会使植物叶片气孔关闭,抑制细胞延展和生长,破坏细胞结构,中断酶的合成反应,严重的干旱胁迫会终止光合作用,最终导致植物死亡。本研究结果表明, 重度干旱胁迫会导致黄秋葵种子不能萌发或者幼苗死亡,但黄秋葵两品种对轻度干旱胁迫均具有一定的耐性,PEG-6000浓度为5%和10%时,‘红秋葵’幼苗对干旱胁迫的抗性强于‘纤指’,而PEG-6000浓度15%时则弱于‘纤指’,提示不同品种黄秋葵对干旱胁迫的响应可能不同,导致其适应的胁迫程度不同。
本研究结果表明,‘纤指’和‘红秋葵’幼苗叶片的SOD、POD和CAT活性和可溶性蛋白、可溶性糖、游离脯氨酸、丙二醛含量随PEG-6000浓度的增加而增加,这与Rabert等[17]的研究结果一致,同时也与水稻[18]、玉米(Zea mays)[19]等作物的研究结果相似。Manivannan等[20]研究表明,SOD可增强植物对水分胁迫的耐受力,同时SOD和CAT的协同作用可将O2·和H2O2转换成水和分子态氧,从而避免细胞因缺水而破损。植物细胞内游离脯氨酸和可溶性蛋白的积累可能起渗透调节作用,是对干旱胁迫引起伤害的反映。丙二醛含量反映植物细胞膜质的过氧化程度[21],干旱胁迫条件下,黄秋葵丙二醛含量增加,说明其细胞膜质过氧化程度较高,细胞膜受损。干旱胁迫会引起细胞内活性氧的爆发,从而引起细胞内的代谢紊乱,因此,植物可能通过提高其抗氧化能力来抵御干旱胁迫对植物细胞的伤害。本研究仅初步研究了干旱胁迫对黄秋葵种子萌发、幼苗细胞内含物含量和抗氧化酶活性的影响,后续将研究抗旱相关基因的表达模式,以进一步揭示黄秋葵对干旱胁迫的应答机制。
| [1] | Adelakun O E, Oyelade O J, Ade-omowaye B I O, et al. Chemical composition and the antioxidative properties of Nigerian okra seed (Abelmoschus esculentus Moench) flour[J]. Food Chem Toxicol, 2009, 47(6): 1123-1126. DOI:10.1016/j.fct.2009.01.036 |
| [2] | AHMADI A, EMAM Y, PESSARAKLI M, et al. Response of various cultivars of wheat and maize to salinity stress[J]. J Food Agric Environ, 2009, 7(1): 123-128. |
| [3] | AMOATEY H M, AHIAKPA J K, QUARTEY E K. Agromorpholo gical characterisation of 29 accessions of okra (Abelmoschus spp. L.)[J]. J Biol Agric Heal, 2015, 5(4): 6-16. DOI:10.09183/JBAH/19384.39 |
| [4] | JARRET R, WANG M L, LEVY I J. Seed oil and fatty acid content in okra (Abelmoschus esculentus) and related species[J]. J Agric Food Chem, 2011, 59(8): 4019-4024. DOI:10.1021/jf104590u |
| [5] | TAS S, TAS B. Some physiological responses of drought stress in wheat genotypes with different ploidity in Turkiye[J]. World J Agric Sci, 2007, 3(2): 178-183. |
| [6] | CLAVEL D, DRAME N K, ROY-MACAULEY H, et al. Analysis of early responses to drought associated with field drought adaptation in four Sahelian groundnut (Arachis hypogaea L.) cultivars[J]. Environ Exp Bot, 2005, 54(3): 219-230. DOI:10.1016/j.envexpbot.2004.07.008 |
| [7] | ZHENG M M, TAO Y, HUSSAIN S, et al. Seed priming in dry direct-seeded rice:Consequences for emergence, seedling growth and associated metabolic events under drought stress[J]. Plant Growth Regul, 2016, 78(2): 167-178. DOI:10.1007/s10725-015-0083-5 |
| [8] | LEMOINE R, LA CAMERA S, ATANASSOVA R, et al. Source-to-sink transport of sugar and regulation by environmental factors[J]. Front Plant Sci, 2013, 4: 272 DOI:10.3389/fpls.2013.00272 |
| [9] |
WEI J, LI J P, LUO Y C, et al. The physiological and biochemical reaction of different accessions of okra under drought condition[J].
Chin Agric Sci Bull, 2008, 24(6): 452-455. 韦吉, 黎军平, 罗燕春, 等. 不同黄秋葵种质对干旱的生理生化反应[J]. 中国农学通报, 2008, 24(6): 452-455. |
| [10] | HAQ I U, KHAN A A, KHAN I A. Comprehensive screening and selection of okra (Abelmoschus esculentus) germplasm for salinity tolerance at the seedling stage and during plant ontogeny[J]. J Zhejiang Univ Sci B, 2012, 13(7): 533-544. DOI:10.1631/jzus.B1200027 |
| [11] | GEORGIOU C D, GRINTZALIS K, ZERVOUDAKIS G, et al. Mecha-nism of Coomassie brilliant blue G-250 binding to proteins:A hydro-phobic assay for nanogram quantities of proteins[J]. Anal Bioanal Chem, 2008, 391(1): 391-403. DOI:10.1007/s00216-008-1996-x |
| [12] | DAVIES D R, MERRY R J, WILLIAMS A P, et al. Proteolysis during ensilage of forages varying in soluble sugar content[J]. J Dairy Sci, 1998, 81(2): 444-453. DOI:10.3168/jds.S0022-0302(98)75596-1 |
| [13] |
SHI Y, TAN X H, CHI Y M, et al. Study on IR fingerprint spectra of Abelmoschus corolla[J].
Chin Wild Plant Res, 2012, 31(2): 29-32. 石芸, 谈献和, 池玉梅, 等. 黄蜀葵花红外指纹图谱研究[J]. 中国野生植物资源, 2012, 31(2): 29-32. DOI:10.3969/j.issn.1006-9690.2012.02.008 |
| [14] | JAJEEL C A, MANIVANNAN P, LAKSHNANAN G M, et al. Alterations in morphological parameters and photosynthetic pigment responses of Catharanthus roseus under soil water deficits[J]. Colloids Surf B Biointerfaces, 2008, 61(4): 298-303. |
| [15] | ALTAF R, HUSSAIN K, MARYAM U, et al. Effect of different levels of drought on growth, morphology and photosynthetic pigments of lady finger (Abelmoschus esculentus)[J]. World J Agric Sci, 2015, 11(4): 198-201. DOI:10.5829/idosi.wjas.2015.11.4.1856 |
| [16] | RAZMJOO K, HEYDARIZADEH P, SABZALIAN M R. Effect of salinity and drought stresses on growth parameters and essential oil content of Matricaria chamomila[J]. Int J Agric Biol, 2008, 10(4): 1560-8530. |
| [17] | RABERT G A, RAJASEKAR M, MANIVANNAN P, et al. Effect of triazole fungicide on biochemical and antioxidant enzymes activity in okra (Abelmoschus esculentus L.) plant under drought stress[J]. Int J Agric Food Sci, 2013, 3(3): 100-107. |
| [18] | CHANDRASHEKRAR R P, VAJRANABHAINAN S N, UDAYA-KUMAR M. Lipid peroxidation as a mechanism of stress tolerance in upland rice (Oryza sativa L.) calli[J]. Ind J Plant Physiol, 1998, 3(1): 68-70. DOI:10.1021/la903815t |
| [19] | JIANG M, ZHANG J. Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves[J]. J Exp Bot, 2002, 53(379): 2401-2410. DOI:10.1093/jxb/erf090 |
| [20] | MANIVANNAN P, JALEELL C A, KISHOREKUMAR A, et al. Changes in antioxidant metabolism under drought stress in Vigna unguiculata (L.) Walp[J]. Ind J Plant Physiol, 2007, 12(2): 133-137. |
| [21] | CONRAD A C, MATHABATHA M F. Characterization and expression analyses of chalcone synthase (CHS) and anthocyanidin synthase (ANS) genes in Clivia miniata[J]. Transcriptomics, 2016, 4(2): 136 DOI:10.4172/2329-8936.1000136 |
 2018, Vol. 26
2018, Vol. 26


