角毛藻属(Chaetoceros Ehrenberg)物种广泛分布于全球各类水体[1-2],某些物种还是重要的藻华生物[3-4]。该属是硅藻门中物种多样性最为丰富的大属之一,目前已报道534个分类单位[5],但至少有一半被怀疑是同种异名[2, 6-7]。
异角毛藻(C. diversus Cleve)和平滑角毛藻(C. laevis Leuduger-Fortmorel)是常见的近岸暖水种,两者的典型特征是:(1)链状群体短而直,窗孔窄甚至不可见;(2)存在粗大角毛;(3)角毛上具有螺旋排列的小刺及孔纹; 区别特征主要在于粗大角毛的延伸方向不同,异角毛藻的粗大角毛自壳面边缘生出后与链轴成45°角延伸,后平行于链轴,而平滑角毛藻的粗大角毛与链轴呈垂直方向延伸,后平行于链轴。其次, 两者的地理分布也有所不同,异角毛藻被认为是热带近岸种,而平滑角毛藻是热带大洋种[8-10]。然而也有学者认为上述形态学差异细微, 地理分布差异也不明显,推测它们是同种异名[11-12]。截止目前,关于异角毛藻和平滑角毛藻的分类学争论,还停留在单纯的形态学水平,未见分子生物学技术的引入,因此仍未能建立可信的结论。目前, 基于特异基因序列分析的分子分类学技术已被应用于藻类学研究,尤其是核糖体大亚基编码基因D1~D3区,在硅藻的分类学和系统学研究中得到较为广泛地应用和认可,极大促进了重要硅藻类群的分类学和系统学进展[13-15]。
本文基于建立的单克隆培养藻株,结合生活史中形态特征的连续观察,以及基于目标基因的分子系统学方法,开展分类学和系统学工作,以期能够明确异角毛藻和平滑角毛藻的物种信息,澄清现存的分类学疑问。
1 材料和方法 1.1 样品采集2017年5月利用浮游植物网(孔径10 μm)在广东省南澳岛附近海域进行水平拖网采集活体浮游植物样品。采集的水样尽快带回实验室进行目标藻株的分离、纯化。水体盐度为32‰,水温25℃。
1.2 单克隆培养株系的建立根据目前认知的异角毛藻和平滑角毛藻的形态特征,在明美MI-12生物倒置显微镜下,利用毛细管分离法挑取单个藻细胞或单条链状群体,转移至48孔培养板中,以L培养液扩繁。确认其存活并开始繁殖之后,转移至100 mL三角瓶中培养。藻株培养条件为20℃、光/暗=12 h/12 h、光强50~ 80 μmol m-2s-1。本文共建立了7个单克隆培养株系: MC2613、MC2615、MC2661、MC2667、MC2668、MC2669和MC2677。
1.3 休眠孢子的诱导吸取5 mL对数生长期的藻液,转移到100 mL三角瓶中,以L无氮培养液诱导休眠孢子。培养条件同上。每个藻株至少诱导3次以上,定期观察休眠孢子的产生。
1.4 形态学特征观察光学显微镜(light microscope, LM)观察 取100 μL对数期藻株,在Olympus BX53显微镜下进行观察和拍照。
扫描电子显微镜(scanning electron microscope, SEM)观察 取1 mL对数期藻液,加入等体积浓硫酸,静置10 min以去除有机质,双蒸水多次水洗至中性[16]。吸取适量样品,过滤至5 μm Milipore滤膜上,自然晾干后用碳导电胶贴于铜台上,喷金并置于扫描电镜(Zeiss Utras55, Germany)下观察和拍照。
透射电镜(transmission electron microscopy, TEM)观察 样品的处理方法同上。吸取10 μL酸化样品,滴加在喷镀碳膜的微孔铜网上,自然晾干后,置于透射电镜(Philips Tecnai 10, Holland)下观察和拍照。
为避免室内培养环境对形态特征的影响,形态学观察在株系建立后的1个月内完成。
1.5 基于LSU nrDNA的分子系统学分析离心法收集对数生长期藻细胞,提取总DNA, 扩增核糖体大亚基编码基因(large subunit ribosomal encoding gene, LSU)的D1~D3区序列[14]。PCR产物送往深圳华大基因公司(BGI)进行纯化和测序。
在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)检索和下载形态相似种、遗传相似种的LSU序列。运用BioEdit软件进行序列的比对和矩阵[17],有774个碱基用于最终的分析。基于MrModeltest 2.3[18]的计算,选择最适模型。利用RAxML-HPC2[19]和MrBayes 3.2[20]构建最大似然树(maximum likelihood, ML)和贝叶斯推理树(bayesian inference, BI)。ML分析的自检值(bootstrap test)为1 000, 以霍氏半管藻(Hemiaulus hauckii Grunow, EF423428)为外类群。
2 结果 2.1 基于形态特征的物种鉴定利用LM和EM对7个分离藻株进行了形态学观察,并根据粗大角毛的延伸方向,可划分为两个类群。
类群Ⅰ:包括株系MC2613、MC2667和MC2669。细胞链短且直,窗孔窄甚至无。藻株分离初期,观察到链中角毛粗大,自壳面边缘生出后与链轴成45°角延伸,后平行于链轴。随着培养时间的延伸,有些粗大角毛与链轴几乎垂直延伸,然后平行于链轴。鉴于藻株建立初期的特征符合异角毛藻的原始描述[21],可鉴定为异角毛藻。
类群Ⅱ:包括MC2615、MC2661、MC2668和MC2677。细胞链短且直,窗孔窄甚至无。藻株分离初期,链中角毛粗大,先与链轴呈垂直方向延伸, 后逐渐平行于链轴。培养一段时间后,有些粗大角毛自壳面边缘生出后与链轴成45°角延伸,后平行于链轴。鉴于藻株建立初期的特征符合平滑角毛藻的原始描述[22],可鉴定为平滑角毛藻。
2.2 基于LSU nrDNA部分序列的分子系统学分析基于LSU nrDNA D1~D3序列信息,分别构建了ML和BI系统进化树,两者具有相似的拓扑结构。最终用于分析的774个碱基中,异角毛藻株系(MC2613、MC2667和MC2669)与3个平滑角毛藻株系(MC2615、MC2668和MC2677)具有完全相同的碱基序列,另有1个平滑角毛藻株系(MC2661)存在2个差异碱基,均为C-T。系统树(图 1)显示异角毛藻与平滑角毛藻株系聚在同一分支上,具有相同的系统学位置,置信值较高(BPP=1.00, ML= 100),表明本文建立的7个株系应该属于同一物种。
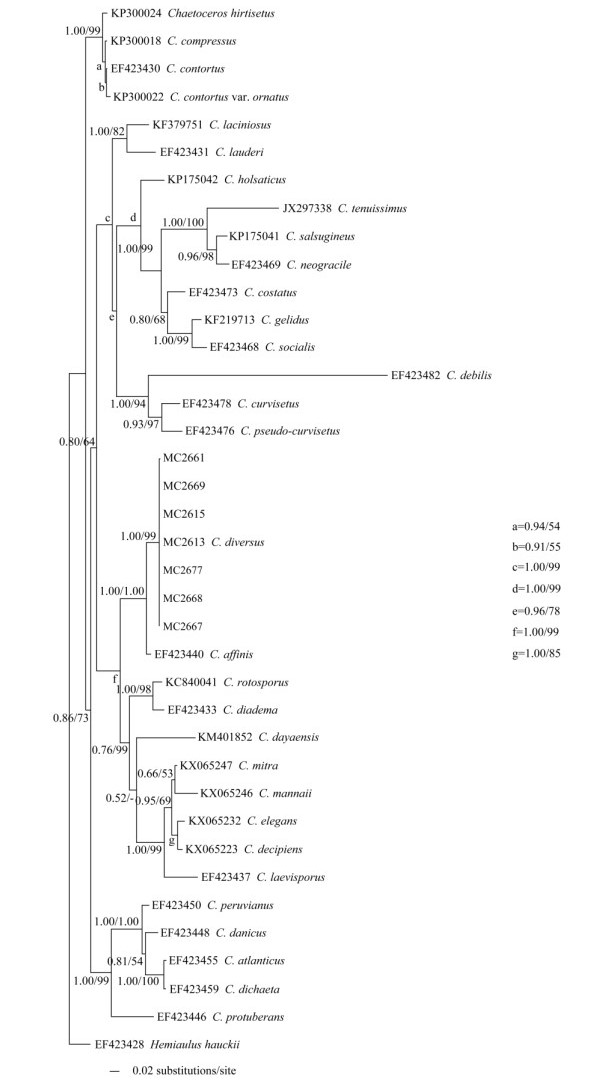
|
图 1 基于LSU nrDNA部分序列的系统树 Fig. 1 Molecular phylogenetic tree based on sequences of LSU rDNA |
结合形态特征和分子系统学结论,我们认为本文建立的7个单克隆培养株系具有高度同源的LSU nrDNA D1~D3序列,应该属于同一物种。
2.4 分类处理
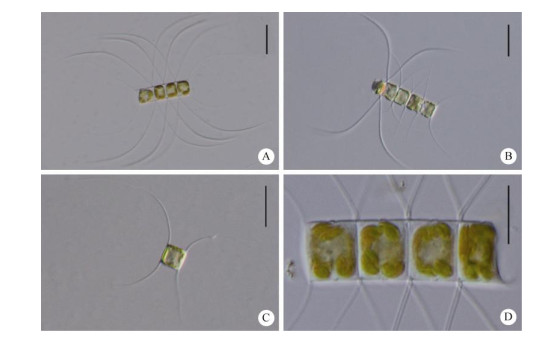
|
图 2 异角毛藻(LM). A, B:链状群体(MC2613); C:单细胞(MC2668); D:链状群体放大(MC2613)。标尺: A~C=20 μm; D=10 μm Fig. 2 Chaetoceros diversus under LM. A, B: Chain colonies (MC2613); C: Single cell (MC2668); D: Enlargement of chain (MC2613). Bars: A-C=20 μm; D=10 μm |

|
图 3 异角毛藻(SEM: A, B, D, F, H, I; TEM: C, E, G). A:链状群体(MC2613); B, C:相邻壳面(MC2661)和窗孔(MC2667); D, E:链端壳面(MC2668); F:链中壳面(MC2669); G:环带(MC2667); H, I:角毛结构(MC2669)。标尺: A=10 μm; B, E~G=2 μm; C=5 μm; D, H, I=1 μm Fig. 3 Chaetoceros diversus under SEM (A, B, D, F, H, I) and TEM (C, E, G). A: Chain colonies (MC2613); B, C: Sibling valves (MC2661) and apertures (MC2667); D, E: Terminal valves (MC2668); F: Intercalary valve (MC2669); G: Girdle band (MC2667); H, I: Structure on setae (MC2669). Bars: A=10 μm; B, E-G=2 μm; C=5 μm; D, H, I=1 μm |
Chaetoceros diversus Cleve, 1873 Bihang till K Svenska Vet-Akad Handlingar., 1(11): 9, pl. 2, fig. 12 Cleve Synonym: Chaetoceros laevis Leuduger- Fortmorel 1892;郭玉洁和钱树本2003。
细胞链直, 常形成2~6个细胞的短链群体(图 2: A, B),也有单细胞生活的情况(图 2: C),细胞宽环面观呈矩形(图 2: B~D)。每个细胞含1个色素体(图 2: D)。壳套高度大于贯壳轴的二分之一(图 2: A, D), 分布有小孔(图 3: C),基部有1圈凹槽(图 3: B, C)。相邻细胞之间的窗孔窄,甚至不可见(图 2: D), 常覆盖一层硅质膜(图 3: B),中央平或有略微缢缩(图 3: A, B)。壳面观呈宽椭圆形或近圆形(图 3: E, F),中央区域凸起。壳面散布有数量众多的小孔, 边缘有圆弧形肋纹(图 3: E)。壳面长轴两端有明显隆起,上生角毛。链端壳面近中央位置有一个唇形突,外管较短(图 3: D, E),链中壳面则无唇形突(图 3: F)。壳面长轴8.95~11.11 μm,平均为(10.14±0.55) μm, 贯壳轴高6.03~10.74 μm,平均为(8.70±0.81) μm (n > 50)。
角毛分为3种类型:链端角毛、普通链中角毛和粗大链中角毛。链端角毛细微,延伸方向多变, 有时与链轴成45°角延伸(图 2: A,图 3: A),有时略垂直于链轴(图 2: B, C)。链中角毛的延伸方向亦有变化,有时与链轴成45°角延伸(图 2: D, 图 3: A),后平行于链轴(图 2: A),也有垂直于链轴延伸(图 2: B)。链端角毛与普通链中角毛结构相似,分布有交替纵向排列的孔纹和小刺,孔纹呈长条形(图 3: H),长0.07~0.13 μm,平均为(0.09±0.01) μm,密度为9.82~12.23 μm-1,平均为(10.89±0.61) μm-1。粗大的链中角毛硅质化重,在弯曲部分最粗,末端尖细如镰刀状。角毛上均分布有交替纵向排列的孔纹和小刺,每两行小刺之间有一条凹沟,凹沟上有成排的小孔和零散分布的大孔(图 3: I),大孔纹呈椭圆形,两大孔之间的距离为1.15~5.22 μm,平均为(2.92± 1.24) μm,小孔卵圆形,密度为9.88~11.47 μm-1, 平均为(10.49±0.47) μm-1 (图 3: I)。环带上分布有肋纹(图 3: G)。
未见休眠孢子。
分布:本文标本采集广东省南澳岛(5月),山东、海南岛也曾有分布[23]。本种还曾记录于大西洋[11]、南墨西哥湾[12]、北美西部沿岸[8]、日本海[24]、韩国[25]、印度洋[26]。
3 讨论 3.1 异角毛藻和平滑角毛藻的分类学争议以往关于异角毛藻和平滑角毛藻的分类学争议,集中体现在对于粗大角毛延伸方向的分类学赋值。有学者认为粗大角毛延伸方向是稳定特征,具有分类学意义,故认为异角毛藻和平滑角毛藻是独立的物种[8-10, 24]。也有学者认为粗大角毛延伸方向受环境、生活史等因素影响,是不稳定特征,因此认为平滑角毛藻应该是异角毛藻的同种异名[11]。Moreno等[12]曾详细地研究了异角毛藻和平滑角毛藻的形态学特征,认为粗大角毛的延伸方向存在变化的情况,认为平滑角毛藻应该是异角毛藻的同种异名。但是该研究仅局限于形态学方法,并不能建立可信的结论,因此未被广泛接受。
本文基于培养株系生活史的连续观察,也发现平滑角毛藻株系(MC2615和MC2668)的粗大角毛延伸方向存在变化,甚至在同一个株系中,有些粗大角毛壳面边缘生出后与链轴成45°角延伸,后平行于链轴(图 2: A, 图 3: A),也有部分粗大角毛自壳面边缘生出后垂直于链轴,后平行于链轴(图 2: B, C)。较细链中角毛和端角毛的延伸方向也存在变化的情况。这些表明角毛延伸方向是不稳定的,因此角毛延伸方向不宜作为分类学特征。与此同时,基于核糖体大亚基基因D1~D3区的序列分析表明, 异角毛藻和平滑角毛藻株系具有完全一致的碱基信息,仅有1个平滑角毛藻株系(MC2661)存在2个差异碱基。分子系统树也显示它们具有相同的系统学位置,也支持它们是同一物种。
金德祥等[9]曾认为异角毛藻和平滑角毛藻粗大角毛的末端形态也有不同,前者粗大角毛的末端呈镰刀型,弯曲处最宽,而后者粗大角毛尖细呈圆形,未见明显最宽处,这一特征在作者手绘图中有清晰展示(loc. cit.图 112)。然而在其他学者的研究中, 这一特征未再有报道,普遍认为两者粗大角毛末端形态是一致的,弯曲处最为宽大,呈镰刀型,本文亦支持这一观点。
除了上述形态学差异之外,不同的地理分布区域也曾被用来支持他们是独立物种。以往认知中, 认为异角毛藻属于热带近海种,多分布于东海的福建沿海及南海的广东北部湾,此外,欧洲北海和地中海及黑海、印度尼西亚的爪哇、浙江舟山群岛、台湾海峡、日本沿海也有报道。而平滑角毛藻被认为是热带大洋种,曾报道于南海的海南岛和东海的外海区,以及韩国南部,日本海,爪哇海和美国加利福尼亚海域[8-10]。其次,在东海(厦门一带)仅见到异角毛藻,而南海南的海南岛一带常见到平滑角毛藻,却少见异角毛藻[8-10]。然而通过查阅文献, 印度、加拿大、北美等远洋海域也曾报道过异角毛藻[26]。异角毛藻和平滑角毛藻分布广泛,在分布区域上也有交叉,本研究也在南澳岛同时采集到异角毛藻和平滑角毛藻。另外,粗大角毛的延伸方向易受水温等环境因素的影响, 或多或少也误导了以往研究的鉴定结果。
3.2 角毛特征的分类学探讨角毛是角毛藻属的标志特征,被赋予重要的分类学价值[2, 6, 27]。然而作为具有三维复合形态的重要结构,角毛各个特征的分类学价值各不相同。以往研究中,对于角毛各个特征分类学价值的认定差异,也导致了诸多分类学争议。在光镜时代,由于能够观察到的特征有限,角毛延伸方向与链轴的关系、角毛基部与壳面的关系等,都被作为重要特征。如粗大角毛的延伸方向被认为是异角毛藻和平滑角毛藻的区分依据[8-10, 25],相邻角毛基部是否存在并行融合被认为是并基角毛藻(C. decipiens Cleve)和洛氏角毛藻(C. lorenzianus Grunow)的重要区别依据[2, 28]。然而近年研究表明某些角毛特征的多变和不稳定,如扁面角毛藻(C. compressus Lauder)的角毛延伸方向,有时呈Brunel Ⅱ型,有时呈Brunel Ⅲ型[13, 29],并基角毛藻的相邻角毛基部,有时融合并行一段距离,有时则无此特征[30],本研究也观察到异角毛藻粗大角毛延伸方向的变化。这些均证实了角毛延伸方向、基部融合等特征的不稳定性,不宜继续赋予分类学意义。
另一方面,随着电镜技术的广泛应用,能够观察到角毛上的超微结构,如刺和孔的形状、排列方式,以及角毛横截面等,近年研究认为,角毛的这些超微特征是稳定的,可赋予重要的分类学价值[13, 25, 30]。本文两个类群的超微结构极为相似,如链端角毛和链中角毛上均分布有交替纵向排列的孔纹和小刺,且孔纹呈长条形。两个类群的粗大角毛形态相似,在弯曲部分最粗,末端尖细如镰刀状。粗大角毛上分布有交替纵向排列的孔纹和小刺,每两行小刺之间有一条凹沟,凹沟上有成排的小孔和零散分布的大孔,大孔纹呈椭圆形,小孔卵圆形。相似的超微特征亦支持两个类群是同一物种。
3.3 异角毛藻的系统学划分因为物种多样性丰富,角毛藻属被划分为3亚属(subgenus)、21个组(section)[31-32]。Hernández- Becerril[2, 28]基于形态学特征将异角毛藻列入异角组Diversa,然而在基于LSU nrDNA D1~D3序列构建的分子系统树中,异角毛藻与窄隙角毛藻(C. affinis Lauder)聚在一起,具有较高的置信值(BPP=1.00, ML=99),而窄隙角毛藻属于窄隙组Stenocincta。Hernández-Becerril[2, 28]归纳了窄隙组Stenocincta的形态学特征:(1)细胞链直;(2)单色素体;(3)端角毛宽U型,增粗或细小;(4)休眠孢子具刺。异角毛藻也具有这些特征,区别在于窄隙角毛藻的粗大角毛是链端角毛,而异角毛藻则为链中角毛;窄隙角毛藻的窗孔呈窄椭圆至披针形,而异角毛藻的窗孔窄,甚至不可见。分子系统学结论与形态学划分观点不一致,目前尚无定论,需要后续更多数据的补充。
| [1] | Round F E, Crawford R M, Mann D G. Diatoms:Biology and Morphology of the Genera[M]. Cambridge: Cambridge University Press, 1990: 747-749. |
| [2] | HASLE G R, SYVERTSEN E E. Marine diatoms[M]//TOMAS C R. Identifying Marine Phytoplankton. London: Academic Press, 1997: 5-387. |
| [3] | FRYXELL G A, HASLE G R. Taxonomy of harmful diatoms[M]//HALLEGRAEFF G M, ANDERSON D M, CEMBELLA A D. Manual on Harmful Marine Microalgae. 2nd ed. Paris, France: UNESCO Publishing, 2003: 465-510. |
| [4] | Kownacka J, Edler L, Gromisz S, et al. Non-indigenous species Chaetoceros cf. lorenzianus Grunow 1863:A new, predominant component of autumn phytoplankton in the southern Baltic Sea[J]. Estuar, Coast Shelf Sci, 2013, 119: 101-111. DOI:10.1016/j.ecss.2013.01.010 |
| [5] | Guiry M, Guiry M D, Guiry G M, et al. AlgaeBase[EB/OL]. Galway: World-wide Electronic Publication, National University of Ireland. 2018. http://www.algaebase.org |
| [6] | RINES J E B, HARGRAVES P E. The Chaetoceros Ehrenberg (Bacillariophyceae) flora of Narragansett Bay, Rhode Island, USA[J]. Bibl Phycol, 1988, 79: 1-196. |
| [7] | JENSEN K G, MOESTRUP Ø. The genus Chaetoceros (Bacillario-phyceae) in inner Danish coastal waters[J]. Nord J Bot, 1998, 18(1): 88 DOI:10.1111/j.1756-1051.1998.tb01103.x |
| [8] | CUPP E E. Marine plankton diatoms of the west coast of North America[J]. Bull Scripps Inst Oceanograf, 1943, 5(1): 1-238. |
| [9] |
Jin D X, Chen J H, Huang K G.
Planktonic diatoms from China Sea[M]. Shanghai: Shanghai Science and Technology Press, 1965: 131-133.
金德祥, 陈金环, 黄凯歌. 中国海洋浮游硅藻类[M]. 上海: 上海科学技术出版社, 1965: 131-133. |
| [10] |
GUO Y J.
Flora Algarum Marinarum Sinicarum, Tomus V. Bacilla-riophyta, No. 1 Centricae[M]. Beijing: Science Press, 2003: 344-346.
郭玉洁. 中国海藻志, 第5卷(硅藻门)第1册(中心纲)[M]. 北京: 科学出版社, 2003: 344-346. |
| [11] | Hustedt F. The diatom of Germany, Austria and Switzerland with the consideration of the other countries Europassowie of the adjacent marine areas, Part 1[M]. Leipzig: Academic publishing company mbH, 1930: 1-920. |
| [12] | Moreno R J L, Soto P J, Zamudio M E, et al. Morphology and taxonomy of Chaetoceros diversus (Bacillariophyceae) based on material from the southern Gulf of Mexico[J]. Diatom Res, 1993, 8(2): 419-428. DOI:10.1080/0269249X.1993.9705271 |
| [13] | Chamnansinp A, Moestrup Ø, Lundholm N. Diversity of the marine diatom Chaetoceros (Bacillariophyceae) in Thai waters-revisiting Chaetoceros compressus and Chaetoceros contortus[J]. Phycologia, 2015, 54(2): 161-175. DOI:10.2216/14-074.1 |
| [14] | LUNDHOLM N, DAUGBJERG N, MOESTRUP Ø. Phylogeny of the Bacillariaceae with emphasis on the genus Pseudo-nitzschia (Bacillar-iophyceae) based on partial LSU rDNA[J]. Europ J Phycol, 2002, 37(1): 115-134. DOI:10.1017/s096702620100347x |
| [15] | Li Y, Boonprakob A, Gaonkar C C, et al. Diversity in the globally distributed diatom genus Chaetoceros (Bacillariophyceae):Three new species from warm-temperate waters[J]. PLoS ONE, 2017, 12(1): e0168887 DOI:10.1371/journal.pone.0168887 |
| [16] |
Cheng Z D, Gao Y H, Liu S C.
Nano-diatoms in Fujian Coast[M]. Beijing: Ocean Press, 1993: 91-95.
程兆第, 高亚辉, 刘师成. 福建沿岸微型硅藻[M]. 北京: 海洋出版社, 1993: 91-95. |
| [17] | HALL T A. BioEdit:A user-friendly biological sequence alignment editor and analysis program for windows 95/98/NT[J]. Nucl Acid Symp Ser, 1999, 41: 95-98. |
| [18] | NYLANDER J A A. MrModeltest v2. Program[M/OL]. Uppsala: Evolutionary Biology Centre, Uppsala University, 2004. http://www.citeulike.org/user/mbutler808/article/7578084. |
| [19] | MILLER M A, PFEIFFER W, SCHWARTZ T. Creating the CIPRES science gateway for inference of large phylogenetic trees[C]//Proceedings of 2010 Gateway Computing Environments Workshop (GCE). New Orleans, LA: IEEE, 2010: 8. doi: 10.1109/GCE.2010.5676129. |
| [20] | RONQUIST F, TESLENKO M, van der MARK P, et al. MrBayes 3.2:Efficient Bayesian phylogenetic inference and model choice across a large model space[J]. Syst Biol, 2012, 61(3): 539-542. DOI:10.1093/sysbio/sys029 |
| [21] | Cleve P T. Examination of diatoms found on the surface of the Sea of Java[J]. Bihang till Kongliga Svenska Ventenskaps Akademiens Handlingar, 1873, 1(11): 1-15. |
| [22] | Leuduger-Fortmorel G. Diatomées de la Malaisie[M]. Annales du Jardin Botanique de Buitenzorg, 1892: 1-60. |
| [23] | kUO Y J. Phytoplankton as Indicators of the Currents in the Yellow Sea[C]//Proceeding of 2nd International Synonym on Marine Science of Yellow Sea (July 27-29, 1991). Beijing: Ocean Press, 1993: 193-202. |
| [24] | Shevchenko O G, Orlova T Y, HernÁndez-Becerril D U. The genus Chaetoceros (Bacillariophyta) from Peter the Great Bay, Sea of Japan[J]. Bot Mar, 2006, 49(3): 236-258. DOI:10.1515/BOT.2006.028 |
| [25] | Lee S D, Joo H M, Lee J H. Critical criteria for identification of the genus Chaetoceros (Bacillariophyta) based on setae ultrastructure:Ⅱ. Subgenus Hyalochaete[J]. Phycologia, 2014, 53(6): 614-638. DOI:10.2216/14-51R2.1 |
| [26] | Sournia A. Diatomées Planctoniques du Canal de Mozambique et de L'ile Maurice[M]. Paris: Office de la Recherche Scientifique et Technique Outre-mer, 1968. |
| [27] | Tabassum A, Saifullah S M. The planktonic diatom of the genus Chaetoceros Ehrenberg from northwestern Arabian Sea bordering Pakistan[J]. Pakist J Bot, 2010, 42(2): 1137 |
| [28] | HERNÁNDEZ-BECERRIL D U. A morphological study of Chaetoceros species (Bacillariophyta) from the plankton of the Pacific Ocean of Mexico[J]. Bull Nat Hist Mus Lond (Bot), 1996, 26(1): 1-73. |
| [29] | Rines J E B, Hargraves P E. Morphology and taxonomy of Chaetoceros compressus Lauder var. hirtisetus var. nova, with preli-minary consideration of closely related taxa[J]. Diatom Res, 1990, 5(1): 113-127. DOI:10.1080/0269249X.1990.9705097 |
| [30] |
CHEN Z Y, LI Y. Preliminary study on some taxonomic puzzles of Chaetoceros decipiens Cleve[J].
Acta Hydrobiol Sin, 2017, 41(4): 914-922. 陈作艺, 李扬. 并基角毛藻若干分类学疑问的初步探讨[J]. 水生生物学报, 2017, 41(4): 914-922. DOI:10.7541/2017.114 |
| [31] | Ostenfeld C H. Phytoplankton from the sea around the Færöes[M]//Waring E. Botany of the Færöes Ⅱ. Nordish Forlag, Copen-hague, 1903: 559-611. |
| [32] | Hernández-Becerril D U. Note on the morphology of two planktonic diatoms:Chaetoceros bacteriastroides and C. seychellarus, with comments on their taxonomy and distribution[J]. Bot J Linn Soc, 1993, 111(2): 117-128. DOI:10.1006/bojl.1993.1010 |
 2018, Vol. 26
2018, Vol. 26


