植物的雄配子或小孢子发育异常导致不能产生正常的花药、花粉或雄配子称为雄性不育[1]。自然界中植物雄性不育现象普遍存在,已在多达43科162属320种617亚种或中间杂种中被发现[2]。植物雄性不育因在杂交育种中可以免去人工去雄的繁杂工作、提高杂交种子纯度而备受欢迎[1]。研究雄性不育的生理生化特性有利于揭示植物雄性不育的生化和遗传机制,为雄性不育的利用奠定一定的基础[3]。目前,在水稻(Oryza sativa)和玉米(Zea mays)等作物上,通过利用雄性不育生产的杂交种已经得到了广泛应用[4]。无籽刺梨(Rosa sterilis)又名无子刺梨、金刺梨,为蔷薇科(Rosaceae)蔷薇属攀缘灌木,贵州省特有种,仅集中分布于黔西南的兴仁和安顺地区,1985年时圣德将其作为新分类群予以发表[5]。无籽刺梨果实中VC含量丰富且含有多种有益成分[6], 在医药及保健方面具有一定的开发潜力,经济价值较高,受到学术界及相关企业的高度关注。史肖白等[7]观察到无籽刺梨花粉畸形、空瘪
现象,属败育型花粉。有关无籽刺梨的研究主要集中于生物学特征[8-9]、果实成分分析[10]、果实加工技术[11-13]、生态适宜性[14-15]、组织快繁技术[16]和丰产栽培技术[17]等方面。无籽刺梨花药发育过程中生理生化变化特征与雄性不育关系的研究尚未见报道。本文以无籽刺梨为材料,以近缘种刺梨(R. roburghii)为对照,探讨无籽刺梨花药雄性不育的生理生化特征,揭示无籽刺梨雄性不育机理,为进一步研究其雄性不育的生理生化特征积累资料。
1 材料和方法 1.1 材料在贵州植物园采集无籽刺梨(Rosa sterilis)和近缘种刺梨(R. roburghii)从现蕾期到盛花期的花药, 用数码游标卡尺准确测量花蕾大小,花蕾大小对应花药造孢期、花粉母细胞时期、四分体时期、单核期和成熟期5个发育阶段(表 1)。
| 表 1 小孢子发育时期与花蕾大小的相关性 Table 1 Relationship between microspore development stage and flower bud size |
参照李合生等[18]的方法,采用考马斯亮蓝G-250染色法测定可溶性蛋白质含量;采用蒽酮法测定可溶性糖、可溶性淀粉含量;采用茚三酮法测定脯氨酸含量;丙二醛(MDA)含量测定采用硫代巴比妥酸法;过氧化物酶(POD)活性测定采用愈创木酚法,以1 min内OD470 nm减少0.01所需酶量为1个单位,用U g–1min–1表示;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法,以光还原50%为1个单位,用U g–1表示。各指标测定均重复3次,盛花期采集无籽刺梨及刺梨成熟花粉,经1% I2-KI染色,在20倍光显微镜下观察花粉活力,统计10个视野,每个视野不少于100粒,3个重复。花粉活力=(有活力花粉数/花粉总数)×100%。
利用Excel软件对实验数据进行统计分析,采用SPSS 22.0软件进行单因素的方差分析, 并应用LSD法在5%水平上的差异显著性进行检验。
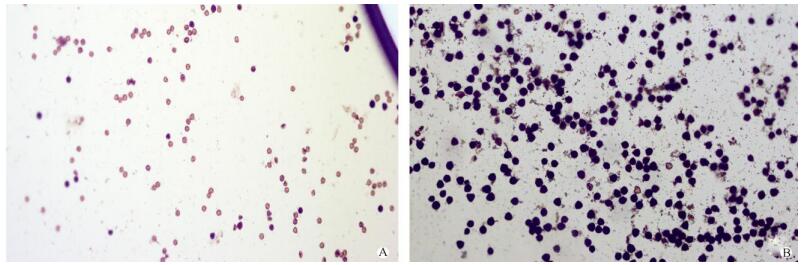
2 结果和分析 2.1 花粉育性的表现成熟花粉粒经1% I2-KI染色后在显微镜下观察,无籽刺梨有95.5%的成熟花粉粒染色异常(图 1: A),说明花粉败育,而对照刺梨正常成熟花粉粒高达98% (图 1: B)。
|
图 1 用1% I2-KI染色的无籽刺梨(A)和刺梨(B)成熟花粉(200×) Fig. 1 Mature pollen of Rosa sterilis (A) and R. roburghii (B) stained with 1% I2-KI |
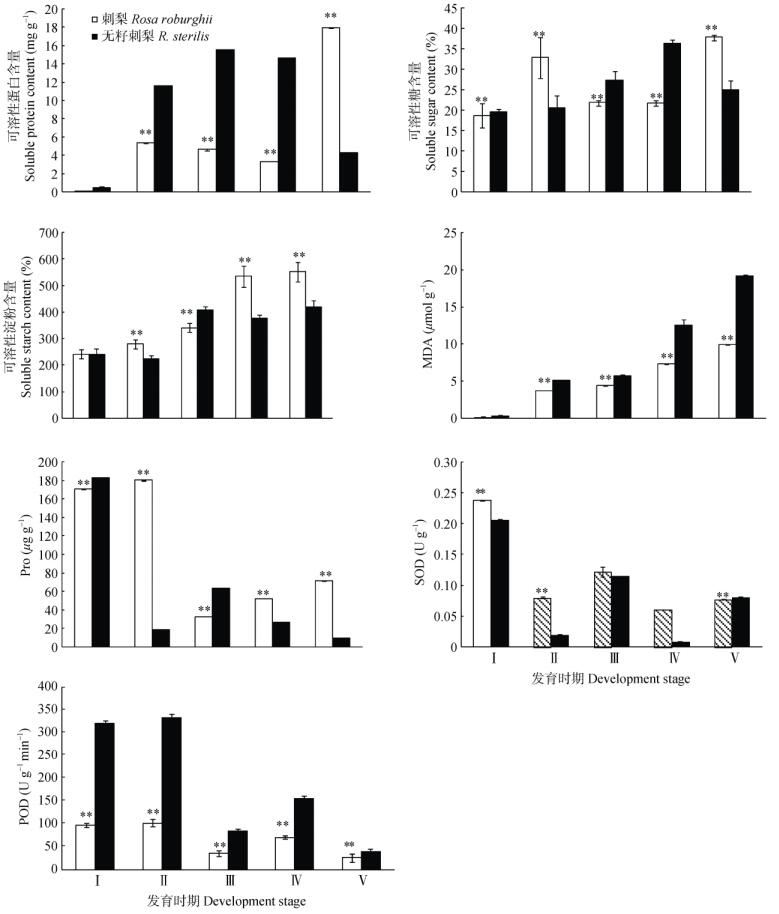
从图 2可见,花药造孢期的刺梨与无籽刺梨可溶性蛋白质含量相近,无显著差异。刺梨花药由造孢期到花粉母细胞初期的可溶性蛋白质含量从0.13 mg g–1上升到5.39 mg g–1,之后花粉母细胞减数分裂成四分体,进一步形成单核小孢子,此过程中由于分裂需要消耗营养物质和能量,可溶性蛋白质含量出现下降,从单核期到花粉成熟期,可溶性蛋白质含量急剧升高,从单核期的3.34 mg g–1上升到花粉成熟期的17.95 mg g–1。无籽刺梨花药造孢期到四分体时期可溶性蛋白质含量从0.43 mg g–1上升到15.53 mg g–1,四分体时期到单核期略微下降到14.67 mg g–1,单核期到花粉成熟期的可溶性蛋白质含量变化与同时期的刺梨完全相反,花粉成熟期无籽刺梨的可溶性蛋白质含量急剧下降,从14.67 mg g–1降到4.30 mg g–1。成熟花粉期,无籽刺梨与刺梨的可溶性蛋白质含量存在极显著差异,说明此时无籽刺梨花药中缺少蛋白质积累。
|
图 2 无籽刺梨和刺梨花药在发育过程中生理指标的变化。Ⅰ:造孢期; Ⅱ:花粉母细胞期; Ⅲ:四分体期; Ⅳ:单核期; Ⅴ:花粉成熟期。 Fig. 2 Changes in physiological indexes of Rosa sterilis and R. roburghii in anther at different development stages. Ⅰ: Sporogenous cell stage; Ⅱ: Pollen mother cell (PMCs) stage; Ⅲ: Tetrad stage; Ⅳ: Mononuclear stage; Ⅴ: Pollen mature stage. |
刺梨花药在发育过程中可溶性糖含量的变化规律与可溶性蛋白含量的一致(图 2),四分体时期可溶性糖含量为21.85%,到单核期下降为21.78%, 花粉成熟期又急剧上升到37.81%。无籽刺梨花药的可溶性糖含量从造孢期的19.69%上升到单核期的36.39%,之后下降,花粉成熟期为24.94%。在花粉成熟期,无籽刺梨的可溶性糖含量与刺梨的存在极显著差异。
在各发育时期,刺梨的可溶性淀粉含量与无籽刺梨均存在极显著差异。在花药发育过程中刺梨的可溶性淀粉含量呈不断上升趋势,从造孢期的241.87%上升到花粉成熟期的552.20% (图 2)。无籽刺梨在花药造孢期的可溶性淀粉含量为239.77%, 花粉母细胞初期下降为225.23%,四分体时期又上升到409.31%,单核期又下降为376.45%,花粉成熟期淀粉含量平缓上升为418.82%,但显著少于刺梨,推测无籽刺梨在花粉成熟期由于可溶性糖和可溶性淀粉含量的降低,影响了花粉的正常发育。
2.4 游离脯氨酸含量刺梨花药在造孢期和花粉母细胞初期的脯氨酸(Pro)含量分别为171.07和180.13 μg g–1 (图 2), 四分体期急剧下降至32.6 μg g–1,至花粉成熟期又上升到71.69 μg g–1。而无籽刺梨花药的脯氨酸含量从造孢期的182.83 μg g–1至花粉母细胞初期急剧下降为18.87 μg g–1,四分体期又上升为63.20 μg g–1,之后又下降,花粉成熟期仅为9.74 μg g–1。在花粉成熟期,无籽刺梨的花药脯氨酸含量极显著低于刺梨。
2.5 丙二醛含量刺梨和无籽刺梨在花药发育过程中丙二醛(MDA)含量均呈上升趋势(图 2),刺梨的MDA含量为0.12~ 9.95 μmol g–1,无籽刺梨为0.34~19.16 μmol g–1,无籽刺梨的MDA含量上升趋势较为明显。除造孢期外,其他发育时期无籽刺梨的MDA含量均极显著高于刺梨,花粉成熟期无籽刺梨的MDA含量比刺梨高出9.21 μmol g–1。
2.6 SOD和POD活性刺梨和无籽刺梨在花药发育过程中的SOD活性变化趋势相同(图 2),刺梨在花药发育各时期的SOD活性分别为0.238、0.08、0.122、0.061和0.077 U g–1,而无籽刺梨的分别为0.206、0.019、0.114、0.008和0.08 U g–1。无籽刺梨的SOD活性均低于刺梨,在造孢期、花粉母细胞初期、单核期两者间的SOD活性存在极显著差异,四分体时期和花粉成熟期无显著差异。
刺梨与无籽刺梨在花药发育过程的POD活性变化趋势相同(图 2),无籽刺梨的POD活性变化较大,且均高于刺梨。在造孢期与花粉母细胞时期两者间的POD活性差异最为明显,无籽刺梨在造孢期、花粉母细胞时期的POD活性分别为320和333.33 U g–1min–1,而刺梨的分别为97.78和102.22 U g–1min–1。
3 结论和讨论从形态上观察,无籽刺梨成熟果实中种子干瘪且不育,个别果中偶尔有极少数饱满种子。无籽刺梨成熟花粉经1% I2-KI染色后,异常花粉达95.5%,即花粉败育。营养物质,如可溶性蛋白质、可溶性糖、脯氨酸、可溶性淀粉对花粉的正常发育起着重要的作用,可溶性蛋白质中包含各种酶和代谢调节物,对花药的发育具有决定性的意义[19]。花药发育过程中的主要营养物质是糖,糖含量会影响小孢子的育性[20]。脯氨酸存在于所有蛋白质的组成部分中[21],花药中层和绒毡层为花粉提供了丰富的脯氨酸。有研究表明,雄性不育植物中花药脯氨酸缺乏或降低是非常普遍的现象[22-23],曾维英等认为花粉内缺少淀粉积累导致花粉败育[24]。本研究结果表明,刺梨花药在发育过程中可溶性蛋白质、可溶性糖、脯氨酸含量的总体变化趋势相同,可溶性淀粉含量呈上升趋势,花药发育过程中伴随淀粉的积累。而无籽刺梨花药在发育过程中可溶性蛋白质、可溶性糖、脯氨酸、可溶性淀粉含量变化不规律, 花粉成熟期的这些物质含量均明显低于刺梨。由此推测,无籽刺梨花药在发育过程中代谢紊乱和花粉成熟期缺少营养物质的积累可能是导致花粉败育的原因之一。
超氧化物歧化酶(SOD)能清除植物代谢中产生的活性氧自由基,防止活性氧在体内积累过多导致膜脂受损,从而维持膜脂的稳定性[25]。SOD活性低,活性氧自由基含量增加,脂膜结构受损加剧,影响正常发育。本研究结果表明,无籽刺梨花药在发育过程中SOD活性均低于刺梨。MDA作为交联剂, 使膜蛋白、酶及DNA等大分子发生交联反应, MDA含量过多时将导致代谢紊乱。本研究结果表明,无籽刺梨花药在发育过程中MDA含量呈上升趋势, 且均高于刺梨,尤其在花粉成熟期显著高于刺梨。POD能降解植物内的IAA,对于控制植物体内的IAA含量、维持源库平衡起关键作用[22]。POD活性升高,IAA含量降低,营养物质减少,致使发生雄性不育[26]。本研究中无籽刺梨花药在发育过程中POD活性均高于刺梨。
无籽刺梨在花药及小孢子发育过程中,营养物质(可溶性蛋白质、可溶性糖、可溶性淀粉和脯氨酸)含量不是一开始就缺少,在发育过程中有积累的过程,证明控制营养物质合成的基因能正常表达,而到花粉成熟期,营养物质含量发生了显著的下降, 猜测是由于某种基因的特异性表达抑制了调控营养物质合成基因的正常表达,且由于无籽刺梨的雄性不育特性是稳定存在的,即抑制营养物质合成基因的表达调控是特异且稳定存在的,不受环境影响的,此推测可通过无籽刺梨和刺梨的调节因子表达差异对比分析来验证。也有可能,此时期无籽刺梨由于某种原因导致营养物质的运输受阻,导致缺乏营养物质的积累发生败育,其中绒毡层作为花药的最内层,对营养物质的合成运输具有很重要的作用,绒毡层在花药发育过程中一旦发生异常就会影响花粉的发育,导致败育的发生。因此无籽刺梨发育过程中营养物质含量降低的更深层原因应从基因工程等方面去探究。
综上所述,在无籽刺梨花药在发育过程中,可溶性蛋白质、可溶性糖、可溶性淀粉和脯氨酸含量下降,尤其在花粉成熟期营养物质含量的急剧下降,导致成熟期小孢子中所需营养物质和能量不足,营养物质代谢紊乱,从而引起花粉败育。对无籽刺梨花药进行石蜡切片组织化学分析(结果待发表)表明,花粉成熟期小孢子内也缺少营养物质积累。无籽刺梨花药败育与MDA含量、POD、SOD活性的变化是否有关还有待于进一步研究。
| [1] |
KONG X H. Research advance in the molecular biology of cyto-plasmic male sterility in plants[J].
Chin J Eco-Agric, 2004, 12(3): 36-39. 孔祥海. 植物细胞质雄性不育分子生物学研究进展[J]. 中国生态农业学报, 2004, 12(3): 36-39. |
| [2] | KAUL M L H. Male Sterility in Higher Plant[M]. Berlin: Springer-Verlag, 1988: 100-111. |
| [3] |
SONG J, ZHANG Z H, PAN G T. Physiological and biochemical characteristics in ramie male sterile line[J].
J Trop Subtrop Bot, 2007, 15(5): 428-432. 宋军, 张中华, 潘光堂. 苎麻雄性不育材料的生理生化特性初探[J]. 热带亚热带植物学报, 2007, 15(5): 428-432. DOI:10.3969/j.issn.1005-3395.2007.05.010 |
| [4] |
GAO J P, HAN G J, GONG Y C, et al. Advances in molecular biology of male sterility in cotton[J].
Mod Agric Sci Technol, 2008(2): 116-117. 高俊平, 韩广津, 宫永超, 等. 棉花雄性不育的分子生物学研究进展[J]. 现代农业科技, 2008(2): 116-117. DOI:10.3969/j.issn.1007-5739.2008.02.077 |
| [5] |
SHI S D. New taxa of Rosa from Guizhou[J].
Guizhou Sci, 1985(1): 7-8. 时圣德. 贵州蔷薇属新分类群[J]. 贵州科学, 1985(1): 7-8. |
| [6] |
HUANG G Z, HUANG Y P, TANG Y F. Manufacturing technique of Rosa roburghii jam[J].
J Food Sci Technol, 1993(5): 43-44, 53. 黄果柱, 黄一萍, 唐玉芳. 刺梨果酱生产工艺[J]. 食品工业科技, 1993(5): 43-44, 53. |
| [7] |
SHI X B, GU Y, CAI J H, et al. Studies on pollen morphology of Rosa roxburghii and Rosa sterilis[J].
Acta Agric Shanghai, 1994, 10(1): 88-92. 史肖白, 顾渊, 蔡剑华, 等. 刺梨花粉形态观察[J]. 上海农业学报, 1994, 10(1): 88-92. |
| [8] |
ZHENG Y, XIN P Y, GAO J, et al. The current situation and outlook of research and development of Rosa sterilis[J].
Guizhou For Sci Technol, 2013, 41(2): 62-64. 郑元, 辛培尧, 高健, 等. 无籽刺梨的研究与应用现状及展望[J]. 贵州林业科技, 2013, 41(2): 62-64. |
| [9] |
WEI J F, CHENG Y Z, MENG X J, et al. Observation of biological characteristics of Rosa sterilis[J].
For By-Prod Spec China, 2012(6): 27-29. 韦景枫, 程友忠, 蒙先举, 等. 无籽刺梨生物学特性观察[J]. 中国林副特产, 2012(6): 27-29. DOI:10.3969/j.issn.1001-6902.2012.06.012 |
| [10] |
WU X Q, LUO H, JIN J L, et al. GC-MS analysis of volatile oil from Rosa sterilis by supercritical CO2 extraction[J].
Chin J Exp Trad Med Form, 2014, 20(10): 98-101. 吴小琼, 罗会, 金吉林, 等. 超临界CO2萃取无籽刺梨挥发油及GC-MS分析[J]. 中国实验方剂学杂志, 2014, 20(10): 98-101. DOI:10.13422/j.cnki.syfjx.2014100098 |
| [11] |
LUO Y, WANG L, DING Z H. Development of muddy type on Rosa sterilis beverages[J].
Food Sci Technol, 2014, 39(11): 91-96. 罗昱, 王亮, 丁筑红. 浑浊型无籽刺梨果汁饮料的研制[J]. 食品科技, 2014, 39(11): 91-96. DOI:10.13684/j.cnki.spkj.2014.11.019 |
| [12] |
WANG Z X. Preparation method of gold roxburgh rose tea: CN, CN102972593A[P]. 2013-03-20.
汪朝祥.一种金刺梨茶的制作方法: 中国, CN102972593A[P]. 2013-03-20. |
| [13] |
HE H Z, WANG Y, REN C G, et al. Seedless spiny pear fruit wine and production method thereof: CN, CN103555514A[P]. 2014-02-05.
贺红早, 王莹, 任春光, 等.一种无籽刺梨果酒及其制作方法: 中国, CN103555514A[P]. 2014-02-05. |
| [14] |
ZHENG Y, WU Y Y, XIN P Y, et al. Relationship between photo-synthetic physiology diurnal dynamics of Rosa sterilis and environ-mental factors[J].
J W China For Sci, 2013, 42(3): 21-27. 郑元, 吴月圆, 辛培尧, 等. 环境因子对无籽刺梨光合生理日变化进程的影响研究[J]. 西部林业科学, 2013, 42(3): 21-27. DOI:10.3969/j.issn.1672-8246.2013.03.005 |
| [15] |
CHENG Y Z. Cultivation technology of Rosa sterilis in rocky deser-tification area[J].
Mod Agric Sci Technol, 2015(5): 116-117. 程友忠. 石漠化地区无籽刺梨栽培技术[J]. 现代农业科技, 2015(5): 116-117. DOI:10.3969/j.issn.1007-5739.2015.05.072 |
| [16] |
QIU Z L. Occurrence and control techniques of gray mould in blue-berry[J].
S China Fruits, 2014, 43(1): 90 仇智灵. 蓝莓灰霉病发生规律及其防治技术[J]. 中国南方果树, 2014, 43(1): 90 DOI:10.13938/j.issn.1007-1431.2014.01.011 |
| [17] |
DU W Y. Rosa roburghii, natural green health care products[J].
Rural Pract Sci, 2006(3): 19 杜文义. 天然绿色保健品——刺梨[J]. 农村实用科技信息, 2006(3): 19 DOI:10.3969/j.issn.1674-0653.2006.03.025 |
| [18] |
LI H S, SUN Q, ZHAO S J, et al.
Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2000: 1-200.
李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 1-200. |
| [19] | MASCARENHAS J P. The biochemistry of angiosperm pollen development[J]. Bot Rev, 1975, 41(3): 259-314. DOI:10.1007/BF02860839 |
| [20] |
LIU Q Y, ZHU X W, LIU F H, et al. Changes of the contents of several substances during the development of male sterile flower buds in tobacco[J].
Acta Agric Univ Jiangxi, 2007, 29(3): 336-340. 刘齐元, 朱肖文, 刘飞虎, 等. 烟草雄性不育花蕾发育过程中几种物质含量的变化[J]. 江西农业大学学报, 2007, 29(3): 336-340. DOI:10.3969/j.issn.1000-2286.2007.03.003 |
| [21] | DASH S S, KUMAR S, SINGH J N. Cytomorphological charac-terization of a nuclear male sterile line of Chilli pepper (Capsicum annuum L.)[J]. Cytologia, 2001, 66(4): 365-371. DOI:10.1508/cytologia.66.365 |
| [22] |
DENG M H, WEN J F, ZOU X X, et al. A study on material metabolism and peroxidase in cytoplasmic male-sterile lines and their maintainer lines of hot pepper[J].
J Yunnan Agric Univ, 2007, 22(6): 791-794. 邓明华, 文锦芬, 邹学校, 等. 辣椒细胞质雄性不育系的物质代谢和过氧化物酶分析[J]. 云南农业大学学报, 2007, 22(6): 791-794. DOI:10.16211/j.issn.1004-390x(n).2007.06.020 |
| [23] |
MIAO J S, YANG W C, LIU C X, et al. Dynamic changes of physio-logical and biochemical substances and energy metabolism enzyme activities in bud of welsh onion CMS line[J].
Acta Bot Boreali-Occid Sin, 2010, 30(6): 1142-1148. 苗锦山, 杨文才, 刘彩霞, 等. 葱胞质雄性不育花蕾生化物质含量和能量代谢酶活性的动态变化特征[J]. 西北植物学报, 2010, 30(6): 1142-1148. |
| [24] |
ZENG W Y, YANG S P, YU D Y, et al. A comparative study on anther proteomics between cytoplasmic-nuclear male-sterile line NJCMS2A and its maintainer of soybean[J].
Acta Agron Sin, 2007, 33(10): 1637-1643. 曾维英, 杨守萍, 喻德跃, 等. 大豆质核互作雄性不育系NJCMS2A及其保持系的花药蛋白质组比较研究[J]. 作物学报, 2007, 33(10): 1637-1643. DOI:10.3321/j.issn:0496-3490.2007.10.012 |
| [25] |
HAN X Y, WANG S F, WEI Y Y, et al. Physiological and biochemical characterization of radish male-sterile line and its maintainer line[J].
Shangdong Agric Sci, 2012, 44(12): 36-38. 韩晓雨, 王淑芬, 魏佑营, 等. 萝卜雄性不育系与保持系的生理生化指标分析[J]. 山东农业科学, 2012, 44(12): 36-38. DOI:10.3969/j.issn.1001-4942.2012.12.009 |
| [26] |
HE Z C, XU N Y. Studied on relationship between the indole-3-acetic acid oxidase and the preoxidase in isoenzyme analysis[J].
Wuhan Univ J (Nat Sci), 1994(1): 91-94. 何之常, 徐乃瑜. 吲哚乙酸氧化酶和过氧化物酶关系的同工酶研究[J]. 武汉大学学报(自然科学版), 1994(1): 91-94. |
 2018, Vol. 26
2018, Vol. 26


