鸳鸯茉莉(Brunfelsia acuminata)为茄科(Solanaceae)鸳鸯茉莉属常绿矮灌木,原产于中美洲和南美洲热带。花期为4-10月,花冠5裂,花瓣有明显的锯齿,每朵花开放5 d左右,花刚开放时为蓝紫色,渐变为浅紫色,到最后变为白色[1]。因为单花开放时间不同,在同一株上能够见到蓝紫色和白色的花,并且拥有茉莉花的芳香,故又叫双色茉莉[2]。通常将其作为盆栽观赏花卉,在走廊、庭台楼阁、门口等地方作美化装饰,观赏价值极高[3]。
花色是观赏植物十分重要的一种观赏特性。植物的花色受众多因素协同作用,与花瓣内含有的色素种类及其含量、色素所处的环境、花瓣的物理结构等多种因子有关,但是起着最主要作用的是色素的种类及其含量[4]。在自然界中,最为常见的花青素有6种,分别是天竺葵色素(pelargonidin, Pg)、矢车菊色素(cyanidin, Cy)、飞燕草色素(delphinidin, Dp)、芍药花色素(peonidin, Pn)、矮牵牛色素(petunidin, Pt)和锦葵色素(malvidin, Mv)。
目前对于鸳鸯茉莉的研究,主要有花瓣基因的克隆与生物信息学分析[5-7]、蛋白质研究[8]、组织培养[9]、修剪措施[3]等。Bar-Akiva[10]等采用高效液相色谱-质谱联用技术(HPLC-MS)分析了大花鸳鸯茉莉(Brunfelsia calycina)开花当天花瓣中花青苷的种类。本研究以鸳鸯茉莉花瓣为材料,使用优化的高效液相色谱分析技术,检测开花过程中花瓣的花青苷种类和含量,为研究鸳鸯茉莉花色变化机理,延长紫色花瓣的花期奠定基础,同时也为培育蓝色鸳鸯茉莉提供支持。
1 材料和方法 1.1 材料鸳鸯茉莉(Brunfelsia acuminata)于2017年4月采自福建农林大学,从植株的各个方向随机采取生长健康的花瓣,分别于开花的0 (花苞期)、1、2、3、4和5 d采摘,花色如图 1,取鲜样提取花青素。

|
图 1 鸳鸯茉莉开花过程中花瓣颜色的变化 Fig. 1 Changes in petal color of Brunfelsia acuminata during blooming |
主要试剂包括分析纯甲醇、甲酸、盐酸,色谱纯甲醇和乙腈(均购自福州南江生物技术有限公司);花青苷标准品购于福州南江生物技术有限公司HPLC分析级产品,锦葵色素-3-O-葡萄糖苷(Mv)为Cerilliant品牌,飞燕草素葡萄糖苷(Dp)、矮牵牛素葡萄糖苷(Pt)、矢车菊素-3-葡萄糖苷(Cy)、芍药素葡萄糖苷(Pn)和天竺葵素-3-氯化葡萄糖苷(Pg)为Solarbio品牌。主要仪器为超纯水机(湖南科尔顿水务有限公司);LC-100液相色谱仪、LC-P100高压恒流泵、LC-UV100紫外检测器、色谱柱C18、手动进样器(均购于上海伍丰科学仪器有限公司);台式高速冷冻离心机(Sigma公司);溶剂抽滤机(天津市津腾实验设备有限公司);超声波清洗器(昆山市超声仪器有限公司)。
1.3 花青素的提取参照Simões等[11]和Weiss等[12]方法,略有改动。将鸳鸯茉莉花瓣剪碎,准确称取新鲜花瓣0.1 g放入试管中,加入5 mL 1%盐酸甲醇提取液。在黑暗处4℃放置1 h后,将浸提液转入新的离心管中置于暗处,再往试管中加入5 mL提取液,黑暗处4℃放置1 h后,再次将浸提液转入离心管中。在10 000×g下离心10 min,收集上清液,用0.22 μm滤膜过滤,滤液存于4℃冰箱中遮光保存待用。均重复3次。
1.4 HPLC体系的优化色谱柱C18 (250 mm×4.6 mm,5 μm);色谱条件:柱温30℃,进样体积20 μL, 波长525 nm。流动相的选择,E1:流动相A,乙腈:水:甲酸[500:450:50,(V/V/V,下同)];流动相B,甲酸:水(50:950)。E2:流动相A,乙腈:甲酸(925:75);流动相B,甲酸:水(75:925)。洗脱梯度的筛选,G1:流速为0.8 mL min–1,洗脱程序为:0 min,8%A; 15 min,18%A;25 min,23%A;45 min,40%A; 50 min,8%A。G2:流速1.0 mL min–1,洗脱程序为:1 min,3%A;12 min,15%A;24 min,25%A;28 min,30%A;35 min,30%A;40 min,3%A。在525 nm下检测鸳鸯茉莉花瓣中花青苷的种类并根据峰面积法计算花青苷的含量。
1.4 数据统计分析应用LC-WS100色谱工作站软件进行HPLC图谱绘制;采用Excel 2003进行数据整理和作图, SPSS 19软件的Duncan’s多重比较法进行数据的差异显著性分析。
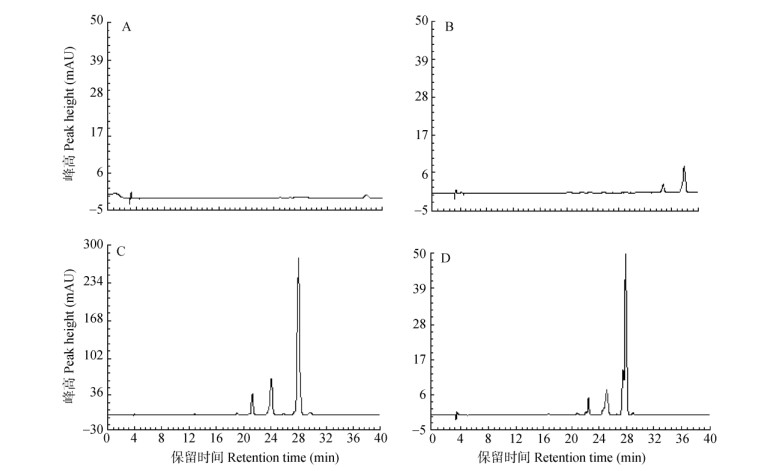
2 结果和分析 2.1 HPLC的优化选用鸳鸯茉莉花苞期(0 d)的花瓣为试材,通过设置不同的溶剂体系和洗脱程序进行HPLC体系优化。当选用乙腈浓度较低的溶剂体系E1时,不管洗脱梯度如何(图 2: A, B),获得的图谱效果均不理想,出色谱峰所需要的时间较长,在36 min以后才会有色谱峰出现。当选用溶剂体系E2时,乙腈浓度大幅度提高后(图 2: C, D),出现色谱峰的时间相对缩短,最早的1个色谱峰在21 min左右出现,而且色谱峰型明显,能准确分辨出不同的花青苷。当溶剂体系为E2,洗脱梯度为G1时(图 2: C)的出峰时间较早,花青苷的浓度较高,能够明确分辨不同花青苷所形成的色谱峰,且获得到更稳定的图谱。故最后选择乙腈含量高的溶剂体系和时间较长、梯度较大的洗脱程序进行HPLC分析,即E2G1体系。
|
图 2 鸳鸯茉莉花瓣的HPLC图谱。A: E1G1; B: E1G2; C: E2G1; D: E2G2 Fig. 2 HPLC chromatogram of Brunfelsia acuminata petals. A: E1G1; B: E1G2; C: E2G1; D: E2G2. |
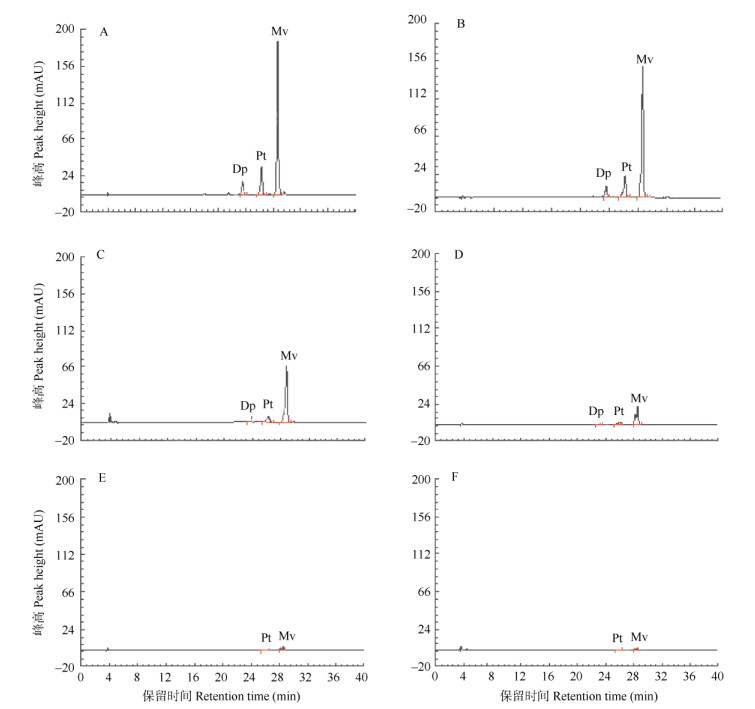
利用优化的色谱体系E2G1对鸳鸯茉莉6个开花时期的花瓣进行分析。从图 3可见,开花0、1、2和3 d的花瓣中检测出3种花青苷,在开花4和5 d的花瓣中仅检测出2种花青苷。依据花青苷标样出峰的保留时间确定花青苷的种类,保留时间23.348 min为飞燕草色素葡萄糖苷(Dp),保留时间26.140 min为矮牵牛素葡萄糖苷(Pt),保留时间28.490 min为锦葵色素3-O-葡萄糖苷(Mv)。所以,开花0、1、2和3 d的花瓣中花青苷为Dp、Pt和Mv (图 3: A~D)。开花4和5 d的为Pt和Mv (图 3: E, F),基本上没有Dp。
|
图 3 鸳鸯茉莉花瓣不同开花时期的HPLC图谱。A: 0 d; B: 1 d; C: 2 d; D: 3 d; E: 4 d; F: 5 d; Mv:锦葵色素-3-O-葡萄糖苷; Pt:矮牵牛素葡萄糖苷; Dp:飞燕草色素葡萄糖苷。以下图表同。 Fig. 3 HPLC chromatogram of Brunfelsia acuminata petals at different days of blooming. A: 0 d; B: 1 d; C: 2 d; D: 3 d; E: 4 d; F: 5 d; Mv: Malvidin-3-O-glucoside chloride; Pt: Petunidin-3-glucoside; Dp: Delphinidin-3-glucoside. The same is following Table and Figure. |
同时,在鸳鸯茉莉整个开花过程中均未检测到鸳鸯茉莉花瓣矢车菊素-3-葡萄糖苷、天竺葵素-3-氯化葡萄糖苷和芍药素葡萄糖苷。
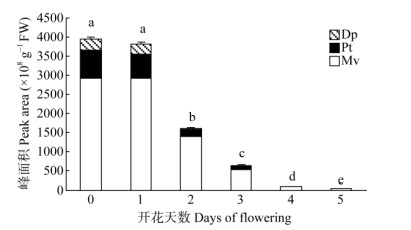
2.3 花青苷含量的分析随着鸳鸯茉莉花的开放,花色由深紫色变为白色。花瓣在开花0~5 d的开放过程中,花青素总含量呈现下降的变化趋势(图 4)。开花0与1 d的花青素含量无显著差异,但显著高于后期的(P < 0.05)。鸳鸯茉莉花瓣中主要含有3种花青苷(表 1),其中Mv的含量最高,Dp的最低,并且Mv、Pt和Dp含量随着开花进程逐渐减少。开花0与1 d的花青苷含量变化不大,开花1~2 d花瓣从紫色变为浅紫色,Dp含量急剧下降,开花4~5 d的花瓣中只含少量的Mv和Pt。
|
图 4 鸳鸯茉莉花瓣中花青素含量变化 Fig. 4 Changes in anthocyanin contents in Brunfelsia acuminata petals |
| 表 1 鸳鸯茉莉不同开花期花瓣中花青苷的含量(×108 g–1 FW) Table 1 Contents of anthocyanins (×108 g–1 FW) in Brunfelsia acuminata petals at different blooming stage |
不同的植物材料所需的HPLC色谱条件不同。Machado等[13]测定蓝莓(Vaccinium myrtillus)的花青苷种类时,使用的色谱体系为流速0.7 mL min–1, 流动相A为5%甲酸,流动相B为100%甲醇,洗脱梯度为0 min,5%B;1.50 min,5%B;3.50 min, 15%B;5.00 min,25%B;5.50 min,40%B;6.50 min,45%B;7.00 min,100%B;9.30 min,100%B;10 min,10%B,与测定黑莓(Rubus fruticosus)花青苷时使用的洗脱梯度不同。王峰[14]在测定月季(Rose germplasms)花青苷种类时,使用的流动相A为0.1%甲酸,固定相B为含有0.1%甲酸的乙腈溶液。王琳[15]以葡萄风信子(Muscari latifolium)为材料,建立高效液相色谱技术的花青素苷分析方法,以0.1%甲酸水溶液,80%乙腈为流动相可获得良好的洗脱效果。为了得到高效、稳定的色谱体系,需要对色谱条件进行优化,最终缩短保留时间并且能够更好地分离色谱峰。本研究结果表明,流动相A中乙腈浓度较高,洗脱梯度较大,流速稍慢且时间稍长,可以快速稳定分离鸳鸯茉莉的花青苷。流速小有助于使连在一起的两个色谱峰分开,便于进行定性分析;若设置分析时间稍长可以使色谱图更稳定。
HPLC溶剂体系是影响色谱分离中很重要的因素, 常用的溶剂中极性最大的为水,其次为甲酰胺和乙腈。本试验中,当选用溶剂体系E1时,流动相A中水的体积比为45%、乙腈的体积比为50%,溶剂极性较大,不易分离色谱峰,组分保留时间短; 当选用溶剂体系E2时,流动相A中乙腈的体积比为92.5%,溶剂极性降低,色谱峰易分离且出峰时间缩短,所以最终选定溶剂体系E2洗脱程序G1:流动相A,7.5%甲酸乙腈(V/V);流动B,7.5%甲酸水(V/V);线性洗脱程序:0 min,8%A;15 min, 18%A;25 min,23%A;45 min,40%A;50 min, 8%A, 建立了高效、稳定分析鸳鸯茉莉花青苷成分的HPLC色谱体系。
3.2 开花过程中花青苷的定性定量分析花色是花卉的观赏性状和价值的体现,花色变化与花青苷的种类和含量有很大关系。通常天竺葵色素(Pg)呈现出的颜色为砖红色,飞燕草色素(Dp)、矮牵牛色素(Pt)和锦葵色素(Mv)呈现出蓝紫色,矢车菊色素(Cy)和芍药花色素(Pn)则呈现出紫红色[16]。因此,主要含有Mv、Pg、Dp、Pt等花青苷的花瓣一般为蓝紫色。孙卫[17]报道蓝色瓜叶菊(Senecio cruentus)花瓣主要含有Dp,紫色瓜叶菊主要含有Dp和Cy。在本研究中,鸳鸯茉莉花瓣中共检测出3种花青苷,分别为锦葵色素-3-O-葡萄糖苷(Mv)、飞燕草素葡萄糖苷(Dp)和矮牵牛素葡萄糖苷(Pt),且主要成分为Mv,它们都表现为蓝紫色,是鸳鸯茉莉花瓣呈紫色的原因。这与Bar-Akiva等[10]对大花鸳鸯茉莉紫色花瓣研究结果一致。
从鸳鸯茉莉花瓣中均未检测到鸳鸯茉莉花瓣矢车菊素-3-葡萄糖苷、天竺葵素-3-氯化葡萄糖苷和芍药素葡萄糖苷。在开花初期,花瓣为紫色,含有3种花青苷,即锦葵色素-3-O-葡萄糖苷、矮牵牛素葡萄糖苷和飞燕草素葡萄糖苷,随着开花进程,紫色渐渐褪去,后期花瓣几乎退为白色,色谱图中只显示Pt和Mv两种花青苷,且整个过程中以Mv含量最多。因此鸳鸯茉莉花的呈色与Mv、Pt和Dp有关,且Mv起主导作用。
| [1] | Vaknin H, Bar-akiva A, Ovadia R, et al. Active anthocyanin degradation in Brunfelsia calycina (yesterday-today-tomorrow) flowers[J]. Planta, 2005, 222(1): 19-26. DOI:10.1007/s00425-005-1509-5 |
| [2] |
CHEN X Q, GUO Z X, LIN L, et al. POD isozyme system optimi-zation of Brunfelsia acuminate (Solanaceae) in different development stages[J].
Chin J Trop Crops, 2014, 35(8): 1510-1516. 陈小琴, 郭志雄, 林琳, 等. 鸳鸯茉莉不同发育时期POD同工酶体系优化[J]. 热带作物学报, 2014, 35(8): 1510-1516. DOI:10.3969/j.issn.1000-2561.2014.08.011 |
| [3] |
ZHAI S H, ZOU X J, DING L, et al. Effect of different pruning treatments on florescence of Brunfelsia latifolia[J].
J Kunming Univ, 2014, 36(3): 61-63. 翟书华, 邹晓菊, 丁丽, 等. 不同修剪措施对鸳鸯茉莉花期的影响[J]. 昆明学院学报, 2014, 36(3): 61-63. DOI:10.14091/j.cnki.kmxyxb.2014.03.024 |
| [4] | de ROSAS I, PONCE M T, MALOVINI E, et al. Loss of anthocyanins and modification of the anthocyanin profiles in grape berries of Malbec and Bonarda grown under high temperature conditions[J]. Plant Sci, 2017, 258: 137-145. DOI:10.1016/j.plantsci.2017.01.015 |
| [5] |
CAO Y T. Cloning the full length cDNA of anthocyanins biosynthasis key genes and CHS gene promoter from Brunfelsia acuminate flowers[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012: 1-82.
曹玉婷.鸳鸯茉莉花瓣色素合成关键酶基因cDNA及CHS基因启动子的克隆[D].福州: 福建农林大学, 2012: 1-82. http://cdmd.cnki.com.cn/article/cdmd-10389-1012425887.htm |
| [6] |
CAO Y T, QIU D L. Cloning and sequence analysis of chalcone isomerase gene (CHI) from Brunfelsia acuminata flowers[J].
J Trop Subtrop Bot, 2012, 20(5): 475-481. 曹玉婷, 邱栋梁. 鸳鸯茉莉查尔酮异构酶基因(CHI) cDNA的克隆与生物信息学分析[J]. 热带亚热带植物学报, 2012, 20(5): 475-481. DOI:10.3969/j.issn.1005-3395.2012.05.008 |
| [7] | LI M, CAO Y T, YE S R, et al. Isolation of CHS gene from Brunfelsia acuminata flowers and its regulation in anthocyanin biosysthesis[J]. Molecules, 2017, 22(1): 44-53. DOI:10.3390/molecules22010044 |
| [8] |
LI M, YE S R, QIU D L. Optimization of two-dimensional electro-phoresis technology for Brunfelsia acuminate petals[J].
Subtrop Agric Res, 2015, 11(4): 262-266. 李敏, 叶丝蕊, 邱栋梁. 鸳鸯茉莉花瓣蛋白质双向电泳技术的优化[J]. 亚热带农业研究, 2015, 11(4): 262-266. DOI:10.13321/j.cnki.subtrop.agric.res.2015.04.009 |
| [9] |
YUAN Y, LIAN F Q. A preliminary study on the callus of Brunfelsia latifolia induced by different explants[J].
N Hort, 2010(1): 168-171. 袁媛, 连芳青. 鸳鸯茉莉不同外植体诱导愈伤组织研究初探[J]. 北方园艺, 2010(1): 168-171. |
| [10] | BAR-AKIVA A, OVADIA R, ROGACHEV I, et al. Metabolic net-working in Brunfelsia calycina petals after flower opening[J]. J Exp Bot, 2010, 61(5): 1393-1403. DOI:10.1093/jxb/erq008 |
| [11] | SIMÕES C, BIZARRI C H B, DA SILVA CORDEIRO L, et al. Anthocyanin production in callus cultures of Cleome rosea:Modu-lation by culture conditions and characterization of pigments by means of HPLC-DAD/ESIMS[J]. Plant Physiol Biochem, 2009, 47(10): 895-903. DOI:10.1016/j.plaphy.2009.06.005 |
| [12] | WEISS D, HALEVY A H. Stamens and gibberellin in the regulation of corolla pigmentation and growth in Petunia hybrida[J]. Planta, 1989, 179(1): 89-96. DOI:10.1007/BF00395775 |
| [13] | da FONSECA MACHADO A P, PEREIRA A L D, BARBERO G F, et al. Recovery of anthocyanins from residues of Rubus fruticosus, Vaccinium myrtillus and Eugenia brasiliensis by ultrasound assisted extraction, pressurized liquid extraction and their combination[J]. Food Chem, 2017, 231: 1-10. DOI:10.1016/j.foodchem.2017.03.060 |
| [14] |
WANG F, YANG S H, LIU X Y, et al. The diversity of petal colors and its relation to anthocyanins in Rose germplasms[J].
Acta Hort Sin, 2017, 44(6): 1125-1134. 王峰, 杨树华, 刘新艳, 等. 月季种质资源花色多样性及其与花青苷的关系[J]. 园艺学报, 2017, 44(6): 1125-1134. DOI:10.16420/j.issn.0513-353x.2016-0789 |
| [15] |
WANG L, LIU Y L, LOU Q, et al. Method development for the identification of anthocyanins in Muscari latifolium flower[J].
Acta Bot Boreali-Occid Sin, 2017, 37(5): 1031-1037. 王琳, 刘雅莉, 娄倩, 等. 葡萄风信子花青素苷分析方法建立及成分鉴定[J]. 西北植物学报, 2017, 37(5): 1031-1037. DOI:10.7606/j.issn.1000-4025.2017.05.1031 |
| [16] |
ZHANG J, WANG L S, GAO J M, et al. Identification of anthocyanins involving in petal coloration in Chaenomeles speciosa cultivars[J].
Acta Hort Sin, 2011, 38(3): 527-534. 张洁, 王亮生, 高锦明, 等. 贴梗海棠花青苷组成及其与花色的关系[J]. 园艺学报, 2011, 38(3): 527-534. |
| [17] |
SUN W, Li C H, WANG L S, et al. Anthocyanins present in flowers of Senecio cruentus with different colors[J].
Acta Hort Sin, 2009, 36(12): 1775-1782. 孙卫, 李崇晖, 王亮生, 等. 花青苷成分对瓜叶菊花色的影响[J]. 园艺学报, 2009, 36(12): 1775-1782. DOI:10.16420/j.issn.0513-353x.2009.12.011 |
 2018, Vol. 26
2018, Vol. 26



