荔枝(Litchi chinensis Sonn.)是无患子科(Sapin- daceae)荔枝属的亚热带常绿果树,喜高温高湿。荔枝原产于中国,栽培区域主要分布在17°~32°的纬度带,国内主要在广东、广西、海南、福建和云南等地栽种[1]。常见的荔枝栽培品种有‘怀枝’、‘三月红’、‘桂味’、‘糯米糍’、‘妃子笑’等。荔枝是雌雄同株异花树种,雌花和雄花着生在同一花穗上。荔枝果实味甘,肉质细腻多汁,香甜可口,营养价值丰富。荔枝蜜同样是深受广大消费者喜爱的营养保健品。
蜂蜜是蜜蜂采集植物花朵蜜腺上的花蜜、蜜露和其他分泌物,结合自身特殊的分泌物质在体内酿造而成。蜂蜜主要成分是糖类物质,约占总组分的80%,并富含蛋白质、氨基酸以及人体所需的维生素和微量元素等,是人体优质的营养来源[2-3]。蜂蜜中还含有酚酸和黄酮类物质,具有抑菌、抗氧化和护肝等保健作用[4-7]。不同来源的蜂蜜因含有不同组分的挥发性物质,而具有各自特殊的风味[8-10]。近年来,有关蜂蜜的主要组分鉴定、风味特征和保健功能等方面的研究较多,但随着人们对单花蜂蜜消费需求的迅速增长[11],有关花蜜的研究显得极为重要。
花蜜是植物花朵蜜腺分泌出来的一种汁液,可吸引传粉昆虫来采取花蜜,也是影响传粉昆虫行为的重要因素[12-13]。花蜜中主要成分也含有糖类、氨基酸、蛋白质、脂类、无机离子、以及生物碱和萜烯类挥发性物质[14-17]。但花蜜和相对应的蜂蜜中的主要组分和含量仍有较大差异[18]。花蜜的形成、运输和分泌模式取决于蜜腺的组织结构和发达程度[19-23],因此,雄花和雌花分泌花蜜的模式也各不相同[20, 22], 并且同一植物的不同品种所分泌的花蜜主要组分和含量差异较大[24-25]。花蜜的分泌还受外界环境因子的影响。荔枝蜜是华南地区极具特色的蜂蜜,但有关荔枝花蜜的研究较少。本研究选取3个品种的荔枝,在不同天气状况下分别采取雄花和雌花上的花蜜,分析花蜜的分泌规律,测定花蜜中可溶性固形物和可溶性糖含量,为荔枝栽培和荔枝单花蜜的生产提供依据。
1 材料和方法 1.1 材料本研究所选用荔枝(Litchi chinensis Sonn.)树均为3年生空中压条苗,种植于华南农业大学园艺试验基地(中国,广州),定植密度为2.5 m×6 m。选用的荔枝品种为‘桂味’(‘Guiwei’, GW)、‘糯米糍’(‘Nuomici’, NMC)和‘怀枝’(‘Huaizhi’, HZ)。
1.2 花蜜的采集和分离每个品种荔枝选择长势良好的5棵树,树上选取固定的花穗进行取样,晴天和阴天各取样4次, 每次取雌雄花各30朵,采样时间为早上7:30-10:00。采样时用镊子采摘有花蜜的花放入5 mL的带孔塑料管中,塑料管放置于15 mL离心管中,在1 570×g下离心5 min,离心管底部滤液即为花蜜,称量后放入-20℃的冰箱中冻存。
2017年3月21日至4月9日期间,分别在晴天和阴天对3个荔枝品种的花蜜进行采样,并记录采样时的温度和相对空气湿度(表 1)。采集花蜜的时间在上午8-10点,可见阴天和晴天果园气温差异不明显,但阴天的相对空气湿度显著高于晴天,阴天为90%以上,而晴天为50%~80%。
| 表 1 花蜜的采集 Table 1 Collection of nectar |
可溶性固形物含量采用手持式糖度计Atago PR-101 R (Thermo Fisher, 日本)测定。
可溶性糖含量参照Yang等[26]的方法测定,并做适当更改。吸取10 μL花蜜,用超纯水稀释至1 mL, 充分震荡,稀释液经Sep-Pak®1cc (100 mg) C18 Cartridges过滤后,使用HPLC (Agilent Technologies, 德国)检测可溶性糖含量。HPLC配有四元泵、视差检测器RID (G1362A)、自动进样器,使用Coregel 87 C (Transgenomic CHO-99-5860)色谱柱,采用超纯水作为流动相,流速为0.4 mL min–1, 柱温为80℃。蔗糖、葡萄糖、果糖和甘露醇色谱纯的标准品均购自Sigma公司,配制成8 000、4 000、2 000、1 000和500 mg L–1浓度梯度的混合标准品上机检测,制作标准曲线和浓度计算公式。
1.4 数据分析采用SPSS (V. 19)软件进行数据的统计分析, 采用Duncan方法进行数据差异的显著性分析。
2 结果和分析 2.1 雌花和雄花的花蜜分泌量荔枝花蜜的分泌受品种、花性和天气情况(晴天或者阴天)的影响。整体上看,阴天荔枝的花蜜分泌量要高于晴天,雌花的高于雄花(图 1)。不同品种的雌花以‘桂味’的花蜜分泌量最多,阴天和晴天每朵花的分泌量分别达到0.020和0.019 g,‘糯米糍’次之,‘怀枝’最少;不同品种的雄花均是‘糯米糍’的花蜜分泌量最多,阴天与晴天的分泌量分别为0.017和0.015 g,‘桂味’和‘怀枝’的分泌量较少。晴天时, 雌花中‘桂味’的分泌量最多,‘糯米糍’次之,‘怀枝’最少;雄花中,‘糯米糍’的分泌量最多,‘桂味’和‘怀枝’较少。阴天时,雌花中‘桂味’的分泌量最多,雄花中‘糯米糍’的分泌量最多。
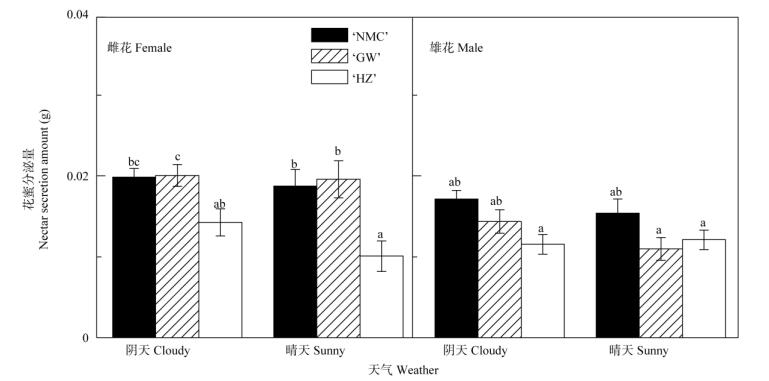
|
图 1 荔枝系每朵花的花蜜分泌量 Fig. 1 Nectars secretion amount per flower of litchi |
从图 2可知,晴天花蜜中可溶性固形物含量要高于阴天,在雌花中尤为明显。在不同花性和不同天气状况下均是‘怀枝’花蜜中的可溶性固形物含量最高,可达37.7%,‘桂味’其次,‘糯米糍’最少(17.7%)。不同天气状况对‘桂味’和‘怀枝’雌花的可溶性固形物含量有显著影响,但对雄花花蜜的可溶性固形物含量没有显著影响(图 2)。

|
图 2 荔枝花蜜中的可溶性固形物含量 Fig. 2 Soluble solid content in litchi nectar |
采用高效液相色谱对蔗糖(sucrose)、葡萄糖(glucose)、果糖(fructose)和甘露醇(mannitol)标准品的检测,他们的出峰时间分别是12.1、14.8、21.8和28.4 min, 且能较好的区分(图 3: A),制作标准曲线用于定量分析。从荔枝花蜜的可溶性糖提取液中, 检测到蔗糖、葡萄糖和果糖,但几乎检测不到甘露醇(图 3: B)。

|
图 3 荔枝花蜜中可溶性糖组分的高效液相色谱图。A:标准品; B:花蜜 Fig. 3 HPLC diagram of soluble sugars in litchi nectar. A: Standard substance; B: Nectar |
从图 4可知,在荔枝花蜜中检测到的3种可溶性糖中,葡萄糖含量最多,其次为果糖,蔗糖含量相对较少。3个荔枝品种中,‘怀枝’雌花晴天花蜜中的可溶性糖含量达到450.36 μg mL–1,显著高于另外两个品种,而雄花花蜜的可溶性糖含量在品种间差异不显著(图 4)。

|
图 4 荔枝花蜜的可溶性糖含量 Fig. 4 Soluble sugar content in litchi nectar |
研究荔枝花蜜的分泌模式和规律,分析花蜜的主要组分,对荔枝栽培和单花蜂蜜的生产具有重要意义[12-13]。本研究选取了‘糯米糍’、‘怀枝’和‘桂味’3个荔枝主栽品种,在阴天和晴天分别对雄花和雌花的花蜜进行采样,分析荔枝花蜜的分泌规律。结果表明,总体上荔枝阴天的花蜜分泌量要高于晴天, 雌花的花蜜分泌量高于雄花,‘桂味’和‘糯米糍’的花蜜分泌量均要高于‘怀枝’(图 1)。花蜜的分泌需要消耗树体营养[19],泌蜜量与植株叶片数量和株高等呈正相关关系[27],而不同品种荔枝的生物量和代谢水平不同,导致荔枝品种间花蜜分泌量的差异。荔枝和西葫芦(Cucurbita pepo)等雌雄同株植物雄花和雌花的蜜腺虽然结构较为类似[20-21],但花蜜的分泌量和组分存在较大差异[20]。荔枝的泌蜜活动与呼吸作用密切相关,荔枝雌花的呼吸酶活性均要高于同一时段雄花,无论是氧气的吸收还是二氧化碳的释放,雌花明显高于雄花[28],因此,雌花的泌蜜量要高于雄花。
温度和湿度是影响植物花泌蜜的重要因素,温湿度可对植株体内酶活性和物质运输产生重要影响[29],而花是新陈代谢和物质运输十分活跃的组织,且荔枝单个花朵体积较小,受外界环境影响更明显。本研究结果表明,阴天花蜜分泌量要高于晴天,这可能是因为晴天与阴天上午果园的气温相近,但晴天的空气相对湿度较低(表 1),花蜜中的水分较容易蒸发,导致晴天花蜜分泌量低于阴天(图 1),但可溶性固形物含量要高于阴天(图 2)。另外, 花蜜的分泌受开花时间的影响,刺五加(Eleuthero- coccus senticosus)雄株花朵在开花后1~3 d分泌花蜜,雌株花朵在开花后5~9 d分泌花蜜,而两性株在开花后有两次分泌花蜜的过程,花蜜分泌主要集中在8:30-11:30[27]。百子莲(Agapanthus africanus)的花蜜分泌速率和花蜜常备量均在开花第2天达到最大[30]。淫羊藿(Epimedium wushanense)花蜜常备量在花早期较高,但花蜜的含糖量在花晚期较高[31],因此,研究荔枝花蜜分泌规律还需确定荔枝的泌蜜周期,且须排除授粉昆虫等外界干扰因素。
花蜜的成分不仅构成了蜂蜜的主要风味,也是影响授粉昆虫的主要因素[32]。本研究结果表明,3种荔枝品种花蜜的主要可溶性糖组分为蔗糖、葡萄糖和果糖,其中葡萄糖含量最高(图 3, 4),这与前人的研究结果[17, 33]一致。花蜜中不同可溶性糖组分对蜜蜂和蚂蚁等授粉昆虫的吸引力不一样,有些糖分甚至不能被授粉昆虫消化,从而形成毒害[34]。因此,根据花蜜分泌规律和主要成分,可对果园的荔枝品种进行相应搭配,以有效吸引蜜蜂等授粉昆虫,并生产适合特别人群的蜂蜜产品。
| [1] |
CHEN H B, SU Z X, ZHANG R, et al. Progresses in research of litchi floral differentiation[J].
Sci Agric Sin, 2014, 47(9): 1774-1783. 陈厚彬, 苏钻贤, 张荣, 等. 荔枝花芽分化研究进展[J]. 中国农业科学, 2014, 47(9): 1774-1783. DOI:10.3864/j.issn.0578-1752.2014.09.012 |
| [2] | NICOLSON S W. Amino acid concentrations in the nectars of southern African bird-pollinated flowers, especially Aloe and Erythrina[J]. J Chem Ecol, 2007, 33(9): 1707-1720. DOI:10.1007/s10886-007-9342-x |
| [3] |
QING Z, SU R, DONG K, et al. Research progress on nectar compo-sitions and their ecological functions[J].
Chin J Ecol, 2014, 33(3): 825-836. 卿卓, 苏睿, 董坤, 等. 花蜜化学成分及其生态功能研究进展[J]. 生态学杂志, 2014, 33(3): 825-836. DOI:10.13292/j.1000-4890.2014.0078 |
| [4] | CHEN Y C, LIN J T, LIU S C, et al. Composition of flavonoids and phenolic acids in lychee (Litchi chinensis Sonn.) flower extracts and their antioxidant capacities estimated with human LDL, erythrocyte, and blood models[J]. J Food Sci, 2011, 76(5): C724-C728. DOI:10.1111/j.1750-3841.2011.02164.x |
| [5] | KENJERIĆ D, MANDIĆ M L, PRIMORAC L, et al. Flavonoid profile of Robinia honeys produced in Croatia[J]. Food Chem, 2007, 102(3): 683-690. DOI:10.1016/j.foodchem.2006.05.055 |
| [6] | PYRZYNSKA K, BIESAGA M. Analysis of phenolic acids and flavor-noids in honey[J]. TrAC Trends Anal Chem, 2009, 28(7): 893-902. DOI:10.1016/j.trac.2009.03.015 |
| [7] | WESTON R J, BROCKLEBANK L K, LU Y R. Identification and quantitative levels of antibacterial components of some New Zealand honeys[J]. Food Chem, 2000, 70(4): 427-435. DOI:10.1016/S0308-8146(00)00127-8 |
| [8] | JERKOVIĆ I, TUBEROSO C I G, MARIJANOVIĆ Z, et al. Head-space, volatile and semi-volatile patterns of Paliurus spina-christi unifloral honey as markers of botanical origin[J]. Food Chem, 2009, 112(1): 239-245. DOI:10.1016/j.foodchem.2008.05.080 |
| [9] |
SU Y Z, XIE L Q, WANG Q, et al. SPME-GC-MS analysis of volatile compounds from four xinjiang monofloral honey[J].
Food Sci, 2010, 31(24): 293-299. 粟有志, 谢丽琼, 王强, 等. 4种新疆单花蜜挥发性成分的SPME-GC-MS分析[J]. 食品科学, 2010, 31(24): 293-299. DOI:10.7506/spkx1002-6630-201024063 |
| [10] |
PEI G P, SHI B L, ZHAO L, et al. The analysis research of three nectar source honey aroma ingredients differentiation information[J].
Food Sci Technol, 2014, 39(2): 68-73. 裴高璞, 史波林, 赵镭, 等. 3种蜜源蜂蜜香气成分差异化信息分析研究[J]. 食品科技, 2014, 39(2): 68-73. DOI:10.13684/j.cnki.spkj.2014.02.016 |
| [11] |
ZHAO L F, XU Y Y, DONG R, et al. Research progress of chemical components in monofloral honey[J].
Food Sci, 2013, 34(7): 330-334. 赵立夫, 徐云友, 董蕊, 等. 单花蜜的化学成分研究进展[J]. 食品科学, 2013, 34(7): 330-334. DOI:10.7506/spkx1002-6630-201307070 |
| [12] | CARTER C, THORNBURG R W. Tobacco nectarin:Ⅰ. Purification and characterization as a germin-like, manganese superoxide dismutase implicated in the defense of floral reproductive tissues[J]. J Biol Chem, 2000, 275(47): 36726-36733. DOI:10.1074/jbc.M006461200 |
| [13] | JOHNSON S D, NICOLSON S W. Evolutionary associations between nectar properties and specificity in bird pollination systems[J]. Biol Lett, 2008, 4(1): 49-52. DOI:10.1098/rsbl.2007.0496 |
| [14] | GUFFA B, NEDIĆ N M, DABIĆ ZAGORAC D Ć, et al. Characte-rization of sugar and polyphenolic diversity in floral nectar of different 'Oblacinska' sour cherry clones[J]. Chem Biodiv, 2017, 14(9): e1700061 DOI:10.1002/cbdv.201700061 |
| [15] | HEIL M. Nectar:Generation, regulation and ecological functions[J]. Trends Plant Sci, 2011, 16(4): 191-200. DOI:10.1016/j.tplants.2011.01.003 |
| [16] | PACINI E, NEPI M, VESPRINI J L. Nectar biodiversity:A short review[J]. Plant Syst Evol, 2003, 238(1/2/3/4): 7-21. DOI:10.1007/s00606-002-0277-y |
| [17] | ROY R, SCHMITT A J, THOMAS J B, et al. Review:Nectar biology:From molecules to ecosystems[J]. Plant Sci, 2017, 262: 148-164. DOI:10.1016/j.plantsci.2017.04.012 |
| [18] | SIMOVA S, ATANASSOV A, SHISHINIOVA M, et al. A rapid diffe-rentiation between oak honeydew honey and nectar and other honey-dew honeys by NMR spectroscopy[J]. Food Chem, 2012, 134(3): 1706-1710. DOI:10.1016/j.foodchem.2012.03.071 |
| [19] | LIN I W, SOSSO D, CHEN L Q, et al. Nectar secretion requires sucrose phosphate synthases and the sugar transporter SWEET9[J]. Nature, 2014, 508(7497): 546-549. DOI:10.1038/nature13082 |
| [20] | NEPI M, CIAMPOLINI F, PACINI E. Development and ultrastructure of Cucurbita pepo nectaries of male flowers[J]. Ann Bot, 1996, 78(1): 95-104. DOI:10.1006/anbo.1996.0100 |
| [21] | NING X P, TANG T X, WU H. Relationship between the morpho-logical structure of floral nectaries and the formation, transport, and secretion of nectar in lychee[J]. Trees, 2017, 31(1): 1-14. DOI:10.1007/s00468-016-1504-4 |
| [22] | PENG Y B, LI Y Q, HAO Y J, et al. Nectar production and trans-portation in the nectaries of the female Cucumis sativus L. flower during anthesis[J]. Protoplasma, 2004, 224(1/2): 71-78. DOI:10.1007/s00709-004-0051-9 |
| [23] | WIST T J, DAVIS A R. Floral nectar production and nectary anatomy and ultrastructure of Echinacea purpurea (Asteraceae)[J]. Ann Bot, 2006, 97(2): 177-193. DOI:10.1093/aob/mcj027 |
| [24] | AGOSTINI K, SAZIMA M, GALETTO L. Nectar production dynamics and sugar composition in two Mucuna species (Leguminosae, Faboideae) with different specialized pollinators[J]. Naturwissenschaften, 2011, 98(11): 933-942. DOI:10.1007/s00114-011-0844-6 |
| [25] | NI C Z, ZHU B H, WANG N N, et al. Simple column-switching ion chromatography method for determining eight monosaccharides and oligosaccharides in honeydew and nectar[J]. Food Chem, 2016, 194: 555-560. DOI:10.1016/j.foodchem.2015.08.049 |
| [26] | YANG Z Y, WANG T D, WANG H C, et al. Patterns of enzyme activities and gene expressions in sucrose metabolism in relation to sugar accumulation and composition in the aril of Litchi chinensis Sonn[J]. J Plant Physiol, 2013, 170(8): 731-740. DOI:10.1016/j.jplph.2012.12.021 |
| [27] |
LIU L D, LI W, ZHU N, et al. The relations among the nectar secretive rhythms, nectar compositions and diversities of floral visitors for both Eleutherococcus senticosus and E. sessiliflorus[J].
Acta Ecol Sin, 2002, 22(6): 847-853. 刘林德, 李玮, 祝宁, 等. 刺五加、短梗五加的花蜜分泌节律、花蜜成分及访花者多样性的比较研究[J]. 生态学报, 2002, 22(6): 847-853. DOI:10.3321/j.issn:1000-0933.2002.06.008 |
| [28] |
LI J H, MIAO X Q, YOU M S. Study of secretion of litchi nectar[J].
J Bee, 2000(2): 6-8. 李江红, 缪晓青, 尤民生. 荔枝泌蜜的研究[J]. 蜜蜂杂志, 2000(2): 6-8. |
| [29] | WYATT R, BROYLES S B, DERDA G S. Environmental influences on nectar production in milkweeds (Asclepias syriaca and A. exaltata)[J]. Amer J Bot, 1992, 79(6): 636-642. DOI:10.1002/j.1537-2197.1992.tb14605.x |
| [30] |
SUN Y, ZHUO L H. The nectar secretion rhythms and influencing factors of pollination efficiency of Agapanthus africanus ssp. orientalis 'Big Blue'[J].
Acta Agric Shanghai, 2009, 25(2): 36-40. 孙颖, 卓丽环. 百子莲的花蜜分泌节律及传粉效率影响因素的研究[J]. 上海农业学报, 2009, 25(2): 36-40. DOI:10.3969/j.issn.1000-3924.2009.02.008 |
| [31] |
WANG Y, QUAN Q M, LI Y X. Effects of flowering period on nectar secretion and fruit set of Epimedium wushanense (Berberidaceae)[J].
Plant Divers Resour, 2012, 34(5): 471-477. 王怡, 权秋梅, 黎云祥. 开花时间对巫山淫羊藿花蜜分泌和结实的影响[J]. 植物分类与资源学报, 2012, 34(5): 471-477. DOI:10.3724/SP.J.1143.2012.12024 |
| [32] | BARLOW S E, WRIGHT G A, MA C, et al. Distasteful nectar deters floral robbery[J]. Curr Biol, 2017, 27(16): 2552-2558. DOI:10.1016/j.cub.2017.07.012 |
| [33] | ANTOŃ S, KOMOŃ-JANCZARA E, DENISOW B. Floral nectary, nectar production dynamics and chemical composition in five nocturnal Oenothera species (Onagraceae) in relation to floral visitors[J]. Planta, 2017, 246(6): 1051-1067. DOI:10.1007/s00425-017-2748-y |
| [34] | SOLS A, CADENAS E, ALVARADO F. Enzymatic basis of mannose toxicity in honey bees[J]. Science, 1960, 131(3396): 297-298. DOI:10.1126/science.131.3396.297 |
 2018, Vol. 26
2018, Vol. 26


