丛枝菌根(arbuscular mycorrhiza)是球菌门真菌侵染植物根系形成的共生体。丛枝菌根真菌(AMF)对宿主的选择专一性不强,自然界中约90%的维管植物能够形成丛枝菌根。丛枝菌根特有的泡囊-丛枝以及菌丝等结构极大地扩展了宿主根系的水分和养分吸收面积,从而促进宿主生长,此已被许多研究所证实[1-2]。而适宜的AMF能够促进宿主生长, 与宿主水分和营养的改善进而增强其光合作用和碳素营养密切相关[3]。因此,通过AMF接种试验研究植物生长和光合能力,有助于探究AMF对于植物促生效应及其生理机制。
菌根化育苗是提升苗木质量的有效措施之一, 已对印度檀香(Santalum album)[4]、马褂木(Lirio- dendron chinese)[5]和伯乐树(Bretschneidera sinensis)[6]等珍贵树种以及绿化树种[7]幼苗开展了AMF筛选和接种效应研究,还对同一树种不同种质(种源、无性系等)幼苗的AMF接种效应进行了探究,认为宿主种质差异亦显著影响菌根共生体的潜力[8-11]。这为相应树种及其种质材料的菌根化苗木培育奠定了基础。
西南桦(Betula alnoides)是我国热带、南亚热带地区的速生乡土珍贵树种,木材材质优良、用途广泛,尤其是西南桦家具、木地板等深受市场青睐, 树皮可入药,用于治疗眼疾、感冒、风湿和消化道疾病等[12-13]。近20年来,西南桦人工林发展迅速,已成为该地区造林面积最大的乡土阔叶树种之一。西南桦是兼具丛枝菌根和外生菌根的典型菌根营养型树种,具有较强的菌根依赖性[14]。李丽等[15]的调查表明,AMF侵染能够减轻西南桦溃疡病的发病程度,认为苗期接种AMF有助于提高抗病性。本研究选用普适性较强且易分离扩繁的3个菌种6个菌株,应用初步推广的西南桦4个无性系开展组培苗接种试验,探究AMF接种与无性系对西南桦幼苗生长和光合生理的影响,旨在筛选最佳AMF和菌株,为西南桦菌根化育苗实践提供理论依据和技术支撑。
1 材料和方法 1.1 试验材料参试的FB4、BY1、FB4+和A5共4个西南桦(Betula alnoides)无性系的组培苗由中国林业科学研究院热带林业研究中心提供,选用生长正常且长势一致的组培生根瓶苗,平均高约4 cm。
供试菌种为6个AMF菌株,其中AMF1和AMF2为幼套球囊霉(Glomus etunicatum)的XZ03B和XJ04B菌株;AMF3和AMF4为摩西球囊霉(G. mosseae)的HUN03B和XJ04B菌株,这4个菌株由北京市农林科学院植物营养与资源研究所提供; AMF5和AMF6分别为根内球囊霉(G. intraradices)和幼套球囊霉,均分离自甘蔗根际,由广西农业科学院微生物研究所提供。利用小麦(Triticum aestivum)对供试菌种分别进行生物扩繁,3个月后剪去小麦茎叶,将根系剪碎与培养基质(泥炭:河沙= 1:1,V/V)充分混匀,制成AMF菌剂,晾干后装入自封袋,于4℃冰箱短期保存备用。
1.2 试验设计试验采用裂区设计,主区设置7个接种处理, 即6个菌株接种处理和1个不接种对照,副区设置4个无性系,每个主小区内安排1个接种处理,每个副小区内安排1个无性系6株,3次重复(区组),合计504株。
1.3 接种和育苗2016年9月于中国林业科学研究院热带林业研究所温室内进行盆栽实验。育苗基质(泥炭、蛭石、珍珠岩比例为3:2:2, V/V)经高温高压灭菌(121℃, 1 h)后装入规格为13 cm×12.3 cm×11 cm的塑料盆中,每盆移栽1株幼苗。移栽前先放入2/3体积的基质,然后均匀铺上5 g AMF菌剂,移入截根后的幼苗,使苗根与菌剂充分接触,再将无菌基质覆盖其上轻轻压实;对照则接入5 g灭活的菌剂。为避免杂菌污染,塑料盆均用锡箔纸覆盖,幼苗以去离子水浇灌。每天称重浇水,保持基质湿度为60%~70%;每周施加20%的Hoagland营养液50 mL[16];每隔2周移动一次苗木,以减小边际效应。试验期间每天观测记录温室内的温度和湿度。
1.4 方法移植100 d后,利用直尺测量所有幼苗高,游标卡尺测量地径。每个主小区内随机选取每个无性系3株幼苗,测定光合参数、叶绿素荧光参数、叶面积、叶绿素含量。
光合参数测定 于晴朗无云天气上午9:00- 11:00 (室温24℃),每株幼苗选取顶芽以下第5片健康完整叶片,使用LI-6400便携式光合仪(LI- COR公司, 美国)测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。设定光强为1 200 μmol m–2s–1(通过预备试验确定的饱和光强), 叶室温度26℃,CO2浓度400 μmol m–2s–1。水分利用效率(WUE)= Pn/Tr。
叶绿素荧光参数测定 使用PAM-2500便携式调制叶绿素荧光仪(Walz公司, 德国)测定叶绿素荧光参数。每株幼苗选取3片健康完整叶片(顶芽以下第4或5叶),暗适应30 min后,在饱和光强下测定PSⅡ的潜在活性Fv/Fo和PSⅡ最大光合效率Fv/Fm;在光适应下测定PSⅡ实际光合效率ΦPSⅡ。
叶面积和叶绿素含量测定 使用LI-3050C便携式叶面积仪(LI-COR公司, 美国)测定幼苗叶面积,随即采用舒展等[17]的方法测定单位面积叶绿素含量,并计算单株叶绿素含量。
菌根感染率测定 每株幼苗剪取所有根系置于尼龙网筛上,流水缓慢冲洗干净后迅速置于25℃室内,剪取50段1 cm长的根段,利用醋酸-墨水染色法[18]观察、统计丛枝菌根侵染状况。菌根侵染率(%)=(菌根侵染的根段数/检测根段总数)× 100%
1.5 数据分析试验数据运用SPSS 13.0软件中一般线性模型进行裂区设计方差分析和LSD多重比较分析。比较各菌剂接种效果时取4个无性系的平均值,无性系间比较则取7个接种处理的平均值。菌根侵染率在方差分析之前利用Excel进行反正弦转换。
2 结果和分析方差分析结果表明(表 1),AMF菌株差异对西南桦幼苗菌根侵染、生长以及光合生理影响极显著(P < 0.01);4个无性系间除菌根侵染率和叶片气孔导度差异不显著(P > 0.05)之外,其它各指标均存在显著(P < 0.05)或极显著差异;AMF菌株与无性系间的交互作用仅显著影响幼苗地径和净光合速率。
| 表 1 接种AMF西南桦无性系幼苗生长和光合生理指标的方差分析 Table 1 ANOVA of seedling growth and photosynthetic indexes of Betula alnoides clones inoculated with AMF |
接种AMF 100 d后,西南桦无性系幼苗根系均受到不同程度侵染,其菌根侵染率为15%~39% (图 1)。接种AMF3和AMF5菌株的幼苗菌根侵染率显著高于其他菌株(P < 0.05)。不同无性系幼苗接种同一菌株的菌根侵染率差异不显著(P > 0.05)。
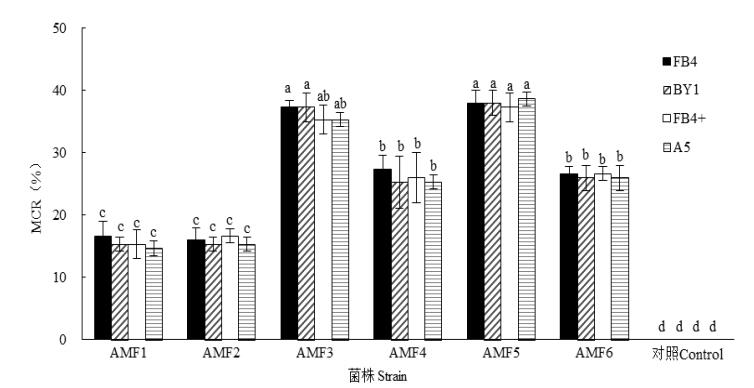
|
图 1 西南桦无性系幼苗接种AMF后的菌根侵染率(MCR)。柱上不同字母表示差异显著(P < 0.05)。 Fig. 1 Mycorrhizal colonization rate (MCR) of Betula alnoides clone seedlings inoculated with AMF strains. Different letter upon column indicate significant difference at 0.05 level. |
由表 2可见,AMF5处理的苗高、叶面积与AMF3、AMF4处理的差异不显著(P > 0.05),三者均显著高于其他处理(P < 0.05);AMF5处理的地径显著高于AMF3处理的,两者显著高于其他处理。AMF1处理的各项生长指标与对照差异不显著; AMF2处理的苗高、叶面积与AMF1差异不显著, 但地径显著高于AMF1。AMF5处理的苗高、地径和叶面积分别比对照高20.95%、33.94%和59.60%。从无性系来看,FB4的各项生长指标均最大,其次为BY1,两者的苗高、地径差异显著,而叶面积差异不显著;他们的各项生长指标均显著高于FB4+和A5。
| 表 2 AMF接种和无性系对西南桦幼苗生长的影响 Table 2 Effects of AMF inoculation and clone on growth performance of Betula alnoides seedlings |
西南桦幼苗净光合速率(Pn)以AMF5处理为最高,其次为AMF3,两者均显著高于其他菌株处理(P < 0.05)(表 3);以AMF1和对照最低,显著低于其他菌株处理。AMF5和AMF3处理间的气孔导度(Gs)差异不显著(P > 0.05),均显著高于其他菌株处理。AMF3、AMF4、AMF5和AMF6处理间蒸腾速率(Tr)差异不显著,但显著高于AMF1、AMF2和对照。水分利用效率(WUE)则以AM6处理和对照最低, 显著低于其他菌株处理。而胞间CO2浓度(Ci)则以对照最高,其次为AMF1处理,两者显著高于AMF5处理。AMF5处理的Pn和WUE分别比对照高19.50%和6.78%。Pn在无性系间差异显著,以无性系FB4最高,其次为BY1。Tr和WUE以无性系FB4和BY1最高,显著高于无性系FB4+和A5;而Ci则刚好相反。FB4的Pn和WUE比A5分别高13.29%和3.76%。
| 表 3 AMF接种和无性系对西南桦幼苗叶片光合参数的影响 Table 3 Effects of AMF inoculation and clone on photosynthetic parameters of Betula alnoides seedling leaves |
西南桦幼苗叶片的叶绿素a、b和叶绿素a+b含量均以AMF5处理为最高,AMF1、AMF2和对照的最低(表 4)。PSⅡ潜在活性(Fv/Fo)、最大光合效率(Fv/Fm)和实际光合效率(ΦPSⅡ)亦以AMF5处理最高,Fv/Fo以AMF1和对照最低,Fv/Fm和ΦPSⅡ以对照最低。AMF5处理的幼苗叶片叶绿素a、b和叶绿素a+b含量以及ΦPSⅡ分别比对照高46.63%、70.63%、52.34%和16.17%。
| 表 4 AMF接种和无性系对西南桦幼苗叶片叶绿素含量与荧光参数的影响 Table 4 Effects of AMF inoculation and clone on leaf chlorophyll contents and fluorescence parameters of Betula alnoides seedlings |
无性系FB4和BY1间叶片叶绿素a、b和叶绿素a+b含量差异不显著,均显著高于FB4+和A5。FB4的Fv/Fo、Fv/Fm和ΦPSⅡ均最高,显著高于其他无性系。4个无性系间Fv/Fm变化较小,FB4的Fv/Fo和ΦPSⅡ比A5分别高8.95%和6.35%。
3 讨论和结论许多研究表明,尽管AMF对宿主植物的专一性不强,但二者间仍然具有明显的相互选择性。对于同一树种,幼苗的菌根侵染状况亦因种质材料不同而异。麻楝(Chukrasia tabularis)的5个种源幼苗接种3个AMF菌株,菌根侵染率因种源和菌株组合不同而异,约为12.0%~96.3%[8]。Chen等[19]研究了2个柑橘(Citrus sp.)品种对根内球囊霉的接种效应,结果表明侵染率差异显著。本研究结果表明, 参试的6个AMF菌株均能侵染西南桦幼苗从而形成共生关系,菌根侵染率因AMF菌株不同而存在显著差异,AMF1和AMF2处理的幼苗菌根侵染率仅约15%,说明幼套球囊霉XZ03B、XJ04B菌株与西南桦的亲和力不强,而AMF5和AMF3处理的幼苗菌根侵染率均在35%以上,显示出根内球囊霉和摩西球囊霉HUN03B菌株与西南桦有较强亲和力。然而,弓明钦等[14]报道西南桦幼苗接种地表球囊霉(Glamus versiforme)的9004菌株和苏格兰球囊霉(G. caledonium)的90036、90068菌株,菌根侵染率均在70%以上,远高于本研究结果。这可能与所用菌种、剂量和育苗基质等差异有关。对于每个菌株而言,西南桦不同无性系对菌根侵染率无显著影响。Granger等[20]亦报道两个苹果(Malus pumila)无性系幼苗间的G. epigaeum侵染率尽管差异较大,但未达到显著水平。Jiang等[11]应用3个AMF菌株对火力楠(Magnolia macclurei)的2个种源幼苗接种,结果表明菌种间的侵染率差异显著,而种源间的差异不显著。因此,菌根侵染率的差异会因树种或种源、菌种或菌株而异。
本研究结果表明,接种根内球囊霉菌株(AMF5)的西南桦幼苗,苗高、地径、叶面积显著高于其他菌株,摩西球囊霉HUN03B菌株(AMF3)的促生效果亦较为明显,而接种幼套球囊霉XZ03B、XJ04B菌株(AMF1、AMF2)的幼苗,生长表现与对照无显著差异。然而弓明钦等[14]报道西南桦幼苗接种AMF和不接种在苗高和生物量上均差异极显著,这可能与菌种选择有关,因为并非所有AMF均会促进植物生长,一些AMF还可能会表现为接种无效甚至抑制植物生长[21-22]。西南桦FB4和BY1无性系的苗高、地径和叶面积显著高于FB4+和A5。Chen等[19]报道2个柑橘品种接种根内球囊霉,苗高显著高于未接种对照,而且两个品种间苗高差异显著; Jiang等[11]报道接种AMF火力楠的苗高、地径显著高于对照,且两个种源间苗高、地径差异显著;而Granger等[20]对苹果2个无性系接种Glomus epigaeum的研究表明,1个无性系的苗高、叶面积显著高于未接种对照,而另1个无性系则与对照差异不显著。因此,接种AMF对宿主种质材料的促生效应有差异,说明宿主种质与AMF匹配对于菌根化育苗的重要性。
AMF对于西南桦幼苗的促生效应差异可以从幼苗的光合生理响应得以解释。大量研究表明,西南桦幼苗接种适宜的AMF,能够显著提高幼苗Pn、WUE、叶绿素含量与叶绿素荧光参数,从而促进其生长[23-26]。Chen等[19]用根内球囊霉接种柑橘2个品种,结果表明接种处理的Pn、叶绿素含量和Fv/Fo、Fv/Fm显著高于未接种处理,且两个品种间差异显著。本研究结果与之相似,接种根内球囊霉菌株的西南桦幼苗,Pn、WUE、叶绿素含量和荧光参数优于其他菌株和对照,其次为摩西球囊霉HUN03B菌株,而幼套球囊霉XZ03B、XJ04B菌株接种的幼苗各项光合生理指标与对照差异较小,从而造成幼苗生长量显著低于前2个菌株处理。而且生长表现最优的无性系FB4和BY1,在Pn、WUE、叶绿素含量和荧光参数上亦显著高于FB4+和A5。不同种质材料对于AMF接种的光合生理响应存在差异,亦是AMF与宿主种质优良组合筛选的重要依据。
综上所述,西南桦幼苗对不同AMF菌株的偏好性,致使菌株间的菌根侵染率存在显著差异,以接种根内球囊霉菌株的幼苗菌根侵染率最高,其次是摩西球囊霉HUN03B菌株,菌根侵染率均在35%以上,从而显著增加了西南桦幼苗叶绿素含量、叶绿素荧光和光合参数,促进了苗高、地径生长和叶片发育。因此,菌根侵染率可作为适宜AMF菌株筛选的重要指标,参试的根内球囊霉和摩西球囊霉菌株促生效果最佳,建议在未来西南桦菌根化育苗实践中予以应用。参试的4个西南桦无性系间幼苗AMF侵染率差异不显著,然而其生长、光合参数、叶绿素含量以及叶绿素荧光参数差异显著,均以FB4和BY1无性系为优。
致谢: 承蒙徐大平研究员和陆俊锟博士指导,特致谢忱。| [1] | Whiteside M D, Digman M A, Gratton E, et al. Organic nitrogen uptake by arbuscular mycorrhizal fungi in a boreal forest[J]. Soil Biol Biochem, 2012, 55: 7-13. DOI:10.1016/j.soilbio.2012.06.001 |
| [2] | JIANG W X, GOU G Q, DING Y L. Influences of arbuscular mycorrhizal fungi on growth and mineral element absorption of Chenglu hybrid bamboo seedlings[J]. Pak J Bot, 2013, 45(1): 303-310. |
| [3] | BIRHANE E, STERCK F J, FETENE M, et al. Arbuscular mycorrhizal fungi enhance photosynthesis, water use efficiency, and growth of frankincense seedlings under pulsed water availability conditions[J]. Oecologia, 2012, 169(4): 895-904. DOI:10.1007/s00442-012-2258-3 |
| [4] | KAMALOLBHAVAN B, ASHOKAN P K, BALASUNDARAN M. Influence of different arbuscular mycorrhizal fungi and shade on growth of sandal (Santalum album) seedlings[J]. J Trop For Sci, 2015, 27(2): 158-165. |
| [5] |
ZHOU Z C, CHEN L Q, HUANG X F. Screening of Chinese tulip tree mycorrhizal fungi and effect of growing seedling with mycorrhizae[J].
For Res, 2009, 22(2): 196-199. 周志春, 陈连庆, 黄秀凤. 马褂木菌根真菌筛选和菌根化育苗效果研究[J]. 林业科学研究, 2009, 22(2): 196-199. DOI:10.3321/j.issn:1001-1498.2009.02.008 |
| [6] |
QIAO Q, GUO X F, XING F W, et al. Symbiosis effect of Glomus eburneun on seed of Bretschneidera sinensis[J].
J Zhejiang For Sci Technol, 2015, 35(3): 43-46. 乔琦, 郭幸飞, 邢福武, 等. 摩西球囊霉与伯乐树的共生效应研究[J]. 浙江林业科技, 2015, 35(3): 43-46. |
| [7] |
LU Y D, ZHAO H J, TIAN X Q, et al. Mycorrhizal dependency of ten seedling species for landscaping and the inoculation effects[J].
J Trop Subtrop Bot, 2007, 15(3): 237-243. 陆耀东, 赵鸿杰, 田雪琴, 等. 10种绿化苗木对VA菌根的依赖性及其接种效应[J]. 热带亚热带植物学报, 2007, 15(3): 237-243. DOI:10.3969/j.issn.1005-3395.2007.03.009 |
| [8] |
CHEN Y, JIANG Q B, ZHONG C L, et al. Effects of arbuscular mycorrhizal fungi on seedling growth of Chukrasia tabularis[J].
Sci Silv Sin, 2011, 47(5): 76-81. 陈羽, 姜清彬, 仲崇禄, 等. 接种AM菌对麻楝不同种源苗期的生长效应[J]. 林业科学, 2011, 47(5): 76-81. DOI:10.11707/j.1001-7488.20110511 |
| [9] | de SOUSA L F, da SILVA S C. Growth and nutrition of eucalyptus clones seedlings inoculated with mycorrhizal fungi[J]. Pesqui Agro-pecu Trop, 2014, 44(2): 110-118. DOI:10.1590/S1983-40632014000200006 |
| [10] |
ZHOU Z Q, HU Y N, PENG Y L, et al. Effects of three arbuscular mycorrhizas on different provenances of amur cork seedlings[J].
Bull Bot Res, 2015, 35(1): 92-100. 周志强, 胡燕妮, 彭英丽, 等. 3种丛枝菌根真菌对不同种源黄檗幼苗的影响[J]. 植物研究, 2015, 35(1): 92-100. DOI:10.7525/j.issn.1673-5102.2015.01.015 |
| [11] | JIANG Q B, LI Q Y, CHEN Y, et al. Arbuscular mycorrhizal fungi enhanced growth of Magnolia macclurei (Dandy) Figlar seedlings grown under glasshouse conditions[J]. For Sci, 2017, 63(4): 441-448. DOI:10.5849/forsci.2016-004 |
| [12] |
ZENG J, GUO W F, ZHAO Z G, et al. Domestication of Betula alnoides in China:Current status and perspectives[J].
For Res, 2006, 19(3): 379-384. 曾杰, 郭文福, 赵志刚, 等. 我国西南桦研究的回顾与展望[J]. 林业科学研究, 2006, 19(3): 379-384. DOI:10.3321/j.issn:1001-1498.2006.03.022 |
| [13] |
ZENG J.
Question and Answer on High-Yield Cultivation Technique for Betula alnoides[M]. Beijing: China Forestry Publishing House, 2010: 1-44.
曾杰. 西南桦丰产栽培技术问答[M]. 北京: 中国林业出版社, 2010: 1-44. |
| [14] |
GONG M Q, WANG F Z, CHEN Y, et al. Mycorrhizal dependency and inoculant effects on the growth of Betula alnoides seedlings[J].
For Res, 2000, 13(1): 8-14. 弓明钦, 王凤珍, 陈羽, 等. 西南桦对菌根的依赖性及其接种效应研究[J]. 林业科学研究, 2000, 13(1): 8-14. DOI:10.3321/j.issn:1001-1498.2000.01.002 |
| [15] |
LI L, WU J R, MA H C, et al. The investigation of AMF on the resistance of Betula alnoides stem rot[J].
J Yunnan Agric Univ, 2015, 30(3): 369-375. 李丽, 伍建榕, 马焕成, 等. 丛枝菌根真菌(AMF)对西南桦溃疡(干腐)病的抗性调查研究[J]. 云南农业大学学报, 2015, 30(3): 369-375. DOI:10.16211/j.issn.1004-390X(n).2015.03.008 |
| [16] |
CHEN N, WANG Y S, LI X L, et al. Effects of nutrient solution strength on development of arbuscular mycorrhizal fungi[J].
Myco-systema, 2003, 22(3): 394-401. 陈宁, 王幼珊, 李晓林, 等. 营养液强度对AM真菌生长发育的影响[J]. 菌物系统, 2003, 22(3): 394-401. DOI:10.3969/j.issn.1672-6472.2003.03.013 |
| [17] |
SHU Z, ZHANG X S, CHEN J, et al. The simplification of chlorophyll content measurement[J].
Plant Physiol Commun, 2010, 46(4): 399-402. 舒展, 张晓素, 陈娟, 等. 叶绿素含量测定的简化[J]. 植物生理学通讯, 2010, 46(4): 399-402. DOI:10.13592/j.cnki.ppj.2010.04.001 |
| [18] |
SHENG P P, LIU R J, LI M. Methodological comparison of observation and colonization measurement of arbuscular mycorrhizal fungi[J].
Mycosystema, 2011, 30(4): 519-525. 盛萍萍, 刘润进, 李敏. 丛枝菌根观察与侵染率测定方法的比较[J]. 菌物学报, 2011, 30(4): 519-525. |
| [19] | CHEN Y Y, HU C Y, XIAO J X. Effects of arbuscular mycorrhizal inoculation on the growth, zinc distribution and photosynthesis of two citrus cultivars grown in low-zinc soil[J]. Trees, 2014, 28(5): 1427-1436. DOI:10.1007/s00468-014-1046-6 |
| [20] | GRANGER R L, PLENCHETTE C, FORTIN J A. Effect of a vesicular arbuscular (VA) endomycorrhizal fungus (Glomus epigaeum) on the growth and leaf mineral content of two apple clones propagated in vitro[J]. Can J Plant Sci, 1983, 63(2): 551-555. DOI:10.4141/cjps83-067 |
| [21] | REYNOLDS H L, HARTLEY A E, VOGELSANG K M, et al. Arbuscular mycorrhizal fungi do not enhance nitrogen acquisition and growth of old-field perennials under low nitrogen supply in glasshouse culture[J]. New Phytol, 2005, 167(3): 869-880. DOI:10.1111/j.1469-8137.2005.01455.x |
| [22] |
ZAI X M, XIA L Q, YAN D L, et al. Effects of arbuscular mycorrhizal fungi on the rooting, growth and enzymatic activity relating to disease resistance of beach plum (Prunus maritima) cuttings[J].
Guihaia, 2011, 31(3): 393-397. 宰学明, 夏连全, 闫道良, 等. 丛枝菌根真菌对滨梅扦插苗生根、生长和抗病相关酶活性的影响[J]. 广西植物, 2011, 31(3): 393-397. DOI:10.3969/j.issn.1000-3142.2011.05.021 |
| [23] |
HE Y J, ZHONG Z C, LIU J C, et al. Photosynthetic characteristics of Broussonetia papyrifera seedlings inoculated AM fungus in limestone soil substratum[J].
Bull Bot Res, 2008, 28(4): 452-457. 何跃军, 钟章成, 刘锦春, 等. 石灰岩土壤基质上构树幼苗接种丛枝菌根(AM)真菌的光合特征[J]. 植物研究, 2008, 28(4): 452-457. DOI:10.7525/j.issn.1673-5102.2008.04.015 |
| [24] | ZAI X M, ZHU S N, QIN P, et al. Effect of Glomus mosseae on chlorophyll content, chlorophyll fluorescence parameters, and chloro-plast ultrastructure of beach plum (Prunus maritima) under NaCl stress[J]. Photosynthetica, 2012, 50(3): 323-328. DOI:10.1007/s11099-012-0035-5 |
| [25] | GONG M G, TANG M, CHEN H, et al. Effects of two Glomus species on the growth and physiological performance of Sophora davidii seedlings under water stress[J]. New For, 2013, 44(3): 399-408. DOI:10.1007/s11056-012-9349-1 |
| [26] |
MA K, WANG Y Q, YANG J J, et al. Effect of arbuscular mycorrhizal fungi on chlorophyll fluorescence parameters of Bombax ceiba under different drought stress conditions[J].
J Plant Resour Environ, 2017, 26(3): 35-43. 马坤, 王彦淇, 杨建军, 等. 不同干旱胁迫条件下丛枝菌根真菌对木棉叶绿素荧光参数的影响[J]. 植物资源与环境学报, 2017, 26(3): 35-43. |
 2018, Vol. 26
2018, Vol. 26


